miR-218和miR-152在浆液性卵巢癌的表达及临床意义
赵立红,石淑莉,齐秀玲
(河北廊坊市广阳区人民医院妇产科,廊坊 065200)
卵巢恶性肿瘤是一种常见的女性生殖器肿瘤,发病率占妇科肿瘤的25%,其死亡率占据妇科肿瘤的第一位。上皮性卵巢肿瘤是最常见的卵巢肿瘤,占卵巢恶性肿瘤85%~90%,而其中浆液性卵巢癌占上皮性卵巢癌的75%[1-2],且75%的患者确诊时已是晚期,多伴有腹腔等远处转移。因此,寻找早期卵巢癌的肿瘤标志物显得尤为重要。
miRNAs是一种高度保守性的非编码RNA,在肿瘤的发生发展过程中发挥着重要的作用,与肿瘤细胞的增殖、凋亡、迁移、侵袭相关[3-4]。miR-218和miR-152表达的改变与肿瘤的恶性程度密切相关。有报道显示miR-218在肾细胞癌[5]、膀胱癌[6]中表达下调,可抑制卵巢癌细胞[7]、胃肠癌细胞[8]的侵袭转移;miR-152在卵巢癌[9]、子宫内膜癌[10]、胃癌[11]中呈低表达,与上述肿瘤的发生发展密切相关。但是,miR-218和miR-152在卵巢癌特别是浆液性卵巢癌的研究报道较少。本研究运用Real-time PCR方法,以正常输卵管伞端组织和良性病变组织为对照,检测了miR-218和miR-152 在正常卵巢组织、良性病变卵巢组织以及浆液性卵巢癌组织的表达情况,分析探讨了其与浆液性卵巢癌病理特征之间的关系以及在浆液性卵巢癌发生发展中的作用。
材料和方法
一、研究对象
正常卵巢组织(正常输卵管伞端上皮组织)、良性病变卵巢组织以及浆液性卵巢癌组织标本取自于本院2008年7 月至2012 年2 月行手术治疗的患者,包括浆液性卵巢癌患者50例、良性上皮性卵巢肿瘤患者20 例以及正常卵巢腹腔镜活检病例10例。所有患者均签署知情同意书。
患者术前均未接受过化疗、放疗或激素治疗,术后均得到病理确诊。组织标本离体后10 min内置于液氮罐内迅速冷冻后置-80 ℃保存。
二、试剂和仪器
Trizol、Taqman miRNA 反 转 录 试 剂 盒 以 及TaqMan®MicroRNA Assays(miR-218,Cat #4427975;miR-152,Cat # 4366596;U6,Cat #4440047)(Life Technologies,美 国);RNase-free H2O(上海生工);荧光定量PCR 仪ABI 7500(ABI,美 国);NanoDrop @ND-1000 紫 外 分 光 光 度 仪(NanoDrop,美国)。
三、Real-time PCR
1.逆转录反应:Trizol法抽提卵巢组织中的总RNA,用TaqMan miRNA 反转录试剂盒中反转录酶和miRNA 特异性茎环结构(stem-loop)反转录引物进行miRNA 反转录反应,操作参照说明书进行。反应体 系 为15μl,包 括3μl 5×反 转 录 引 物、0.15μl 100mmol/L dNTP和dTTP混合物、1μl反转录酶、1.5μl 10×反转录缓冲液、0.19μl RNA 抑制剂以及500ng RNA。反应条件:16 ℃2min,42 ℃1min,50℃1s,上述3步经40个循环反应,再85℃孵育5min。
2.Real-time PCR检测:应用TaqMan MicroRNA试剂盒对合成的cDNA 进行实时定量PCR 反应。反应条件:95 ℃1min变性,95℃15s、60℃20s、70 ℃15s,40个循环,以U6为内参照;分别以2-△Ct法进行数据分析,实验重复3 次,其中,△Ct=Ct(miRNA)-Ct(U6)。TaqMan®MicroRNA Assays所有miRNA 及内参都采用同一个标准反应程序。
四、统计学方法
采用SPSS 11.0软件进行统计学分析。实验数据以均数±标准差表示,采用两独立样本t检验,P<0.05为差异有统计学意义。
结 果
一、一般资料
组织标本来自本院2008年7月至2012年2月行手术治疗的80例患者。患者病历资料完整,术前均未接受放射治疗和化疗,术后均经病理明确诊断。
50例卵巢癌患者中,年龄29~73 岁,平均53岁,FIGO I期9例、Ⅱ期12例、Ⅲ期27例、Ⅳ期2例;10例正常卵巢组织患者年龄34~69岁,平均55岁;20例良性上皮性卵巢肿瘤组织患者年龄31~71岁,平均57岁。
二、卵巢癌、良性卵巢肿瘤及正常卵巢组织中miR-218和miR-152表达
浆液性卵巢癌组织中miR-218 的相对表达量为404.5,显著低于正常卵巢组织(相对表达量为598.7)和良性卵巢肿瘤组织(相对表达量为523.3),差异有统计学意义(分别为P=0.004 和P=0.000)(图1A);浆液性卵巢癌组织中miR-152的相对表达量为382.9,显著低于正常卵巢组织(相对表达量为678.4)和良性卵巢肿瘤组织(相对表达量为587.3),差异有统计学意义(分别为P=0.003和P=0.001)(图1B)。
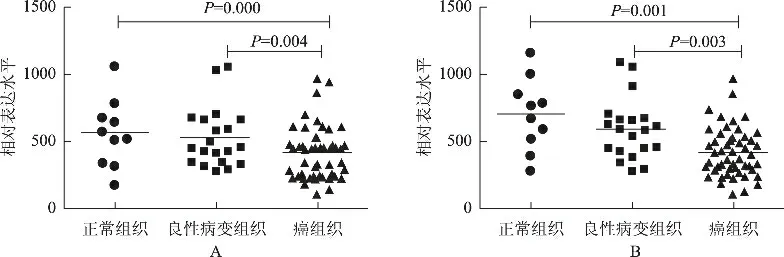
图1 miR-218和miR-152在不同卵巢组织中的表达
三、卵巢癌组织中miR-218和miR-152与临床病理特征的关系
miR-218下调表达程度与卵巢癌恶性程度、肿瘤分化程度以及肿瘤转移情况有关。随着卵巢癌恶性程度的增高,miR-218 表达有下降的趋势,其中III期、IV 期中miR-218表达显著低于I期、II期(P=0.011);在中低分化癌组织中的miR-218表达显著低于高分化癌组织(P =0.023);淋巴转移组miR-218表达显著低于无淋巴转移组(P=0.014)(表1)。
miR-152表达与卵巢癌组织学类型、肿瘤分化程度以及肿瘤转移情况均无显著相关性(P>0.05)(表1)。
表1 浆液性卵巢癌患者临床病理特征与miR-218和miR-152表达的关系(±s)

表1 浆液性卵巢癌患者临床病理特征与miR-218和miR-152表达的关系(±s)
注:与临床病例特征各相应组比较,*P<0.05
临床特征 例数 miR-218表达水平miR-152表达水平年龄(岁) ≥55 39 405.1±0.614 376.1±0.824 <55 11 402.4±1.017 384.6±0.472 TNM 分期 I-II期 40 425.4±1.042* 394.9±0.198 III-IV 期 10 320.9±1.021 379.9±0.861有无淋巴结转移 是 29 299.5±0.271* 397.8±0.104 否 21 549.5±0.613 372.1±1.012细胞分化程度 高 7 618.5±0.714* 406.5±0.121 中-低43 369.6±0.511 379.1±0.638
讨 论
卵巢癌是影响女性生命健康的三大恶性肿瘤之一,具有高度侵袭性和致死率的特点[12-13],寻找有效的诊断及预后评价指标和分子治疗靶标已成为目前卵巢癌分子肿瘤学研究热点。近来miRNAs 成为分子生物学研究的焦点,目前研究表明,miRNA能够在多种肿瘤中调控肿瘤相关基因的表达而影响细胞增殖、凋亡和迁移等生物学行为[13-15]。miRNA表达失调可能是肿瘤发生发展的潜在因素,比如miR-31、miR-100和miR-200的缺失可促进肿瘤的发展,而miR-21、miR-93和miR-199a等miRNA 的过表达,也可以促进肿瘤细胞的增殖[14-15]。因此,miRNAs在卵巢癌中异常表达,在卵巢癌发病机制中发挥举足轻重的作用,也是肿瘤早期筛查的潜在生物标志物。
研究表 明,miR-218在 肾 细 胞 癌[5]、膀 胱 癌[6]、头 颈 鳞 状 细 胞 癌[16]、胃 癌[17]、肺 癌[18]和 卵 巢癌[19-21]等多种恶性肿瘤中表达下调。本研究采用Real time PCR 技 术 检 测 了 正 常 卵 巢 组 织、良 性 病变卵巢组织以及浆液性卵巢癌组织中miR-218的表达,发现miR-218 在卵巢癌组织中的表达量明显低于正常卵巢组织和良性卵巢肿瘤组织,miR-218 可能作为抑癌基因调节卵巢癌的发生发展过程。
miR-152前体位于人类17 号染色体上,是miR-148/152家族成员之一[20]。miR-152在多种肿瘤中被证实为肿瘤相关miRNA,可以影响肿瘤细胞的生长和转移。miR-152 在多种肿瘤如卵巢癌[21-23]、子 宫 内 膜 癌[10]、胃 癌[11]呈 低 表 达,可 通 过作用其靶点DNA 甲基化转移酶1在胃癌中发挥重要的作用[11]。本研究结果发现,miR-152在卵巢癌组织中的表达显著低于正常卵巢组织和良性卵巢肿瘤组织(P<0.01),提示miR-152也可能作为抑癌基因调节卵巢癌的发生发展过程。
本研究中也进行了miR-218 和miR-152 与临床病理特征的关系研究。在与临床病理特征的相关性分析中我们发现,miR-218随着浆液性卵巢癌的临床分期进展和恶性程度增高如淋巴结转移而表达降低,表明miR-218表达与卵巢癌临床进展及转移呈负相关,与病理分化程度呈正相关。而miR-152在浆液性卵巢癌中的表达与其各临床病理特征之间无统计学相关,提示miR-152可能主要在浆液性卵巢癌的发生过程中起作用,而与其发展、转移、侵袭及预后等临床进展无关。
综上所述,miR-218和miR-152在浆液性卵巢癌组织中的表达与在正常卵巢组织和良性病变组织中的表达存在差异,且miR-218表达水平与患者临床进展呈负相关,提示miR-218和miR-152可能成为潜在的卵巢癌诊断和预后判断标志物和治疗靶点。
[1] Syrios J,Banerjee S,Kaye SB.Advanced epithelial ovarian cancer:from standard chemotherapy to promising molecular pathway targets-where are we now?[J].Anticancer Res,2014,34:2069-2077.
[2] Marsh DJ,Shah JS,Cole AJ.Histones and their modifications in ovarian cancer-drivers of disease and therapeutic targets[J].Front Oncol,2014,4:144.
[3] Bartels CL,Tsongalis GJ.MicroRNAs:novel biomarkers for human cancer[J].Clin Chem,2009,55:623-631.
[4] Visone R,Croce CM.MiRNAs and cancer[J].Am J Pathol,2009,174:1131-1138.
[5] Yamasaki T,Seki N,Yoshino H,et al.MicroRNA-218 inhibits cell migration and invasion in renal cell carcinoma through targeting caveolin-2 involved in focal adhesion pathway[J].J Urol,2013,190:1059-1068.
[6] Zhao Y,Li Y,Wang L,et al.MicroRNA response elementsregulated TRAIL expression shows specific survivalsuppressing activity on bladder cancer[J].J Exp Clin Cancer Res,2013,32:10.
[7] 饶玉梅,纪妹,史惠蓉,等.miR-218靶向Wnt2B抑制卵巢癌细胞转移侵袭功能[J].华中科技大学学报(医学版),2013,42:656-658.
[8] Chen Y,Song Y,Wang Z.Altered expression of MiR-148a and MiR-152 in gastrointestinal cancers and its clinical significance[J].J Gastrointest Surg,2010,14:1170-1179.
[9] 娄艳辉,杨兴升,王福玲,等.miR-21在上皮性卵巢癌组织中的表 达 及 临 床 意 义[J].南 方 医 科 大 学 学 报,2010,30:608-632.
[10] Tsuruta T,Kozaki K,Uesugi A,et al.miR-152is a tumor suppressor microRNA that is silenced by DNA hypermethylation in endometrial cancer[J].Cancer Res,2011,71:6450-6462.
[11] Chen Y,Song Y,Wang Z,et al.Altered expression of MiR-148aand MiR-152in gastrointestinal cancers and its clinical significance[J].J Gastrointest Surg,2010,14:1170-1179.
[12] 刘菲,姚丽,张佳瑞,等.miR-129-1-3p在浆液性卵巢癌中的表达及临床意义[J].现代肿瘤医学,2014,22:1921-1924.
[13] 陈凯英,方美玉.培美曲塞联合卡铂治疗铂类敏感复发转移卵巢癌38例临床观察[J].生殖医学杂志,2014,23:490-494.
[14] Hede K.MicroRNAs as Onco-miRs,drivers of cancer[J].J Natl Cancer Inst,2010,102:1306-1308.
[15] 洪甲,姚丽,张佳瑞,等.miR-450a-5p在浆液性卵巢癌中的表达 及 临 床 意 义[J].现 代 生 物 医 学 进 展,2014,14:3240-3243.
[16] Kinoshita T,Hanazawa T,Nohata N,et al.Tumor suppressive microRNA-218inhibits cancer cell migration and invasion through targeting laminin-332in head and neck squamous cell carcinoma[J].Oncotarget,2012,3:1386-1400.
[17] Tie J,Pan Y,Zhao L,et al.MiR-218inhibits invasion and metastasis of gastric cancer by targeting the Robo1receptor[J].PLoS Genet,2010,6(3):e1000879.
[18] Davidson MR,Larsen JE,Yang IA.MicroRNA-218is deleted and downregulated in lung squamous cell carcinoma[J].PLoS One,2010,5(9):e12560.
[19] Xiang Y,Ma N,Wang D,et al.MiR-152and miR-185cocontribute to ovarian cancer cells cisplatin sensitivity by targeting DNMT1 directly:a novel epigenetic therapy independent of decitabine[J].Oncogene,2014,33:378-386.
[20] Irio MV,Visone R,DiLeva G,et al.MicroRNA signatures in human ovarian cancer[J].Cancer Res,2007,67:8699-8707.
[21] 娄艳辉,王福玲,崔竹梅,等.微小RNA-21与PTEN 在上皮性卵巢癌组织中的表达及临床意义[J].现代生物医学进展,2010,10:2851-2854.
[22] Zhou X,Zhao F,Wang ZN,et al.Altered expression of miR-152 and miR-148a in ovarian cancer is related to cell proliferation[J].Oncol Rep,2012,27:447-454.
[23] Braconi C,Huang N,Patel T.MicroRNA-dependent regulation of DNA methyltransferase-1and tumor suppressor gene expression by interleukin-6 in human malignant cholangiocytes[J].Hepatology,2010,51:881-890.

