囊胚滋养层细胞评分与移植后第7日血β-HCG 和妊娠结局的关系
王雪,甄璟然,孙正怡,郁琦,邓成艳,周远征,王含必,何方方
(中国医学科学院,北京协和医学院,北京协和医院妇产科生殖中心,北京 100730)
近年来随着胚胎培养液体系和培养环境的改善,越来越多的中心进行囊胚培养,而且为了避免多胎,开始尝试单囊胚移植。囊胚培养过程中,囊胚的形态学评分非常重要。目前世界范围内主要采用的评分方法是Gardner的评分方法,该方法对囊胚的扩张状态、内细胞团和滋养层细胞进行评分[1]。β-人绒毛膜促性腺激素(β-HCG)是由囊胚的滋养层细胞分泌的一种糖蛋白类激素,当胚胎在囊胚期着床后,合体滋养层细胞开始产生HCG。在临床上β-HCG 是评估早期妊娠的重要指标之一[2]。β-HCG最早可在受精后第6日的母体外周血中测出,在辅助生殖操作中,通常在患者进行胚胎移植后第7天后进行血清β-HCG 的检测,以初步判断妊娠情况[3]。本研究回顾性分析了2005年1月至2014年12月进行复苏囊胚移植的患者临床资料,分析囊胚Gardner评分中滋养层细胞的分级与移植后第7日血β-HCG 值和妊娠结局的关系,旨在探讨Gardner评分对预测单囊胚移植的妊娠结局的价值,为将来的单囊胚移植提供理论依据。
资料和方法
一、研究对象
回顾性分析2005年1月至2014年12月在本生殖中心进行复苏囊胚移植患者的临床资料。纳入标准:(1)新鲜周期的不育原因为:①输卵管因素;②子宫内膜异位症及子宫腺肌症;③男方因素;④排卵障碍(包括多囊卵巢综合征等);⑤不明原因不孕。(2)每次只移植1 枚囊胚。(3)复苏囊胚移植后第7日查HCG 显示生化妊娠者。排除移植2枚及以上胚胎的患者,排除HCG 日显示未妊娠的患者。根据Gardner评分法,按照滋养层细胞的级别(A、B、C)分为三组,第一组定义为A 组,即滋养层细胞级别为A 级的患者;第二组定义为B 组,即滋养层细胞级别为B 级的患者;第三组为C 组,即滋养层细胞级别为C级的患者。
二、研究方法
1.体外受精(IVF)治疗方案:所采用的超排卵方案按照本中心的常规进行,获卵后根据患者情况采用自然授精或卵胞浆内单精子注射(ICSI)授精,取卵24h后观察受精情况,72h观察卵裂球胚胎情况,根据胚胎评分情况决定移植,移植后剩余的胚胎经患者知情同意后全部进行囊胚培养,在受精后第5日或第6日分别观察囊胚形成情况及形态,并进行冷冻保存。
2.囊胚评分及冷冻标准:采用Gardner评分系统对囊胚进行评分[1]。首先根据囊腔扩张程度进行分期,囊腔不足胚胎的50%为1 期,囊腔超过胚胎的50%为2期,囊腔占满整个胚胎为3 期,囊胚扩张透明带变薄为4期,囊胚开始孵化为5期,囊胚完全孵出为6期,对4~6期的囊胚进一步评价。内细胞团(inner cell mass,ICM)评分:A,细胞数目多,排列紧密;B,细胞数目较少,排列松散;C,细胞数目很少;滋养外胚层细胞(trophectoderm,TE)评分:A,细胞数目多,囊腔四周均有细胞,排列紧密;B,细胞数较少,排列较松;C,细胞数目很少。由于此前的观察发现早期囊胚及孵出的囊胚冷冻后复苏率不理想,因此本中心均在囊胚发育到4期时进行冷冻保存。挑选内细胞团质量达到A 或B 级的囊胚进行冷冻,C级的囊胚放弃,而滋养层细胞的质量不限。
3.囊胚冷冻:本中心全部采用玻璃化冷冻方法进行胚胎冷冻。具体方法如以往文章所述[4-5],囊胚冷冻之前进行人工皱缩,然后将囊胚放入含有7.5%(v/v)DMSO 和7.5%(v/v)乙二醇的预平衡液中平衡2min,之后将胚胎转移入玻璃化冷冻液(15%(v/v)DMSO+15%(v/v)乙二醇+0.65mol/L蔗糖+10mg/ml Ficoll)中平衡30s,将胚胎转移至冷冻环(cryoloop环)上,直接浸入液氮保存。
4.胚胎复苏:在冻融囊胚移植当天进行。在囊胚复苏之前,准备囊胚复苏液,在胚胎培养皿内依次配制含有0.33mol/L的蔗糖溶液,0.2mol/L 的蔗糖溶液和基础培养液(G-MOPS Plus,Vitrolife,瑞典),将含有囊胚的冷冻环从液氮中取出,在空气中停留5s后,直接将胚胎浸入上述复苏液中,时间依次为2min、3min和5min。将复苏后的囊胚全部进行激光辅助孵化,选择在远离细胞团的透明带上部位切割透明带的1/4左右。将囊胚移入提前准备好的囊胚培养液(G2,Vitrolife,瑞典)中,放入37℃、6%CO2和5%O2的培养箱内培养2h,移植前评估胚胎的存活情况,囊胚腔重新扩张判断为囊胚存活。
5.子宫内膜准备及胚胎移植:本研究中患者的子宫内膜准备方法分为两种:(1)自然周期法:用于月经周期规律,排卵正常的患者,在排卵前注射HCG 2 000U(艾泽,默克雪兰诺,德国),之后超声监测到卵泡破裂后开始给予黄体支持,肌注黄体酮(浙江仙琚)20~40 mg/d,在排卵后第6 日移植胚胎。(2)人工周期法:月经第2~4 日常规B 超检查,口服戊酸雌二醇(补佳乐,先灵,德国),根据患者以往的内膜情况,选择不同的起始剂量(2~18mg/d)。B超监测内膜,当内膜厚度达到8mm 时肌注黄体酮(20mg×2d、40mg×2d、20~40mg×1d),第6日进行囊胚复苏移植。胚胎移植均在B超引导下进行,每周期移植1个胚胎。移植后常规采用肌注黄体酮进行黄体支持。
6.妊娠结局的判断:移植后第7 日测血清HCG>5 U/L 则判断为生化妊娠,若移植后25~30d超声检查,可见胎心和胎囊则判断为临床妊娠。移植后第7日判断为生化妊娠而之后超声检查未见胎囊者定义为极早期妊娠丢失。确定临床妊娠后发生流产的患者所占的比例,定义为流产率。将生化妊娠组和胚胎停育组定义为妊娠不良组,其余定义为继续妊娠组,继续妊娠组患者所占的比例称为继续妊娠率。
7.血清β-HCG 的测定:患者在进行冻融囊胚移植后第7日抽血,离心取血清测定血清β-HCG 的水平,测定方法为化学发光法,测定试剂盒为美国Beckman公司产品,操作按照说明书进行。
三、统计学分析
采用SPSS22.0 软件进行统计学分析,进行t检验、卡方检验和Kruskal-Wallis非参的检验,并进行多因素Logistic回归分析。P<0.05为差异有统计学意义。
结 果
一、一般情况
按照上述标准共纳入201例患者,202 个冻融移植周期。复苏囊胚205个,复苏后1枚胚胎未扩张,丢弃,其余囊胚腔均扩张,复苏成活率99.5%。另外有2例患者坚决要求移植1枚胚胎,将另外一枚丢弃。
二、复苏周期资料比较
依据滋养层细胞级别分为A、B和C三组,其中纳入的例数分别为35、104和63;三组患者的复苏囊胚时年龄分别为(33.2±4.4)岁、(34.8±9.1)岁和(34.0±4.5)岁,三组间无显著性差异;C 组胚胎的冻存时间(256.2±210)d,略低于A 组和B 组[(357.6±480.8)d、(367.5±474.5)d],但差异无统计学意义(P>0.05)。三组的内膜准备方案和移植日内膜厚度均无明显的统计学差异。根据滋养层细胞的评分,移植后第7 日血HCG 呈明显的递减趋势,A 组、B 组和C 组分别为(288±433.1)U/L、(90.8±172.1)U/L、(60±102.9)U/L,且三组间差异有统计学意义(P<0.05)(表1)。
表1 三组复苏周期资料比较[(±s),n(%)]
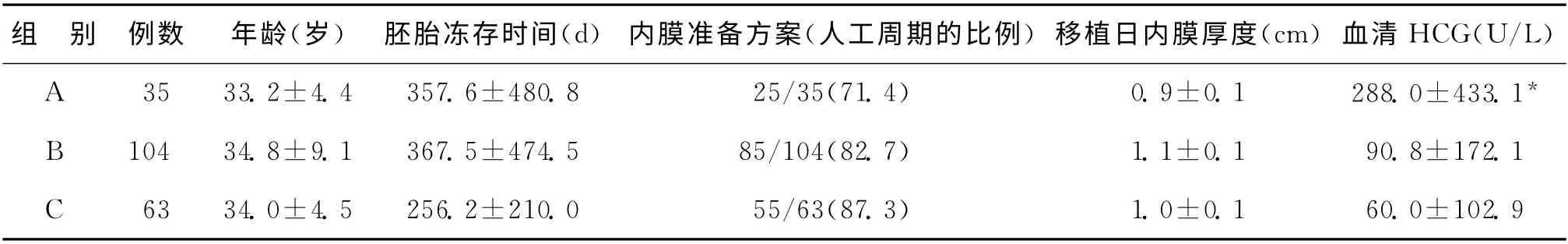
表1 三组复苏周期资料比较[(±s),n(%)]
注:与B、C组比较,*P<0.05
组 别 例数 年龄(岁) 胚胎冻存时间(d) 内膜准备方案(人工周期的比例)移植日内膜厚度(cm)血清HCG(U/L)A 35 33.2±4.4 357.6±480.8 25/35(71.4) 0.9±0.1 288.0±433.1*B 104 34.8±9.1 367.5±474.5 85/104(82.7) 1.1±0.1 90.8±172.1 C 63 34.0±4.5 256.2±210.0 55/63(87.3)1.0±0.1 60.0±102.9
三、妊娠结局比较
在C组中极早期妊娠丢失率为30.2%,明显高于A 组 和B 组(分 别 为11.4%和9.6%)(P <0.05)。A 组的流产率略低于B 组和C 组,但无显著性差异(P>0.05)。把生化妊娠组和胚胎停育组定义为妊娠不良组,其余为继续妊娠组,经统计学分析发现A 组和B 组的继续妊娠率显著高于C 组(P 均<0.05),但A 和B组之间无统计学差异(P>0.05)(表2)。按照内细胞团的A 和B级进行分组,发现两组之间的妊娠结局无显著性差异(表2)。将是否发生极早期妊娠丢失,确定临床妊娠后是否发生流产和是否继续妊娠作为因变量,内细胞团、滋养层细胞的评分和年龄作为自变量进行Logistic回归分析。我们发现滋养层细胞的质量对极早期妊娠丢失率的影响最大,比值比(OR)为2.299,且有统计学意义(P=0.012),而ICM 和年龄与极早期妊娠丢失率无显著性相关。TE、ICM 和年龄与流产率无明显的相关性。在分析继续妊娠率时发现,滋养层细胞的质量显著影响继续妊娠率(P=0.017),而内细胞团和年龄对继续妊娠率无显著影响(表3、4、5)。

表2 三组妊娠结局比较[n(%)]
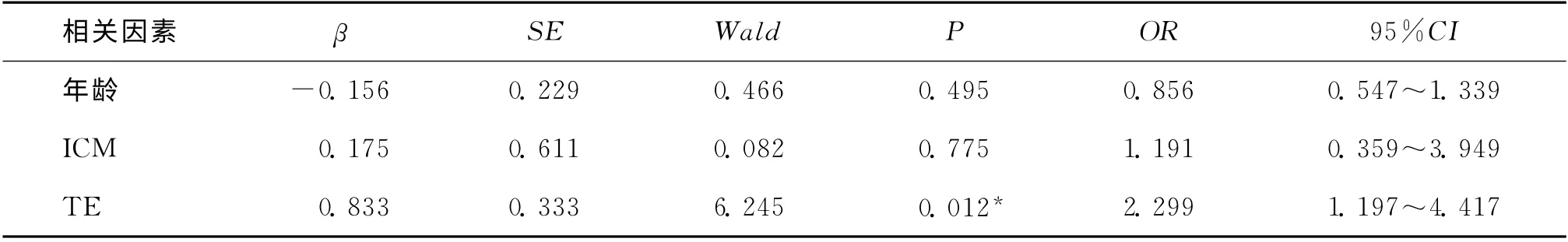
表3 年龄、ICM 和TE对极早期妊娠丢失率影响的Logistic分析
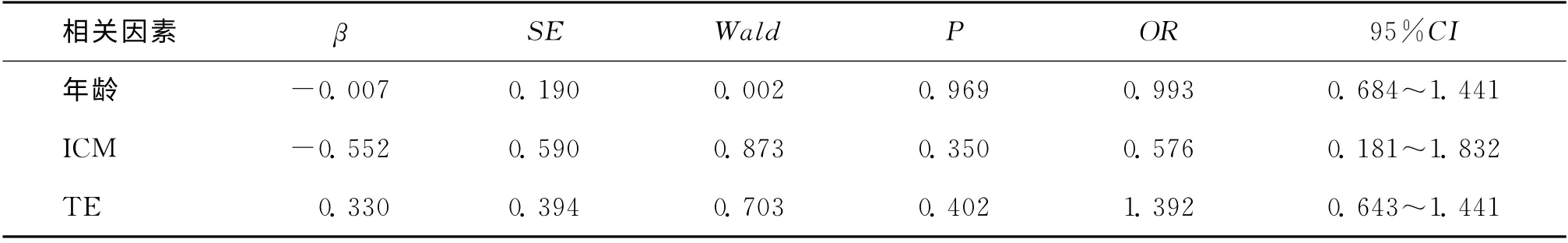
表4 年龄、ICM 和TE对流产率影响的Logistic分析
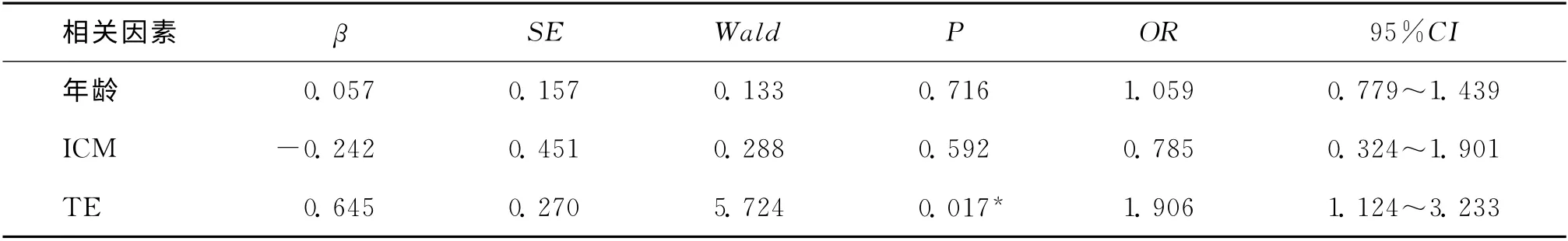
表5 年龄、ICM 和TE对继续妊娠率影响的Logistic分析
讨 论
囊胚在体外培养过程中经历了胚胎的再次选择,因此囊胚移植能够达到更高的妊娠率和活产率。但是怎样挑选囊胚是目前面临的主要问题。囊胚的形态学评分是应用最多的无创性评价方法。目前应用最广泛的是1999年Gardner等[1]提出的囊胚评分法。此评分体系需要对囊胚的三个参数进行评估,包括囊胚腔的扩张程度(分为1~6级),内细胞团质量(根据细胞的数量和紧密程度分为A、B 和C)和滋养层细胞质量(根据细胞的数量和紧密程度分为A、B和C)。有研究提示囊胚的扩张程度对囊胚的种植非常重要[6-7]。但也有研究发现胚胎的扩张程度与妊娠结局无明显的相关性[6]。在我们之前的研究中,发现4期的囊胚冷冻复苏后复苏成活率最高,而且冷冻复苏后胚胎的质量几乎没有明显变化,因此我们在囊胚发育到4期后再进行冷冻保存。因此本研究没有分析囊胚的扩张程度与妊娠的关系。另外,在胚胎培养过程中多数囊胚的内细胞团质量都为A 或B级,极少数形成C 级的囊胚,若内细胞团质量为C 级时,胚胎的种植潜能极差,因此在挑选胚胎冷冻时放弃内细胞团质量为C 级的胚胎。在本研究中所有胚胎质量均为4AX 或4BX,因此,在本文中我们着重分析滋养层细胞与妊娠早期β-HCG与妊娠的关系。
在本研究中只挑选复苏单囊胚移植后第7日查血显示生化妊娠阳性的患者来分析,发现三组血清β-HCG 的水平有明显的统计学差异,随着滋养层细胞级别的降低,移植后第7日血清β-HCG 的水平显著降低。可见Garedner评分法与移植后第7日血清β-HCG 值相一致。早期的研究证实在胚胎的发育过 程 中β-HCG 的 分 泌 很 早[8],1999 年Andrea等[9]证实2-细胞阶段胚胎已经出现β-HCG mRNA表达,其表达量随胚胎发育快速、稳定增加。有研究显示在受精后第6日,囊胚的滋养外胚层细胞开始分泌微量HCG,HCG 的产生直接与滋养层细胞的数量和发育有关,被认为是早期预测妊娠结局的一个最有价值的生化指标,而且随着胚胎滋养层细胞数目的增加和进一步发育,其分泌β-HCG 能力显著增强[10]。但是不是β-HCG 的水平越高胚胎质量越好,还有待于进一步研究。众所周知,囊胚最早分化出两种不同类型的细胞,一种为内细胞团细胞,将来发育为胎儿部分,另一部分为滋养层细胞,将来发育为胎儿的胎盘。滋养层细胞在胚胎移植后胚胎的种植早期发挥了重要作用,包括HCG 介导的信号通路,胚胎从透明带中孵出,胚胎的粘附和侵入子宫内膜以及与母胎对话等[11-14],所有的这些功能对一次成功妊娠的稳定和防止流产都是非常重要的。
囊胚的Gardner评分系统在世界范围内已经应用了10多年,已经有一些研究来分析囊胚的评价参数与妊娠结局的关系。关于囊胚期别对妊娠结局的影响存在很多争议,本研究都是利用的4期囊胚,因此尚未探讨囊胚期别对妊娠结局的影响。有研究发现内细胞团质量与妊娠结局呈正相关,认为内细胞团是将来发育为胎儿的部分,对妊娠结局更重要[15-17]。也有研究发现内细胞团的质量与妊娠结局无明显的相关性[18-19]。在本研究中,发现内细胞团为A 或B时,两组的极早期妊娠丢失率、流产率和继续妊娠率均无明显的统计学差异,而且在做回归分析时也未发现内细胞团质量与极早期妊娠丢失率和继续妊娠率有相关性,也可能是与我们囊胚评分有关,因为我们在新鲜周期进行囊胚冷冻时,考虑到内细胞团质量太差,质量为C 级的囊胚可能会影响将来胎儿的发育,在本中心这类囊胚均未进行冷冻,因此可能会存在一定的误差。近年来很多研究发现,滋养层细胞的形态学能够预测IVF 的妊娠结局,发现TE的形态学与胚胎的种植率、妊娠率呈正相关[18,20];Ahlström 等[18]认 为TE 的 形 态 学 与 活产率呈明显的正相关;Honnma等[19]发现TE 的形态学与继续妊娠率呈明显的正相关。这与我们的研究结论相似,我们发现随着滋养层细胞的评分降低,极早期妊娠丢失率明显升高,而继续妊娠率明显降低。在本回归分析中,若调整ICM 和年龄等混杂因素后发现,随着TE 的形态与极早期妊娠丢失率和继续妊娠率呈明显的相关性,但是内细胞团和年龄与极早期妊娠丢失率和继续妊娠率均无相关性。分析原因可能与以下几点相关:①TE 细胞能够产生HCG,而且高级别的滋养层细胞分泌HCG 时间更早,分泌量更多,HCG 能够刺激黄体合成和分泌更多孕激素,能够调节子宫内膜对植入胚胎的容受性,HCG 在母胎对话和成功维持妊娠中发挥着重要作用[12,22]。②Parks等[14]对 滋 养 层 细 胞 进 行 活 检 发现,每一个囊胚的基因表达情况与其结局相关,包括胚胎种植以及妊娠丢失等。另外,Alfarawati等[13]发现滋养层细胞非整倍体的发生率与囊胚的形态呈明显的相关性。他们发现与滋养层细胞A 级相比,滋养层细胞C 级胚胎发生非整倍体的比例增加2.5倍,他们认为挑选高质量的囊胚可以避免严重的染色体异常,从而减少流产率。这也比较好地解释了为什么滋养层细胞质量越差,越容易发生极早期妊娠丢失。
总之,本研究利用复苏单囊胚移植,进一步证实了Gardner囊胚评分系统的应用与临床结局的关系,我们发现挑选高质量滋养细胞的囊胚能够避免极早期妊娠丢失,能够提高继续妊娠率。当然,本研究还有一定的局限性,如本研究中内细胞团的评分只有A 和B,可能存在一定的偏倚,还有待于进一步的研究。
[1] Gardner DK,Lane M,Stevens J,et al.Blastocyst score affects implantation and pregnancy outcome:towards a single blastocyst transfer[J].Fertil Steril,2000,73:1155-1158.
[2] Delbaere I,Vansteelandt S,Gerris J,et al.Human chorionic gonadotropin levels in early IVF/ICSI pregnancies are higher in singletons after single embryo transfer compared with singletons after double embryo transfer[J].Hum Reprod,2008,23:2421-2426.
[3] Carmona F,Balasch J,Creus M,et al.Early hormonal markers of pregnancy outcome after in vitro fertilization and embryo transfer[J].J Assist Reprod Genet,2003,20:521-526.
[4] 甄璟然,王雪,孙正怡,等.复苏单囊胚移植周期中囊胚形态学评分对临床妊娠的影响[J].生殖医学杂志,2014,23:7-10.
[5] 王雪,甄璟然,孙正怡,等.囊胚发育速度对冻融移植结局的影响[J].生殖医学杂志,2014,23:356-360.
[6] Van den Abbeel E,Balaban B,Ziebe S,et al.Association between blastocyst morphology and outcome of singleblastocyst transfer[J/OL].Reprod Biomed Online,2013,27:353-361.
[7] Shapiro BS,Daneshmand ST,Garner FC,et al.Large blastocyst diameter,early blastulation,and low preovulatory serum progesterone are dominant predictors of clinical pregnancy in fresh autologous cycles[J].Fertil Steril,2008,90:302-309.
[8] Lopata A,Hay DL.The potential of early human embryos to form blastocysts,hatch from their zona and secrete HCG in culture[J].Hum Reprod,1989,4:87-94.
[9] Jurisicova A,Antenos M,Kapasi K,et al.Variability in the expression of trophectodermal markers beta-human chorionic gonadotrophin,human leukocyte antigen-G and pregnancy specific beta-1 glycoprotein by the human blastocyst[J].Hum Reprod,1999,14:1852-1858.
[10] Poikkeus P,Hiilesmaa V,Tiitinen A.Serum HCG 12days after embryo transfer in predicting pregnancy outcome[J].Hum Reprod,2002,17:1901-1905.
[11] Jones GM,Cram DS,Song B,et al.Novel strategy with potential to identify developmentally competent IVF blastocysts[J].Hum Reprod,2008,23:1748-1759.
[12] Tsampalas M,Gridelet V,Berndt S,et al.Human chorionic gonadotropin:a hormone with immunological and angiogenic properties[J].J Reprod Immunol,2010,85:93-98.
[13] Alfarawati S,Fragouli E,Colls P,et al.The relationship between blastocyst morphology,chromosomal abnormality,and embryo gender[J].Fertil Steril,2011,95:520-524.
[14] Parks JC,McCallie BR,Janesch AM,et al.Blastocyst gene expression correlates with implantation potential[J].Fertil Steril,2011,95:1367-1372.
[15] Richter KS,Harris DC,Daneshmand ST,et al.Quantitative grading of a human blastocyst:optimal inner cell mass size and shape[J].Fertil Steril,2001,76:1157-1167.
[16] Goto S,Kadowaki T,Tanaka S,et al.Prediction of pregnancy rate by blastocyst morphological score and age,based on 1 488single frozen-thawed blastocyst transfer cycles[J].Fertil Steril,2011,95:948-952.
[17] Zhang H,Zhou Y,Li Y,et al.Prediction of clinical pregnancy in vitrified-warmed single blastocyst transfer cycles by prefreeze morphology[J].Iran J Reprod Med,2014,12:567-572.
[18] Ahlström A,Westin C,Reismer E,et al.Trophectoderm morphology:an important parameter for predicting live birth after single blastocyst transfer[J].Hum Reprod,2011,26:3289-3296.
[19] Honnma H,Baba T,Sasaki M,et al.Trophectoderm morphology significantly affects the rates of ongoing pregnancy and miscarriage in frozen-thawed single-blastocyst transfer cycle in vitro fertilization[J].Fertil Steril,2012,98:361-367.
[20] Hill MJ,Richter KS,Heitmann RJ,et al.Trophectoderm grade predicts outcomes of single-blastocyst transfers[J].Fertil Steril,2013,99:1283-1289.
[21] Licht P,Russu V,Wildt L.On the role of human chorionic gonadotropin (hCG ) in the embryo-endometrial microenvironment:implications for differentiation and implantation[J].Semin Reprod Med,2001,19:37-47.

