多杀性巴氏杆菌毒力因子及基因表达的研究进展
李卉
(西南大学动物科技学院 重庆 北碚400715)
多杀性巴氏杆菌是巴氏杆菌属重要的致病菌,以其菌体抗原区分为16个血清型,菌体呈细小球杆状或短杆状,两端钝圆,在培养物中呈圆形、卵圆形或杆状,瑞氏染色或美兰染色可见明显的两极着色,为革兰阴性菌。
1 毒力因子
1.1毒力因子概述
致病菌要成功侵袭宿主,首先要突破宿主机体防御系统,进行吸附和侵入,并能在其中繁殖与扩散,同时还要抵御宿主免疫系统的防御,这样致病菌才能最终获得存活所需的营养条件、定居下去。疾病发生一方面与宿主自身抵抗力和遗传因素有关,另一方面受细菌毒力因子影响。有些毒力因子本身还具有免疫原性,可为研究防治疾病的疫苗提供理论基础。
1.2毒力因子的归纳性对比
随着现代生物技术飞速发展,各种多杀性巴氏杆菌的毒力因子纷纷浮出水面,其中最主要的4种为荚膜、外膜蛋白、脂多糖、皮肤坏死毒素,而溶血素、胞外酶、透明质酸酶[1]可能作为毒力因子,这里也作介绍。
众多文献采用逐一罗列的方式叙述毒力因子详情,现总结为如下表格。
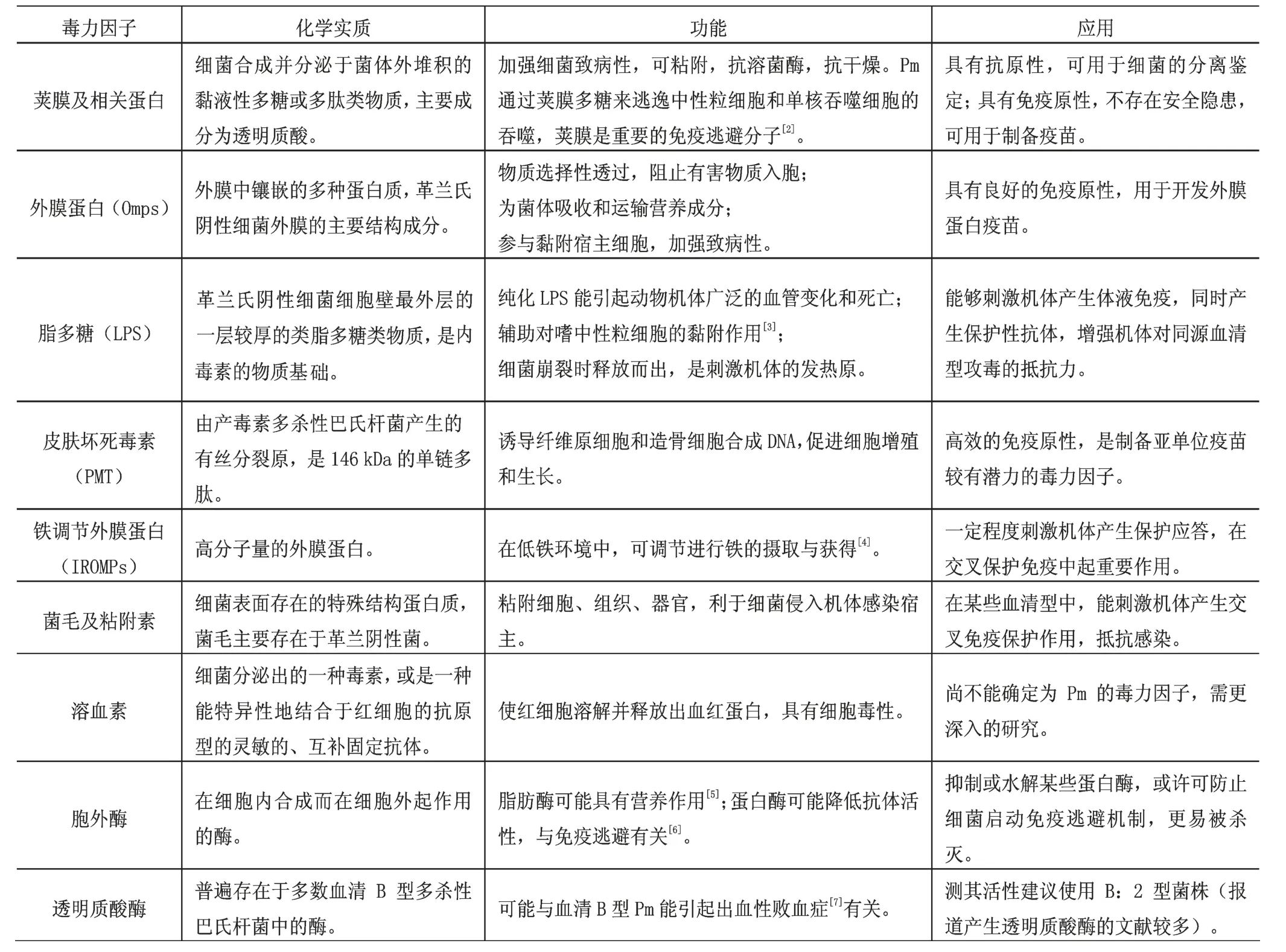
?
以上毒力因子各有特点,细菌致病性的强弱是多种因子共同作用的结果。将它们分开来逐个细致研究,筛选出免疫原性较强的毒力因子,可推动高效亚单位疫苗的开发利用。
2 多杀性巴氏杆菌体内表达基因技术
2.1体内表达技术(IVET)
多杀性巴氏杆菌外膜蛋白基因分析的研究来源于基因的体内表达技术(in vivo expression technology),IVET体内表达基因是指能在宿主体内环境下表达,而在宿主体外环境不能表达的病原菌基因[8]。病原菌在宿主体内、外生活环境差异明显,细菌会对自身基因表达做出一系列适应性改变。由于宿主体内免疫反应过程十分复杂,基因若在体外表达,就不能精准重现宿主与细菌的相互关联,所以IVET技术对于筛选出在宿主体内被激活的基因具有显著效果。
早在2001年,Mahan等人最先提出体内表达技术(IV ET),并用其来鉴定细菌体内表达基因。Hunt等人[9]使用IVET技术通过建立禽多杀性巴氏杆菌体内表达基因筛选系统,成功筛选到十几个基因,并初步推测这些基因可能与细菌编码外膜蛋白、催化生物新陈代谢的酶等功能有关。
2.2信号标签突变技术(STM)
STM是一种有效的负向选择法,广泛用于决定病原能否在宿主体内成功定殖的基因筛选[10]。Ful ler等人[11]在2000年使用信号标签突变技术(STM)从牛多杀性巴氏杆菌中成功筛选出20多个体内表达基因,并对这些基因的表达产物进行了细致的功能预测。
2.3 DNA微阵列(DNA Microarray)技术
DNA Micmarray又名寡核苷酸阵列(Ol igonucleitide ar ray)[12]。该技术的基本原理是在固体表面上集成已知序列的基因探针,被测生物细胞或组织中大量标记的核酸序列与上述探针阵列进行杂交,通过检测相应位置杂交探针,实现基因信息的快速检测[8]。2002年,Boyce等人[13]使用DNA微阵列技术,通过雏鸡建立起自然感染模型,对禽多杀性巴氏杆菌进行了体内表达基因的筛选研究,并提出理论——在宿主体内高水平表达的病原菌基因很有可能就是其毒力基因。
2.4体内诱导抗原技术(IVIAT)
IVIAT的基本原理是通过利用已感染过目标病原的宿主血清来研究宿主体内特异性表达的病原基因。Handfield等人[14]在研究空腔病原菌时发现了116个体内诱导表达的抗原,并从中得到11个新的IVI基因,同时提出了IVIAT的概念。如今来看,应用该技术对Pm体内表达基因的筛选具有重要的借鉴意义。
3 展望
针对Pm虽已有多种疫苗成功取得效果并对疾病发展有一定控制,如多种灭活、弱毒菌苗、荚膜亚单位疫苗和高免血清等。但由于Pm血清型多达16种而疫苗免疫谱窄,只可对同型毒株有免疫效果,且保护期短,易出现耐药性等原因,多杀性巴氏杆菌病仍在多地区时有发生。随着毒力因子研究更加深入,构建多价融合性外膜蛋白菌株或许为制备具交叉免疫保护性的亚单位疫苗指明了方向。与此同时,研究毒力因子的功能与特性、体内表达基因的提取、鉴定和筛选等,对于阐明Pm致病机理有推动性作用,也促进研制出高效、安全、廉价的疫苗,使控制多杀性巴氏杆菌病成为可能。
[1]蔡广强.多杀性巴氏杆菌毒力因子研究进展,上海畜牧兽医通讯[J].2013,6:7-9.
[2]Boyce J D,Adler B.The capsule is a virulence determinant in the pathogenesis of Pasteurel lamul tocida M1404(B:2)[J].Infect Immun,2000,68(6):3463~3468.
[3]Galdiero M,Folgore A,Nuzzo,et a1.Adhesion and transmigration through bovine endothelial cel ls in vitro by protein Hand LPSof Pasteurel lamul tocida[J].Immuno,2004,202(3):226~238.
[4]Ramdani,Adler B.Opsonic monoclonal antibodies against l i popol ysacchari de(LPS)antigens of Pasteurel la multocida and the role of LPSin immunity[J].Vet Microbiol,1991,26:335~347.
[5]Pratt J,Cooley JD,Purdy CW,et a1.Lipase activity f romst rains of Pasteurel la mul tocida [J].Curr MicrobioI,2000,40(5):306~309.
[6]Negrete—Abascal E,Tenorio V R,de la Garza M.Secretion of proteases f rom Pasteurel la mul tocida isolates [J].Cur r Microbiol,1999,38(1):6 4~6 7.
[7]Car ter GR,Chengappa MM.Hyaluronidase production by type B Pasteurel la mul tocida f rom cases of hemor rhagic septicemia[J].J Clin Microbiol,1980,11:94~96.
[8]黄先奇,沈爱梅,廖艳,叶鹏.多杀性巴氏杆菌体内表达基因的研究进展[J].畜禽业,2011,10:34-35.
[9]Hunt,M.L.,D.J.Boucher,J.D.Boyce,and B.Adler.2001.In vivo-expressed genes of Pasteurel lamul tocida.Infect.Immun.69:3004-3012.
[10]赫明雷,刘思国.信号标签诱导技术的研究进展[J].专论与综述,2008,9:5-6.
[11]Troy E. Ful ler, Michael J. Kennedy &David E. Lowery.Identi fication of Pasteurel la mul tocida virulence genes in a septicemic mouse modelusing signature-tagged mutagenesis.Microbial Pathogenesis[J],2000,29(10):25-38.
[12]Shalon,D.,1995.“DNAmicro arrays:A new tool for genetic analysis.”Ph.D.thesis,Stanford University,Stanford,CA.
[13]John D.Boyce,Ian Wi lkie,Marina Harper,etal.Genomic Scale Analysis of Pasteurel la multocida Gene Expression during Growth within the Natural Chicken Host[J].Infection and Immunity,2002,12(7):6871-6879.
[14]Handfield,M.,D.E.Lehoux,F.Sanschagrin,M.J.Mahan,D.E.Woods, and R. C. Levesque. 2000. In vivo-induced genes inPseudomonas aeruginosa.Infect.Immun.68:2359-2362.

