基于层状二硫化钼-石墨烯构建新型17β-雌二醇电化学生物传感器
骆定法,刘 雪
(信阳师范学院 化学化工学院,河南 信阳 464000)
0 引言
17β-雌二醇是一种环境激素,它会扰乱人体的内分泌系统,进而对人的生殖、成长和发展产生负面影响,也会对后代的健康带来极大的隐患[1],因此,发展构建用于高灵敏检测17β-雌二醇的分析方法十分重要.传统的用于17β-雌二醇测定的分析方法包括高效液相色谱 (HPLC) 和气相色谱-质谱 (GC-MS) 联用技术[2-3],基于适配体的电化学生物传感器受到很多研究者的关注,适配体是一种人工合成的单链寡核苷酸,在生物传感器中可以为目标物的分析提供简单快速,且灵敏度高、特异性好的分析平台[4-5].
纳米材料作为基底材料可以为生物分子提供大的比表面积,为生物分子的固定提供更多的负载空间,此外还可以加快电子传递速率,二者协同作用可提高传感器的灵敏度.层状过渡金属二硫化钼具有和石墨类似的结构,由三个原子层 (S-W-S) 通过范德华力堆积而成,具有比表面积大、吸附能力强、反应活性高、催化性能强等特点,使其成为材料科学研究中的热点[6-7].但由于其作为一种半导体材料,导电性能相对较差.本实验采用一步水热合成法合成层状二硫化钼-石墨烯纳米复合材料(MoS2-Gr),并结合金纳米作为传感器制备的基底材料,制备了高灵敏、高选择性且稳定性好的适配体生物传感器,用于17β-雌二醇的灵敏检测.
1 实验部分
1.1 主要仪器
上海辰华公司生产的CHI 660E电化学工作站,采用三电极体系,纳米材料修饰玻碳电极为工作电极(3 mm直径),参比电极为饱和甘汞电极,辅助电极为铂电极.
1.2 主要试剂
钼酸钠、氯金酸、L-半胱胺酸均购于上海国药集团试剂有限公司;17β-雌二醇、1-氨基蒽醌、萘均购买于上海生物工程有限公司.17β-雌二醇适配体序列由上海生物工程有限公司合成,其碱基序列为:
5’-SH-(CH2)6-TTT TTT TTT T GCT TCC AGC TTA TTG AAT TAC ACG CAG AGG GTA GCG GCT CTG CGC ATT CAA TTG CTG CGC GCT GAA GCG CGG AAG C-3’
17β-雌二醇适配体和17β-雌二醇均溶解于100 mmol/L tris-HCl缓冲液 (pH 8.0,含 200 mmol/L NaCl,25 mmol/L KCl,10 mmol/L MgCl2和5% 乙醇).
1.3 二硫化钼-石墨烯纳米复合材料的制备
首先根据之前报道的Hummers[8]方法制备得到氧化石墨,然后再根据水热法制备MoS2-Gr复合材料.具体步骤如下:称取0.1 g的氧化石墨粉末溶入50 mL的蒸馏水中,超声搅拌2 h,然后向该溶液中加入0.5 g Na2MoO4并搅拌30 min,再向该混合液中滴加0.1 mol/L NaOH调节pH至6.5,称取1.0 g L-cysteine加入上述溶液中,稀释至80 mL后超声分散1 h.将混合溶液转移至100 mL的高压反应釜中在180 ℃下恒温反应48 h.反应完成后使体系自然冷却至室温,抽滤,分别用三重蒸馏水、无水乙醇各洗涤数次并于60 ℃下干燥24 h 即可得到MoS2-Gr复合材料.
1.4 适配体生物传感器的构建

图1 适配体生物传感器的制备Fig. 1 The preparation of aptamer biosensor
玻碳电极(GCE)首先依次用粒径为0.5 μm和0.05 μm的α-Al2O3抛光粉仔细打磨并抛光成镜面,并依次用乙醇和蒸馏水超声清洗干净,吹干,备用.取1 mg 的MoS2-Gr超声分散于1 mL的蒸馏水得1 g/L的MoS2-Gr悬浮液.将10.0 μL 1 g/L MoS2-Gr悬浮液滴涂到GCE表面,在室温下自然晾干后用蒸馏水冲洗,得到MoS2-Gr/GCE修饰电极.然后将该电极浸入含有0.1% HAuCl4的0.1 mol/L KNO3溶液中,利用电沉积法在MoS2-Gr/GCE修饰的玻碳电极表面沉积金纳米颗粒,制得MoS2-Gr复合物和AuNPs修饰的玻碳电极AuNPs/MoS2-Gr/GCE.随后将8.0 μL 1.0×10-7mol/L的适配体溶液滴加到AuNPs/MoS2-Gr/GCE上,室温下反应过夜,通过Au-S键共价键和将巯基修饰的适配体修饰到电极表面,反应结束后,再滴加8 μL 1 % 的牛血清白蛋白反应约30 min,作为封闭剂减少适配体在电极表面的非特异性吸附.该传感器的制备过程如图1.
1.5 电化学测定
在含有0.1 mol/L KCl 的1.0 mmol/L K3Fe(CN)6和K4Fe(CN)6的混合溶液中,用电化学工作站记录各修饰电极的循环伏安曲线(CV)和差分脉冲伏安曲线(DPV).实验参数如下:循环伏安法(CV):扫描电位区间为-0.2~+0.6 V,扫速为100 mV/s; 微分脉冲伏安法(DPV):初始电位为-0.2 V;终止电位为+0.6 V,脉冲宽度为0.02 s,静置时间为2 s.交流阻抗法(EIS):外加恒电位为+0.2 V,激发振幅为5 mV,频率范围0.1~105Hz.
2 结果与讨论
2.1 材料表征
如图2A所示,合成的石墨烯为典型的褶皱片层结构.图2B显示的为MoS2-Gr复合物的TEM图,从图中可以看出,层状的MoS2堆积在Gr纳米片上.
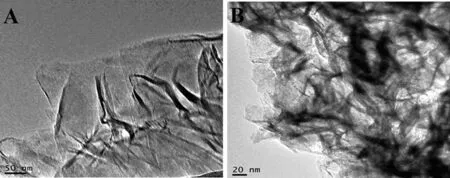
图2 石墨烯(A)和MoS2-Gr(B)的TEM图Fig. 2 TEM image of Gr (A) and MoS2-Gr (B)
2.2 不同修饰电极的电化学行为

图3 不同修饰电极在1.0 mmol/L [Fe(CN)6]3-/4-中的CV图Fig. 3 CVs of different electrodes in 1.0 mmol/L [Fe(CN)6]3-/4- (a) GCE, (b) MoS2-Gr/GCE, (c) AuNPs/MoS2-Gr/GCE, (d) aptamer/AuNPs/MoS2-Gr/GCE, (e) BSA/aptamer/AuNPs/MoS2-Gr/GCE
首先通过CV对不同修饰电极进行电化学表征,如图3所示,探针[Fe(CN)6]3-/4-在裸GCE(曲线a)上有一对明显的氧化还原峰.当GCE表面修饰上MoS2-Gr后(曲线b),其氧化还原峰电流显著增大,这是由于层状MoS2-Gr纳米复合材料具有大的比表面积和好的导电性能,有利于电子在电极表面的传输.将AuNPs沉积于MoS2-Gr/GCE后(曲线c),电流达到最大,说明金纳米具有很好的导电性,进一步促进电子在电极上的传输,从而增强反应信号,同时,AuNPs的引入也是为了下一步aptamer在电极上的固定.当aptamer通过Au-S键固定于AuNPs/MoS2-Gr/GCE表面后, [Fe(CN)6]3-/4-的氧化还原峰电流明显减小(曲线d),这是由于aptamer表面呈电负性的磷酸骨架与同样带负电的 [Fe(CN)6]3-/4-相互排斥,阻碍其电子传递,因此峰电流减小.当引入牛血清白蛋白对电极的活性位点进行封闭后,电流进一步下降 (曲线e),这是由于大量的大分子固定于电极表面,其不导电性能及空间位阻阻碍电子传递,使得[Fe(CN)6]3-/4-的氧化还原峰电流更小.这些现象也证明了传感器的成功构建.
2.3 实验条件的优化
修饰电极上的适配体与目标物17β-雌二醇的反应受反应温度和反应时间的影响.为了获得高的检测灵敏度,我们对这两个条件进行了优化.
首先考察反应温度的影响.制备了6支BSA/aptamer/AuNPs/MoS2-Gr/GCE,与相同浓度的17β-雌二醇分别在不同温度(25 ℃、30 ℃、35 ℃、37 ℃、40 ℃、43 ℃ )下反应3 h.然后测定DPV曲线,结果表明,随着反应温度的增大,峰电流逐渐减小,当温度达37 ℃时,峰电流达到最小,再增大反应温度峰电流反而下降.这是因为当选择的温度低于37 ℃ 时,由于适配体不够活泼而在电极表面上与雌二醇特异性结合量变小,而当温度高于37 ℃时,可能是由于适配体过于活泼,结合到电极表面后又掉下来或者是适配体本身的结构发生变化而使得适配体与雌二醇的特异性结合量降低,因此选择37 ℃为最佳反应温度.
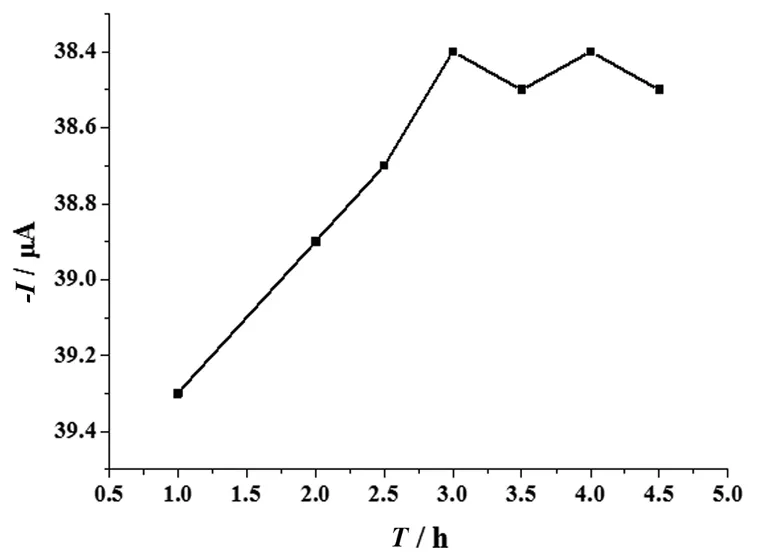
图4 不同反应时间的影响Fig. 4 Effect of reaction time
其次考察了反应时间的影响.制备了7支BSA/aptamer/AuNPs/MoS2-Gr/GCE,与相同浓度的17β-雌二醇在37 ℃下反应不同的时间(1、2、2.5、3、3.5、4、4.5 h),然后测DPV的峰电流,如图4所示.当反应时间低于3 h时,可能是由于二者未反应完全导致峰电流较大,而反应时间大于3 h的DPV峰电流几乎不变,这表明当反应进行3 h 左右时,电极表面的适配体几乎全部与17β-雌二醇反应,因此即使再延长杂交时间,材料表面的17β-雌二醇的量也不会有太大的变化,峰电流变化非常的微小.故选择最佳反应时间为3 h.
2.4 分析性能
适配体的选择性是适配体生物传感器有选择地与目标物质进行反应,并排除其他非目标物质的干扰,即检测目标的专一性,传感器的选择性是其应用于实际中的关键所在.本实验将适配体生物传感器分别与17β-雌二醇(a)、萘(b)、1-氨基蒽醌(c)进行反应,所得结果如图5所示.可以看出当传感器与17β-雌二醇反应后峰电流最小,而空白溶液的峰电流最大.这说明该适配体传感器能与17β-雌二醇特异性反应结合,具有较好的选择性.
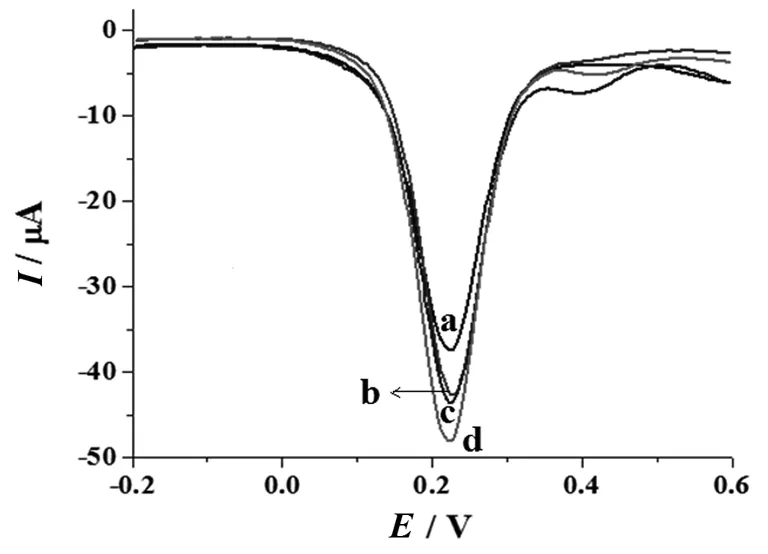
图5 生物传感器与17β-雌二醇、醌、萘反应的CV图Fig. 5 CVs of biosensor reaction with (a) 17β-estradiol, (b) quinone, (c) naphthalene, (d) 空白.
将传感器BSA/aptamer/AuNPs/MoS2-Gr/GCE与不同浓度的17β-雌二醇在37 ℃下杂交反应3 h,然后进行DPV测定,其结果如图6所示.随着17β-雌二醇浓度的增大,峰电流逐渐下降.
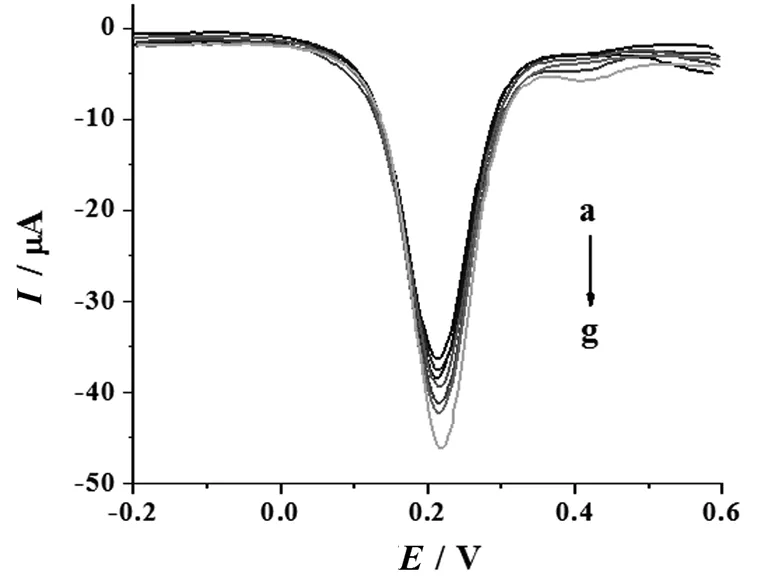
图6 BSA/aptamer/AuNPs/MoS2-Gr/GCE与 不同浓度17β-雌二醇反应后的DPV曲线Fig. 6 DPVs of BSA/aptamer/AuNPs/MoS2-Gr/GCE in 1 mmol/L [Fe(CN)6]3-/4- after reaction with different concentrations of 17β-雌二醇: (a) 1.0×10-8 mol/L, (b) 5.0×10-9mol/L, (c) 1.0×10-10mol/L, (d) 8.0× 10-11 mol/L, (e) 5.0×10-11 mol/L, (f)1.0×10-11 mol/L,(g) 0.
图7是测量所得的峰电流ip与17β-雌二醇浓度的负对数(-log c (mol/L))之间的关系图.由图7可以发现峰电流ip值与17β-雌二醇浓度的负对数在1.0×10-11mol/L到1.0×10-8mol/L浓度范围内呈现良好的线性关系.线性方程为:ip(μA)=-19.00+1.878logc(R=0.999 5).通过空白的三倍标准偏差,可计算出该方法对17β-雌二醇浓度的检出限为5.0×10-12mol/L.
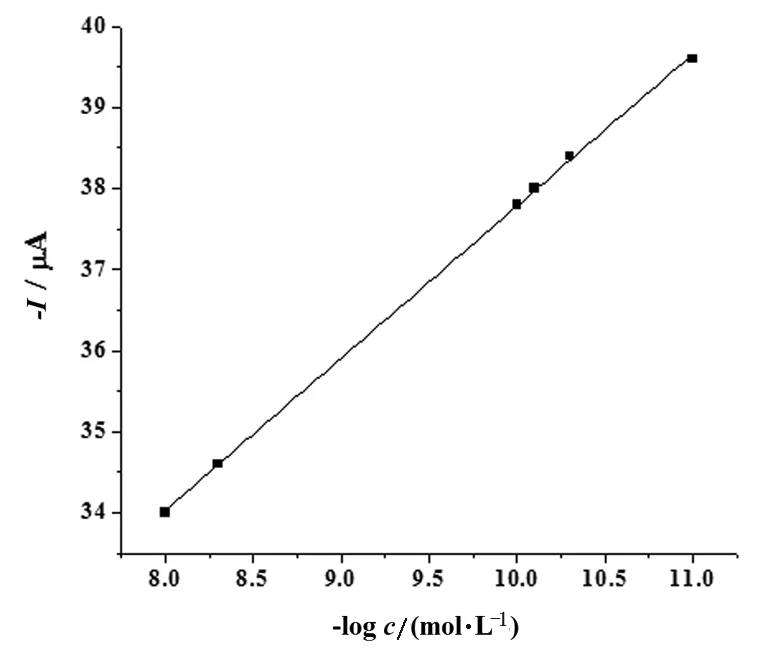
图7 峰电流与17β-雌二醇浓度的负对数的线性关系Fig. 7 Linear relationship between peak current and negative logarithm of 17β-estradiol concentration
2.5 重现性和稳定性
将所制备的适配体生物传感器 (BSA/aptamer/AuNPs/MoS2-Gr/GCE)用于检测1.0×10-10mol/L 的17β-雌二醇,实验发现,在 [Fe(CN)6]3-/4-中连续测定10次后,其相对标准偏差(RSD)为2.4%.平行制备7根BSA/aptamer/AuNPs/MoS2-Gr/GCE 用于检测同一浓度的17β-雌二醇,其RSD为4.5%.说明该传感器具有良好的重现性.
3 结论
本文以MoS2-Gr纳米复合物为基底修饰玻碳电极,然后利用电沉积方法将纳米金沉积到MoS2-Gr纳米复合物修饰的玻碳电极表面,构建了新型的适配体生物传感器用于环境激素17β-雌二醇的检测.实验结果表明,该适配体生物传感器不仅具有高的灵敏度,而且具有良好的选择性.此外,该传感器重现性好、稳定性强、制备简单,具有较好的应用潜力.

