产紫杉醇植物内生真菌的研究进展
陈 刚,周 谦,王 旻*,顾觉奋*
(1.中国药科大学生命科学与技术学院,天然药物活性组分与药效国家重点实验室,江苏南京 210009;2.江苏省中西医结合医院心血管科,江苏南京 210028)
紫杉醇(paclitaxel,商品名taxol),是一线抗肿瘤药物,20世纪60年代中期,在太平洋红豆杉(Taxus brevifolia)树皮中被发现,经过30年的研究和临床试验,于1992年12月29日,被美国食品药品管理局(FDA)批准为治疗卵巢癌新药。目前临床和科研所需的紫杉醇主要是从红豆杉中直接提取,但是紫杉醇在植物体中平均仅含0.015%,大量砍伐会导致树种濒临灭绝。同时,紫杉醇本身资源很匮乏,且植株生长缓慢,这对紫杉醇的进一步开发利用造成了很大的困难。化学合成虽已完成,但由于产量低,经费高,不具有产业化意义。半合成方法虽比较成熟,但需要消耗大量红豆杉树木,与直接提取的方法并无本质区别,仍不能从根本上解决资源匮乏的问题,组织培养法因其成本高而难以大规模生产。显然,寻找紫杉醇的新来源具有十分重要的意义。
植物内生真菌(Plant Endophytic Fungi)是指生长于植物组织的内部,分布于叶鞘、种子、花、茎、叶片和根中度过全部或近乎全部生活周期而不引起明显病害症状的一类微生物。内生真菌长期生活在植物体内的特殊环境中,并与宿主协同进化,可能产生与宿主相同或相似的具有生物活性的次生代谢产物。1993年美国化学家 Stierle和植物病理学家Strobel最早从短叶红豆杉(Taxus brevifolia)的韧皮部分离出一株产紫杉醇的内生真菌Taxomyces andreanae,产量约为25~50 ng/L发酵液体积。此后,各国学者纷纷开展紫杉醇内生真菌的研究工作,陆续从西藏红豆杉、云南红豆杉、欧洲红豆杉、中国红豆杉等分离到产紫杉醇的内生真菌,其宿主植物几乎涉及红豆杉的各个种。此外,研究人员在与红豆杉有相同环境要求的其它植物中也分离到了可产紫杉醇的内生真菌。利用真菌发酵产紫杉醇与从植物中提取有独特的优势,真菌不仅能在简单的培养基上良好生长,产生大量的发酵产物,还可以在生物反应器中人为控制各种参数,并可通过诱变育种等手段改变菌种性能以提高紫杉醇产量,因此便于大规模工业化生产的实现,前景十分广阔;而且对于植物来源天然药物新生成途径的开发及濒危药用植物的保护具有十分重要的经济及生态效益。因此,利用内生真菌生产紫杉醇是解决药源问题的有效途径[1]。
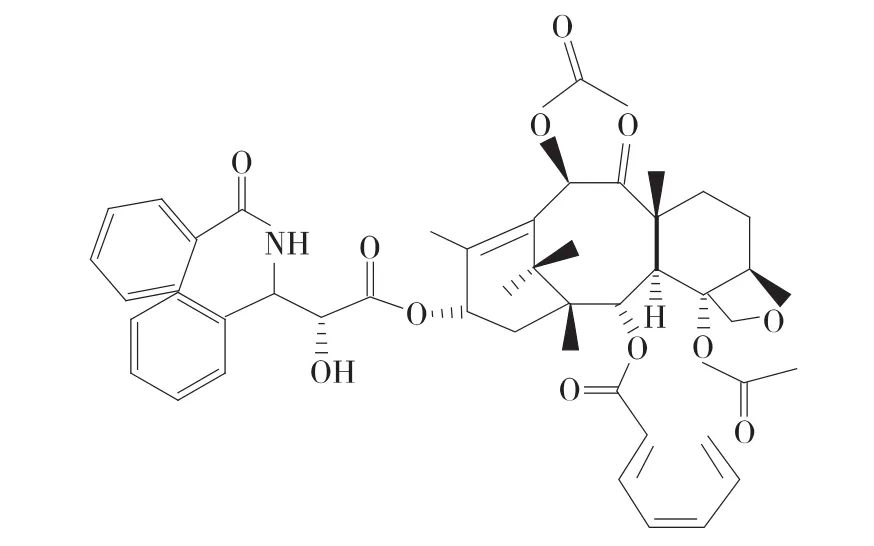
图1 紫杉醇的化学结构
1 产紫杉醇内生真菌的分离与鉴定方法
1.1 产紫杉醇内生真菌的分离与培养方法[2-3]
从宿主植物分离内生真菌主要有两种方法:⑴标准的真菌分离纯化方法。取健壮的植物组织,用清水冲洗干净,再用75%酒精、0.1%升汞等进行消毒,用无菌水漂洗剩余消毒剂后将外层组织削去,内部组织削成小片,置入添加青霉素或链霉素的PDA培养基或水琼脂培养基中,菌丝长出后,采用尖端菌丝挑取法挑取形态不同的菌丝置于新的培养基中培养。⑵平板灌注法。将外皮层除去,再用酒精、升汞等消毒,无菌水漂洗,将组织样品加入适量无菌水中,放入研钵中充分研磨,取匀浆注入融化的PDA培养基中,摇匀,置平板,25℃恒温培养。待菌丝长出后,挑取其尖端接种至新的培养基上,据此,不断纯化直至纯培养,斜面保存备用。
培养基的种类与培养条件的选择对菌种的生长与代谢产物的积累是非常重要的,目前,常用的培养基有马铃薯葡萄糖培养基(PDA)、察氏培养基、马丁氏培养基及麦芽浸膏琼脂培养基或是与酵母浸膏结合的培养基等。培养温度与pH值反应自然条件情况,典型的温度范围是18~25℃,pH自然。培养过程中还可以通过添加诱导物、代谢产物合成抑制剂及前体物质以促进紫杉醇的积累。常用的诱导物有植物激素、无机离子、多糖、茉莉酸等。通过添加代谢产物合成抑制剂可以抑制其它次级代谢产物的合成,常用的有麦角固醇、酪氨酸、RNA酶抑制剂、硫酸氧矾等。添加前体物质可通过增加底物量来加快反应速度、提高产率,如10-去乙酰巴卡亭Ⅲ和巴卡亭Ⅲ等。
1.2 产紫杉醇内生真菌的鉴定[4]
传统的菌种鉴定是根据菌群的性状、形态特征、生长特性及生理生化指标等方面的相近或相异的程度加以归并或分开,再根据这些菌群相互之间差异的大小和亲缘关系远近的区别,列为纲、目、科、属、种等分类单位。如果通过这些处理后还不能查出菌种的归类,那就以新的种属来对待。
由于某些真菌的属、种之间形态学或生理生化差异极不显著,而且形态特征有时会受环境因素的影响,常规条件下培养产孢会比较困难,所以采用传统的分类方法对菌株进行分类鉴定相当困难。随着分子生物学的飞速发展,近年来已形成多种全新的方法,如DNA中的(G+C)%含量测定、核酸杂交技术、限制性酶切片段长度多态性分析、电泳核型分析、随机扩增多态性DNA分析、多位点酶电泳、β-微管蛋白(TB)基因的序列对比等,其中,rDNA序列分析由于快速、简便及高特异性显示出了极大的优势,一系列分子标记应用于真菌的分类鉴定中,rDNA是rRNA基因以及与之相邻的间隔区的合称,真核生物的 rDNA序列均有非常明显的特点,18S,5.8S,28S rDNA基因序列进化缓慢而相对保守,但这3个基因序列之间的ITS序列的进化则相当迅速,所以,可利用其保守区设计通用引物,对其变异区进行PCR扩增和对扩增片段测序,然后与DNA序列数据库中的已有序列进行对比,通过分析同源性,构建系统进化树等得到真菌的分类地位,ITS区序列分析可获得属、种间、种内的分类地位广泛适用于较低分类阶元。若只需获得系统发育中种级以上的分类地位,则可对18S rDNA或28S rDNA进行分析,其中18S比28S基因更保守,所以更多的用于界、门、纲、目、科、属、种间的分类分析。目前,在产紫杉醇内生真菌的鉴定中,人们往往采取形态学与分子生物学相结合的策略,以期最准确的获得菌种的分类地位。
2 紫杉醇的提取与检测技术
2.1 紫杉醇的提取
进行提取之前首先要获得足够的发酵产物,先将菌种接至基本培养基上一段时间,获得足够菌丝后,再接种至发酵培养基上积累次生代谢产物。例如Li等[5]将F.mairei K178在基本培养基上培养3 d后,按5%的接种量接入500 mL的锥形瓶中,170 r/min,25℃培养12 d。也有学者直接利用改良的MID培养基进行培养,例如Pandi等在每升MID培养基中加入1 g蛋白胨,对菌株Botryodiplodia theobromae Pat.培养 22 d,而后进行紫杉醇的提取[6]。
紫杉醇的提取要全面考虑预处理方法,所用溶剂,浓缩的温度、压力等条件。常用有机溶剂,如氯仿、甲醇、乙酸乙酯等。同时,不同的提取方法也会对结果带来一定影响。Pandi等[7]将发酵产物过滤除菌丝体,滤液加入Na2CO3,且边加边振荡,以除脂肪酸的污染,用2倍体积的二氯甲烷进行提取,收集有机相,35℃下减压浓缩,所得固体用甲醇溶解。Chen等则将菌丝体搅拌均匀后,直接用甲醇进行提取,离心并收集上清液,旋转蒸发去有机溶剂,加入等体积蒸馏水和次甲基氯化物溶解固体并进行提取,待有机相挥发后再用甲醇溶解过柱纯化。Dai等将发酵产物进行离心并收集上清液,菌丝体搅拌15~20 min以释放目标产物,离心,合并两组上清液,50℃浓缩至原体积的1/3,用氯仿提取,提取物加Na2SO4在35℃下浓缩,所得固体再用甲醇溶解[2]。
2.2 紫杉醇的检测
真菌发酵液中紫杉醇的测定可用TLC、HPLC、MTLC、HPLC/LC-MS、MS、微管蛋白依赖的生物化学检测、受体蛋白介导的生物测定法、免疫分析法、生物活性测定等。通常情况下,样品的HPLC与标准品停滞时间在误差范围内相近,加上质谱分子量谱,可以初步判断是紫杉醇。若单独采用HPLC检测是不足以确定所测样品就是紫杉醇,因为有些物质具有与紫杉醇相近的滞留时间,如球毛壳甲素、三尖杉宁碱等。HPLC-MS法的主要特点是高速、高压、高效及高灵敏度,是目前较常用的方法,然而需要对样品事先处理,工作费时、繁重,且对仪器要求较高,尤其是对活性形式不能有效识别。微管蛋白依赖的生物学方法则不能够检测有潜在价值的非活性同源物,如巴卡亭Ⅲ或10-去乙酰巴卡亭Ⅲ。基于受体蛋白的生物学测定对紫杉醇具有一定的特异性,而且拥有抗原与抗体反应相似的可逆性,但它不能有效识别紫杉醇类似物及其代谢产物,交叉反应性比较弱仅能对紫衫烷中某一种或某一类有效识别,具有一定的局限性。ELISA检测通常采用竞争抑制免疫酶分析法(competitive inhibition enzyme immunoassay,CIEIA),该法是利用对紫杉醇有专一特性的单抗进行测定,简单易行,灵敏度高,能够大批量的处理样品,在检测极低浓度的紫杉醇时优势更为突出,但费用昂贵,且对紫杉醇和其结构类似物多烯紫杉醇识别率不高。生物学活性检测有对癌细胞毒性、动物细胞的毒性及卵菌的敏感性等方法。以上方法的联合使用,往往更能提供可信的证据[8-9]。
3 产紫衫醇的内生真菌
到目前为止,研究者发现能产紫杉醇的内生真菌已有20多个属(部分见表1),随着植物内生真菌研究的深入,越来越多的产紫杉醇内生真菌被发现,这充分说明了产紫杉醇内生真菌的物种多样性。Kumaran等从日本红豆杉的叶中分离到的Phomopsis BKH27,紫杉醇产量达到了418μg/L,是最早分离到的产紫杉醇内生真菌Taxomyces andreanae 8360倍,经测试对人肿瘤细胞有很强的细胞毒作用[10]。程首先等以从红豆杉树皮中分离得到的高产紫杉醇菌013为出发菌株,采用紫外线诱变、亚硝基胍诱变交替进行的方法,同时复合含1%乙酰胺的理性化筛选模型,获得一株遗传性状稳定的链格孢单孢变种ST026,摇瓶发酵产量可稳定达到227000 μg/L,比出发菌株产量提高81.6%,已进入中试和产业化研究[11]。Zhang等利用农杆菌介导的遗传转化,将农杆菌与产紫杉醇的Cladosporium cladosporioides MD2协同培养,使紫杉醇合成的限速酶过量表达,发现对紫杉醇的稳定转化有所帮助[12]。Soliman等将红豆杉内生真菌Paraconiothyrium SSM001与同样来源的Alternaria属内生菌共同培养发现紫杉醇产量达到了原来的3倍,再加入同样来源的Phomopsis属内生菌时产量达到原来的8倍,这些结果证明相同植物宿主的内生菌群可以直接或间接地影响紫杉醇的合成[26]。

表1 产紫杉醇的内生真菌(2004年)
4 存在的问题与前景
通过真菌发酵生产紫杉醇具有明显的优势,但其产业化道路并不平坦,还存在着一些亟待解决的重大问题。如产率低是制约产业化的一个重要因素,产量越高,对细胞的毒害作用就越严重,菌株生长速度也就减慢,生长缓慢又限制了紫杉醇的产量。再如产紫杉醇的稳定性,据报道产紫杉醇内生真菌Taxomyces andreanae无法重复获得紫杉醇,可能原因有紫杉醇并非最终产物,不同的培养时间和条件,可能转化成其它紫杉烷或者被分解。基因组的不稳定性也可能导致合成紫杉醇的某些基因的丢失。
解决以上问题可从几方面入手:一是继续从自然界中筛选更好的适合发酵的原始出发菌株;二是对现有高产紫杉醇的内生真菌进行菌种改造,以期能够产生大量菌丝体来提高紫杉醇产量,如诱变育种、原生质体融合、构建基因工程菌等;三是优化发酵工艺,可以采取优化培养条件和培养基成分、添加诱导物、前体物质及代谢产物抑制物等方法。相信随着研究的深入,紫杉醇合成机制的进一步揭示及一系列基础问题的解决以生产紫杉醇为目的的微生物产业途径前景光明。
[1]Chandra S.Endophytic fungi:novel sources of anticancer lead molecules[J].Appl Microbiol Biotechnol,2012,95(1):47-59.
[2]Zhou X W,Zhu H F,Liu L,et al.A review:recent advances and future prospects of taxol- producing endophytic fungi[J].Appl Microbiol Biotechnol,2010,86(6):1707-1717.
[3]Miao Z,Wang Y,Yu X,et al.A new endophytic taxane production fungus from Taxus Chinensis[J].Appl Bioch Microbiol,2009,45(1):81-86.
[4]Zhou X,Zheng W,Zhu H,et al.Identification of a taxol-producing endophytic fungus EFY-36[J].African J Biotech,2009,8(11):2623-2625.
[5]Li Y C,Tao W Y.Interactions of taxol-producing endophytic fungus with its host(Taxus spp.)during taxol accumulation[J].Cell Biol Intern,2009,33(1):106-112
[6]Pandi M,Manikandan R,Muthumary J.Anticancer activity of fungal taxol derived from Botryodiplodia theobromae Pat.,an endophytic fungus,against 7,12 dimethyl benz(a)anthracene(DMBA)-induced mammary gland carcinogenesis in Sprague dawley rats[J].Biomed Pharm,2010,64(1):48-53.
[7]Pandi M,Rajapriya P,Suresh G,et al.A fungal taxol from Botryodiplodia theobromae Pat.,attenuates 7,12 dimethyl benz(a)anthracene(DMBA)-induced biochemical changes during mammary gland carcinogenesis[J].Biomed Prev Nutr,2011,1(2):95-102.
[8]Deng B W,Liu K H,Chen W Q,et al.Fusarium solani,Tax-3,a new endophytic taxox-producing fungus from Taxus chinensis[J].World J Microbiol Biotechnol,2009,25(1):139-143.
[9]Wang Y C,Tang K X.A new endophytic taxol and baccatinⅢ-producing fungus isolated from Taxus chinensis var.mairei[J].African J Biotech,2011,10(72):16379-16386.
[10]Kumaran R S,Hur B K.Screening of species of the endophytic fungus Phomopsis for the production of the anticancer drug taxol[J].Biotechnol Appl Biochem,2009,54(1):21-30.
[11]程首先,王荣华,陈杰鹏,等.紫杉醇高产菌发酵产物的分离、纯化和鉴定[J].中国药科大学学报,2011,42(6):570-572.
[12]Zhang P,Liu T T,Zhou P P,et al.Agrobacterium tumefaciensmediated transformation of a taxol- producing endophytic fungus,Cladosporium cladosporioides MD2[J].Curr Microbiol,2011,62(4):1315-1320.
[13]Gangadevi V and Muthumary J.A novel endophytic taxol- producing fungus Chaetomella raphigera isolated from a medicinal plant,Terminalia arjuna[J].Appl Biochem Biotechnol,2009,158(3):675-684.
[14]Gangadevi V,Muthumary J.Taxol production by Pestalotiopsis terminaliae,an endophytic fungus of Terminalia arjuna(arjun tree)[J].Biotechnol Appl Biochem,2009,52(1):9-15.
[15]Sonaimuthu V,Krishnamoorthy S,Johnpaul M.Optimization of process parameters for improved production of taxol by a novel endophytic fungus Pestalotiopsis oxyanthi SVJM060 isolated Taxus baccta[J].Biotech,2010,150(Supplement):471.
[16]Sonaimuthu V,Krishnamoorthy S,Johnpaul M.Taxol producing endophytic fungus Fusarium culmorum SVJM072 from medicinal plant of Tinospora cordifolia- a first report[J].2010,150(Supplement):425.
[17]Kumaran R S,Kim H J,Hui B K.Taxol promising fungal endophyte,Pestalotiopsis species isolated from Taxus cuspidata[J].Journal of Bioscience and Bioengineering,2010,110(5):541-546.
[18]Kathiravan G and Raman V S.In vitro Taxol production,by Pestalotiopsis breviseta- A first report[J].Fitoterapia,2010,81(6):557-564.
[19]Pandi M,Kumaran R S,Choi Y K ,et al.Isolation and detection of taxol,an anticancer drug produced from Lasiodiplodia theobromae,an endophytic fungus of the medicinal plant Morinda citrifolia[J].Afric J Biotech,2011,10(8):1428-1435.
[20]Vennila R and Muthumary J.Taxol from Pestalotiopsis pauciseta VM1,an endophytic fungus of Tabebuia pentaphylla[J].Biomed Prev Nutr,2011,1(2):103-108.
[21]Bi JN,Ji Y,Pan J,et al.A new taxol- producing fungus(Pestalotiopsis malicola)and evidence for taxol as a transient product in the culture[J].African J Biotech,2011,10(34):6647-6654.
[22]Elavarasi A,Rathna G S,Kalaiselvam M.Taxol producing magrove endophytic fungi Fusarium oxysporum from Rhizophora annamalayana[J].Asian Pac Trop Biomed,2012,2(2):1081-1085.
[23]李强,季更生,朱婧,等.一株利用纤维素产紫杉醇菌株BJ-11的分离鉴定[J].江苏科技大学学报(自然科学版),2012,26(6):611-614.
[24]苗莉云,张鹏,刘博,等.产紫杉醇内生真菌Z58的分离和鉴定[J].中国生物化学与分子生物学报,2012,28(12):1141-1146.
[25]张鹏,刘博,徐曼,等.产紫杉醇内生真菌O60B1的分离及鉴定[J].湖北农业科学,2012,51(23):5315-5323.
[26]Soliman S S M,Raizada M N.Interactions between co-habitating fungi elicit synthesis of taxol from an endophytic fungus in host Taxus plants[J].Front Microbiol,2013,4(3):1- 14.
[27]Xiong Z Q,Yang Y Y,Zhao N,et al.Diversity of endophytic fungi and screening of fungal paclitaxel producer from Anglojap yew,Taxus x media[J].BMC Microbiology,2013,13(71):1-10.
[28]Garyali S,Kumar A,Reddy M S.Taxol production by an endophytic fungus,Fusarium redolens,isolated from Himalayan yew[J].J Microbiol Biotech,2013,23(10):1372-80.
[29]Liu L,Wei Y M,Zhou X W,et al.Agrobacterium tumefaciens-mediated genetic transformation of the Taxol-producing endophytic fungus Ozonium sp EFY21[J].Genet Mol Res,2013,12(3):2913-22.
[30]Yang Y,Zhao H,Barrero R A,et al.Genome sequencing and analysis of the paclitaxel-producing endophytic fungus Penicillium aurantiogriseum NRRL 62431[J].BMC Genomics,2014,15(69):1-14.
[31]汪友明,马忠友,胡丰林,等.黄山地区红豆杉中产紫杉醇内生真菌的分离和筛选[J].天然产物研究与开发,2014,26(10):1624-1627.
[32]刘明志,段中岗,吕镇城,等.高产紫杉醇内生真菌J11的鉴定[J].中国生物化学与分子生物学报,2014,30(10):1031-1038.
[33]张红涛,邓百万,陈文强,等.一株产紫杉醇的红豆杉内生真菌的分离鉴定[J].陕西理工学院学报(自然科学版),2014,30(2):41-45.

