一种新的西瓜果斑病种子带菌检测方法
马艺荞,惠长敏,王秀峰,王利波,陈莹,王永卓,王健鹂
(吉林省蔬菜花卉科学研究院,长春,130033)
一种新的西瓜果斑病种子带菌检测方法
马艺荞,惠长敏,王秀峰,王利波,陈莹,王永卓,王健鹂
(吉林省蔬菜花卉科学研究院,长春,130033)
通过采用病原菌分离、培养基富集培养与PCR技术建立了一套西瓜果斑病菌检测方法。结果表明,MOPS缓冲液对西瓜种子所带病菌分离效果最佳,且利用WFB1/WFB2引物对富集到的病菌进行PCR检测,都产生了预期360 bp片段;对BFB纯菌液和模拟带菌种子浸提液的最低检测限为1.0×102cfu/mL。利用OD值法结合平板涂布记菌落数方法绘制西瓜细菌性果斑病病原菌浓度梯度标准曲线:Y=3.984 1x+0.088 1,R2=0.9991(Y×108cfu/mL)。该检测方法的建立,为西瓜生产中果斑病防治提供了重要技术支持。
西瓜;细菌性果斑病;种子;检测
瓜类细菌性果斑病(Bacterial Fruit Broth,BFB)是一种由西瓜嗜酸菌西瓜种(Acidovorax citrulli)引起的严重的世界性种传病害[1,2]。经KB培养基分离培养的细菌性果斑病菌的菌落为乳白色、圆形、光滑、金缘、隆起、不透明,菌落直径1~2 μm,在365 nm紫外线照射下,菌落不发亮,即不产生荧光色素,对光观察菌落周围有透明圈[3]。瓜类细菌性果斑病分别被农业部(2006年)和国家质检总局(2007年)列入我国规定的检疫性病害之一[4]。瓜类细菌性果斑病主要为害葫芦科植物,如西瓜、甜瓜、南瓜、黄瓜等,自报道以来已经在山东、内蒙古、甘肃、新疆、海南等省发生,给当地的西瓜种植业造成严重的损失[5,6]。
细菌性果斑病主要通过种子远距离传播[7],病菌在种子中的存活时间较长,且抗逆能力强,主要存活在种皮下的胚乳表层[8],因此在生产中使用健康无菌的种子是防止细菌性果斑病发生和传播的关键。
当前国内对细菌性果斑病的检测方法主要采用半选择性培养基、ELISA、PCR及实时荧光定量PCR法等技术。ELISA法应用最普遍,Walcott等[9]利用Elisa法检测了西瓜种子带菌情况,其灵敏度为105cfu/mL,但不能区分与果斑病菌同属的其他亚种;熊亮斌等[10]建立改良DAS-Dot-ELISA法检测瓜类细菌性果斑病菌,检测灵敏度为1.9×105cfu/mL;冯建军等[11]利用TaqMan探针实时荧光定量PCR检测瓜类细菌性果斑病菌,其灵敏度达103~104cfu/mL;Ha等[12]将磁珠捕获法和多通道实时荧光定量PCR相结合,可检测到5 000粒种子中存在一粒带病种子。但由于实时荧光定量PCR所需仪器耗材成本较高,且成本低的半选择性培养基法的检测灵敏度较低,因此在实际生产中需要建立一套灵敏、快速且特异性较高的检测方法。本研究在已有检测方法的基础上,采用病原菌分离、培养基富集培养与PCR技术相结合,建立一套病原菌分离-富集培养-PCR鉴定检测体系,以期为生产中检测西瓜种子果斑病带菌情况奠定基础。
1 材料与方法
1.1 供试材料
供试品种:华欣西瓜种子(北京京研益农科技发展中心生产)。供试菌株:西瓜果斑病Pslb27菌株(由中国农科院植保所赵廷昌提供)。供试培养基为KBA培养基(蛋白胨20 g、硫酸镁1.5 g、磷酸氢二钾1.5 g、甘油10 g、琼脂15 g、蒸馏水1 000 mL、pH值7.0)(以上试剂均购自北京鼎国生物技术有限公司)。
1.2 仪器与试剂
PCR仪为东胜创新生物科技有限公司EDC-810,紫外-可见分光光度计为上海精科UV759,凝胶成像系统为UVP BioDoc-It(美国)。PCR反应体系中10×PCR buffer、dNTPs、10×Taq buffer、Taq DNA聚合酶购自天根生化科技(北京)有限公司。
1.3 细菌性果斑病病原菌浓度梯度标准曲线的绘制
在KBA平面培养基上培养Pslb27病原菌菌株,挑取生长良好的病原菌单菌落在液体KB液体培养基中,28℃下220 r/min摇菌过夜(16~18 h)至细菌指数生长期,将菌悬液用KB培养基梯度稀释6、8、10、12、14、16、18倍,利用紫外-可见分光光度计在波长600nm下测定OD值,取其OD值在0.2~0.8绘制果斑病病原菌浓度梯度标准曲线。将菌悬液采用涂布记菌落数的方法用KB液体培养基稀释进行平板计数[13]。
1.4 果斑病4个梯度病原菌的稀释与接种
挑选在KB平板上生长良好的单菌落,在KB液体培养基中28℃、220 r/min培养24 h。用KB液体培养基对菌悬液进行稀释,在波长600下nm测定OD值使其在0.2~0.8,利用之前绘制的果斑病病原菌标准曲线得出此菌悬液的准确浓度,用KB液体培养基将菌悬液稀释为1×102、1×104、1×106、1×108cfu/mL 4个梯度。按照1g种子3mL菌液的比例,将健康种子分别浸泡在不同浓度的菌悬液中[14],25℃摇床160r/min接菌90min,取出后于超净工作台过夜晾干,以超纯水浸泡种子为对照,共进行5个处理,每个处理3次重复,每次重复处理20粒种子。
1.5 不同浸提液对种子病菌的分离、富集培养效果比较
0.04 mol/L MOPS(3-
以超纯水、MOPS浸提液、PBS浸提液作为带菌种子的病菌浸提液,按照1 g种子3 mL浸提液的比例,将不同浓度菌悬液接种的西瓜种子及超纯水对照(CK)种子分别放入灭菌离心管中,30℃、220 r/min摇培4 h[4],重复3次。吸取摇培后的浸提液100 μL涂布于KB固体平板上,28℃培养48 h,比较平板上3次重复的平均菌落个数。
1.6 细菌性果斑病原菌的PCR鉴定
挑取1×102cfu/mL接种浓度下PBS和MOPS浸提液分离出的KB平板上菌落直径1~2 μm乳白色、圆形、光滑、隆起、不透明的单菌落,置于5 μL超纯水中,PCR仪上99℃裂解15 min后迅速置于冰上,将以此作为模板进行PCR。特异性引物WFB1(5'GAC CAG CCA CAC TGG GAC 3')和WFB2(5'CTG CCG TAC TCC AGC GAT 3')[9,15],该引物由上海生工公司合成。
PCR扩增体系:10×PCR buffer 2 μL,2.5 mmol/L dNTPs 1 μL,10×Taq buffer 2 μL,WEB1/WEB2各1 μL,Taq DNA聚合酶0.2 μL,模板5 μL,超纯水补足至20 μL。
反应条件为:95℃预变性4 min;94℃变性30 s,65℃退火30 s,72℃延伸40 s,30次循环;72℃再延伸10 min。PCR产物用1.0%琼脂糖凝胶电泳分离。
2 结果与分析

表1 西瓜细菌性果斑病OD值与菌液浓度统计

图1 不同浸提液对种子带菌分离情况涂板比较
2.1 西瓜细菌性果斑病病原菌浓度梯度的标准曲线的确定
利用OD值法结合平板涂布记菌落数方法绘制西瓜细菌性果斑病病原菌浓度梯度标准曲线。采用涂布记菌落数的方法确定病原菌菌悬液的浓度为2.3×109cfu/mL;取OD值在0.2~0.8的稀释梯度(8、10、12、14、16倍),算出对应菌液浓度(表1),利用菌液浓度与OD值之间的线性关系,绘制西瓜细菌性果斑病病原菌浓度梯度标准曲线为Y=3.984 1x+0.088 1(R2= 0.9991)(Y×108cfu/mL)。
2.2 不同浸提液对种子病菌的分离、富集培养效果比较
平板涂布的富集菌落结果如图1所示。对1×102、和1×104cfu/mL接菌浓度下3种浸提液的KB平板涂布菌落数计数(图2),结果表明,在1×102cfu/mL接菌浓度的3次重复中,超纯水涂布平板没有菌落生长,PBS浸提液涂布平均菌落数为1个,MOPS浸提液平均菌落数为2个;在1×104cfu/mL接菌浓度的3次重复中,超纯水涂布平均菌落数为89个,PBS浸提液涂布平均菌落数为206个,MOPS浸提液平均菌落数为277个。综上所述,MOPS和PBS浸提液对不同接菌浓度的西瓜种子的果斑病菌分离效果均优于超纯水,且MOPS浸提液的分离效果明显优于PBS浸提液,以超纯水为浸提液不能对1×102cfu/mL接菌浓度下的西瓜种子所带病菌进行准确分离。
以1×102cfu/mL和1×104cfu/mL接菌浓度为例,比较3种浸提液对种子带病原菌分离情况。蓝色为超纯水分离菌落个数,红色为PBS缓冲液分离菌落个数,绿色为MOPS缓冲液分离菌落个数。
2.3 细菌性果斑病病原菌的PCR鉴定
利用合成的特异性引物,对在1×102cfu/mL接种浓度下,PBS和MOPS浸提液分离出的果斑病进行PCR,产物经1%琼脂糖凝胶电泳及成像系统分析。结果如图3所示,对PBS和MOPS浸提液分离出的菌落进行PCR,均出现360 bp目标条带,从分子水平进一步证实,PBS和MOPS浸提液分离出的菌落均为西瓜细菌性果斑病菌。
3 结论与讨论
本研究利用OD值法,结合涂布记菌落数方法,绘制西瓜细菌性果斑病病原菌浓度梯度的标准曲线:Y=3.984 1x+0.088 1,R2=0.999 1(Y×108cfu/mL)。分光光度计的有效OD范围一般在0.2~0.8。通过对果斑病菌悬液进行适当稀释,使其OD值在分光光度计有效读数范围内,即可通过上述标准曲线准确计算出果斑病病原菌浓度,解决了传统涂布记菌落数法操作复杂且周期长等问题,大大提高了效率。
本研究比较了超纯水、MOPS缓冲液及PBS缓冲液对模拟带菌西瓜种子的病菌分离情况。结果表明,通过不同浸提液分离病原菌、涂布KB平板及富集培养,经过形态学分析初步鉴定了西瓜种子所带病菌为西瓜细菌性果斑病。本研究表明,在数量和质量方面MOPS缓冲液都明显优于超纯水及PBS缓冲液。这与任毓忠等[16]研究得出的在西瓜种子病菌分离方面PBS缓冲液优于水的结论一致;也与许福寿等[4]研究对比的MOPS缓冲液在对西瓜种子病菌的分离效果上优于PBS缓冲液的结论一致。因此MOPS缓冲液在对西瓜种子病原菌分离方面效果较优。本研究中MOPS缓冲液能分离出1×102cfu/mL模拟接种浓度下种子带有的较少病原菌。
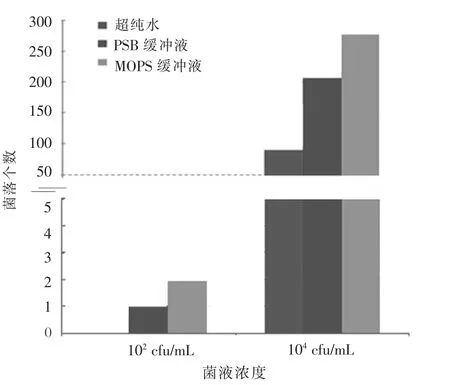
图2 不同浸提液下种子带病原菌分离情况

图3 不同浸提液分离出的BFB单菌落PCR
本研究以Walcott等[9]报道的果斑病病原菌WEB1/WEB2为引物,对PBS和MOPS浸提液在1×102cfu/mL模拟带菌种子分离出的单菌落进行PCR检测,结果均出现目标条带,从分子水平进一步表明PBS和MOPS浸提液分离出的菌落均为西瓜细菌性果斑病菌。结果证明,此方法最低可检测出1×102cfu/mL左右菌体,较熊亮斌等[10]建立改良DAS-Dot-ELISA法1.9×105cfu/mL检测灵敏度提高1 000倍,较冯建军等[11]建立的实时荧光定量PCR 103~104cfu/mL检测灵敏度提高至少10倍。
综上所述,本研究建立了一套快速、灵敏、低成本的病原菌分离-富集培养-PCR检测技术,其灵敏度可达1×102cfu/mL。应用此方法对西瓜种子进行果斑病检测,有望为西瓜细菌性果斑病的防控提供病害预警,以减少病害损失,对促进西瓜产业健康发展具有重要价值。
[1]Schaad N W,Postnikova E,Sechler A,et al.Reclassification of subspecies ofAcidovorax avenaeas A.Avenae (Manns,1905)emend.,A.cattleyae(Pavarino,1911)comb.nov.,A.citrulli(Schaad et al.,1978)comb.nov.,and proposal ofA.oryzaesp.nov[J].Systematic Applied Microbiology,2008,31(6/8):434-446.
[2]Willems A,Goor M,Thielemans S,et al.Transfer of several phytopathogenicPseudomonasspecies toAcidovoraxas Acidovorax avenaesubsp.avenae subsp.nov.,comb.nov., Acidovorax avenaesubsp.citrulli,Acidovorax avenaesubsp. cattleyae,andAcidovorax konjaci[J].International Journal of Systematic Bacteriology,1992,42(1):107-119.
[3]赵廷昌,孙福在,王兵万,等.哈密瓜细菌性果斑病病原菌鉴定[J].植物病理学报,2001,31(4):357-364.
[4]徐福寿,王笑,谢关林,等.免疫捕捉PCR法检测西瓜种子带细菌性果斑病菌[J].果树学报,2008,25(2):215-218.
[5]许勇,张兴平,宫国义,等.细菌性果腐病与瓜类作物健康种子生产及检测技术(上)[J].中国西瓜甜瓜,2003,(6):36-37.
[6]许勇,张兴平,宫国义,等.细菌性果腐病与瓜类作物健康种子生产及检测技术(下)[J].中国西瓜甜瓜,2004(1):33-35.
[7]Latin R,Tikhonova I,Rane K.Factors affecting the survival and spread ofAcidovorax avenaesubsp.citrulli in watermelon transplant production facilities[J].Phytopathology, 1995(85):1 413-1 417.
[8]Dutta B,Genzlinger L L,Walcott R R.Localization ofAcidovorax avenaesubsp.citrulli(Aac),the bacterial fruit blotch pathogen in naturally infested watermelon seed[J].Phytopathology,2008,98(6S):S49.
[9]Walcott R R,Gtaitis R D.Detection ofAcidovorax avenae subsp.citrulliin Watermelon seed using immunomagnetic sparation and the polymerase chain reaction[J].Plant Disease, 2000,84(4):470-474.
[10]熊亮斌,刘箐,王天昌,等.改良DAS-Dot-ELISA检测西瓜细菌性果斑病菌[J].微生物学通报,2010,37(10):1551-1556.
[11]冯建军,许勇,李健强,等.免疫凝聚试纸条和TaqMan探针实时荧光PCR检测西瓜细菌性果斑病菌比较研究[J].植物病理学报,2006,36(2):102-108.
[12]Ha Y,Fessehaie A,Ling K S,et al.Simultaneous detection ofAcidovorax avenaesubsp.citrulliandDidymella bryoniaein cucurbit seedlots using magnetic capture hybridization and real-time polymerase chain reaction[J].Phytopathology,2009,99(6):666-678.
[13]乔军,孟庆玲,贾桂珍.利用OD值法进行细菌计数的研究[J].中国家禽,1996(4):26-27.
[14]赵丽涵,王笑,谢关林,等.免疫捕捉PCR法检测西瓜细菌性果斑病[J].农业生物技术学报,2006,14(6):946-951.
[15]Walcott R R,Gitaitis R D,Castro C.Role of blossoms in watermelon seed infestation byAcidovorax avenaesubsp. citrulli[J].Phytopathology,2003,93(5):528-534.
A New Pathogen Detection Methodon for Watermelon Seeds
MA Yiqiao,HUI Changmin,WANG Xiufeng,WANG Libo, CHEN Ying,WANG Yongzhuo,WANG Jianli
(Jilin Academy of Vegetable and Flower Science,Changchun,130033)
In this study,we established a separation-enrichment-PCR detection system.The results showed the MOPS solution was the best one for detecting the seeds carrying BFB,the enrichment of bacteria was amplified by the primer sets WFB1/ WFB2 and all produced 360 bp specific fragments;the method assay had a lowest detection limit of 1.0×102 cfu/mL.We drew a watermelon bacterial fruit blotch of standard curve:Y=3.9841x+0.0881,R2=0.9991(Y×108cfu/mL).This method can greatly increase the precision of this detection and provide an important technical support for the prevention and control of BFB.
Watermelon;Baetefial fruit blotch;Seed;Detection
S651;S436.42
A
1001-3547(2015)20-0091-04
10.3865/j.issn.1001-3547.2015.20.035
国家西甜瓜产业技术体系(CARS-26-26);吉林省西瓜细菌性果斑病快速检测及综合防治技术研究(20130102047JC)
致谢:感谢国家西甜瓜产业技术体系病虫害防控研究室赵廷昌教授对实验的指导与帮助!
马艺荞(1984-),女,硕士,助理研究员,主要从事植物保护研究,电话:13944852755,E-mail:xiaoquezai@163.com
惠长敏,通信作者,女,研究员,E-mail:huichm@126.com
2015-07-23

