华木莲叶中内生真菌的群落结构
刘紫英+冷桂华+周秀玲
摘要:为了解我国特有珍稀植物华木莲叶片的内生真菌菌群结构特征,以华木莲叶片为材料,采用组织分离法分离华木莲的内生真菌。结果表明,PDA改良培养基(PDA培养基内加20 g/L华木莲叶汁液、30 mg/L 链霉素)的分离效果最好。从华木莲的叶中共分离得到87株内生真菌,经显微形态鉴定,鉴定菌株74株,为4目5科10属,分别为青霉属、木霉属、曲霉属、小孢霉属、交链孢属、枝孢属、长蠕孢属、镰孢霉属、拟茎点霉属、丝核菌属,结果显示叶中内生真菌菌群多样性较丰富,优势属为无性丝孢类菌群中青霉属、木霉属、交链孢属和无性腔孢类拟茎点霉属;分离率分别为17.2%、12.6%、10.4%和11.5%,对开发和利用植物内生真菌及丰富真菌的物种具有重要意义。
关键词:华木莲;内生真菌;分离;鉴定
中图分类号: S567.23+9.01 文献标志码: A
文章编号:1002-1302(2015)03-0316-03
华木莲(Sinomanglietia glauca Z.X.Yu et Q.Y.Zheng),别称落叶木莲, 为木兰科单种属植物,是我国江西省宜春市特有的珍稀濒危新树种,仅狭域分布于宜春市境内明月山山地,落叶乔木,1995年被列入国务院公布的“国家重点保护野生植物名录”中国家I级重点保护植物[1-3],同时被英国皇家植物园收编在册,华木莲保护工程已被列入国家重点植物21种极小种群的保护工程。目前,国内外对华木莲的报道主要集中在华木莲生物学特性及繁殖技术、保护生物学、遗传多样性及群落种间联结性等方面[4-6],施建敏等对华木莲叶黄酮类化合物抗氧化作用、多糖的提取及其抗氧化作用进行了研究,结果显示,华木莲叶内多糖和黄酮类化合物有较好的抗氧化性,华木莲具有潜在的利用价值[7-8]。
植物内生真菌是近30年国内外真菌资源多样性和分类学的研究热点之一。在许多药用植物和重要价值植物体内,内生真菌的组成和分布得到了比较深入的研究[9-11],但是植物内生真菌具有丰富的多样性,特有植物可能具有特殊的内生真菌区系组成。现有研究表明,内生真菌能够产生与宿主植物相同或相似的化学成分[12]。因此,开发和利用植物内生真菌对于丰富真菌的种类、探讨真菌和宿主的相互作用和协同进化等都具有重要意义,在保护植物种质资源、分离新的产物和新的活性成分等方面都具有重要的价值。到目前为止,对华木莲内生真菌国内外还没有研究报道,因此笔者以珍稀植物华木莲叶为试验材料,分离鉴定其内生真菌,为华木莲叶中内生真菌种群多样性分析提供基础,同时保护珍稀植物为江西省的植物资源开发开辟了新途径。
1 材料和方法
1.1 试验材料
材料为华木莲新鲜健康叶片,取于江西省宜春市明月山风景区周边林木种植场。叶片摘取后,用自来水冲洗干净备用。
1.2 培养基
采用改良PDA培养基:200 g 马铃薯(煮汁)+20 g 葡萄糖+20 g华木莲叶(煮汁)+20 g琼脂,加水定容至 1 000 mL。临用前加入30 mg/L 氯霉素。
1.3 内生真菌分离
选用健康植株的叶片,用自来水冲洗干净,切段;超净工作台上,无菌水清洗2~3次;75%乙醇消毒2 min,无菌水清洗4次;0.1% HgCl2消毒,消毒时间设1、2、2.5、3、3.5、4 min等6个梯度,以考察其最佳消毒时间,无菌水清洗6次,无菌滤纸吸干水分;用无菌刀片将叶片切成5 mm×5 mm的小片,分别置于培养基中,26 ℃恒温培养5~7 d,待组织块周围菌丝生长旺盛时再挑取部分菌丝转接到新鲜培养基上进行纯化培养。设无消毒对照和空白对照,将表面消毒后的叶片不作切割处理并放置在相同条件下培养,以确定是否彻底消毒。根据培养时间、菌落的生长速度和真菌的生长种类确定最佳消毒时间进行扩大培养;并对菌株进行编号,华木莲的叶分离所得内生真菌分别标记为SL1、SL2、…、SL87。
1.4 内生真菌的鉴定
采用点植法、胶带粘贴法、真菌学插片培养法及真菌玻片培养法制成玻片,置于高级数码生物显微镜SK-DM500光学摄像仪下摄像,观察菌丝形态、产孢结构及孢子形态,鉴定真菌种类[13-14]。对在人工培养条件下较少产孢的菌株采用菌落造伤、近紫外灯照射、冰箱短暂冷藏等方法诱导产孢。
2 结果与分析
2.1 HgCl2消毒时间的确定
0.1% HgCl2的消毒时间梯度处理结果显示,在0.1% HgCl2消毒1 min的培养基内可以观察到部分明显的细菌菌落,2 min以上的消毒效果较好,明显优于1 min,而4 min对鲜嫩叶的组织损害较大。2、2.5、3 min为比较合适的消毒时间,综合分离菌群所得多样性和消毒效果,试验选取0.1% HgCl2处理2.5 min作为消毒处理时间,既能除去表面可能带有的杂菌,又可避免因消毒时间过长而伤害组织,还能尽可能分离更多的内生真菌群落。
2.2 华木莲内生真菌鉴定
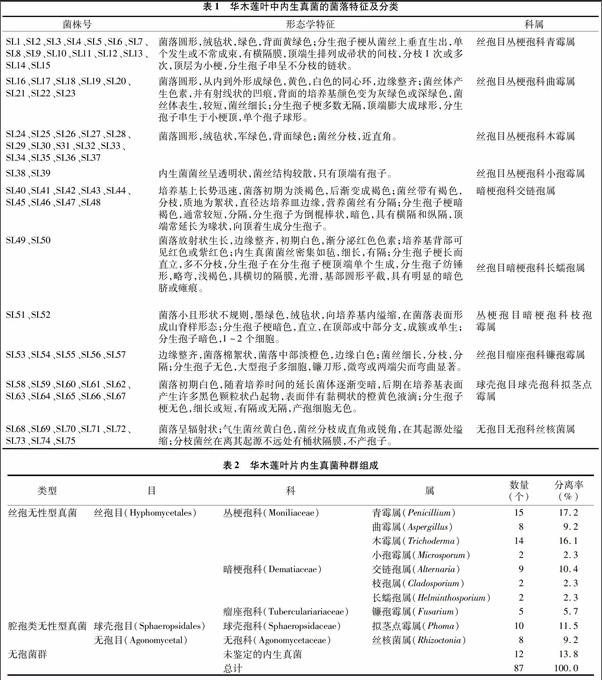
用改良PDA平板培养基分离菌株,从菌落形态、菌体显微形态2方面对所分离的内生真菌进行观察,对照《真菌鉴定手册》根据菌株的菌落形态特征、颜色、质地、生长培养基颜色变化以及菌丝体和孢子的形态特征进行鉴定,总共分离到内生真菌87株,已鉴定菌株75株,为4目5科10属,均属丝孢纲,分别为青霉属、木霉属、曲霉属、小孢霉属、交链孢属、枝孢属、长蠕孢属、镰孢霉属、拟茎点霉属、丝核菌属(表1),可见华木莲叶中内生真菌菌群多样性丰富。
2.2 华木莲内生真菌群落结构分析
表2显示,华木莲内生真菌均属丝孢无性型真菌和腔孢无性型真菌。在目分类水平上,以丝孢目(Hyphomycetales)为优势菌群,占65.5%。在科的分类水平上,丛梗孢科(Moniliaceae)、暗梗孢科(Dematiaceae)和球壳孢科(Sphaeropsidaceae)为优势菌群,分别占总菌株数量的44.8%、15.0%、11.5%。在属的水平上分类,丝孢无性型真菌中青霉属、交链孢属、木霉属和腔孢类无性型真菌的拟茎点霉属分别占所分离菌株数的172%、10.4%、16.1%和11.5%,为华木莲内生真菌的优势种群。因实验室培养条件下不产孢,有8株菌株无法鉴定到归属的无孢菌群。这与传统的真菌菌种鉴定主要通过菌落及显微形态学观察而作出判断的局限性有关,因而在以后工作中将结合分子生物学以分离的内生真菌总DNA为研究对象,用ITS序列分析法对华木莲的内生真菌进行进一步鉴定。endprint
3 结论与讨论
内生真菌在植物体内分布不均衡,随着外界环境的改变,在植物中内生真菌分布的种类、数量及生长状况有所不同[15]。所以,在分离时要尽量模拟内生菌在其宿主体内自然状态下的生活环境,以便能够最大量地分离出内生菌。本研究对PDA培养基进行了改良,改良PDA培养基中添加了宿主植物华木莲叶汁液,补充了华木莲内生真菌可能需要的特殊营养,通过培养基筛选的前期试验发现,在这种改良PDA培养基上华木莲内生真菌菌群较丰富,但不能保证所有生活在组织内的真菌全部分离出来,可能有的内生真菌不能在人工培养基上生长,或者只能在其他选择性培养基上生长。因此,尽量选择多种分离培养基获得多种群的内生真菌是必要的。
华木莲内生真菌菌群较丰富,分属于青霉属、木霉属、曲霉属、小孢霉属、交链孢属、枝孢属、长蠕孢属、镰孢霉属、拟茎点霉属、丝核菌属。其中,丝孢无性型真菌的青霉属、交链孢属、木霉属和腔孢类无性型真菌的拟茎点霉属分别占所分离菌株数的17.2%、12.6%、11.5%和14.9%,为华木莲内生真菌的优势种群。植物内生真菌的生物多样性受多种因素影响,同一植物在不同的地理区域或位点具有不同的内生菌类群。华木莲仅生长于江西省宜春市明月山风景区,所以分离华木莲叶中不存在不同地域种群的差异。
参考文献:
[1]国家重点保护野生植物名录:第一批[J]. 植物杂志,1999(5):4-11.
[2]郑庆衍. 新发现的濒危物种——落叶木莲[J]. 植物杂志,2000(1):1.
[3]俞志雄. 华木莲属——木兰科一新属[J]. 江西农业大学学报,1994,16(2):202-204.
[4]林新春,俞志雄,裘利洪,等. 濒危植物华木莲的遗传多样性研究[J]. 江西农业大学学报,2003,25(6):805-810.
[5]熊 敏,田 双,张志荣,等. 华木莲居群遗传结果和保护单元[J]. 生物多样性,2014,22(4):476-484.
[6]俞志雄,廖 军,林新春,等. 华木莲植物群落的生态学研究[J]. 江西农业大学学报,1999,21(2):73-77.
[7]Shi J M,施建敏,俞志雄,庞会忠,等. 华木莲叶黄酮类化合物抗氧化作用[J]. 江西农业大学学报,2006,28(5):693-697.
[8]庞会忠,俞志雄,施建敏,等. 华木莲叶多糖的提取及其抗氧化作用[J]. 江西农业大学学报,2006,28(6):813-818.
[9]Strobel G A. Endophytes as sources of bioactive products[J]. Microbes and Infection,2003,5(6):535-544.
[10]孙剑秋,郭良栋,臧 威,等. 药用植物内生真菌及活性物质多样性研究进展[J]. 西北植物学报,2006,26(7):1505-1519.
[11]臧威,孙 翔,孙剑秋,等. 南方红豆杉内生真菌的多样性与群落结构[J]. 应用生态学报,2014,25(7):2071-2078.
[12]徐范范. 药用植物内生真菌产次生代谢产物的研究进展[J]. 医学综述,2010,16(17):2667-2669.
[13]魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979:4-397.
[14]邵力平,沈瑞祥,张素轩,等. 真菌分类学[M]. 北京:中国林业出版社,1984:305-340.
[15]Phongpaichit S,Nikom J,Rungjindamai N A,et al. Biological activities of extracts from endophytic fungi isolated from Garcinia plants[J]. FEMS Immunology and Medical Microbiology,2007,51(3):517-525.endprint

