干扰SULT2B1抑制人肝癌细胞BEL- 7402的上皮间质化
杨晓明,李桂忠,田 珏,徐 华,杨晓玲,殷莲华
(1.宁夏医科大学 基础医学院 病理生理学系,宁夏 银川 750004;2.复旦大学 基础医学院生理与病理生理学系,上海 200032)
研究论文
干扰SULT2B1抑制人肝癌细胞BEL- 7402的上皮间质化
杨晓明1*,李桂忠1,田 珏1,徐 华1,杨晓玲1,殷莲华2
(1.宁夏医科大学 基础医学院 病理生理学系,宁夏 银川 750004;2.复旦大学 基础医学院生理与病理生理学系,上海 200032)
目的研究羟基类固醇硫酸基转移酶SULT2B1与人肝癌细胞BEL- 7402上皮间质转化的关系及其作用机制。方法细胞分为空白对照组(NC)、阴性对照组(control-siRNA)和SULT2B1干扰组(SULT2B1-siRNA),LipofectamineTM2000脂质体转染细胞,real-time PCR和Western blot检测干扰效果。Western blot检测紧密连接蛋白(ZO- 1)、波形蛋白(vimentin)和转录因子ZEB1的表达。结果SULT2B1干扰BEL- 7402细胞后其mRNA与蛋白表达均显著降低 (P<0.05),ZO- 1表达水平升高(P<0.05),vimentin的表达及ZEB1的蛋白水平均降低(P<0.05)。结论干扰SULT2B1通过下调ZEB1的表达抑制人肝癌细胞BEL- 7402的上皮间质化。
肝癌细胞;羟基类固醇硫酸基转移酶SULT2B1;上皮间质转化;ZEB1
羟基类固醇硫酸基转移酶(Hydroxysteroid sulfotransferases)2B1 (SULT2B1)参与了肝脏的氧化固醇硫酸化[1]、脂质代谢[2]和肝细胞再生过程[3- 4]。前期研究发现,SULT2B1在人肝癌组织和肝癌细胞中高表达,干扰SULT2B1可抑制肝癌细胞的体内外增殖[5]。近年来,上皮-间质转化(epithelial-mesenchymal transition,EMT)在肿瘤的发生与进展中的作用倍受关注,肿瘤中的EMT被认为是胚胎发育的再度激活[6]。本研究检测EMT相关分子紧密连接蛋白(zonula occludens- 1, ZO- 1)、波形蛋白(vimentin)和E盒锌指结合蛋白1(Zinc finger E-box binding homeobox 1, ZEB1)的表达,探讨SULT2B1与人肝癌细胞BEL- 7402 EMT间的关系及其可能机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞:人肝癌细胞系BEL- 7402(ATCC)。
1.1.2 实验试剂:DMEM培养基和胎牛血清(Gibco公司)、Trizol Reagent 和LipofectamineTM2000(Invitrogen公司)、RevertAIdTMFirst Strand cDNA Synthesis Kit #1622(Fermentas公司)、SYBR GREEN supermix(Bio-Rad公司);BCA-100蛋白质定量试剂盒(上海申能博彩生物科技有限公司)、RIPA蛋白裂解液(上海碧云天生物)、ECL化学发光检测试剂盒(北京康维世纪公司)、0.25%胰蛋白酶(杭州吉诺生物公司)、SULT2B1兔多克隆抗体(Abcam公司)、ZO- 1、vimentin和ZEB- 1兔多克隆抗体(Cell Signal Technology公司)、Tubulin兔多克隆抗体(Bioworld公司)、山羊抗兔IgG抗体、山羊抗兔FITC标记IgG抗体(Santa Cruz公司)、DAPI染色液(武汉博士德生物公司);SULT2B1-siRNA序列(SULT2B1-siRNA)和对照序列(control-siRNA)由上海吉凯基因化学有限公司合成;引物由上海桑尼公司合成。
1.2 实验方法
1.2.1 细胞培养:用含10%胎牛血清的DMEM培养液培养细胞,待BEL- 7402细胞增殖至铺满瓶底后用含0.125%的胰蛋白酶消化液消化细胞,每3~4 d换液1次。培养条件为37 ℃、5% CO2、饱和湿度。
1.2.2 BEL- 7402细胞免疫荧光染色: 取正常条件下培养24 h 的BEL- 7402细胞制作细胞爬片,用4%多聚甲醛溶液室温固定10 min,PBS漂洗3次,每次5 min,0.5% Triton- 100通透15 min,滴加1% 牛血清白蛋白封闭剂置于37 ℃湿盒中温育30 min,吸干封闭剂,滴加1∶200稀释的SULT2B1兔多克隆抗体,同时设置正常IgG兔多克隆抗体代替一抗的阴性对照,4 ℃孵育过夜。PBS漂洗3次,每次5 min,加入1∶50稀释荧光素FITC标记羊抗兔二抗,37 ℃湿盒孵育30 min,PBS漂洗3次,加入5 μg/mL的DAPI染核2 min(避光),PBS漂洗3次,封片,激光共聚焦显微镜下观察并采集图片。
1.2.3 细胞转染及分组:实验设立空白对照组(NC)、阴性对照组(control-siRNA)和SULT2B1干扰组(SULT2B1-siRNA)。转染前,将BEL- 7402细胞以2×105/孔接种于6孔板中,并将细胞培养基换成不含血清和抗生素的新鲜培养基,空白对照组不做相应处理,SULT2B1干扰组和阴性对照组,用合成的SULT2B1-siRNA(靶序列:5′-CGGAAATCAGC CAGAAGTT-3′)和阴性对照control-siRNA(序列:5′-UUCUCCGAACGUGUCACGUTT-3′)分别与Lipofect-amineTM2000转染试剂混合后,按说明书进行操作。转染后48 h,抽提细胞RNA和蛋白,检测干扰效果。1.2.4 Real-time PCR检测BEL- 7402细胞中SULT2B1的mRNA表达水平:PCR引物序列:SULT2B1:5′-AGTTTGGCTCCTGGTTGG-3′ (上游)、5′-GAGGCAG CAGCGTGTAGTT-3′(下游);内参GAPDH:5′-AAC GGATTTGGTCGTATTG-3′(上游)、5′-GGAAGATGG TGATGGGATT-3′(下游)。Trizol法提取细胞总RNA,使用Fermentas反转录试剂盒并按照说明合成cDNA。反应结束计算实验组相对于对照组基因表达量。1.2.5 Western blot检测BEL- 7402细胞中SULT2B1、ZO- 1、vimentin和ZEB- 1的表达水平:采用RIPA裂解缓冲液冰上裂解细胞,BCA法测定蛋白浓度,每个样品取20 μg上样,10% SDS-PAGE、PVDF转膜、用含5%脱脂奶粉的TBST溶液封闭1 h,分别用相应的SULT2B1抗体(1∶500)、ZO- 1抗体(1∶1 000)、vimentin抗体(1∶1 000)、ZEB- 1抗体(1∶500)和tubulin抗体(1∶5 000)孵育, 4 ℃冰箱中摇床孵育过夜,次日复温0.5 h后,TBST洗3次,每次5 min,加入HRP标记的山羊抗兔IgG抗体(1∶2 000)37 ℃孵育45 min,TBST洗3次,每次5 min,ECL显色,化学发光试剂检测目的蛋白的相对表达量。
1.3 统计学分析

2 结果
2.1 SULT2B1在BEL- 7402细胞中的表达与定位
SULT2B1在BEL- 7402细胞中高表达,且主要分布在胞质(绿色荧光)(图 1)。
2.2 BEL- 7402细胞中SULT2B1-siRNA片段的干扰效果
BEL- 7402细胞中转染针对SULT2B1靶序列的siRNA干扰片段后,其mRNA与蛋白表达水平均显著低于阴性对照组和空白对照组(P<0.05)(图2)。
2.3 干扰SULT2B1对ZO- 1与vimentin表达水平的影响
BEL- 7402细胞中干扰SULT2B1后,与阴性和空白对照组相比, 上皮标志物ZO- 1蛋白表达水平显著升高(P< 0.05),vimentin的蛋白表达水平显著降低(P< 0.05)(图3)。

图1 SULT2B1在BEL- 7402细胞中的表达与定位Fig 1 SULT2B1 expression and localization in BEL- 7402 cells(scale bar=200 μm)

The mRNA (A) and protein (B) levels of SULT2B1 in BEL- 7402 cells with SULT2B1-specific siRNA treatment;*P<0.05 compared with control-siRNA group; #P<0.05 compared with NC group
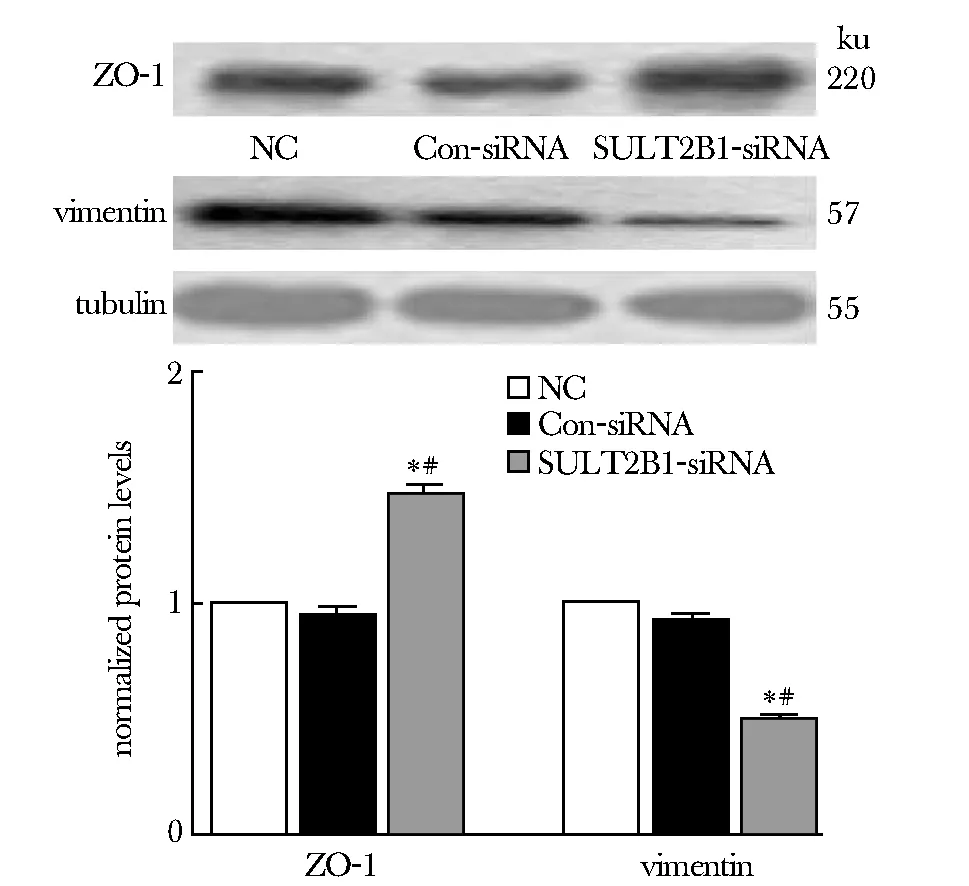
*P<0.05 compared with control-siRNA group; #P<0.05 compared with NC group图3 干扰SULT2B1对ZO- 1与vimentin表达水平的影响Fig 3 The effect of SULT2B1 interference on the ZO- 1and vimentin protein expression in humanhepatocarcinoma BEL- 7402 cells
2.4 干扰SULT2B1对转录因子ZEB1表达水平的影响
BEL- 7402细胞中干扰SULT2B1后,转录因子ZEB1的蛋白表达水平较阴性对照组和空白对照组相比均显著降低(P< 0.05)(图4)。

*P<0.05 compared with control-siRNA group; #P<0.05 compared with NC group图4 干扰SULT2B1对转录因子ZEB1表达水平的影响Fig 4 The effect of SULT2B1 interference on the proteinlevels of transcriptional factor ZEB1 in humanhepatocarcinoma BEL- 7402 cells
3 讨论
SULT2B1通过选择性的催化3β-羟基类固醇参与了机体的多种生物转化反应。近年发现, SULT2B1与前列腺癌、乳腺癌和肝癌的发生有关[5,7- 8]。本结果显示,SULT2B1通过调控ZEB1转录因子,影响上皮与间质标志分子的表达,参与人肝癌细胞BEL- 7402 EMT的发生。
在EMT的发生过程中,具有极性的上皮细胞向具有移行能力的间充质细胞发生转化,同时伴有细胞标志物的改变[9]。主要表现为上皮标志物,如ZO- 1、E-钙黏素(E-cadherin)等表达降低;间质标志物,如vimentin、N-钙黏素等表达增加。研究结果表明,SULT2B1主要表达于BEL- 7402细胞的胞质,提示,SULT2B1可能在参与BEL- 7402肝癌细胞的生物学行为过程中发挥重要作用。干扰SULT2B1使上皮标志物ZO- 1蛋白表达水平升高,间质标志物vimentin的蛋白表达水平降低。提示,干扰SULT2B1可能抑制BEL- 7402细胞的上皮间质化。
进一步研究表明,SULT2B1影响BEL- 7402细胞上皮间质物表达水平的同时,也可降低EMT发生相关转录因子ZEB1的蛋白表达。ZEB1是诱导肿瘤细胞发生EMT的因子之一[10]。有报道,在非小细胞性肺癌(non-small cell lung cancers, NSCLCs)中,ZEB1能增加基质金属蛋白酶MMP2的异常表达,影响NSCLCs的侵袭与转移[11]。在肝细胞肝癌中,ZEB1的阳性表达与肝癌的侵袭转移和患者的不良预后密切相关[12]。在本研究中,SULT2B1引起上皮与间质分子的改变,可能通过调控ZEB1的转录活性引起的。
综上,本结果显示,干扰SULT2B1通过下调ZEB1的表达,引起ZO- 1表达水平升高、vimentin表达水平降低,进而抑制人肝癌细胞BEL- 7402的上皮间质转化。
[1] Li X, Pandak WM, Erickson SK,etal. Biosynthesis of the regulatory oxysterol, 5-cholesten-3beta,25-diol 3-sulfate, in hepatocytes [J]. J Lipid Res, 2007, 48:2587- 2596.
[2] Bai Q, Xu L, Kakiyama G,etal.Sulfation of 25-hydroxycholesterol by SULT2B1b decreases cellular lipids via the LXR/ SREBP- 1c signaling pathway in human aortic endothelial cells [J].Atherosclerosis, 2011,214:350- 356.
[3] Lo SG, Celli N, Caboni M,etalDown-regulation of the LXR transcriptome provides the requisite cholesterol levels to proliferating hepatocytes [J]. Hepatology, 2010, 51:1334- 1344.
[4] Zhang X, Bai Q, Xu L,etal. Cytosolic sulfotransferase 2B1b promotes hepatocyte proliferation gene expressioninvivoandinvitro[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 303:G344- G355.
[5] Yang X, Xu Y, Guo F,etal. Hydroxysteroid Sulfotransferase SULT2B1b Promotes Hepatocellular Carcinoma Cells Proliferationinvitroandinvivo[J]. PLoS One, 2013, 8: 60853. doi: 10.1371/journal.pone.0060853. 0060853.
[6] Ksiazkiewicz M, Markiewicz A, Zaczek AJ. Epithelial-mesenchymal transition: a hallmark in metastasis formation linking circulating tumor cells and cancer stem cells [J]. Pathobiology, 2012, 79:195- 208.
[7] Falany CN, He D, Dumas N,etal. Human cytosolic sulfotransferase 2B1: isoform expression, tissue specificity and subcellular localization [J]. J Steroid Biochem Mol Biol, 2006,102:214- 221.
[8] He D, Meloche CA, Dumas NA,etal. Different subcellular localization of sulphotransferase 2B1b in human placenta and prostate [J]. Biochem J, 2004, 379:533- 540.
[9] Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition [J]. Nat Rev Mol Cell Biol, 2014,15:178- 196.
[10] Avtanski DB, Nagalingam A, Bonner MY,etal. Honokiol inhibits epithelial-mesenchymal transition in breast cancer cells by targeting signal transducer and activator of transcription 3/Zeb1/E-cadherin axis [J]. Mol Oncol, 2014, 8:565- 580.
[11] Bae GY, Choi SJ, Lee JS,etal. Loss of E-cadherin activates EGFR-MEK/ ERK signaling, which promotes invasion via the ZEB1/MMP2 axis in non-small cell lung cancer [J]. Oncotarget, 2013, 4:2512- 2522.
[12] Hashiguchi M, Ueno S, Sakoda M,etal. Clinical implication of ZEB- 1 and E-cadherin expression in hepatocellular carcinoma (HCC) [J]. BMC Cancer, 2013, 13:572. doi: 10.1186/1471- 2407- 13- 572.
SULT2B1 interference inhibits the epithelial-mesenchymaltransition of human hepatocellular carcinoma BEL- 7402 cells
YANG Xiao-ming1*, LI Gui-zhong1, TIAN Jue1, XU Hua1, YANG Xiao-ling1, YIN Lian-hua2
(1.Dept. of Pathophysiology, School of Basic Medical Sciences, Ningxia Medical University, Yinchuan 750004;2.Dept. of Physiology and Pathophysiology, School of Basic Medical Sciences, Fudan University, Shanghai 200032, China)
Objective To investigate the relationship of hydroxysteroid sulfotransferase 2B1 (SULT2B1) and epithelial-mesenchymal transition (EMT), exploring its possible mechanisms. Methods Cells were divided into three groups: control group, negative control siRNA group and SULT2B1-siRNA group. LipofectamineTM2000 was employed for transient transfection. The SULT2B1 interference efficiency in treated BEL- 7402 cells was detected by real-time PCR and western blot assays respectively. The protein levels of zonula occludens- 1 (ZO- 1), vimentin and transcriptional factor ZEB1 in BEL- 7402 cells with SULT2B1 interference were determined by western blot analysis. Results The mRNA and protein levels of SULT2B1 in treated BEL- 7402 cells were decreased significantly as compared with the negative control group (P< 0.05). The protein level of ZO- 1 was significantly up-regulated(P<0.05), while vimentin and the transcriptional factor ZEB1 were decreased in BEL- 7402 cells with SULT2B1 interference (P<0.05). Conclusions SULT2B1 interference can inhibit the epithelial-mesenchymal transition of BEL- 7402 cells by down-regulating transcriptional factor ZEB1.
hepatocellular carcinoma;hydroxysteroid sulfotransferases 2B1;epithelial-mesenchymal transition;ZEB1
2015- 04- 28
2015- 07- 01
宁夏自然科学基金资助项目(NZ14074)
1001-6325(2015)11-1503-05
R735.7
A
*通信作者(corresponding author):yxming1999 @163.com

