胰腺癌淋巴结转移小鼠外周血免疫细胞群的变化
刘乔飞,牛哲禹,李 媛,王梦一,卢朝辉,廖 泉*,赵玉沛*
(中国医学科学院 北京协和医院 1.基本外科; 2.病理科,北京 100730)
研究论文
胰腺癌淋巴结转移小鼠外周血免疫细胞群的变化
刘乔飞1,牛哲禹1,李 媛2,王梦一1,卢朝辉2,廖 泉1*,赵玉沛1*
(中国医学科学院 北京协和医院 1.基本外科; 2.病理科,北京 100730)
目的观察胰腺癌淋巴结转移小鼠外周血免疫细胞群的变化。方法足底注射C57BL/6J小鼠同源Panc02胰腺癌细胞,流式细胞计数检测外周血中13个免疫细胞群的变化。 结果6周后有淋巴结转移的转移率为65%。与正常对照小鼠相比,非淋巴结转移及淋巴结转移小鼠外周血中B淋巴细胞(P<0.05,P<0.01)、T淋巴细胞(P<0.05,P<0.01)均明显减少;而粒细胞(P<0.05,P<0.01)、髓系来源抑制细胞(MDSC)(P<0.01,P<0.01)以及M2型肿瘤相关巨噬细胞(TAM)(P<0.05,P<0.01)均明显增多。淋巴结转移小鼠较非淋巴结转移小鼠上述变化更明显(P<0.05)。结论胰腺癌淋巴结转移可引起强烈的免疫抑制效应,其中MDSC以及M2型TAM可能起到关键作用。免疫环境的重建可能是胰腺癌淋巴结转移防治的重要靶点。
胰腺癌;淋巴结转移;髓系来源抑制细胞;肿瘤相关巨噬细胞;免疫重建
胰腺癌恶性度极高,易发生淋巴结转移,预后极差[1]。胰腺癌淋巴结转移也是影响胰腺癌预后的独立危险因素,其机制不明,有待深入探讨。胰腺癌病理组织形态特殊,肿瘤细胞少,间质细胞多,且以炎性细胞为主[2]。炎性细胞与肿瘤细胞间的相互作用对胰腺癌的生物学行为可产生重要影响。但外周血炎性细胞在胰腺癌发生淋巴结转移过程中的动态变化情况尚不明确。本研究通过足底注射C57BL/6J小鼠同源Panc02胰腺癌细胞诱发淋巴结转移,系统分析了正常对照小鼠,荷瘤未发生淋巴结转移小鼠以及淋巴结转移小鼠外周血中13个免疫细胞群的变化。研究结果提示胰腺癌淋巴结转移过程诱发全身的免疫抑制效应,其中髓系来源抑制细胞(myeloid derived suppressor cells, MDSC)以及M2型肿瘤相关巨噬细胞 (tumor associated macrophages, TAM)可能起关键作用。免疫环境的重建可能成为胰腺癌淋巴结转移防治的重要靶点。
1 材料与方法
1.1 实验动物
25只SPF级雄性C57BL/6J小鼠6~8周龄,体质量25 g~30 g。[北京维通利华实验动物技术有限公司,动物生产合格证号 SCKK(京)2002- 2003]其中5只用于正常对照,剩余20只用于建立胰腺癌淋巴结转移模型。C57BL/6J小鼠同源胰腺导管腺癌Panc02细胞系由北京协和医院基本外科实验室保种传代。实验动物饲养于SPF级环境。动物实验均通过中国医学科学院北京协和医院动物伦理委员会审查。
1.2 试剂及抗体
抗小鼠单克隆或多克隆荧光标记抗体(表1)。
1.3 建立淋巴结转移肿瘤模型
液氮中取出肿瘤细胞,复苏后,培养传至第三代,待80%~95%汇合时,消化细胞,制备细胞悬液备用(2×107/mL)。将2×106/100 μL Panc02 肿瘤细胞悬液注入小鼠足底。术后6周,处死小鼠,观察腹股沟及腹主动脉旁淋巴结转移情况,留取标本常规行HE染色。处死前1 d,经内眦取外周血行流式细胞计数。

表1 实验所用抗体列表Table 1 The list of antibodies
1.4 组织病理染色
获取腹股沟及腹主动脉旁淋巴结,用10%中性甲醛固定4 d后,常规制作4 μm石蜡切片。常规HE染色。
1.5 流式细胞染色计数
毛细管经内眦取血后红细胞裂解液裂解红细胞。常规流式染色方法染色。利用Accuri C6四通道流式细胞仪(BD,USA)检测各种荧光标记表面分子表达。
1.6 统计学分析

2 结果
2.1 小鼠胰腺癌淋巴转移模型的建立
淋巴结转移建模6周后,小鼠后肢明显肿胀。20只荷瘤小鼠中13只病理确认淋巴结转移,转移率65%。典型胰腺癌转移淋巴大体表现为腹股沟及腹主动脉旁可见多发质硬肿大淋巴结。HE染色可见淋巴结结构破坏,大量低分化癌细胞侵润(图1)。

A.the metastatic inguinal lymph node; B.the metastatic paraaortic lymph node; C. HE staining of the metastaic lymph node(×100)
图1 小鼠胰腺癌淋巴结转移大体相及病理特征
Fig 1 General figures and pathological characteristics of the metastatic lymph nodeds of pancreatic cancer in mice
2.2 胰腺癌淋巴结转移小鼠外周血免疫细胞群的变化
非转移组与对照组相比,外周血中T淋巴细胞总数以及B淋巴细胞均显著减少(P<0.05),而粒细胞(P<0.05)、MDSC(P<0.01)、PMN-MDSC(P<0.01)、MO-MDSC(P<0.05)及M2型TAM(P<0.05)均显著增多。转移组与对照组相比,外周血中T淋巴细胞总数(P<0.05)、辅助T细胞(P<0.05)、细胞毒性T细胞(P<0.05)以及B淋巴细胞(P<0.01)均显著减少,而粒细胞(P<0.01)、MDSC(P<0.01)、PMN-MDSC(P<0.01)、MO-MDSC(P<0.05)、巨噬细胞总数(P<0.05)以及M2型TAM(P<0.01)均增多。转移组与非转移组相比,外周血中粒细胞(P<0.05)、MDSC(P<0.01)、PMN-MDSC(P<0.01)及M2型TAM (P<0.05)均增多(表 2,图 2)。
3 讨论
胰腺癌易发生淋巴结转移预后极差[3]。胰腺癌肿瘤组织高度纤维化,肿瘤细胞稀少,富含间质细胞,尤其以各种炎性细胞为主[4- 5]。不可控炎症作已经成为恶性肿瘤的一个新的标志特征[6]。髓系来源抑制细胞(myeloid derived suppressor cells, MDSC)是一群被肿瘤诱导产生的髓系来源的异质性免疫负向调节细胞,进一步分为PMN-MDSC以及MO-MDSC 两种亚型[7]。巨噬细胞在肿瘤细胞的诱导下可由经典的M1型向M2型极化,从而促进肿瘤进展[8]。胰腺癌荷瘤小鼠外周血及肿瘤组织中MDSC与M2型TAM与肿瘤负荷呈正相关[4- 5]。胰腺癌、乳腺癌标本中粒细胞数目、M2型TAM数目也与患者预后呈负相关[9- 10]。Panc02细胞胰腺内原位注射的方法可建立淋巴结转移模型,但小鼠大多死于原发灶快速生长,淋巴结转移率低,不利于长期观察[11]。P53突变基因工程小鼠可诱导小鼠胰腺癌发生,但耗时长、技术要求高,淋巴结转移率低[12]。胰腺癌细胞足底注射方法简便,转移率高达65%且无死亡率。转移组及非转移组及对照组相比,B细胞、T细胞均减少,而粒细胞、MDSC及M2型TAM均显著升高。而转移组与非转移比,虽然B细胞、T细胞均无显著差异,但粒细胞、MDSC及M2型TAM 仍显著升高。而MDSC又以PMN-MDSC 升高为主。可见胰腺癌淋巴结转移过程中,可诱导强烈的全身免疫抑制效应,其中MDSC以及M2型TAM可能起到关键作用。以MDSC以及M2型TAM为靶点的免疫重建,可能成为胰腺癌淋巴结转移防治的新途径。
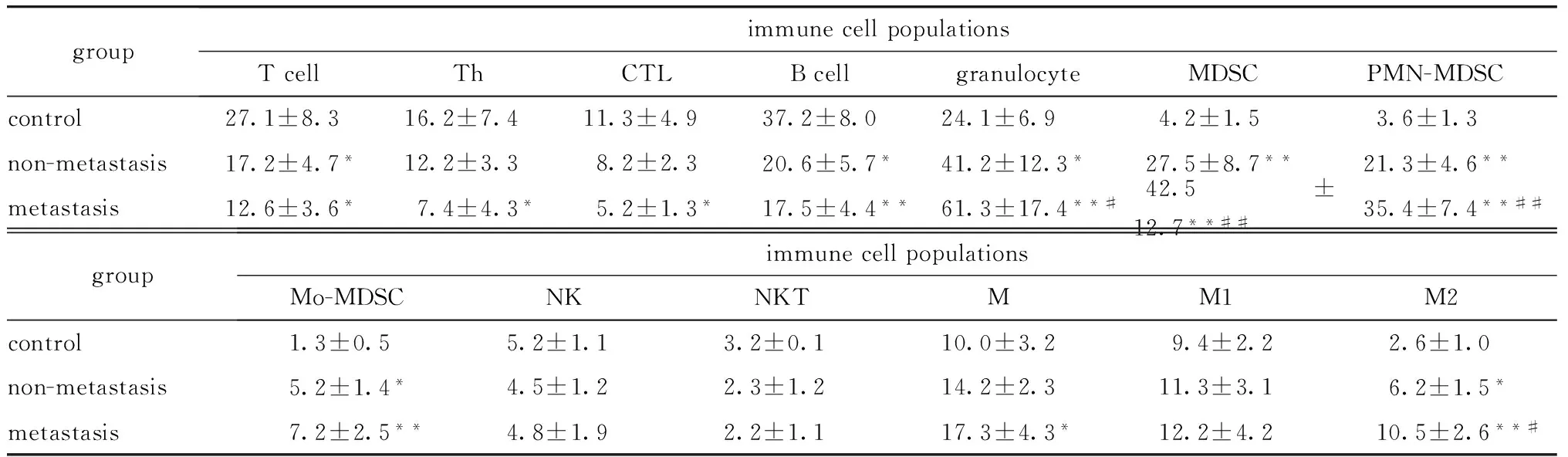
表2 各组小鼠外周血免疫细胞群变化Table 2 The changes of the immune cell populations in peripheral blood[(MEAN±SD)%]
*P<0.05,**P<0.01 compared with the control group;#P<0.05,##P<0.01 compared with non-metastatic group.

Left from upper to lower:total T cell.CD3+, Th.CD3+CD4+, CTL.CD3+CD8+, B cell.CD19+; Right from upper to lower: granulocyte.Gr- 1+, MDSC.CD11b+Gr- 1+, PMN-MDSC/MO-MDSC.CD11b+Ly6ClowLy6G+/ CD11b+Ly6C+Ly6G-(CD11b positive cells were gated); M:F4/80+; M1/M2:F4/80+CD16/32+CD206-/ F4/80+CD16/32+CD206+
图2 外周血免疫细胞群变化流式代表图片
Fig 2 The representative FCM plots of immune cell populations in peripheral blood
[1] Paulson AS, Tran Cao HS, Tempero MA,etal. Therapeutic advances in pancreatic cancer[J]. Gastroenterology, 2013, 144:1316- 1326.
[2] Rucki AA, Zheng L. Pancreatic cancer stroma: understanding biology leads to new therapeutic strategies[J]. World J Gastroenterol, 2014, 20:2237- 2246.
[3] Hartwig W, Werner J, Jager D,etal. Improvement of surgical results for pancreatic cancer[J]. Lancet Oncol, 2013, 14:e476- 485.
[4] 刘乔飞, 廖泉, 宗毅, 等. 免疫健全小鼠Panc02胰腺癌发展过程中髓系来源抑制细胞与肿瘤相关巨噬细胞动态变化[J].中华实验外科杂志, 2014,31:2430- 2433.
[5] 刘乔飞, 廖泉, 宗毅, 等. 免疫健全小鼠Panc02胰腺癌发展过程中免疫细胞群的动态变化[J]. 中国普外基础与临床杂志, 2014, 11:1366- 1371.
[6] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011,144:646- 674.
[7] Condamine T, Ramachandran I, Youn JI,etal. Regulation of tumor metastasis by myeloid-derived suppressor cells[J]. Annu Rev Med, 2015, 66:97- 110.
[8] Qian BZ, Pollard JW. Macrophage diversity enhances tumor progression and metastasis[J]. Cell, 2010,141:39- 51.
[9] 柯星,张淑平,吴梦,等. 肿瘤相关M2型巨噬细胞通过Toll样受体增强卵巢癌细胞MMP- 9的表达[J]. 基础医学与临床, 2014, 34:1315- 1320.
[10] 刘妍,陈翀,曹峰琦,等. 肿瘤微环境中乳酸对巨噬细胞表型极化和功能的影响[J]. 基础医学与临床, 2014, 34:740- 745.
[11] Jiang YJ, Lee CL, Wang Q,etal. Establishment of an orthotopic pancreatic cancer mouse model: cells suspended and injected in Matrigel[J]. World J Gastroenterol, 2014, 20:9476- 9485.
[12] Zhao F, Obermann S, von Wasielewski R,etal. Increase in frequency of myeloid-derived suppressor cells in mice with spontaneous pancreatic carcinoma[J]. Immunology, 2009, 128:141- 149.
The changes of immune cell populations in peripheralblood of mice with lymph node metastasis of pancreatic cancer
LIU Qiao-fei1, NIU Zhe-yu1, LI Yuan2, WANG Meng-yi1, LU Zhao-hui2, LIAO Quan1*, ZHAO Yu-pei1*
(1.Dept. of General Surgery; 2.Dept. of Pathology, PUMC Hospital, CAMS & PUMC,Beijing 100730,China)
Objective To observe the changes of immune cell populations in peripheral blood of mice with lymph node metastasis of pancreatic cancer. Methods C57BL/6J mouse syngeneic Panc02 pancreatic cancer cells were injected into intra-footpad. The FCM (fluorescence activated cytometry) was adopted to detect 13 immune cell populations in peripheral blood. Results Six weeks after injection, the lymph node metastasis rate was 65%. Compared to that of normal mice, in the peripheral blood of the mice with and without lymph node metastasis, the B lymphocytes(P<0.05,P<0.01) and T lymphocytes (P<0.05,P<0.01)were significantly decreased; however, the granulocytes(P<0.05,P<0.01), myeloid derived suppressor cells (MDSC) (P<0.01,P<0.01)and M2 polarized tumor associated macrophages (TAM) (P<0.05,P<0.01)were significantly elevated. Compared with the tumor bearing mice without lymph node metastasis, in the peripheral blood of the tumor bearing mice with lymph node metastasis, the changes of the above immuen cell populations were more obvious(P<0.05). Conclusions Pancreatic cancer with lmyph node metastasis can induce intensively systemic immunosuppression and the MDSC and M2 polarized TAM may play crucial roles. Immune reconstructions are potential important targets for the prevention and treatment of lymph node metastasis of pancreatic cancer.
pancreatic cancer; lymph node metastasis; myeloid-derived suppressor cells; tumor associated macrophages; immune reconstruction
2015- 06- 02
2015- 07- 17
国家自然科学基金(81272573)
1001-6325(2015)11-1471-05
R735.9;R657.5
A
*通信作者(corresponding author):lqpumc@126.com; zhao8028@263.net

