中轴型脊柱关节炎血清Dickkopf-1表达及相关性分析
崔银风 张莉芸 张改连 许珂 马丹 郭东强 闫俊荣
中轴型脊柱关节炎血清Dickkopf-1表达及相关性分析
崔银风 张莉芸 张改连 许珂 马丹 郭东强 闫俊荣
目的 通过检测中轴型脊柱关节炎(ax-SpA)患者血清Dickkopf-1(DKK-1)水平,并进行相关性分析。方法 (1)采用酶联免疫吸附法(ELISA)检测71例初次就诊ax-SpA患者[其中51例强直性脊柱炎(AS)和20例非放射中轴型脊柱关节炎(nr-axSpA)]、疾病对照组34例(其中14例类风湿关节炎、10例骨关节炎和10例痛风患者)和15例健康人,分别检测血清DKK-1水平;(2)根据HLA-B27表达情况,将ax-SpA患者分为阳性组(48例)和阴性组(23例);按照修订纽约放射学骶髂关节炎分级标准,AS患者分为Ⅱ级(16例)、Ⅲ级(12例)和Ⅳ级(23例),比较不同分组血清DKK-1的表达差异;(3)分析血清DKK-1水平与ax-SpA患者临床指标、炎性指标及影像学评分的相关性。结果 (1)AS患者血清DKK-1水平[(2133.9±432.9)ng/L]高于疾病对照组(RA、OA和Gout患者)和健康人[(1718.7±260.4)ng/L],差异有统计学意义(P<0.05)。而低于nr-axSpA患者[(2303.9±289.4)ng/ L],差异无统计学意义。(2)ax-SpA患者HLA-B27阳性血清DKK-1水平[(2150.47±440.9)ng/L]低于HLA-B27阴性患者[(2418.8±319.5)ng/L],差异有统计学意义(P<0.05)。AS患者放射学骶髂关节炎Ⅳ级血清DKK-1水平[(1878.91±285)ng/L]低于Ⅱ级[(2248.18±365.53)ng/L],差异有统计学意义(P<0.05),而Ⅲ级血清DKK-1水平分别与Ⅱ级[(2248.18±365.53)ng/L]、Ⅳ级[(1878.91±285)ng/L]比较,差异无统计学意义。(3)血清DKK-1水平与
ax-SpA患者病程(r=-0.424,P=0.0001)、BASMI(r=-0.264,P=-0.026)和AS患者mSASSS评分(r=-0.581,P=0.023)呈负相关,而与ax-SpA患者临床指标、炎性指标及SPARCC评分无相关性。结论 血清DKK-1水平随着渐进骨化程度的加重呈下降趋势,可能是AS发生关节强直和骨赘形成的一个重要因素;血清DKK-1水平可以作为评价AS骨化程度的潜在生物学标志物之一。
强直性脊柱炎;中轴型脊柱关节炎;Dickkopf-1;骶髂关节X线;骶髂关节磁共振成像
中轴型脊柱关节炎(axial spondyloarthropathy,ax-SpA)累及骶髂关节和脊柱为主,包括强直性脊柱炎(ankylosing spondylitis,AS)和非放射中轴型脊柱关节病(non-radiogrphic axial spondyloarthropathy,nr-axSpA)。AS是一种慢性炎性风湿性疾病,疾病进展情况个体差异很大所以寻找预测疾病进展的生物标志物非常必要。其中12% nr-axSpA患者在2年内进展为AS[1],有学者认为AS和nr-axSpA是一种疾病(ax-SpA)的两个阶段[2],但一些数据显示一部分比例的中轴型SpA患者可能永远不会出现X线骶髂关节炎。有的AS患者在发病短期内就会出现关节融合和脊柱强直,而有些患者长期患病却未出现骨化现象。渐进性骨化必然导致AS患者致畸致残,不仅造成劳动力的丧失,而且严重影响患者的生活质量。目前AS骨化机制尚未明确,初始阶段显示为骨吸收,成骨的晚期阶段则主要由Wnt信号通路转导调控并介导新骨形成。DKK-1是Wnt信号通路的抑制因子。已有实验动物研究表明,封闭DKK-1发生骶髂关节强直的现象[3]。DKK-1也参与以骨形成为原型的疾病即AS骨重塑的发病过程中。目前DKK-1与ax-SpA的相关研究较少,为了帮助临床判断病情进展提供依据,我们设立了此项研究。本研究探讨血清DKK-1在ax-SpA患者的表达以及相关性分析。
1 资料与方法
1.1 一般资料 本研究收集2013年5月~2014年1月就诊于山西医学科学院山西大医院风湿免疫科门诊及住院的51例AS患者和20例nr-axSpA患者临床、实验室及影像学资料(包括1个月之内的骶髂关节X线和MRI)。由专业放射科及磁共振成像医师阅片,其中20例AS患者脊柱X线片显示骨赘形成,行修改Stoke强直性脊柱炎脊柱评分(mSASSS评分)[4]和
42例ax-SpA患者MRI示骶髂关节面骨髓水肿,采用加拿大脊柱关节病研究协会评分(SPARCC评分)[5],并记录评分情况。AS诊断符合修订纽约标准并有放射学骶髂关节炎(至少双侧Ⅱ级或单侧Ⅲ级)和nr-axSpA诊断符合ax-SpA的分类标准但无X线骶髂关节炎。纳入疾病对照组(14例类风湿关节炎、10例骨关节炎和10例痛风)和健康对照(15例),均在性别、年龄方面差异无统计学意义。51例AS患者和20例nr-axSpA患者,男性所占比例分别为78.4%(40例)和45%(9例),平均年龄分别为(35.68±13.62)岁和(30.85±11.22)岁,平均病程分别为(8.78±7.25)年和(4.49±3.01)年,HLA-B27阳性所占比例分别为74.5%(38例)和50%(10例)。
1.2 研究方法
1.2.1 标本采集 收集所有患者和健康者外周静脉血均为清晨空腹抽取,在4℃下处理血液标本,2h内尽快分离血清。3000转离心10min,将血清分装并长期储存在-80℃冰箱保存,备用。
1.2.2 实验方法 使用ELISA法检测所有研究对象血清DKK-1水平,DKK-1试剂盒购自上海源叶生物公司,实验步骤根据说明书进行。
1.3 统计学方法 采用SPSS21.0软件进行统计分析。正态计量资料采用“±s”表示。结果满足正态分布和方差齐性检验,计量资料的比较采用独立样本t检验分析,多组比较采用单因素方差分析,两两比较采用LSD法,计量资料之间相关分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 ax-SpA患者与不同关节炎疾病和健康者血清DKK-1表达差异 本研究AS组血清DKK-1水平高于RA组、OA组、Gout组和NC组,差异均有统计学意义(P<0.05),而低于nr-axSpA组,差异无统计学意义。见表1。
2.2 ax-SpA患者HLA-B27表达与血清DKK-1水平差异 48例HLA-B27阳性ax-SpA患者和23例HLA-B27阴性患者,HLA-B27阳性患者血清DKK-1水平低于HLA-B27阴性患者,差异有统计学意义(P<0.05)。见表2。
表1 中轴型脊柱关节炎患者与疾病对照组和健康对照组血清±s)

表1 中轴型脊柱关节炎患者与疾病对照组和健康对照组血清±s)
注:与nr-axSpA组比较F=7.146,aP=0.101;与RA组比较F=11.76,aP=0.007;与OA组比较F=3.696,aP=0.009;与Gout组比较F=1.109,aP<0.0001;与NC组比较F=9.53,aP=0.001
M±SDAS(n=51)nr-axSpA(n=20)RA(n=14)DKK-12133.9±432.9a2303.9±289.41808.7±218.3 M±SDOA(n=10)Gout(n=10)NC(n=15)DKK-11457.3±644.81556.0±357.21718.7±260.4
表2 中轴型脊柱关节炎患者不同HLA-B27表达血清DKK-1水平比较(±s,ng/L)
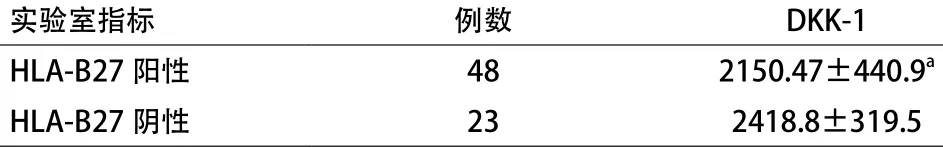
表2 中轴型脊柱关节炎患者不同HLA-B27表达血清DKK-1水平比较(±s,ng/L)
注:与HLA-B27阴性相比,aP=0.011
实验室指标例数DKK-1 HLA-B27阳性482150.47±440.9aHLA-B27阴性232418.8±319.5
2.3 AS患者放射学骶髂关节炎与血清DKK-1水平差异 AS患者不同放射学骶髂关节炎分级血清DKK-1水平差异有统计学意义(P<0.05)。Ⅱ级分别与Ⅳ级比较,差异有统计学意义(P<0.05),Ⅲ级分别与Ⅱ和Ⅳ级比较差异无统计学意义。见表3。

表3 强有性脊柱炎患者不同X线骶髂关节炎分级血清DKK-1水平比较(ng/L)
2.4 ax-SpA患者血清DKK-1水平与临床、实验室及影像学指标相关性分析 71例ax-SpA患者基线时血清DKK-1水平与临床指标及炎性指标的相关性分析结果显示:血清DKK-1水平与病程(r=-0.424,P=0.0001)、BASMI(r=-0.264,P=0.026)呈负相关;与年龄、BASDAI、脊柱痛、脊柱炎症、PGA、夜间痛、BASFI、EI、扩胸度、关节肿胀指数、ESR和CRP无关。见表4。
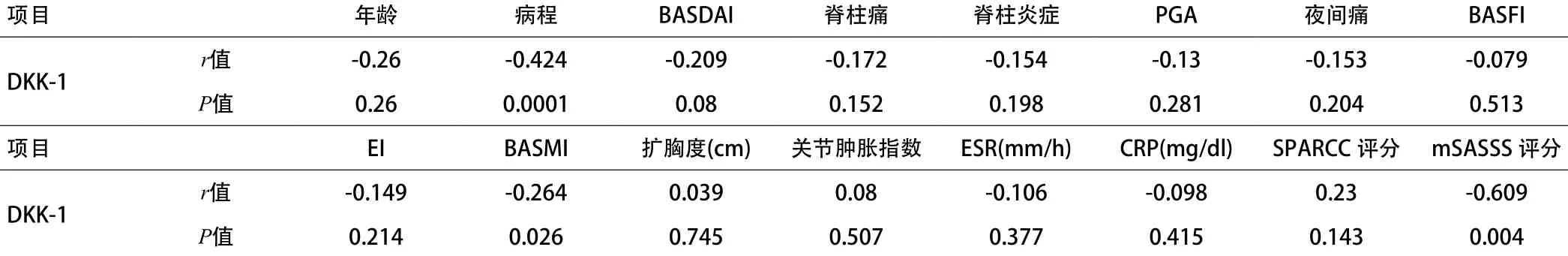
表4 71例中轴型脊柱关节炎患者基线时血清DKK-1水平与临床指标相关性分析(ng/L)
基线时血清DKK-1水平与影像学评分相关分析结果显示:20例AS患者血清DKK-1水平与mSASSS评分呈负相关(r=-0.581,P=0.023),与42例ax-SpA患者SPARCC评分无关(r=-0.23,P=0.143)。见图1。
3 讨论
本研究检测了血清DKK-1水平与ax-SpA患者疾病活动、炎症反应和影像学评分的相关性。血清DKK-1在AS患者体内的表达尚未达成一致结论。研究发现AS患者DKK-1水平高于正常人[6]。而有相反研究发现AS患者血清DKK-1水平低于健康人,认为低水平DKK-1与新骨形成有关[7]。还有研究发现AS患者与正常人血清DKK-1水平无差异[8]。本研究发现AS患者DKK-1水平高于健康人,也高于类风湿关节炎、骨关节炎和痛风患者(P<0.05),而低于nr-axSpA患者(P>0.05)。
HLA-B27转基因大鼠与蛋白多糖BALB/c小鼠模型对比,两者均发生脊椎融合;与雄性DBA小鼠模型对比,两者先前均无侵蚀之后均发生外周关节强直性病变二者先前均无侵蚀之后均发生外周关节强直性病变[9-10]。HLA-B27可能参与中轴关节和外周关节强直发生。研究表明血清DKK-1水平HLA-B27阳性患者比HLA-B27阴性患者是减少的,而BASRI-S和mSASSS评分显著增加[11]。本研究发现ax-SpA患者HLA-B27阳性患者血清DKK-1水平低于HLA-B27阴性患者,差异有统计学意义(P<0.05)。支持Heba的研究HLA-B27阳性患者可能DKK-1低表达或是AS患者关节强直和脊柱骨赘形成的另一个病理生理因素。
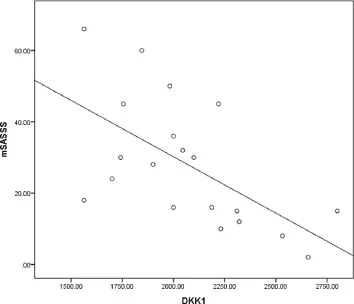
图1 DKK-1与 mSASSS评分相关性
Diarra[12]在关节炎动物模型给予一种DKK-1拮抗剂,与对照组相比,表明阻断DKK-1骨侵蚀可以完全抑制,但有趣的是发现有骨赘形成。Uderhardt等[3]使用TNFtg小鼠探索DKK-1在骶髂关节炎的作用,给予抗DKK-1单克隆抗体的这些小鼠发现骨侵蚀减弱而逐渐出现骶髂关节融合。免疫组化分析显示,封锁DKK-1,骶髂关节内β-连环蛋白量高度上调,提示DKK-1抑制导致Wnt信号增强,随后出现新骨形成。A国内单振兴等[13]检测22例早期AS患者和25例中晚期AS患者血清DKK-1水平,认为中晚期血清DKK-1水平降低于早期患者,差异有统计学意义(P<0.05)。骶髂关节炎Ⅳ级与Ⅱ级血清DKK-1水平比较,差异有统计学意义(P<0.05),Ⅲ级分别与Ⅱ和Ⅳ级比较差异无统计学意义。认为血清DKK-1表达随着骨化程度加重呈下降趋势,可能是AS发生关节强直和骨赘形成的一个重要因素。
Korkosz[14]检测50例AS患者血清DKK-1水平疾病活动组(BASDAI≥4分)高于低疾病活动组(BASDAI<4分)和健康对照组,两组在颈椎和腰椎X线上mSASSS评分无差别,认为AS高度疾病活动可能与新骨形成不相关。本研究发现aSpA患者血清DKK-1水平与病程、BASMI呈负相关,与其他指标年龄、BASDAI、脊柱痛、脊柱炎症、PGA、夜间痛、BASFI、EI、扩胸度和关节肿胀指数无相关性。AA炎症与骨重塑之间的联系还未得到充分的解释。有研究认为AS炎症与新骨形成之间的关系,认为二者是疾病独立的过程[15]。有研究认为基线时的炎症与骨赘形成有关,与炎症持续存在相比,炎症已得到控制的病例骨赘形成更常出现于边缘[16]。Gisela[11]认为Wnt信号通路拮抗剂DKK-1表达与急性时相反应物无关联。AS患者在接受TNF-α抑制剂治疗,CRP值下降与DKK-1水平变化无相关性[17]。本研究检测血清DKK-1水平与炎症反应如ESR、CRP及SPARCC评分无关,支持炎症反应与骨化形成可能并不紧密相关的观点。
有研究认为AS患者血清DKK-1水平与mSASSS评分无相关性[17]。Heiland等[11]研究65例AS患者,在基线时功能性DKK-1水平在无骨赘形成组高于骨赘形成组,但差异无统计学意义;随访了31例无骨赘形成患者2年,无新骨形成的患者DKK-1水平明显高于有新骨形成的患者,DKK-1与另一个Wnt拮抗剂如硬化蛋白水平呈正相关,与CRP无关,但与脊柱放射学评分(mSASSS)呈负相关。本研究对20例AS患者X线显示脊柱骨赘形成(mSASSS)评分,发现DKK-1与mSASSS评分呈负相关,可以作为评价AS骨化程度潜在生物学标志物之一。
综上所述,研究认为血清DKK-1在AS患者异常表达,本研究局限于横断面研究,仍需扩大样本长期随访研究。并进一步研究确定是DKK-1或是其他Wnt拮抗剂用于预测新骨形成的进展。另一方面,增强或者恢复AS患者DKK-1的功能,可能下调Wnt信号通路,可开发一种抑制新骨形成的方法,DKK-1在AS的功能作用仍需进一步研究。
[1] Poddubnyy D,Rudwaleit M,Haibel H,et al.Rates and predictors of radiographic sacroiliitis progression over 2 years in patients with axial spondyloarthritis[J].Ann Rheum Dis,2011,70(8):1369-1374.
[2] Rudwaleit M,Khan MA,Sieper J.The challenge of diagnosis and classification in early ankylosing spondylitis:do we need new criteria?[J]. Arthritis Rheum,2005,52(4):1000-1008.
[3] Uderhardt S,Diarra D,Katzenbeisser J,et al.Blockade of Dickkopflinduces fusion of sacroiliac joints[J].Ann Rheum Dis,2010,69(3):592-597.
[4] Wendling D,Claudepierre P.New bone formation in axial spondyloarthritis[J].Joint Bone Spine,2013,80(5):454-458.
[5] Maksymowych WP,Inman RD,Salonen D,et al.Spondyloarthritis Research Consortium of Canada magnetic resonance imaging index for assessment of sacroiliac joint inflammation in ankylosing spondylitis[J].Arthritis T heum,2005,53(5):703-709.
[6] Zaiying HU,Manlong XU,Qiuxia LI,et al.Adalimumab significantly reduces inflammation and serum DKK-1 level but increases fatty deposition in lumbar spine in active ankylosing spondylitis[J].International Journal of Rheumatic Diseases 2012,15:358-365.
[7] Kwon SR,Lim MJ,Suh CH,et al.Dickkopf-1 level is lower in patients with ankylosing spondylitis than in healthy people and is not influenced by anti-tumor necrosis factor therapy[J].Rheumatol Int,2012,32(8):2523-2527.
[8] Kim TJ,Lee SJ,Cho YN,et al.Immune cells and bone formation in ankylosing spondylitis[J].Clin Exp Rheumatol,2012,30(4):469-475.
[9] Schett G,Landewé R,van der Heijde D.Tumour necrosis factor blockers and structural remodelling in ankylosing spondylitis:what is reality andwhat is fiction?[J].Ann Rheum Dis,2007,66(6):709-711.
[10] Hammer RE,Maika SD,Richardson JA,et al.Spontaneous inflammatory disease in transgenic rats expressing HLA-B27 and human beta 2m:an animal model of HLA-B27-associated human disorders[J]. Cell,1990,63(5):1099-1112.
[11] Heiland GR,Appel H,Poddubnyy D,et al.High level of functional dickkopf-1 predicts protection from syndesmophyte formation in patients with ankylosing spondylitis.Ann Rheum Dis,2012,71(4):572-574. [12] Diarra D,Stolina M,Polzer K,et al.Dickkopf-1 is a master regulator of joint remodeling[J].Nat Med,2007,13(2):156-163.
[13] 单振兴,韩金祥,崔亚洲,等.强直性脊柱炎患者血清中DKK-1的表达及其意义[J].医学检验与临床,2011,22(1):1-2,7.
[14] Korkosz M,Gąsowski J,Leszczyński P,et al.High disease activity in ankylosing spondylitis is associated with increased serum sclerostin level and decreased wingless protein-3a signaling but is not linked with greater structural damage[J].BMC Musculoskelet Disord,2013,14:99.
[15] Lories RJ,Derese I,de Bari C,et al.Evidence for uncoupling of inflammation and joint remodeling in a mouse model of spondylarthritis[J]. Arthritis Rheum,2007,56(2):489-497.
[16] Rennie WJ,Dhillon SS,Conner-Spady B,et al.Magnetic resonance imaging assessment of spinal inflammation in ankylosing spondylitis:standard clinical protocols may omit inflammatory lesions in thoracic vertebrae[J]. Arthritis Rheum,2009,61(9):1187-1193.
[17] Daoussis D,Liossis SN,Solomou EE,et al.Evidence that Dkk-1 is dysfunctional in ankylosing spondylitis[J].Arthritis Rheum,2010,62(1):150-158.
Objective To detect serum levels of DKK-1(Dickkopf-1) in axial spondyloarthropathy (ax-SpA) and correlation analysis. Methods (1) Enzyme-linked immunosorbent assay (ELISA) was used to detect 71 cases of patients with initial visiting ax-SpA [including 51 cases of ankylosing spondylitis (AS) and 20 cases of non- radiology axial spondyloarthropathy (nr-axSpA)] and serum levels of DKK-1 in disease control groups (14 cases of RA, 10 patients of OA and 10 cases of gout patients) and 15 cases of healthy control group; (2)According to the expression of HLA-B27,ax-SpA patients were divided into positive group (48 cases) and negative group (23 cases);accordance with the revised New York radiological sacroiliitis grading standards,ax-SpA patients were divided into grade Ⅱ (16 cases), grade Ⅲ (12 cases) and grade Ⅳ (23 cases), comparing to expression differences of serum DKK-1 in different groups; (3)Correlation analysis serum levels of DKK-1 with ax-SpA patients clinical indicators,inflammatory markers and radiographic score. Results (1)Serum levels of DKK-1 in AS patients [(2133.9±432.9)ng/L] higher than disease control groups (including RA, OA and Gout patients) and healthy control group [(1718.7±260.4)ng/L],it has a statistical significance (P<0.05). But lower than nraxSpA patients [(2303.9±289.4)ng/L], the difference was not statistically significant. (2)Serum DKK-1 levels in ax-SpA patients with HLA-B27 positive below HLA-B27 negative patients [(2150.47±440.9)ng/L], the difference had a statistically significant (P<0.05). Serum levels of DKK-1 in radiographic sacroiliitis grade Ⅳ patients [(1878.91±285)ng/L] and grade Ⅲ patients [(2059.33±324.26)ng/L], the difference had a statistically significant (P<0.05), whereas serum levels of DKK-1 with grade Ⅱ [(2248.18±365.53)ng/L] and Ⅲ grade [(2248.18±365.53)ng/L], grade Ⅲ and grade Ⅳ, differences was no statistically significant. (3)Serum levels of DKK-1 with duration (r=-0.424 P=0.0001), BASMI (r=-0.264,P=-0.026) of ax-SpA patients and mSASSS score of AS patients (r=-0.581,P=0.023) were negatively correlated, Serum levels of DKK-1 with ax-SpA patients in clinical indicators,inflammatory markers and SPARCC score was no correlation. Conclusion With the severity of progressive ossification, DKK-1 level downward trend that may be an important factor in the occurrence of ankylosis and osteophyte formation of AS; DKK-1 level as one of potential biological markers that can be evaluated ossification degree of AS.
Ankylosing spondylitis; Axial spondyloarthropathy; Dickkopf-1; Sacroiliitis joint X-ray; MRI
10.3969/j.issn.1009-4393.2015.5.003
山西 030001 山西医科大学 (崔银风) 山西医学科学院 山西大医院风湿免疫科 (张莉芸 张改连 许珂 马丹) 山西大医院放射科 (郭东强) 山西大医院磁共振室(闫俊荣)
张莉芸 E-mail:zhangly2006@sina.com

