外源NO对玉米幼苗叶片保水能力和抗氧化酶活性的影响
苗丰 刘全永 邵瑞鑫等
摘要:采用三叶一心期的玉米幼苗为试验材料,研究不同浓度外源一氧化氮(NO)供体SNP(硝普钠)处理对玉米幼苗叶片保水能力、丙二醛、叶绿素含量及抗氧化酶活性等指标的影响。结果表明,与对照相比,10、50、100、200 μmol/L SNP处理可提高玉米幼苗离体叶片的含水量1.5%、6.2%、9.8%、8.6%,不同程度减缓其叶片失水速率,增加其叶片光合色素含量。此外,SNP还能显著诱导SOD、CAT、POD活性上升,从而提高玉米幼苗自身抗氧化能力。本试验中以100 μmol/L的SNP使用效果最佳。
关键词:玉米;外源NO;叶片;保水能力;抗氧化酶
中图分类号: S513.01 文献标志码: A
文章编号:1002-1302(2015)03-0082-03
一氧化氮(NO)是植物体内重要的气体自由基分子,诸多研究显示NO参与了植物生长发育的许多过程,如植物抗逆反应[1]、根生长、叶扩展[2]、侧根形成[3]、种子萌发[4]以及细胞凋亡[5]等。但是,NO与其他植物激素相似,在调节植物生长过程中的作用具有浓度效应,低浓度一般促进生长,高浓度则抑制生长,这在小麦、棉花和水稻等植物中已得到证明[6-8]。且大量试验报道以100 μmol/L的SNP调控植物生长发育效果最佳[6,9],但是与浓度更低的NO相比在玉米幼苗中调控效果如何尚无报道。
干旱胁迫是制约玉米生长的重要非生物胁迫因素之一[10],可导致植物叶绿素降解[11]、细胞ROS积累[12]、质膜透性改变[13]、破坏光合作用[14],并抑制生长[15]。关于外源NO能够提高小麦等作物抗逆适应能力的报道较多[5],但在玉米苗期通过外源NO预处理达到提高其抗旱性的研究尚未报道。因此,本试验选用郑单958为材料,通过研究0~200 μmol/L 不同浓度外源NO供体(硝普钠)对玉米幼苗叶片保水能力及抗氧化酶活性的影响,以期为化控预防抗旱技术提供科学依据。
1 材料与方法
1.1 试验材料和方法
试验于2013年在河南农业大学进行,以郑单958为材料,精选均匀、饱满、无病虫害玉米种子,在2% NaClO中消毒10 min,灭菌蒸馏水冲净后浸种8 h,放置在28 ℃培养箱中发芽,3 d后选取萌发一致的种子在1/2 Hogland营养液中水培,昼夜光照为12 h/12 h,昼夜温度为(25±2) ℃/(20±2) ℃,玉米长至1叶1心时喷施4个不同浓度(10、50、100、200 μmol/L)的SNP溶液(NO供体硝普钠)处理,每隔24 h处理1次,以叶面有水滴流下为标准,以清水处理(CK)为对照。至玉米长至三叶一心期,取顶部全展叶片,进行丙二醛含量、叶绿素含量、抗氧化酶活性测定,另取相同部位叶片称取鲜质量后放入清水中饱和吸水6 h后测定叶片的水分含量,每处理重复3次,每重复种植20株。SNP溶液现配现用。
1.2 测定指标和方法
离体叶片相对含水量(RWC)的测量:采用饱和称质量法[16]测定,每隔1h称质量1次,共24次,最后烘干称取干质量。RWC=(初始鲜质量-干质量)/(饱和鲜质量-干质量)×100%。
叶绿素含量测量方法参照赵世杰等的方法[17]。超氧化物歧化酶(superoxide dismutase,SOD)活性的测定采用氮蓝四唑(NBT)还原法[18],以抑制NBT光化还原50%的酶量为一个酶活性单位;过氧化物酶(peroxidase,POD)活性测定采用愈创木酚法比色法[19],以μmol/(min·g)表示POD活性;过氧化氢酶(catalas,CAT)活性测定采用紫外吸收法[20],以U/(min·g)表示CAT活性;丙二醛(malonyldialdehyde,MDA)含量采用硫代巴比妥显色法测定[21]。
1.3 数据统计
数据采用Microsoft Excel软件进行绘图,用SAS统计软件进行统计分析,用Duncans新复极差法进行多重比较。
2 结果与分析
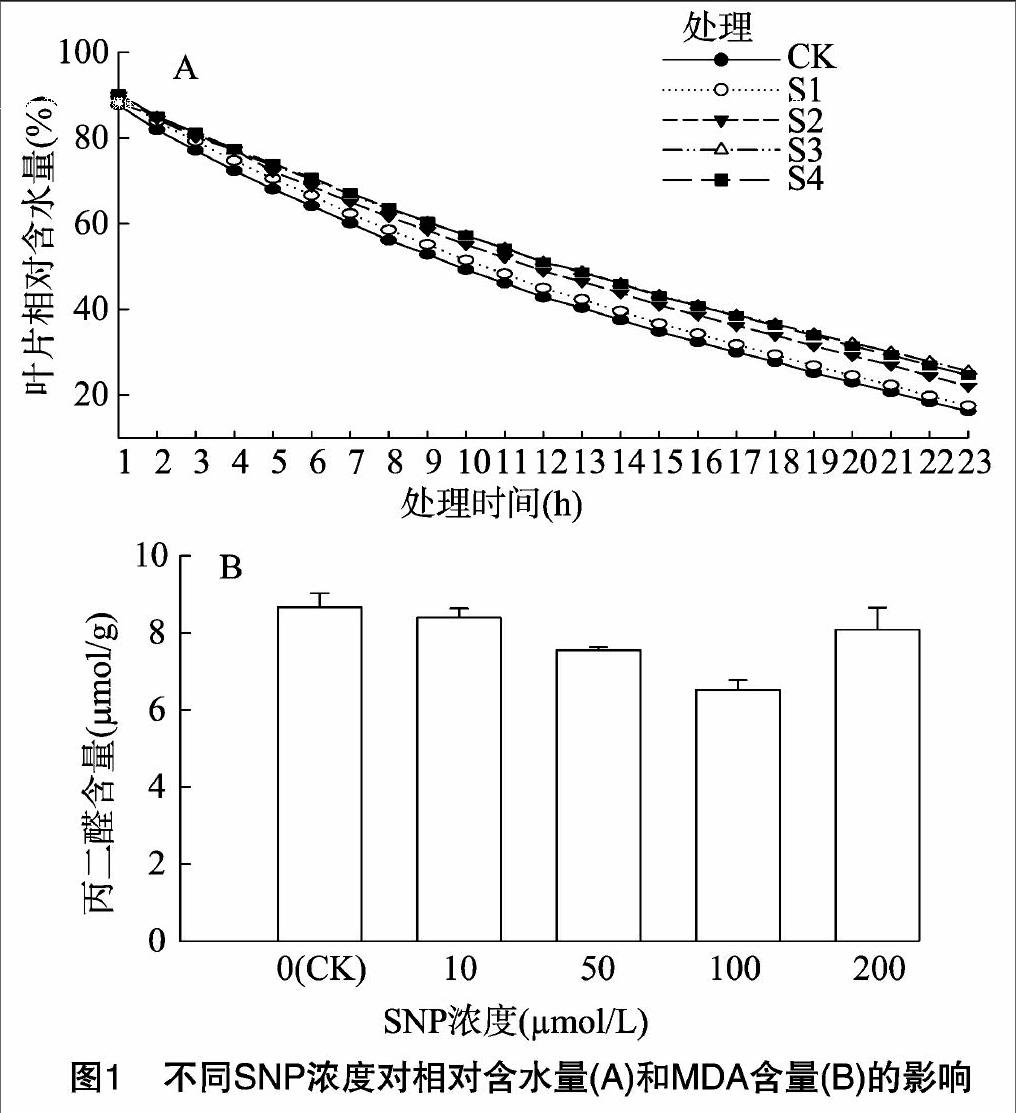
2.1 外源NO对玉米幼苗叶片相对含水量和MDA含量的影响
叶片相对含水量随着时间变化逐渐降低,但是SNP预处理的玉米幼苗叶片相对含水量在23 h内均高于对照(图1-A)。在10~100 μmol/L SNP浓度范围内,随着SNP浓度增加,叶片的相对含水量越高,尤其在处理后23 h时处理之间叶片相对含水量差异最大,10、50、100、200 μmol/L SNP分别比对照的叶片含水量提高1.5%、6.2%、9.8%、8.6%。以上结果表明,低浓度SNP能提高玉米幼苗叶片的相对含水量,以100 μmol/L SNP处理效果最佳。
叶片MDA含量随着SNP浓度升高呈先降低后增加趋势(图1-B)。SNP浓度为50 μmol/L时幼苗体内MDA水平与对照相比降低12.8%;SNP浓度为100 μmol/L时,MDA含量降至最低;SNP浓度为200 μmol/L时MDA含量反而升高,且与对照相比差异不明显。这些结果表明适宜的SNP浓度处理可缓解膜脂过氧化程度,保持细胞膜的稳定性。
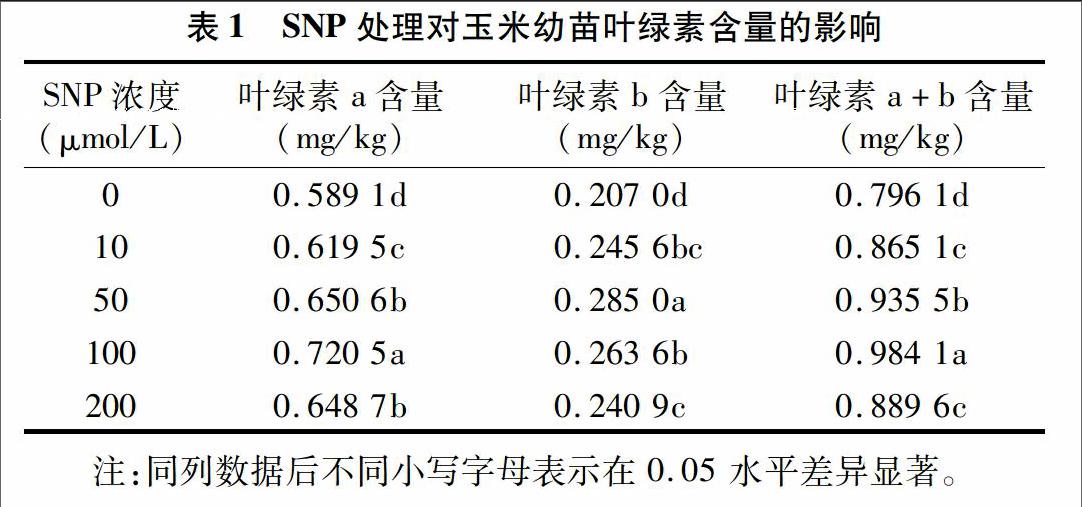
2.2 外源NO对玉米幼苗叶片叶绿素含量的影响
由表1可见,叶绿素a、叶绿素b及叶绿素a+b的含量随着SNP浓度的升高呈先增后降的趋势,在SNP浓度为 100 μmol/L 时,叶片叶绿素a、叶绿素b及叶绿素a+b的含量与对照相比均差异显著。随着SNP浓度进一步增加(即至200 μmol/L),叶绿素含量出现降低的趋势。当处理浓度为10、50、100、200 μmol/L时,叶绿素a含量分别比对照增加了5.16%、10.44%、23.31%、10.12%,叶绿素b含量比对照增加了18.65%、37.68%、27.34%、16.38%,叶绿素b的增加幅度要大于叶绿素a,可能是由于SNP对叶绿素b的影响大于叶绿素a。以上研究结果表明各处理均能提高玉米幼苗叶片叶绿素a、叶绿素b及叶绿素a+b的含量,增强叶片的光合能力,且当SNP浓度为100 μmol/L时效果最好。
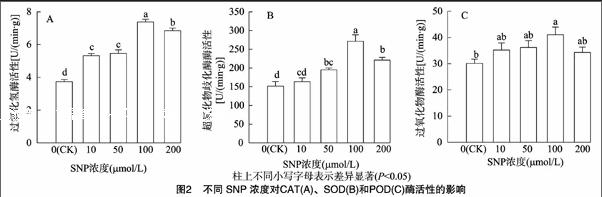
2.3 外源NO对玉米幼苗叶片抗氧化酶活性的影响
由图2可知,随着SNP浓度升高,SOD、POD、CAT活性表现先增后降的趋势,各处理均优于对照,浓度为100 μmol/L时活性增加最明显,与其他处理相比差异均达到显著水平。浓度为200 μmol/L时,叶片CAT活性与10、50 μmol/L时相比也显著提高(图2-A),SOD活性较100 μmol/L SNP处理显著降低,且与50 μmol/L处理间差异不显著(图2-B)。POD活性低于其他浓度处理(图2-C)。
上述研究结果表明,SNP处理能增强玉米幼苗叶片SOD、POD、CAT酶的活性,进而提高玉米叶片的抗氧化能力,其中SOD和CAT酶活性受SNP处理影响较大,适宜的SNP浓度处理能够显著提高玉米叶片的抗氧化能力,清除细胞内过多的活性氧自由基,使之维持在正常水平,从而保护膜结构稳定。浓度为100 μmol/L时效果最好。
3 讨论
植物叶片失水时,不饱和脂肪酸在自由基的作用下,发生膜脂过氧化,膜脂过氧化会引起膜中蛋白质交联、聚合及类脂变化,使膜上孔隙变大,通透性增加,离子大量外泄导致细胞代谢紊乱,严重时导致植物死亡[22]。叶片相对含水量变化可准确反映叶片失水速率[23]。García-Mata等研究发现SNP可以提高小麦叶片含水量[24-25]。陈银萍等认为SNP处理可提高玉米幼苗叶片的相对含水量,减缓叶片的失水速率,显著抑制水分胁迫下玉米幼苗叶片膜脂过氧化的发生[26]。本试验研究结果表明,各浓度SNP处理不同程度降低玉米叶片中MDA含量,100 μmol/L时效果最佳,显著缓解了膜脂过氧化程度,保持细胞膜的稳定性,延缓了玉米叶片的水分散失,提高叶片的保水能力。
SOD、POD、CAT是植物细胞内重要的酶促抗氧化体系[27-29],共同直接或间接消除活性氧和自由基对细胞膜系统的损害,维持正常的活性氧和自由基水平[30]。前人研究表明,玉米抗旱性与超氧化物歧化酶等保护酶活性成显著正相关,抗旱性强的玉米品种POD、CAT、SOD等保护酶活性较高[31]。本试验结果表明,10~200 μmol/L SNP浓度范围内玉米幼苗叶片SOD、POD、CAT酶的活性呈先增后降趋势,100 μmol/L 时清除活性氧自由基、降低膜脂过氧化水平效果最佳。低浓度SNP作为抗氧化剂和ROS相互作用,上调抗氧化酶的基因表达或酶活性,调节ROS水平[32]。蒋明义等证实渗透胁迫下叶绿素的降解主要与活性氧的氧化损伤有关[33]。本研究结果表明施加外源SNP能提高玉米幼苗叶片的叶绿素a、叶绿素b及叶绿素a+b的含量,这和吴雪霞等的研究结果[34]一致。叶绿素在植物体内处于不断更新的状态,NO作为一种重要的生物活性分子,可能是抑制了叶绿素酶的活性或者激活了叶绿素生物合成过程中的某些酶类,进而减少叶绿素的分解,促进叶绿素的合成。
参考文献:
[1]闻 玉,赵 翔,张 骁. 水分胁迫下一氧化氮对小麦幼苗根系生长和吸收的影响[J]. 作物学报,2008,34(2):344-348.
[2]顾庆龙,莫亿伟,涂庆华,等. 盐胁迫下NO对玉米幼苗生理特性的影响[J]. 干旱地区农业研究,2009,27(1):157-162.
[3]曹 冰. 一氧化氮在绿豆侧根发生过程中的作用研究[D]. 西安:陕西师范大学,2005.
[4]Caro A,Puntarulo S. Nitric oxide generation by soybean embryonic axes:possible effect on mitochondrial function[J]. Free Radic Res,1999,31(Sup):205-212.
[5]Pedroso M C,Magalhaes J R,Durzan D. Nitric oxide induces cell death in Taxus cells[J]. Plant Science,2000,157(2):173-180.
[6]邵瑞鑫,上官周平. 外源NO调控小麦幼苗生长与生理的浓度效应[J]. 生态学报,2008,28(1):302-309.
[7]李翠芳,刘连涛,孙红春,等. 外源 NO 对棉花幼苗氧化损伤和保护酶活性的影响[J]. 华北农学报,2013,28(4):158-162.
[8]肖 强,陈 娟,吴飞华,等. 外源 NO 供体硝普钠(SNP)对盐胁迫下水稻幼苗中叶绿素和游离脯氨酸含量以及抗氧化酶的影响[J]. 作物学报,2008,34(10):1849-1853.
[9]王宪叶,沈文飚,徐朗莱. 外源一氧化氮对渗透胁迫下小麦幼苗叶片膜脂过氧化的缓解作用[J]. 植物生理与分子生物学学报,2004,30(2):195-200.
[10]Sharp R E. Poroyko,hejlek L G.root growth maintenance during water deficits:physiology to functional genomics[J]. Joural of Experimental Botany,2004,55(407):2343-2351.
[11]曹 慧,韩振海,许雪峰. 水分胁迫下苹果属植物叶片叶绿素降解的膜脂过氧化损伤作用[J]. 中国农业科学,2003,36(10):1191-1195.
[12]Li C Z,Wang G X. Interactions between reactive Oxygen species,ethylene and polyamines in leaves of Glycyrrhiza inflata seedlings under root osmotic stress[J]. Plant Growth Regulation,2004,42(1):55-60.
[13]陈 军,戴俊英. 水分胁迫下玉米叶片光合作用、脂质过氧化及超微结构变化的关系[J]. 玉米科学,1994,2(4):36-40.
[14]Flexas J,Escalona J M,Medrano H. Water stress induces different levels of photosynthesis and electron transport rate regulation in grapevines[J]. Plant Cell Environ,1999,22:39-48.
[15]范翠丽,牛瑞明,袁 丁. 玉米苗期及萌芽期抗旱性评定方法筛选[J]. 河北北方学院学报:自然科学版,2006,15(5):30-34.
[16]华东师大植物生理教研室.植物生理学实验指导[M]. 北京:人民教育出版社,1980.
[17]赵世杰,刘华山,董新纯. 植物生理学实验指导[M]. 北京:中国农业科技出版社,1998.
[18]刘 萍,李明军. 植物生理学实验技术[M]. 北京:科学出版社,2007.
[19]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[20]邹 琦. 植物生理生化实验指导[M]. 北京:中国农业出版社,1995.
[21]Heath R L,Parker L.Photoperoxidation in isolated chloroplasts kinetics and stoichiometry of fatty acid peroxidation[J]. Arch Biophys,1968,25:189-191.
[22]王晓琴,袁继超,熊庆娥. 玉米抗旱性研究的现状及展望[J]. 玉米科学,2002,10(1):57-60.
[23]白志英,李存东,孙红春. 干旱胁迫对小麦染色体代换系旗叶相对含水量和离体失水速率的影响[J]. 华北农学报,2008,23(1):62-65.
[24]García-Mata C,García Mata C,Lamattina L. Nitric oxide induces stomatal closure and enhances the adaptive plant responses against drought stress[J]. Plant Physiology,2001,126(3):1196-1204.[HJ1.7mm]
[25]García-Mata C. Lamattina L. nitric oxide and abscisic acidcross talk in guard cells[J]. Plant Physiology,2002,128(3):790-792.
[26]陈银萍,陶 玲,杨 莉,等. 一氧化氮对水分胁迫下玉米种子萌发及幼苗生理特性的影响[J]. 广西植物,2010,30(5):672-677.
[27]王志颖,刘 鹏. 柠檬酸抑制剂对铝胁迫下油菜抗氧化酶活性的影响[J]. 江苏农业学报,2013,29(5):957-966.
[28]Liu X Z,Huang B R. Heat stress injury in relation to membrane lipid peroxidation in creeping bentgrass[J]. Crop Science,2000,40(2):503-510.
[29]张治平,於丙军,汪良驹,等. 低温下ALA对番茄光合色素和抗氧化酶活性的影响[J]. 江苏农业学报,2014,30(1):222-224.
[30]马兴立,谌 涛,李 健,等. 不同植物生长调节物质对玉米叶片衰老及产量的影响[J]. 玉米科学,2010,18(3):105-107,112.
[31]李广敏,唐连顺,商振清,等. 渗透胁迫对玉米幼苗保护酶系统的影响及其与抗旱性的关系[J]. 河北农业大学学报,1994,17(2):1-5.
[32]吕 东,张 骁,江 静,等. NO可能作为H2O2的下游信号介导ABA诱导的蚕豆气孔关闭[J]. 植物生理与分子生物学学报,2005,31(1):62-70.
[33]蒋明义,杨文英,徐 江,等. 渗透胁迫下水稻幼苗中叶绿素降解的活性氧损伤作用[J]. 植物学报,1994,36(4):289-295.
[34]吴雪霞,朱月林,朱为民,等. 外源一氧化氮对NaCl胁迫下番茄幼苗生理影响[J]. 中国农业科学,2006,39(3):575-581.

