高效功能菌群RR的筛选及其群落分析
朱玲玉,谢学辉,刘娜,杨芳,俞承志,柳建设
(东华大学环境科学与工程学院,上海 201620)
随着染料和印染工业的迅速发展,大量人工合成的色度高、难降解以及对生物有毒性污染物质的排放,对环境以及人类健康造成了严重的威胁。因此,染料的降解已经被认为是纺织业废水处理亟待解决的问题[1-2]。
国内外常用的染料废水处理方法主要有物理、化学和生物方法。利用物化方法处理印染废水由于其高成本、处理规模有限且目标污染物受限等特点,不适用于印染废水处理常规工艺[3]。微生物处理印染废水中难降解污染物被认为是较为经济有效的方法。细菌、真菌、酵母、放线菌、藻类以及植物均对印染废水中难降解的污染物质有着一定的降解能力,然而细菌由于其生长迅速以及适应性强等特点,目前已成为研究热点[4-6]。
本工作利用梯度浓度压力驯化法,从厌氧反应器中筛选出对直接红28 有具有良好脱色能力的混合菌群RR。研究其培养条件,如温度、pH 值、盐度、初始染料浓度,对混合菌群脱色效果的影响。传统筛选方法中通常利用高营养的LB、蛋白胨培养基筛选功能菌株,这些功能菌株基本上对工程无机环境适应性差、不易存活。本实验筛选功能菌群RR 属于低营养型,为了使功能菌群进一步适应工程无机环境,将培养基中葡萄糖去掉,旨在筛选出以染料为唯一氮源、碳源以及能量的功能菌群RM,并对功能菌群RR、RM 的脱色能力、群落结构进行了分析对比。
1 实 验
1.1 实验材料
1.1.1 染料
采用染料为偶氮类染料直接红28(C.I. Direct Red 28),Tokyo Chemical Industry Co. Ltd.公司,分子式为C32H22N6Na2O6S2,相对分子质量为696.66,特征波长λmax=500nm,分子结构式如图1 所示。
1.1.2 培养基
驯化培养基:葡萄糖2g/L,(NH4)2SO41g/L,K2HPO4·3H2O 1g/L,KH2PO41g/L,MgSO40.2g/L,FeSO4·7H2O 0.05g/L,NaCl 0.1g/L,染 料 50 ~200mg/L,pH 值调整至7.0±0.2。
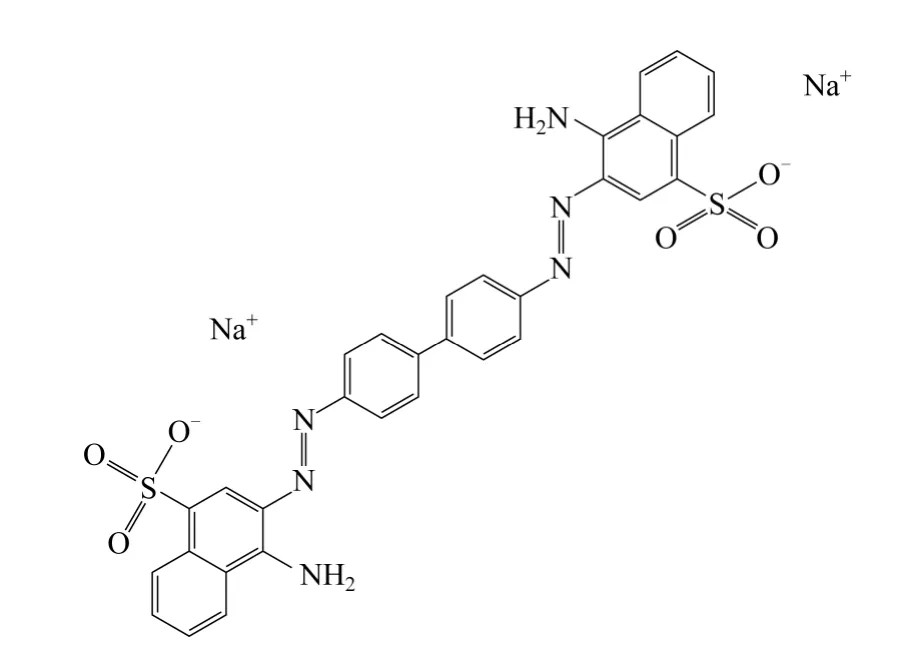
图1 直接红28 分子结构式
染料培养基:葡萄糖2g/L,(NH4)2SO41g/L,K2HPO4·3H2O 1g/L,KH2PO41g/L,MgSO40.2g/L,FeSO4·7H2O 0.05g/L,NaCl 0.1g/L,染料200mg/L,pH 值调整至7.0±0.2。
培养基均在121℃灭菌20min 后冷却备用。
1.1.3 主要仪器设备
HITACHI U-2910 型紫外可见分光光度计,天美(中国)科学仪器有限公司;BIO-RAD DCODETM变性梯度凝聚电泳仪,美国伯乐公司;Gel DocTMXR+BIORAD 凝胶成像系统,美国BIO-RAD。
1.2 方法
1.2.1 实验方法
(1)高效功能菌驯化筛选过程 从运行良好的印染废水生物处理系统厌氧反应器取新鲜活性污泥用无菌玻璃珠在无菌条件下打散制成污泥悬液,取 20mL 加入含 80mL 驯化培养基的 250mL 锥形瓶中,培养温度为 35℃,培养基 pH 值为 7.0,24h 后转入下一瓶驯化培养基中,待染料脱色率达到80%以上,增加驯化培养基中染料的质量浓度,其染料浓度依次为 20mg/L、50mg/L、100mg/L、150mg/L、200mg/L、250mg/L、300mg/L。通过此过程获得了对直接红28 有良好脱色性能的混合菌群RR。
(2)培养条件对菌株脱色效果的影响 分别将温度(25~45℃)、pH 值(4~9)、盐度(1~100mmol/L)、染料初始浓度(10~500mg/L)作为变量,保持其他条件不变,测定其对混合菌群脱色性能的影响。基本实验条件:以初始培养液 (未接菌悬液时) 为空白参比,接入染料培养基(染料浓度200mg/L)于 35℃培养 48h,每8h 测定其脱色率,每一条件做 3 组平行实验。
(3)驯化以染料作为唯一氮源、碳源以及能量的功能菌群 将染料培养基中的葡萄糖去掉,染料浓度变为20mg/L、30mg/L、50mg/L,通过此得到以直接红28 作为唯一氮源、碳源以及能量的菌群RM,将其与功能菌群RR 进行脱色比较。
(4)两种混合菌群群落结构解析 本实验利用变性梯度凝胶电泳(DGGE),对混合菌群RR、RM进行群落结构分析。
①提取总DNA。分别取 1mL 培养至对数期的混合菌群RR、RM 菌液使用基因组抽提实剂盒(EZ-10Span column Genomic DNA Isolation Kit,生工生物工程 (上海) 股份有限公司)提取DNA.
②16S rDNA PCR 扩增。用细菌通用引物对 (正向引物27F5'-AGAGTTYGATCCTGGCTCAG-3'; 反向引物1492R 5'-AAGGAGGTGATCCAGCCGCA -3'[7])扩增两种混合菌群的16S rRNA 基因。聚合酶链式反应 (PCR) 体系为50μL,其组成为:无菌水34μL,10×PCR Buffer 5μL,dNTPs 4μL (2.5mmol/L),MgCl23μL(25mmol/L),引物各1μL (10μmol/L)、Taq DNA 聚合酶 1μL (2.5U/μL),DNA 分别1μL。扩增程序:94 ℃ 3min;94℃ 1min,55℃ 30s,72 ℃ 1min,共32 个循环;72 ℃10min。
③DGGE- PCR 扩增。DGGE-PCR 的引物序列(选用细菌16S rDNA V3 区通用引物)如下所示:引物 338F- GC 序 列 : GC clamp-5′- CCTACGGGAGGCAGCAG-3′;引物517R 的序列:5′-ATTACCGCGGCTGCTGG-3′。扩增程序:95℃ 5min;95℃ 1min,55℃ 30s,72℃ 1min,共30个循环;72℃ 10min。
④DGGE 凝胶电泳及回收DNA 的扩增、测序。变性梯度一般在20%~80%的范围内,根据情况用0~100%的变性溶胶调整混合而成,不同浓度梯度变性胶配方如表1 所示。本实验采用50%~70%变性浓度胶,在温度60℃、电压110V 下,电泳9h。电泳完毕,将凝胶放入EB 中染色30min,然后利用BIO-RAD Gel DocTMXR 凝胶成像系统观察拍照。将纯化产物切下并进行PCR 扩增,将产物送上海生工生物技术有限公司测序。
1.2.2 分析方法
(1)混合菌群脱色液的紫外-可见光谱扫描。取脱色液 2mL,以10000r/min 的转速离心10min,对上清液进行 200~700nm 范围的紫外-可见光谱扫描。
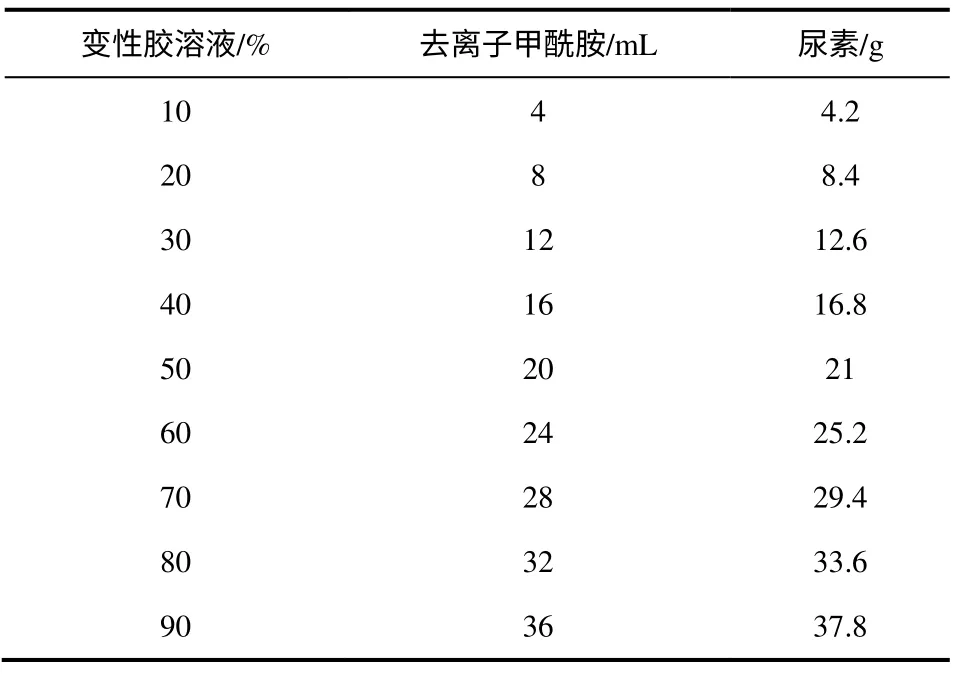
表1 不同浓度梯度变性胶配方
(2)分光光度法测定混合菌群脱色率。按20%接种量将菌群接种于250mL 锥形瓶中,染料最终质量浓度为200mg/L,pH=7.0,35℃培养,每隔8h从染料脱色液中取出2mL,在10000r/min 下离心 10min,取上清液,以富集培养基为空白,测量上清液在染料特征波长处(500nm)的吸光度值,即 A500,以未加菌液的染料培养基为对照,其脱色率根据式(1)计算,并以此来表示菌群的脱色能力。
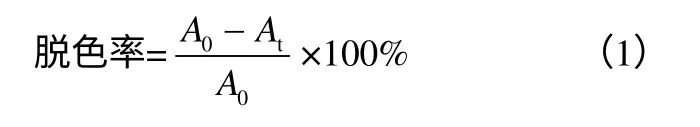
式中,A0为脱色前脱色培养基在500nm 的吸光度值;At为脱色后脱色培养基在500nm 的吸光 度值。
2 结果与讨论
2.1 混合菌群的筛选及脱色
采用梯度浓度压力驯化法,经过7 个染料浓度梯度的依次驯化、筛选,共8 个月的时间得到对直接红28 有良好脱色效果的低营养型功能菌群RR。混合菌群RR 在初始染料浓度为200mg/L 的条件,48h 后其脱色率均稳定在90%以上,脱色效果最高可达96.16%。利用紫外-可见光谱全波长扫描脱色前后的样品,其结果见图2。功能菌群RR 对直接红28 的12h、24h、36h、48h 的脱色率分别为61.61%、75.17%、84.16%、96.16%。
2.2 培养条件对混合菌群脱色作用的影响
2.2.1 pH 值对混合菌群RR 脱色作用的影响
本实验分别对不同pH 值条件下,混合功能菌群RR 的脱色率进行测定,如图3 所示。实验结果表明,在pH=7.0 时,功能菌群的脱色率达到最大为95.2%。功能菌群RR 在pH=4~8 时,脱色率均在60%以上,可见混合功能菌RR 在弱酸、弱碱及中性条件下均有较好的脱色效果,对条件改变适应性强。
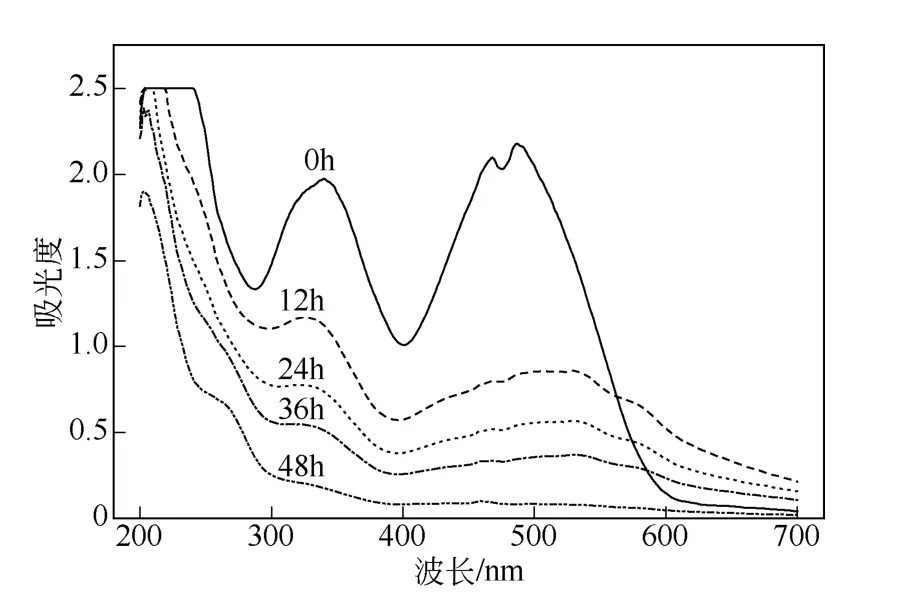
图2 混合菌群 RR 对直接红28 脱色的紫外-可见光扫描谱图
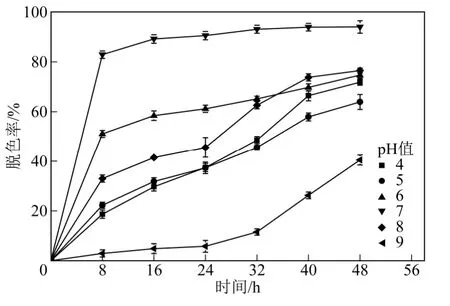
图3 pH 值对混合菌群RR 脱色作用的影响
功能菌群RR 在中性条件下,脱色率达到最大,国外相关研究也得到类似的结果。Patel 等[5]验证混合功能菌群EDPA 在pH=0.7 的条件下,对酸性棕5脱色率达到最大。Prasad 等[8]筛选出对对直接红28降解能力的微生Enterobacter sp. SXCR,最适pH 值为7.0。Anjaneya 等[9]的研究表明,中性条件下更有利于微生物生长、降解以及工程中应用。相关研究表明,pH 值是在染料降解过程中是主要的影响因素,最适pH 值往往在6~10 之间[10-11],对微生物降解染料也有着重要作用的因素依次为初始染料浓度、温度、菌群数量、盐度等。
2.2.2 温度对混合菌群RR 脱色作用的影响
温度对微生物的活性有着至关重要的影响,温度过低微生物活性低,达不到良好的染料降解效果,温度过高,微生物细胞失活,同样降解效率低。如图4 所示,从25℃起,随着温度的升高,染料脱色率不断提高,45℃脱色率达到最大。当温度升到50℃时,脱色率骤减。虽然功能菌群RR 在45℃时降解率达到最大,为了满足工程条件,同时降解率又可以得到保证,所以在后续实验中,培养温度设为35℃。
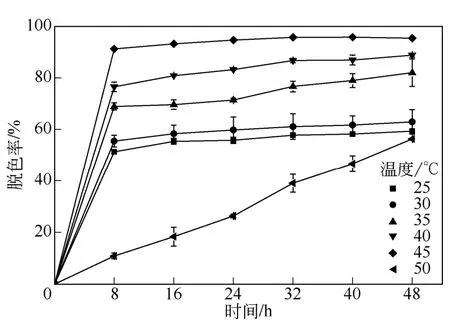
图4 温度对混合菌群RR 脱色作用的影响
由于温度过高,会使细胞中降解酶活性失活,相关研究认为超过35℃情况下,降解率就会降 低[12]。相反,本实验筛选出的功能菌群RR 对直接红28 的降解率在45℃达到最大,Jadhav 等[13]也得到类似的结论。
2.2.3 盐度对混合菌群RR 脱色作用的影响
染料废水中通常含有大量的 NaCl、Na2SO4等盐分,盐度过高会影响微生物细胞的渗透压,从而会抑制微生物生长甚至导致微生物死亡,因此分离、驯化出有较高耐盐性的微生物具有重要的意义。
本实验分别研究不同盐度(1~100mmol/L)情况下对功能菌群降解染料脱色率的影响,当盐度为2mmol/L 时,染料的脱色率达到最大。实验表明(图5),适量的盐度对微生物的生长及脱色有促进作用,而染料浓度过高,会使细胞脱水而死亡。在盐度为1~100mmol/L 范围内,功能菌群RR 对直接红28的脱色效率均在60%以上,说明功能菌群RR 有较好的耐盐能力,适用于工程中稍高盐度的情况。
2.2.4 初始染料浓度对混合菌群RR 脱色作用的 影响
染料的初始浓度会影响功能菌群对其降解效率主要是原因是高浓度的染料对微生物产生生物毒性以及识别底物的相关酶浓度相对降低[14]。在本实验中(图6),随着初始染料浓度的升高,染料的降解率随之降低。初始染料浓度在200mg/L 以内,均可保证在48h 内,染料的脱色率在80%以上,由此可见,功能菌群RR 对直接红28 有着良好的脱色降解能力。
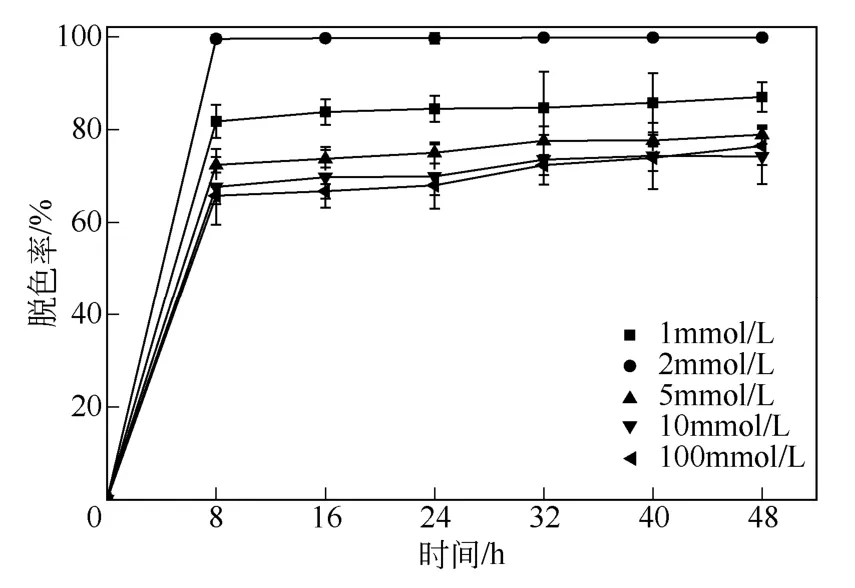
图5 盐度对混合菌群RR 脱色作用的影响
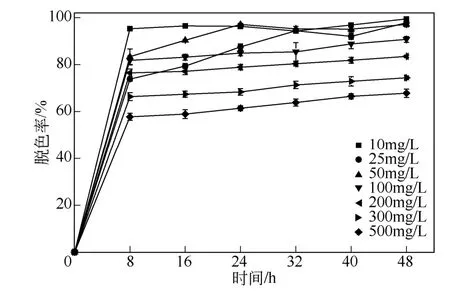
图6 初始染料浓度对混合菌群RR 脱色作用的影响
2.3 以染料为唯一氮源、碳源、能量混合菌群RM筛选
2.3.1 混合菌群RM 的脱色性能
为适应工程无机环境,旨在筛选出以染料作为唯一碳源、氮源以及能量的菌群,将驯化培养基中的碳源葡萄糖去掉,同样利用梯度浓度压力驯化法,经过3 个月的时间,筛选出对直接红28 有一定脱色效果的菌群RM。初始染料浓度为50mg/L、pH=7.0、温度为35℃条件下,48h后染料的脱色率为20.05%。混合菌群RM 对直接红28 没有很高的去除效率,但也是将实验室研究贴近工程无机环境一个很好的开端。今后可以将研究重点放在如何提高混合菌群RM 的脱色率上。利用紫外-可见光谱全波长扫描脱色前后的样品,其结果见图7。
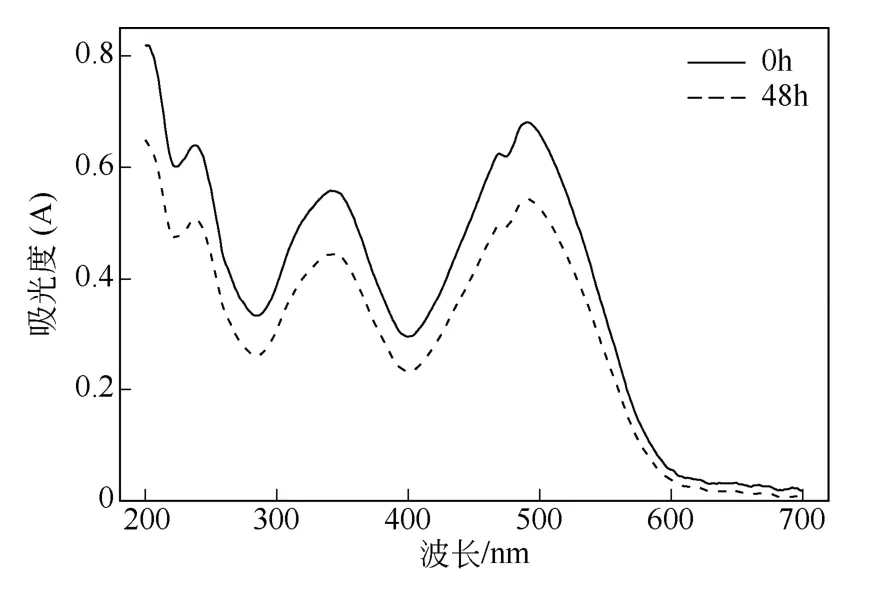
图7 混合菌群RM 对直接红28 脱色的紫外-可见光扫描谱图
国内外许多学者也致力于以目标污染物质作为唯一碳源、氮源以及能量上的研究。Ren 等[15]从印 染废水的活性污泥中发现了对染料有普遍降解能力的DN322 菌株,可以降解偶氮、蒽醌、三苯基甲烷类染料,并且 DN322 可以在降解的过程中把结晶紫用作唯一的碳源和能量,该菌株已经投入到工程中应用。李朝等[16]从土壤中分离出Rhodococcus sp.菌株,该菌株可以把PVA 作为唯一碳源和能量 生长。
2.3.2 功能菌群RR 与RM DGGE 群落分析对比
混合菌群RR、RM 群落分析凝胶电泳图如图8,测序及在Genbank 同源性比较结果如表2 所示。混合菌群RR 及RM 中均存在对直接红28 有降解能力的伯克霍尔德氏菌属菌株Burkholderia sp.,该菌株在有无葡萄糖存在时均能存活,并对直接红28 有一定的降解能力,有葡萄糖存在时对染料脱色率高于没有葡萄糖存在。国外相关研究也表明伯克霍尔德氏菌属 Burkholderia sp.对染料存在降解能力。Laszlo[17]证实,Burkholderia cepacia NRRL B-14803可以在厌氧条件下降解双偶氮染料。Arora 等[18]指出Burkholderia sp. RKJ 800 以4-氯-2-氨基苯酚作为唯一碳源、能量,将其降解为氯离子、铵离子。Zhou等[19]验证,Burkholderia vietnamiensis C09V 可以同时降解结晶紫和二价铜,并将结晶紫作为唯一碳源。研究证明,伯克霍尔德氏菌属菌株(Burkholderia sp.)可在无机条件下对染料存在降解能力,工程应用性极强。
功能菌群RR 中还存在其他两种菌株,属于链球菌属(Streptococcus)和克雷伯氏菌属(Klebsiella sp.)。这两种菌株在葡萄糖存在的条件下,可以存活并对直接红28 存在一定的降解能力;在无葡萄糖存在的无机环境下,随着驯化过程染料浓度不断增加,链球菌属菌株(Streptococcus didelphis strain)和克雷伯氏菌属菌株(Klebsiella sp.)逐渐被淘汰。国外相关研究也证实,两种菌株对染料存在降解能力。Cui 等[20]发现新筛选出的克雷伯氏菌属Klebsiella sp. Y3 可以在厌氧的条件下,降解偶氮染料,并且在pH 值为4~9,温度为30~42℃,盐度为1%~4%时均有良好的降解能力。
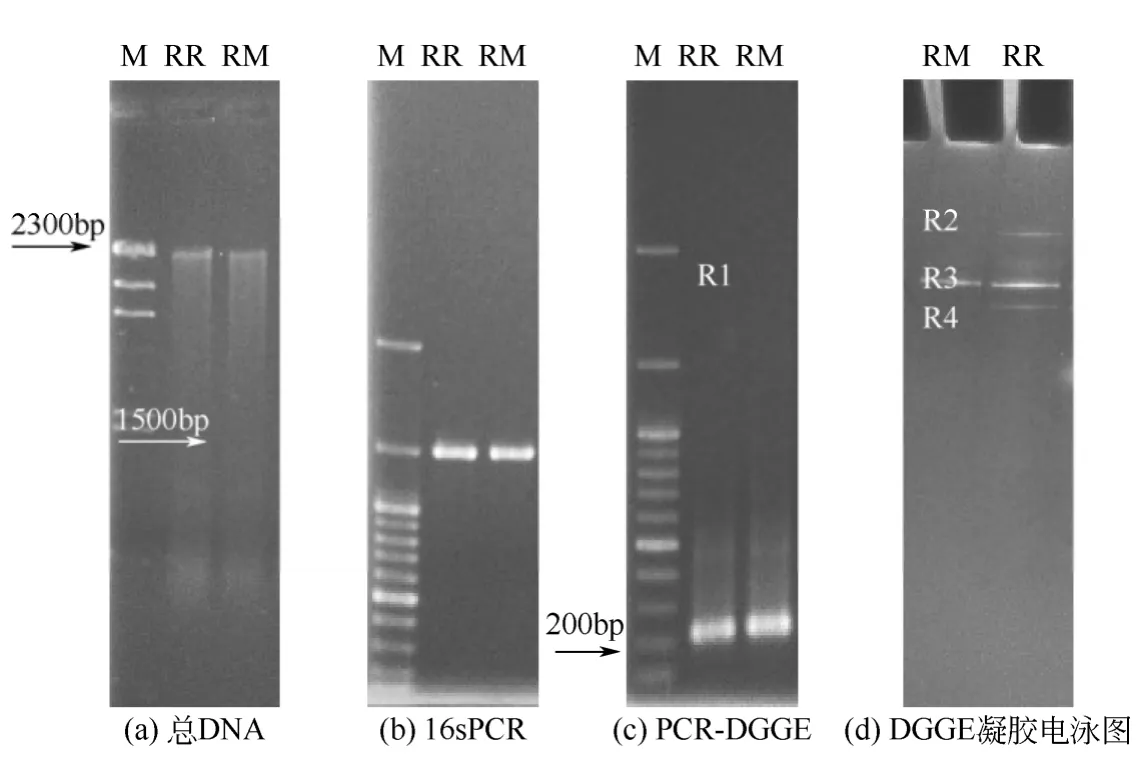
图8 混合菌群RR、RM 群落分析凝胶电泳图

表2 DGGE 切胶条带序列比对结果
3 结 论
从厌氧反应器中利用梯度浓度压力驯化法筛选出对直接红28 有具有良好脱色能力的混合菌群RR。针对其染料脱色性能进行了一系列的研究得出混合菌群RR 脱色最佳条件为:pH=7.0,温度为45℃,盐度为2mmol/L。在最适条件下,功能菌群RR 对直接红28 的脱色率稳定且在48h 内均可达到90%以上。
为了进一步适应工程无机条件,筛选出以染料作为唯一氮源、碳源以及能量的功能菌群,遂将培养基中葡萄糖去掉,筛选出混合菌群RM。混合菌群RM 在无机条件,初始染料浓度为50mg/L、pH=7.0、温度为35℃条件下,48h 后染料的脱色率为20.05%。并对混合菌群RR、RM 进行DGGE 群落分析,RR 主要为伯克霍尔德氏菌属(Burkholderia sp.)、链球菌属(Streptococcus)和克雷伯氏菌属(Klebsiella sp.),菌群RM 主要为伯克霍尔德氏菌属(Burkholderia sp.)。由此表明,伯克霍尔德氏菌属菌株(Burkholderia sp.)可以在无机条件下生存,以染料为唯一碳源、氮源以及能量并对直接红28存在一定的降解能力。
[1] 何兴兵,林永慧,韩国民,等. 开放条件下烟管菌XX-2 对孔雀石绿染料的高效降解[J]. 微生物学通报,2013(7):1163-1174.
[2] 张培培,任随周,许玫英,等. 微生物对三苯基甲烷类染料脱色的研究进展[J]. 微生物学通报,2009(9):1410-1417.
[3] Khan R,Bhawana P,Fulekar M H,et al. Microbial decolorization and degradation of synthetic dyes:A review[J]. Reviews in Environmental Science and Bio-Technology,2013,12(1):75-97.
[4] Saratale R G,Saratale G D,Chang J S,et al. Bacterial decolorization and degradation of azo dyes: A review[J]. Journal of the Taiwan Institute of Chemical Engineers,2011,42(1):138-157.
[5] Patel Y,Mehta C,Gupte A,et al. Assessment of biological decolorization and degradation of sulfonated di-azo dye Acid Maroon V by isolated bacterial consortium EDPA[J]. International Biodeterioration & Biodegradation,2012,75:187-193.
[6] Arunarani A,Chandran P,Ranganathan B V,et al. Bioremoval of Basic Violet 3 and Acid Blue 93 by Pseudomonas putida and its adsorption isotherms and kinetics[J]. Colloids and Surfaces B:Biointerfaces,2013,102:379-384.
[7] Liu J S,Xie X H,Xiao S M,et al. Isolation of Leptospirillum ferriphilum by single-layered solid medium[J]. Journal of Central South University of Technology,2007,14(4):467-473.
[8] Prasad S S , Aikat K. Study of bio-degradation and bio-decolourization of azo dye by Enterobacter sp. SXCR[J]. Environmental Technology,2014,35(8):956-965.
[9] Anjaneya O,Souche S Y,Santoshkumar M,et al. Decolorization of sulfonated azo dye Metanil Yellow by newly isolated bacterialstrains: Bacillus sp. strain AK1 and Lysinibacillus sp. strain AK2[J]. Journal of Hazardous Materials,2011,190(1-3):351-358.
[10] Chen K C,Wu J Y,Liou D J,et al. Decolorization of the textile dyes by newly isolated bacterial strains[J]. Journal of Biotechnology,2003,101(1):57-68.
[11] Kılıç N K,Nielsen J L,Yüce M,et al. Characterization of a simple bacterial consortium for effective treatment of wastewaters with reactive dyes and Cr(Ⅵ) [J]. Chemosphere,2007,67(4):826-831.
[12] Kumar K,Dastidar M,Sreekrishnan T. Effect of process parameters on aerobic decolourization of reactive azo dye using mixed culture[J]. World Academy of Science,Engineering and Technology,2009,58:962-965.
[13] Jadhav U U,Dawkar V V,Ghodake G S,et al. Biodegradation of Direct Red 5B,a textile dye by newly isolated Comamonas sp. UVS[J]. Journal of Hazardous Materials,2008,158(2):507-516.
[14] Pearce C,Lloyd J,Guthrie J. The removal of colour from textile wastewater using whole bacterial cells: A review[J]. Dyes and Pigments,2003,58(3):179-196.
[15] He Y,Gao J F,Feng F Q,et al. The comparative study on the rapid decolorization of azo,anthraquinone and triphenylmethane dyes by zero-valent iron[J]. Chemical Engineering Journal,2012,179(0):8-18.
[16] 王银善,庞学军,方慈祺,等. 共生细菌SB1 降解聚乙烯醇的研究Ⅰ. 共生细菌SB1 的分离及某些性质[J]. 环境科学学报,1991,11(2):236-241.
[17] Laszlo J A. Regeneration of azo-dye-saturated cellulosic anion exchange resin by Burkholderia cepacia anaerobic dye reduction[J]. Environmental Science & Technology,2000,34(1):167-172.
[18] Arora P K,Srivastava A,Singh V P. Novel degradation pathway of 4-chloro-2-aminophenol via 4-chlorocatechol in Burkholderia sp. RKJ 800[J]. Environmental Science and Pollution Research,2014,21(3):2298-2304.
[19] Zhou F,Cheng Y,Gan L,et al. Burkholderia vietnamiensis C09V as the functional biomaterial used to remove crystal violet and Cu(II) [J]. Ecotoxicology and Environmental Safety,2014,105: 1-6.
[20] Cui D,Li G,Zhao M,et al. Decolourization of azo dyes by a newly isolated Klebsiella sp. strain Y3,and effects of various factors on biodegradation[J]. Biotechnology & Biotechnological Equipment,2014,28(3):478-486.

