超声波法黄原酸化壳聚糖的制备
刘盛 ,朱红祥 ,王进 ,刘晨 ,孔巧平 ,曹雪娟
(1 广西大学轻工与食品工程学院,广西 南宁 530004;2 上海交通大学农业与生物学院,中国 上海 200240)
壳聚糖(chitosan,CTS) 是自然界中储量仅次于纤维素的天然高分子多糖,可作为良好的吸附剂用于废水中重金属离子的去除[1],作为目前最热门的研究之一,壳聚糖也被广泛应用于各种领域如医药医疗、造纸、纺织品、生物医药、化妆品、食品加工、农业等方面[2]。壳聚糖对于一些重金属离子的吸附量较小、水不溶性等影响了其进一步的应用,但壳聚糖分子链上存在着活泼的伯氨基以及羟基,通过对其改性,改善其水溶性的同时,增大了重金属吸附性能,拓展其应用范围,例如羧甲基壳聚糖、壳聚糖季铵盐和黄原酸化壳聚糖(xanthated chitosan,XCTS)等衍生物[3-5]。黄原酸化壳聚糖由于分子中存在巯基,和重金属离子的螯合系数小,重金属离子的吸附量大幅度增加,关于黄原酸化壳聚糖的合成研究已有报道[6-7],但由于大分子量壳聚糖不溶于水,其和二硫化碳的反应属于非均相反应,存在反应活性低、反应时间长(达24h)等问题[8-10],而应用超声波辅助合成黄原酸化壳聚糖的研究未见报道,本工作利用超声波法合成黄原酸化壳聚糖并采用单因素实验方法,以硫含量和产率作为指标,研究了反应物配比、温度、超声功率、超声反应时间和碱浓度对CTS 改性的影响,确定了影响超声波法制备XCTS 的主要因素;通过实验选择了最佳合成条件,以探求一种快速、取代度高的XCTS 合成途径;同时对XCTS 进行了傅里叶红外光谱、X 射线衍射、扫描电镜和热重分析,了解黄原酸化前后壳聚糖的架构变化。
1 实验材料与方法
1.1 实验材料
壳聚糖,脱乙酰度为80.0%~95.0%,国药集团化学试剂有限公司;二硫化碳,分析纯,哈尔滨雪佳氟公司;氢氧化钠,分析纯,天津市致远化学试剂有限公司;无水乙醇,分析纯,天津市致远化学试剂有限公司。
1.2 实验方法
一定温度下,壳聚糖和二硫化碳在碱性条件下能够发生黄原酸化反应,生成黄原酸化壳聚糖,这是一种黄色粉末。黄原酸化壳聚糖溶于水,不溶于乙醇、丙酮等有机溶剂,对重金属离子有很强的螯合能力,螯合物不溶于水[11]。黄原酸化壳聚糖的主要合成反应式如图1。 壳聚糖和二硫化碳在强碱作用下发生反应,强碱的作用主要是渗透到壳聚糖的分子链中,溶胀壳聚糖,使壳聚糖分子中的羟基转化为钠盐,有利于和二硫化碳发生黄原酸化反应[8]。反应过程中,溶液呈现橙色,最终的黄原酸化壳聚糖为略带有黄色的粉末。

图1 黄原酸化壳聚糖的合成反应式
1.2.1 常规方法[12]
称取1.0g 的壳聚糖于250mL 三口烧瓶中,加入50mL 10% 的NaOH 溶液,溶胀0.5h。再加入2.5mL 的二硫化碳(冰水浴中用滴液漏斗滴加),一定温度水浴下搅拌反应数小时,离心除去未反应的原料,用3 倍的无水乙醇析出、抽滤并洗涤,50℃烘箱中干燥即得产品。
1.2.2 超声波法
称取1.0g CTS 加入盛有50mL 一定质量浓度的NaOH 的100mL 单口烧瓶中,磁力搅拌预处理1/2h,然后加入一定量的CS2,放入三位一体合成萃取反应器(UWAVE-1000)中于一定功率超声波下反应一段时间后取出、冷却、离心后取上清液,用3 倍的无水乙醇析出产品,过滤,50℃烘箱中干燥即得产品。
1.3 XCTS 中硫含量的测定
产品中硫含量直接反应了壳聚糖黄原酸化改性的程度,实验中采用元素分析仪(Euro EA3000)测定XCTS 中硫的含量。
1.4 壳聚糖和XCTS 的FT-IR 表征
壳聚糖黄原酸化前后的基团变化由傅里叶红外光谱仪测定(NEXUS 470 FT-IR),光谱范围4000~400cm-1。
1.5 壳聚糖和XCTS 的X 射线衍射分析
壳聚糖黄原酸化前后结晶度的变化由X射线衍射仪(SmartLab)进行观察。
1.6 壳聚糖和XCTS 的扫描电镜表征
壳聚糖黄原酸化前后的形貌变化由扫描电子显微镜(日立S-3400N)进行观察。
1.7 壳聚糖和XCTS 的热重分析
壳聚糖黄原酸化前后的热稳定性由综合热重分析仪(ZRY-2P)进行分析。
2 结果与讨论
2.1 XCTS 的制备
2.1.1 常规方法和超声波法合成XCTS 的对比
按1.2 节所述分别进行XCTS 的合成实验,其中常规方法中反应温度为50℃,超声波法中NaOH质量分数为10%、CS2为2.5mL、超声功率为 150W。两种方法分别制备不同方法时间下的XCTS,然后测定反应产物XCTS 的S 含量与反应时间的关系,结果如图2 所示。

图2 常规方法和超声波法合成XCTS 的对比
从图2 中可以看出,无论是超声波法还是常规方法,其合成的XCTS 硫含量都随着反应时间的延长而增加,但超声波法不仅合成速率快,而且合成的XCTS 硫含量也更高,在60min 时即达到了10.56%,此后增加速率较为缓慢。而60min 时常规方法合成的XCTS 硫含量仅为4.4%且增速平缓,在240 mins 后才较为明显。超声波法能够加快合成XCTS 速度的原因归结如下:①超声波对反应固体物质表面存在震荡、击碎等机械作用,能够加快反应介质对反应物的渗透,加速反应进行;②超声波的热效应能增加分子动能、增强CS2的反应活性,加快与壳聚糖反应;③超声波的空化作用能引发反应物在反应中心的生成,催化促进异相合成反应。
2.1.2 温度对反应的影响
因为超声波作用有致热效应,为考察温度对反应的影响,以1.2.1 节的方法,在不同温度下反应60min 合成XCTS,测定其产率和S 含量,结果如图3 所示。

图3 温度对XCTS 产量及硫含量的影响
从图3 可以看出,随着温度的升高,合成XCTS不论产量还是硫含量都不断增加,在60℃时增速变 缓。从20℃到60℃,产量从0.16g 到0.53g,硫含量从2.23%增加到5.12%,说明壳聚糖黄原酸化反应是一个吸热过程,升温可增加分子动能,增加活性分子,增大反应的可能性。温度对壳聚糖黄原酸化反应有不小的促进作用。
2.1.3 CS2用量对反应的影响
按1.2.2 节的方法,改变CS2的用量,超声波作用下合成XCTS,然后测定其产量和S 含量,结果如图4 所示。

图4 CS2 用量对XCTS 产量及硫含量的影响
由图4 可知,反应初期壳聚糖过量,可供反应的—NH2、—OH 较多,随着CS2用量的增加,XCTS合成反应不断进行,产量不断增加,但硫含量增加较少,当CS2用量进一步增加时,一个壳聚糖单元内的—NH2、—OH 被迫同时反应,所以产物硫含量增加明显,产量增速放缓,在CS2用量为2.0mL 时,可供反应位点已饱和,反应已基本完全。
2.1.4 超声波功率对反应的影响
按1.2.2 节的方法,在不同超声功率下合成XCTS,然后测定其产率和S 含量,结果如图5 所示。
从图5 可知随着超声波功率的增加,合成XCTS的硫含量不断增大,而产量有一个先增加后减少的过程,因为超声波有强大的机械震荡作用、热效应和空化作用,在促进壳聚糖黄原酸化反应的同时也加剧了壳聚糖的降解作用。综合产量和硫含量,在150W 时最佳,此时产量最大,为1.24g,硫含量为11.56%。

图5 超声波功率对XCTS 产量及硫含量的影响
2.1.5 超声波作用时间对反应的影响
按1.2.2 节的方法,改变超声波作用时间,合成XCTS,然后测定其产率和S 含量,结果如图6 所示。
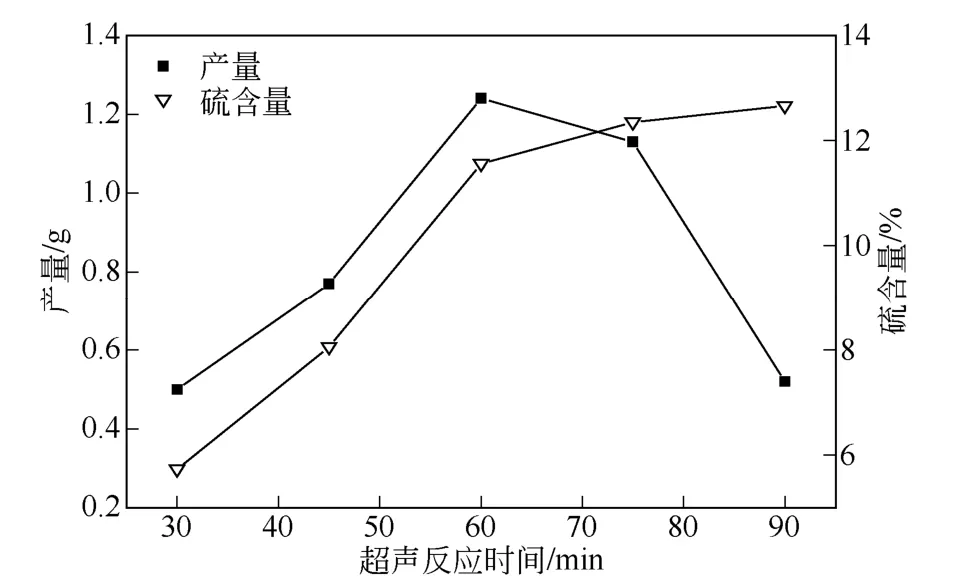
图6 超声波作用时间对反应的影响
由图6 可知在超声波的作用下,随着时间的延长,壳聚糖黄原酸化反应不断进行,XCTS 产量和硫含量都增加,此时主要反应为XCTS 的合成;当时间进一步延长时,合成反应位点减少,超声波对壳聚糖的降解加剧,所以产量剧减而产物硫含量仍略有增加,综合产量和硫含量,超声波作用60min时较佳。
2.1.6 碱浓度对反应的影响
按1.2.2 节的方法,改变碱浓度(NaOH 的质量分数),在超声波作用下合成XCTS,然后测定其产率和S 含量,结果如图7 所示。

图7 碱浓度对反应的影响
稀氢氧化钠预处理可以引起壳聚糖明显润胀,增加内表面积,降低壳聚糖结晶性,增加反应的可 及性,但浓度过高时会造成糖苷键的断裂,壳聚糖大量降解,尤其是在超声波的协同作用下[12],如图7 所示,随着碱浓度的增大,所合成XCTS 的硫含量不断增加,在20%时已基本饱和,但壳聚糖黄原酸化产物的产量却有一个先增后减的过程,综合考虑,碱浓度为15%较好。
2.2 壳聚糖和XCTS 的FT-IR 表征
为研究壳聚糖黄原酸化前后分子结构、基团变化,对壳聚糖和XCTS 分别进行了由傅里叶红外光谱曲线测分析,其结果如图8 所示。
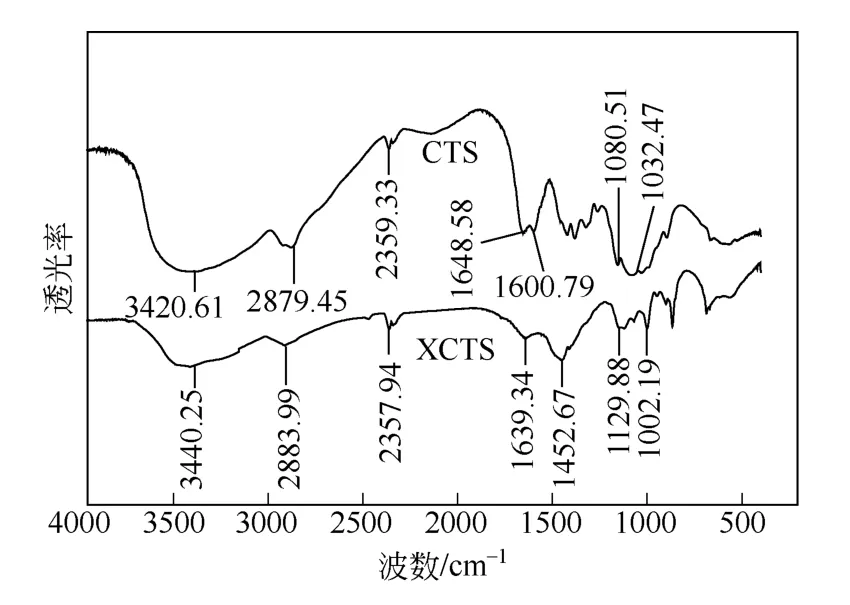
图8 壳聚糖和XCTS 的红外图谱
壳聚糖中的—NH2和—OH 伸缩振动峰在3420.61cm-1偶合形成一宽峰,黄原酸化壳聚糖对应峰在3440.25cm-1,位移较大且吸收强度明显减弱,说明—NH2和—OH 都参与了反应。壳聚糖中1600.79cm-1为氨基的吸收峰,而黄原酸化壳聚糖中出现1452.67cm-1强的吸收峰为N—C=S 键和氨基的吸收峰重合为强峰[13]。另外,2472.80cm-1为分子中少量的巯基吸收峰[14]。壳聚糖中伯羟基和仲羟基C—O 伸缩振动吸收峰分别为1080.51cm-1和1032.47cm-1,而相对应的黄原酸化壳聚糖的吸收峰为1129.88cm-1和1002.19cm-1,波数变化较大,表明壳聚糖中的伯羟基和仲羟基参与黄原酸化反应。结果表明,黄原酸化主要发生在壳聚糖的羟基上。另外,分子中C—S 的不对称伸缩振动吸收峰和对称伸缩振动吸收峰较弱,被羟基的伸缩振动吸收峰覆盖[15-16]。
2.3 壳聚糖和XCTS 的X 射线衍射分析
为观察壳聚糖黄原酸化前后结晶度的变化,对壳聚糖和黄原酸化壳聚糖进行了X 射线衍射分析,结果如图9 所示。
从图9 中可以看出,壳聚糖具有一定的微晶结构,在11.5°处有一个较弱的衍射峰,在20°左右具有一个强的衍射峰,而黄原酸化壳聚糖在11.5°处的峰几乎消失,20°的衍射峰减弱明显,说明壳聚糖的有序度和晶型结构遭到较大程度的破坏。这是由于壳聚糖中的氨基和羟基被黄原酸化,硫元素增多,氨基和羟基含量降低,分子链节间形成氢键 的强度减弱,导致壳聚糖无序度的增强,结晶度 下降[17]。
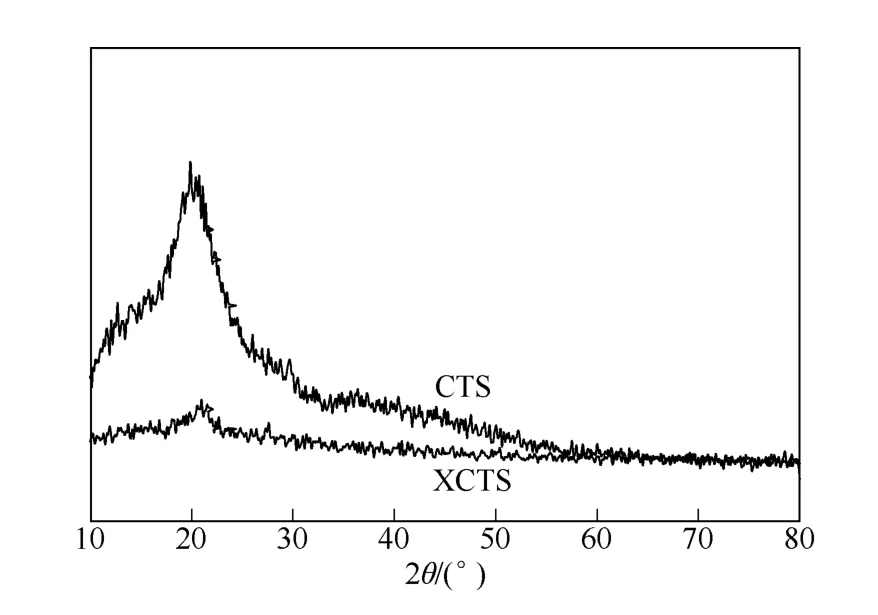
图9 壳聚糖和XCTS 的XRD 图
2.4 壳聚糖和XCTS 的扫描电镜表征
为观察壳聚糖黄原酸化前后的形貌变化,本实验对壳聚糖和XCTS 进行了扫描电子显微镜实验,结果如图10、图11 所示。

图10 壳聚糖的SEM 图

图11 XCTS 的SEM 图
由图10、图11 可见,壳聚糖的表面比较光滑、密实,而黄原酸化壳聚糖表面有大量的空穴、孔洞,呈蜂窝状。表明黄原酸化后,表明壳聚糖的结构有序度和晶体结构被破坏,表面疏松、多孔,而这种空穴结构的增加能够提高壳聚糖对重金属离子的吸附性能[18]。
2.5 壳聚糖和XCTS 的热重分析
为了对比壳聚糖黄原酸化前后的热稳定性,分别对壳聚糖和XCTS 进行热重分析。实验采用ZRY-2P 型综合热分析仪分析物质热稳定性。样品经60℃干燥过夜后,取适量置于氧化铝质坩埚,在空气氛围下,在15℃/min 升温速率下,分别将各试样从40℃加热到700℃,获得样品TG-DTG 曲线。如图12、图13 所示。
从图12、图13 可以看出,壳聚糖的起始分解温度为248℃左右,最大降解速率温度为305℃;而黄原酸化壳聚糖的起始分解温度为230℃左右,最大降解速率温度为265℃。这是由于在—NH2、—OH 上接入了黄原酸基团,而黄原酸基团容易从主链上断裂,所以壳聚糖经黄原酸化后热稳定性降低,黄原酸化壳聚糖的起始分解温度较原壳聚糖有所 降低[6]。

图12 壳聚糖的TG-DTG 曲线图

图13 XCTS 的TG-DTG 曲线图
3 结 论
(1)超声波法能明显加快制备黄原酸化壳聚糖的速度,减少反应时间,降低能耗,增加产量的同时提高产物的硫含量,是一种快速、环保的制备壳聚糖黄原酸盐的方法。
(2)红外光谱曲线显示,超声波法黄原酸化反应使得壳聚糖分子结构发生了较大变化,出现了C=S 键和巯基的吸收峰,在其中引入了黄原酸基团;通过XRD 和SEM 观察对比可知黄原酸化后,壳聚糖的结构有序度和晶体结构被破坏,表面疏松、多孔;TG 热重分析可知壳聚糖分子结构中引入黄原酸基团后,分子链间距离增大,破坏了分子链的规整度和壳聚糖的微晶结构,支链增多,导致XCTS热稳定性能略有下降。
(3)超声波法制备黄原酸化壳聚糖的最佳工艺:壳聚糖与二硫化碳的质量体积比为 1∶2(g/mL),超声波功率为150W,超声波作用时间为60min,NaOH 的质量分数为15%。
[1] 胡惠媛,朱虹. 壳聚糖及其衍生物对重金属离子的吸附[J]. 化学进展,2012,24(11):2212-2223.
[2] 王爱勤,杨立明. 天然高分子材料壳聚糖的研究应用进展[J]. 化工新型材料,1994(9):9-12.
[3] Jayakumar R,Prabaharan M,Nair S V,et al. Novel carboxymethyl derivatives of chitin and chitosan materials and their biomedical applications[J]. Prog. Mater Sci.,2010,55(7):675-709.
[4] 程国君,陈水平,吴国忠,等. 低分子量壳聚糖季铵盐的制备及抗菌性能研究[J]. 辐射研究与辐射工艺学报,2007,25(3):137-140.
[5] 王崇侠,宋庆平,丁纯梅. 交联黄原酸壳聚糖对铅离子的吸附研究[J]. 化学研究与应用,2012,24(2):301-304.
[6] 宋庆平,孟祥瑞,王崇侠,等. 新型黄原酸壳聚糖对铅离子的吸附及机理研究[J]. 离子交换与吸附,2014,30(2):115-123.
[7] 赵玉清,张万筠,艾霞,等. 黄原酸化壳聚糖和巯基化端聚糖在环境保护中的应用研究[J]. 黄金,2006,27(6):47-49.
[8] Zhu Y H,Hu J,Wang J L. Competitive adsorption of Pb(Ⅱ),Cu(Ⅱ) and Zn(Ⅱ) onto xanthate-modified magnetic chitosan[J]. Journal of Hazardous Materials,2012,221-222:155-161.
[9] Gupta A,Yunus M,Sankararamakrishnan N. Equilibrium and dynamic studies of the removal of As(Ⅱ) and As(Ⅴ) from contaminated aqueous systems using a functionalized biopolymer[J]. Journal of Chemical Technology and Biotechnology,2012,87(4):546-552.
[10] Kannamba B,Reddy K L,AppaRao B V. Removal of Cu(Ⅱ) from aqueous solutions using chemically modified chitosan[J]. Journal of Hazardous Materials,2010,175(1-3):939-948.
[11] 蒋挺大. 壳聚糖[M]. 北京:化学工业出版社,2001:36-37.
[12] 莫祺红,卢洁,黄佩芳,等. 超声波预处理脱乙酰化制备壳聚糖的研究[J]. 食品科技,2009,34(8):224-227.
[13] 许海峰,唐瑞仁,曹佐英,等. 壳聚糖黄原酸盐对Cu2+的吸附性能[J]. 应用化学,2008,25(6):673-676.
[14] 曾淼,张廷安,吕国志,等. 黄原酸化交联壳聚糖的制备及表征[J]. 高分子材料科学与工程,2004,30(6):174-177.
[15] Sankararamakrishnan N,Sanghi R. Preparation and characterization of a novel xanthated chitosan[J]. Carbohydrate Polymers,2006,66(2):160-167.
[16] Panda G C,Das S K,Guha A K. Biosorption of cadmium and nickel by functionalized husk of Lathyrus sativus[J].Colloids and Surfaces B:Biointerfaces,2008,62(2):173-179.
[17] 季靓. 改性淀粉重金属捕集剂的合成及性能研究[D]. 上海:同济大学,2007.
[18] Yoshida H,Okamoto A,Katapka T. Adsorption of acid dye on cross-linked chitosan fibers:Equilibria[J]. Chemical Engineering Science,1993,48(12):2267-2272.

