柱芳烃合成及应用研究进展
卜婷婷,崔娜,朱丽君,周玉路,项玉芝,夏道宏
(中国石油大学(华东)化学工程学院,重质油国家重点实验室,山东 青岛 266580)
1987年诺贝尔化学奖授予了Donald J. Cram、Jean-Marie Lehn、Charles J. Pedersen 3 位在超分子化学方面有着杰出贡献的科学家,由此超分子化学的研究获得了全世界科研工作者的普遍关注。在超分子化学的发展过程中,寻找、设计并合成新的超分子主体一直是人们研究的重心。新超分子主体的不断出现,极大地推动了超分子化学的快速发展。历经近30年的发展,超分子主体由第一代冠醚、第二代环糊精、第三代杯芳烃发展至目前的第四代超分子主体葫芦脲及柱芳烃,表现出了更好的选择性和更高的识别能力。
2008年,日本化学家Ogoshi 等[1]首次成功地合成了一种结构对称、苯酚对位桥联的“柱”状大环低聚超分子主体化合物,被命名为柱芳烃。新型的超分子主体柱芳烃一经出现,就引起了世界同行的极大关注。根据形成柱芳烃的单元个数不同,柱芳烃可分为柱[n]芳烃(n=5,6,7,8,9,10),其中柱[n]芳烃(n=5,6)研究较多。Ogoshi 等最早合成了柱[5]芳烃,2009年,我国研究者曹德榕等[2]在改进柱[5]芳烃合成方法时首次发现了柱[6]芳烃、柱[7]芳烃等更大环的柱芳烃,这为柱芳烃的快速发展提供了更大的空间。自柱芳烃问世以来,由于其易合成、高功能性、结构对称性好、主客体识别能力强以及旋转属性、平面手性等性质,柱芳烃得到了快速的发展。Gragg 等[3]详细介绍了柱[5]芳烃的设计与合成,但随着柱芳烃的不断发展,柱芳烃与客体的识别、组装及其应用已经成为了人们的研究热点。
本文全面综述了近几年柱芳烃在合成与应用方面的研究进展。
1 柱芳烃的合成与结构研究进展
1.1 烷氧基柱芳烃的合成
Ogoshi 等[1]首先用路易斯酸三氟化硼乙醚(BF3·OEt2)催化对苯二酚醚与多聚甲醛反应,合成了一种结构对称、苯酚对位桥联“柱”状大环低聚超分子主体化合物-1,4-二甲氧基柱[5]芳烃(DMPillar[5]arene),结构如图1。由于这种新的大环化合物结构与杯芳烃类似,但空间呈现柱状结构,它们被命名为柱芳烃。起初,由于投料比例不佳,合成的柱芳烃产率并不高。后来,在不懈努力下,通过改进反应条件,使多聚甲醛大大过量,并缩短反应时间,同时改善提纯方法,最后将DMPillar[5] arene 的产率提高到71%[4]。
2009年,曹德榕等[2]用2,5-二烷氧基对二苄基醚和多聚甲醛为原料,对甲苯磺酸(TsOH)作催化剂,在二氯甲烷(CH2Cl2)溶剂中反应,改进烷基化柱[5]芳烃合成方法的同时,首次合成并分离出了柱[6]芳烃,反应如图2 所示,并详细研究了以甲基、乙基和丁基为取代基的2,5-二烷氧基对二苄基醚为原料合成柱芳烃的产物收率,具体见表1。

图1 柱芳烃的结构示意图

图2 1,4-二烷氧基柱[n]芳烃的方法[2]
在柱[n]芳烃中,由于—CH2—桥键角张力的制约,柱[5]芳烃是常见的化合物,而柱[4]芳烃需 要—CH2—键角为90°,而柱[6]芳烃需要—CH2—键角为120°,均为不稳定结构。1,4-二甲基柱[5]芳烃的单晶数据显示,—CH2—的平均键角为 111.3°,非常接近碳原子 sp3杂化后轨道键角 109.5°和五边形内角108°,结构比较稳定。因此,柱[5]芳烃的合成方法已经比较成熟。虽然柱[6]芳烃的产率较低,但这一发现对于认识和进一步研究柱芳烃家族的性质具有很大的指导意义。随后,在改进柱[5]芳烃的合成过程中也分别得到了柱[6]芳烃,但收率都不是很理想(均低于15%),因此,如何提高柱[6]芳烃的产率成了化学工作者的研究热点。
为进一步提高柱[6]芳烃产率,曹德榕课题组[5]在先前研究基础上进一步优化了合成柱[6]芳烃的方法。首先以1,4-二乙氧基苯为原料,研究了不同溶剂、催化剂、反应温度、反应时间等对反应的影响,并通过优化找到了最佳反应条件,在此条件下研究底物烷氧取代基变化对柱[6]芳烃产率的影响,并取得了很大进步,为后期柱[6]芳烃合成的研究工作打下了很好的基础,反应见图3。
1.2 高阶柱芳烃的合成
随后,更大空腔体积的柱芳烃相继被合成出来,如1,4-二正丙氧基柱[7]芳烃,并研究了其主客体性质。2012年,侯军利课题组[6]用1,4-二乙氧基苯和多聚甲醛在氯仿溶剂中反应,BF3·OEt2作催化剂,通过控制反应时间,首次成功合成并分离出了柱[5~10]芳烃,见图4,此过程为动力学控制,虽然柱[8~10]芳烃的产率非常低(<5%),但这一发现对于柱芳烃的发展具有重大的意义。
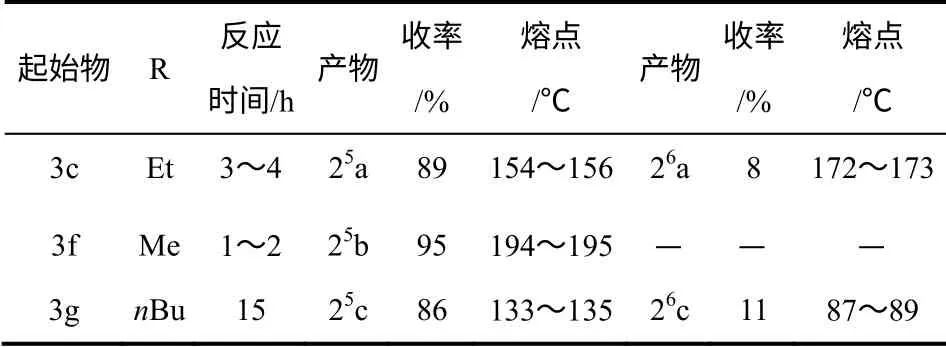
表1 不同取代基条件下柱[5]芳烃和柱[6]芳烃的制备(R’= Et)[2]

图3 以三氯化铁为催化剂柱[6]芳烃的合成步骤[5]

图4 柱[n]芳烃(n=5~10)的合成方法[6]
随后,Ogoshi 等[7]用柱[5]芳烃作起始原料,在氯仿溶剂中与BF3·OEt2发生扩环反应,分离得到了柱[6~15]芳烃。反应适宜时间、温度分别为1h 和50℃,动力学控制占主导地位,反应简单、易操作且无可溶性副产物生成。研究发现,柱[10]芳烃(P10A)可与C60因空腔大小匹配程度高形成1∶1稳定包合物,其结构见图5。由此可看出,在柱芳烃分子识别过程中,空腔匹配效应起决定性作用。
1.3 柱芳烃衍生物的合成
柱芳烃具有独特的化学性质和立体结构,综合了已有超分子主体的特点与优势,并具有高度对称的立体结构,其上下缘皆为疏水空腔,空腔大小调节具有较高的自由度,因此对客体的识别能力更强。另外,柱芳烃母体易于修饰,可以获得大量有独特性能的衍生物。最初合成分离出的主要是烷氧基 柱芳烃,虽然这类柱芳烃在主客体化学方面具有很好的性质,但这类柱芳烃溶解性很差。因此,为了增加柱芳烃的溶解度,大量的柱芳烃衍生物相继被合成出来。

图5 柱[5]芳烃扩环合成柱[6~15]芳烃以及与C60 的 识别作用[7]
在CHCl3溶剂中,烷氧基柱[n]芳烃(n=5,6)与BBr3反应脱烷基生成高度对称的全羟基化柱[n]芳烃,见图6,溶解度、反应活性均有所增加,全羟基化的柱[n]芳烃制备简单,它的出现壮大了柱芳烃家族,丰富了柱芳烃的主客体化学内容。马英杰等[8]通过单晶衍射得到了羟基柱[6]芳烃的晶体结构,发现其具有D6 高度对称结构,分子中排列整齐的羟基通过尾尾相连形成了氢键,更有趣的是,在固态下,柱芳烃分子由上至下形成了一个无限长的通道。
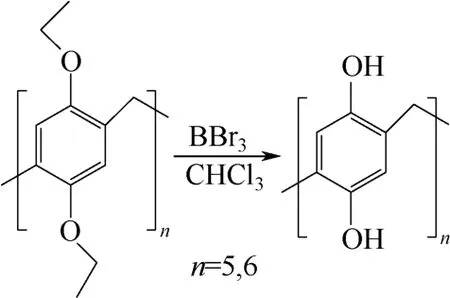
图6 对羟基柱[n]芳烃的制备
Ogoshi 等[9]以柱[5]芳烃为原料,在NaH 催化下与BrCH2COOC2H5反应,然后用NaOH 水解,再和氨水反应生成羧酸盐,得到水溶性柱[5]芳烃化合物(WP5),见图7。
黄飞鹤等分别合成了水溶性的柱[6]芳烃[10]、柱[7]芳烃[11]、柱[9]芳烃[12]和柱[10]芳烃[13],合成路线见图8,经过荧光光谱分析发现,羧酸盐柱[n]芳烃的水溶性可以通过调节溶液的pH值来可逆地调控,1H NMR 谱也进一步证实了这一结论。

图7 Ogoshi,s 水溶性柱[5]芳烃的合成[9]

图8 水溶性柱[6,7,9,10]芳烃的合成方法
随后,多种类型的水溶性柱[n]芳烃相继被合成出来,脂肪胺柱[5]芳烃[14]1、含有12 个咪唑啉官能团的柱[n]芳烃[15]2、季铵盐类柱[n]芳烃[16]3 及吡啶盐类柱芳烃[17]等,其结构如图9。这类柱芳烃在水中溶解度明显增大,在很大程度上拓宽了柱芳烃主客体化学的应用范围。

图9 几类水溶性柱[n]芳烃(WPA)
另外,Ogoshi 等[18]合成了两亲性柱[5]芳烃(AP5),如图10(a),研究发现,此柱[5]芳烃衍生物对KMnO4氧化烯烃具有很好的催化效率及底物选择性。Zhou 等[19]合成了第一个两亲性柱[6]芳烃(AP6),如图10(b),并研究了其在水溶液中自组装形态的变化,其结构如图10(c)所示。
大量柱芳烃衍生物的合成,进一步优化了柱芳烃的性质,使其在主客体化学方面的应用更加广泛。
1.4 柱芳烃的结构与构象
1.4.1 柱芳烃的结构


表2 基于各原子范德华半径所计算得到的P5,P6 及P7 的结构参数[5]
除研究柱芳烃的合成外,对其分子尺寸的研究也取得了进展。曹德榕课题组[5]对柱[5~7]芳烃(P5、P6、P7)结构参数进行了计算,结果见表2。从表2 中数据可以看出,P5 的空腔内径约4.7Å,与葫芦脲[6](5.8Å)和α-环糊精(4.7Å)的内径比较类似。P6 的内径约6.7Å,与葫芦脲[7](7.3Å)和β-环糊精(6.0Å)的内径比较类似。P7 的内径大小大约是8.7Å,与葫芦脲[8](8.8Å)和γ-环糊精(7.5Å)的内径比较类似。
柱[8~10]芳烃(PA[8],PA[9],PA[10])的晶体结构研究表明[6],与柱[5~7]芳烃不同的是,在固态下,柱[8~10]芳烃具有两个腔体,分别是由两个五元环、一个五元环和一个六元环、两个六元环组成的,见图11。

图10 两亲性柱[5]芳烃、两亲性柱[6]芳烃的合成方法及两亲性柱[6]芳烃在胶束与囊泡间的转化[18-19]

图11 PA[8]、PA[9]和PA[10]的单晶衍射结构图[6]
1.4.2 柱芳烃的构象
柱[5]芳烃具有高度对称的结构,在空间上具有两个特性[20]:首先,苯环1,4 位的取代基在环平面两侧的排列有两种不同取向,因此出现了Rp 和Sp两种手性异构体,见图12;其次,苯环会绕桥联的亚甲基单键自由翻转,从而出现许多构象异构体,见图13。X-Ray 单晶衍射得到的晶体结构表明,一般合成的柱[5]芳烃为D5 对称结构的外消旋体[1],是由Rp 和Sp 两种旋光异构体组成。通过在对苯二酚单元上引入大体积的环己甲基官能团,Ogoshi 等成功分离出了柱[5]芳烃构象异构体单体。

图12 柱[5]芳烃的手性异构体[20]
Ogoshi 课题组对柱芳烃的构象进行了详细的研究,不仅分离得到了柱[5]芳烃构象异构体单体,也得到了一种柱[6]芳烃的构象异构体单体。
柱[6]芳烃有13 种构象异构体[21],5 种非对映异构体、5 种对映异构体和3 种内消旋体:1a/b,2a/b,3a/b,4a/b,5a/b,6,7 和 8,如图14 所示。从2009年柱[6]芳烃首次被分离出来后,人们一直没有很好的方法阻止柱[6]芳烃苯酚单元的旋转并分离得到 其构象异构体。

图13 柱[5]芳烃的构象异构体[20]
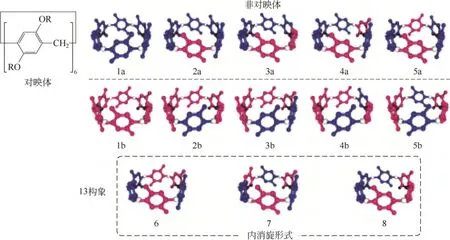
图14 柱[6]芳烃的构象异构体[21]
Ogoshi 等曾采用分离柱[5]芳烃构象异构体的方法试图去分离柱[6]芳烃,然而实验证明这种方法并不适用于柱[6]芳烃,因为柱[6]芳烃有较大的空腔体积。直到2013年,Ogoshi 等[21]借助在对苯二酚单元间引入烷基硅,以上下交替的形式连接对苯二酚单元的非对映选择性的合成方法,显著加强主体柱[6]芳烃的刚性,降低主客体识别过程的熵效应,从而分离出了单构象的柱[6]芳烃。通过1H NMR 分析,发现所得产物是图中的内消旋体7,研究发现,此构象的柱[6]芳烃可以形成稳定的主客体包合物,遗憾的是并没有分离出其他异构体。
2 柱芳烃主客体化学
主体对客体选择性结合并产生某种特定功能的过程,即分子识别作用。从2008年首次合成报道至今,人们对柱芳烃的主客体化学做了大量的研究工作,尤其是对柱[5]芳烃、柱[6]芳烃分子识别性质的研究。研究发现,柱芳烃及其衍生物能很好地识别带正电的氮化物,王凯、张华承[22-23]等分别对此进行了详细综述,但由于柱芳烃腔体大小不同,它们的识别作用也存在一定差异。
2.1 烷氧基柱芳烃的主客体化学
2008年至今,柱芳烃的研究一直是超分子化学的热点。烷氧基柱芳烃是最早被合成出来的柱芳烃,而且是其他柱芳烃衍生物的前体物,所以对烷氧基柱芳烃主客体化学研究比较早。
Ogoshi 等[1]首次合成出1,4-二甲氧基柱[5]芳烃并研究了其主客体化学性质,研究发现,与杯芳烃的性质相似,1,4-二甲氧基柱[5]芳烃可以与客体吡啶衍生物分子(C8BpyC8、C8Py、AdBpyAd)形成主客体包合物。现在人们对更大腔体柱[n]芳烃的研究也越来越多。Chi 等[24]合成了单取代环氧乙基柱[6]芳烃,研究发现环氧乙基柱[6]芳烃与敌草快分子形成了稳定的包合物,而对环氧乙基柱[5]芳烃因空腔尺寸不匹配并没有形成包合物。Fan 等[25]首次研究了乙氧基柱[n]芳烃(n=5,6,7)主体分子对碳正离子客体分子的识别行为,结果表明,柱[6]芳烃和碳正离子四氟硼酸卓离子(TBF4)具有很好的空腔匹配尺寸,在柱芳烃富π 空腔和带正电的π 电子受体芳香卓环的相互作用下,形成了一种新型的电荷转移主客体化合物。
2.2 全羟基化柱芳烃的主客体化学
经脱烷基化反应所得的全羟基化柱芳烃在溶解度、空间结构、反应活性等方面均有所改善。Ogoshi等[20]首次合成出全羟基柱[5]芳烃并研究了其与吡啶衍生物识别的性质。随后,李春举等[29]研究了柱[5]芳烃分别与一系列的百草枯(N,N′-二甲基-4,4′-联吡啶)及其衍生物(G1·2PF6-G5·2PF6)和联吡啶及其衍生物(G6·2PF6-G14·2PF6)的包合作用,发现P5A 与前者形成2∶1 外部包合型物质,与后者则形成1∶1 准轮烷大分子化合物。马英杰等[24]研究发现全羟基柱[6]芳烃在丙酮溶剂中与客体百草枯分子可形成1∶1包合物,稳定常数2.2×102L/mol。同时,全羟基柱[6]芳烃也能与尺寸匹配的联吡啶衍生物发生包合反应。
2.3 水溶性柱芳烃的主客体化学
侯军利等[14]发现在不同pH 值氘代水溶剂中,水溶性柱[5]芳烃对烷基二酸都具有很好的识别性质,包合常数为1.5×104~7.2×104L/mol,加入一定量三乙胺时,两者形成了稳定性很好的端口封锁[2]准轮烷,疏水及离子对静电作用起到了很大的促进作用,而加入的三乙胺加强了离子对间的静电作用,[2]准轮烷的收率及稳定性均明显增加,形成的包合物结构见图15。
Chen Wei 等[17]合成了一种新型的阳离子水溶性柱[6]芳烃,1H NMR 分析表明,该柱芳烃与2,6-萘二磺酸钠(2,6-NDS)及2-萘磺酸钠(2-NS)分别形成了1∶1 稳定包合物,包合常数分别为(2.1× 0.3)×105L/mol、(3.8×0.2)×104L/mol。在包合过程中,静电吸引相互作用占主导地位,因此2,6-NDS 与柱芳烃形成包合物稳定性比2,6-NDS 强。

图15 Hou’s 柱[5]芳烃、二酸和三乙胺形成[2]准轮烷[14]
黄飞鹤课题组[12-13]合成了水溶性羧酸盐柱[5,6,9,10]芳烃(WP5、WP6、WP9、WP10),与WP5、WP6 类似,WP9、WP10 分别与百草枯形成1∶1 稳定包合物,包合常数为(2.27×0.24)× 106L/mol、(1.25±0.21)×107L/mol,几种包合物强弱有所不同,主要是空腔尺寸与静电相互作用力的共同影响下产生的。马英杰等[16]合成了阳离子型水溶性柱[5]芳烃,此柱芳烃上下缘带有10 个正电荷,可很好地识别带负电荷物质,在疏水、静电作用的驱动下,此柱芳烃与正辛基磺酸钠形成1∶1 稳定包合物。
除了可以识别阴离子,阳离子水溶性柱[5]芳烃还能很好地识别中性客体[26],除了甲醇、乙醇、异丙醇、叔丁醇等与水互溶的客体外,阳离子型水溶性柱[5]芳烃可与正己烷、对二甲苯、丙醇及更长碳链的醇、戊酸、2-戊酮、苯乙醇、苯乙酸等形成稳定程度不同的包合物。研究发现,碳链越长、疏水作用越强的客体,识别作用越强,形成的包合物越稳定,同时,C—H…π 作用力在很大程度上促进主客体包合物的形成。
2.4 其他柱芳烃衍生物的主客体化学
黄飞鹤等[27]研究了柱[5]芳烃衍生物与多种阴离子的识别作用,如卤素负离子、CF3COO-、NO3-、HSO4-、CH3COO-、ClO4-、H2PO4-等,其中与前两种的识别作用较强,而与后几种形成的包合物稳定性不高。Ogoshi 等[28]合成了高效选择性识别正构烷烃而不识别环烷烃的柱芳烃二聚物,可从石油醚混合物中分离出正构烷烃。在主客体间C—H…O(N)氢键和C—H…π 作用力的推动作用下,烷基柱[5]芳烃衍生物能够很好地识别中性客体联咪唑衍生 物[29]、双五元氮杂环取代烯烃[30]。
3 柱芳烃的应用研究进展
柱芳烃是一类新的超分子主体,具有不同于其他超分子主体的结构与性质,因此,柱芳烃的主客体化学非常特别,人们逐渐将目光转向柱芳烃应用性能研究。
3.1 柱芳烃自组装体系
超分子化学的重要目标之一即研究分子组装形成功能超分子体系的过程及机理。大量的研究结果表明,分子自组装是在较弱的、可逆的非共价相互作用下形成的,如C-H…π 相互作用等非常弱的作用力等,而正是这些非共价相互作用维持了自组装体系结构的稳定性和完整性。
柱芳烃超两亲分子同时具有疏水和亲水基团,在水相和油相中均可形成自组装结构,在控释制剂、基因转移、光电材料等方面具有很好的应用。为了构筑可控制的超两亲分子体系,通常是引入多重刺激响应功能性官能团,常见的外部刺激源有温度、pH 值、氧化还原及酶,特别是光刺激,因易操作、非侵入性、低成本等优点受到了人们的青睐。
Cao 等[31]成功构造了对pH 值、Ca2+及热均有一定响应的水溶性柱[6]芳烃与两亲性吡啶盐衍生物(SAINT)超分子二元囊泡结构,此结构可与抗癌药物阿霉素(DOX)形成胶囊,通过调节溶液pH值或向溶液中加入一定浓度的Ca2+,DOX 可以被释放出来。细胞毒性实验表明,载有DOX 抗癌药物的超分子囊泡表现出与游离DOX 同样的抗癌效果,而且对正常细胞的损伤显著降低,这种超分子囊泡在药物运输方面具有非常大的应用潜力。
丁基柱[6]芳烃与还原态二茂铁包合作用非常弱,但其与氧化态二茂铁盐(Fc+)形成了1∶1 稳定包合物[32],原因是柱[6]芳烃富电子的空腔将电子转移给二茂铁盐,使两者之间的包合能力增强,这显著改善了二茂铁盐在有机溶剂中的稳定性。利用循环伏安法对包合前后的Fc+进行分析,结果表明丁基柱[6]芳烃与二茂铁盐(Fc+)形成的包合物具有很好的氧化还原响应性能,作用机理见图16。
喻国灿等[10]发现羧酸盐柱[6]芳烃与吡啶盐客体形成的主客体包合物体系在溶液中的自组装形式可以通过溶液的pH 值可逆调控,在常规纳米管与囊泡间转化。Yang 等[33]基于超分子主客体化学性质,利用水溶性柱[6]芳烃(WP6)和含2-硝基苯酯片段的客体构筑了具有紫外响应功能的超两亲分子,这种新型紫外响应超两亲分子自组装体系对碳 纳米管(MWNTs)在水溶液中的分散有极大的促进作用。

图16 高效稳定的氧化还原响应包合物的形成[32]
含有偶氮苯基的两亲性客体2 单独存在于水中时形成平均直径约30nm 的固体纳米颗粒,将WP6加入到客体2 的溶液中时,trans-2 进入到WP6 的疏水空腔中形成了WP6⊃trans-2 的光响应自组装体系[34],在空间位阻和静电作用下形成平均直径约200nm 低曲率囊泡结构。当紫外光照射下,trans-2部分转化成cis-2 并从WP6 腔体中释放出来,cis-2带正电荷的三甲胺基团与WP6 带负电荷的羧酸基团相互作用,破坏了两亲性结构,使体系形貌由囊泡转变成固体纳米颗粒,整个过程均可逆,转化过程见图17,这类光响应自组装超分子体系在药物运输、控释制剂、纳米反应器、超分子聚合物及检测等方面均有很好的应用前景。
Zhou 等[35]将 WP6 和偶氮苯衍生物客体(AzoCh)组装构筑了对pH 值、紫外和可见光响应的超两亲分子,自组装体系的形态可以在囊泡与胶束间可逆转化,此三重刺激响应自组装体系可作为纳米载体封装水溶性荧光染料。酯化柱[5]芳烃能够有效促进质子的转移,Kothur 等[36]将其与PVC反应得到电化学膜,用于离子选择性电极,在pH值从1 升至4 时,电势呈非线性降低,表明此电化学膜是一种优良的pH 值传感器。迟晓东等[37]合成了带有三(环氧乙烷)官能团的水溶性柱[10]芳烃,与相同衍生化的柱[5,6]芳烃一样[38],柱[10]芳烃也具有低临界溶解温度(LCST)特性,其浊点可通过主客体体系的化学响应可逆调控。
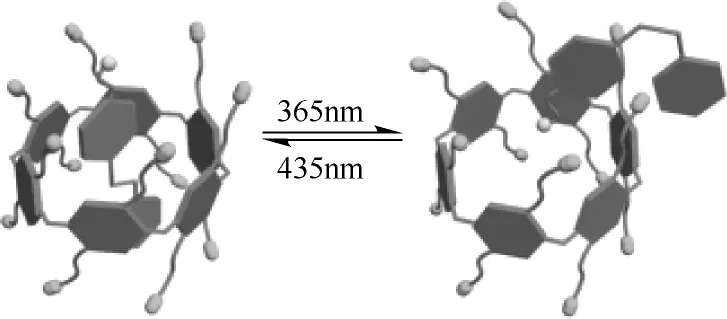
图17 WP6 与客体2 形成的光响应自组装体系[34]
除常见刺激响应官能团外,Jie 等[39]设计并合成了对CO2响应的柱[5]芳烃衍生物,此衍生物含有9个叔胺官能团和一个带有樟脑球的烷基链,单独存在于水溶液中形成胶束,向此溶液中鼓入CO2,叔胺官能团被质子化成亲水基团,在亲水-疏水及静电作用下,自组装成多层壁环形线圈形状,继续鼓入N2可恢复成胶束状,相对于pH 值刺激,CO2响应在环境友好及生物相容性方面具有更大的优势。
郭磊[40]将柱[5]芳烃引入到高分子中,合成了柱[5]芳烃衍生物P5-CTA,与N-异丙基丙烯酰胺(NIPAM)发生聚合,得到温敏性聚合物 P5- PNIPAM。而柱芳烃的疏水作用使P5A-PNIPAM 在水中可以自组装成胶束,加入客体分子吡嗪盐后,由于柱芳烃与吡嗪盐形成了络合物,胶束尺寸增大,而聚合物的浊点也有所下降。另外,夏斌元[41]利用柱[5]芳烃识别咪唑盐客体制备的pH 值响应性超分子AB 型单体能在适当溶液中自发地组装形成超分子聚集体,而且这种聚集体能够实现从环状寡聚物到线性聚合物的转变,这一发现对研制智能材料提供了很大的帮助。
3.2 分子探针
四苯基乙烯衍生物单独存在于水中并没有荧光,当向此溶液中加入WP6 时,出现荧光现象,主要是因为WP6 与客体形成了[2]类轮烷,阻止了客体分子内苯环的转动和无辐射弛豫通道[42]。由于WP6 与百草枯的包合常数比WP6 与四苯基乙烯衍生物大,所以当向WP6 与客体的包合物溶液中加入百草枯后,荧光逐渐猝灭,表明客体从WP6 的腔体中被释放出来了,故此包合反应可作为探针检测溶液中百草枯的存在,而且这一发现为设计更加复杂的诱导发光材料提供了思路和策略。
全甲基化柱[5]芳烃[43]作为离子载体附在碳电极上可检测水溶液中的Na+和K+。Smolko 等[44]利用循环伏安法分析研究了P5 与Ag+、Cu2+的相互作用,P5 作为还原剂,与还原产物Ag 及Cu+化合物作用形成聚集物,对氧化还原活性物种具有很好的检测作用。柱[5]芳烃与正辛基吡嗪鎓阳离子形成的准轮烷及聚准轮烷新型荧光感应器可以选择性地检测溶液中的卤素负离子[45-46]。
有磁性的Fe3O4纳米颗粒与羧酸盐柱[5]芳烃形成新型磁性固体萃取剂混合材料[47],在HPLC 条件下,可以有效追踪饮料样品中的痕量农药,检测范围为5.0~11.3ng/mL。含有12 个咪唑啉官能团的水溶性柱[5,6]芳烃能通过主客体化学有效识别特定的氨基酸,其中WP6 修饰的银纳米粒子[48]在谷氨酸水溶液中可以发生聚集,产生颜色变化,而在其他氨基酸水溶液中只是发生识别,并没有聚集,WP5修饰的银纳米粒子不仅在谷氨酸水溶液中能够聚集,在天门冬氨酸水溶液中也可以发生聚集,所以,WP6 修饰的银纳米粒子可以作为颜色探针选择性检测溶液中的谷氨酸,见图18。
Fang 课题组[49]发现,带有磷化氢官能团的柱[5]芳烃衍生物能有效选择性识别 U(Ⅵ)和Th(Ⅳ),对Th(Ⅳ)的识别能力较弱,利用这一性质可以将U(Ⅵ)和Th(Ⅳ)从多金属离子混合溶液中分离出来。随后合成了带有10 个乙二醇酰胺官能团的柱[5]芳烃,它可以有效识别Am(Ⅲ)而不能识别Eu(Ⅲ),利用这一特性将Am(Ⅲ) 和Eu(Ⅲ)分开,有望用于核废物治理方面[50]。

图18 负载银纳米颗粒的WP5 和WP6 检测氨基酸机理[48]
3.3 生物领域
在柱芳烃骨架上引入具有生物相容性的官能团对其进行化学修饰,所得功能化的柱芳烃在抗菌、抗病毒、药物缓释剂和药物的增溶剂或分散剂等方面取得了很大的进展。
喻国灿等[51]设计合成了一种糖基功能化的两亲性柱[5]芳烃(AP5),在疏水端烷基链间范德华力及亲水端半乳糖间氢键的共同驱使下,浓度高于其临界浓度时,AP5 自发的在水中自组装成纳米管形态。研究发现,AP5 组装成的具有生物相容性的半乳糖涂层纳米管表层具有大量的多价键结合位点,可以作为一种凝聚力很强的细胞黏合剂,有效地识别生物体中的病原体并抑制其生长,如大肠杆菌,这是首次将柱芳烃应用于生物领域,开拓了柱芳烃的应用范围。Iwona Nierengarten 等[52]用Cu 作催化剂,利用带有10 个重氮基取代基柱[5]芳烃衍生物与炔基化甘露糖衍生物发生重氮基-炔基环化反应,所得新的柱[5]芳烃衍生物是一类抑制剂,可以有效地抑制尿道致病性大肠杆菌黏附在血红细胞上。
3.4 相转移催化剂
相转移催化剂(PTC)是一类同时具有亲油和亲水基团的两亲性物质,能够使处在不同相中的物质发生反应。经过修饰的杯芳烃在相转移催化方面已经表现出很好的性能,柱芳烃作为杯芳烃的对位类似物,上下端口经化学修饰后也可以具有这种 性能。
带有10 个四面体烷基磷阳离子取代基的两亲性柱[5]芳烃衍生物[18](AP5),在水溶液及多种有机溶剂中均有很好的溶解性。研究发现,在D2O-CDCl3两相体系中,两亲性柱[5]芳烃衍生物中 Br-与MnO4-在水相中发生离子对交换,AP5 将MnO4-从水相带到有机相中,直链烯烃进入AP5 空腔中,与MnO4-反应被氧化成醛,过程见图19。与传统PTC用量5%~100%(物质的量分数)相比,柱[5]芳烃衍生物只需0.9%(同前),但只对直链烯烃具有很好的催化效果,而对带有支链的烯烃却不起作用,主要是柱[5]芳烃的空腔太小,不能与含有支链的烯烃形成包合物。因此,柱[5]芳烃衍生物对KMnO4氧化烯烃具有很好的催化效率及底物选择性。
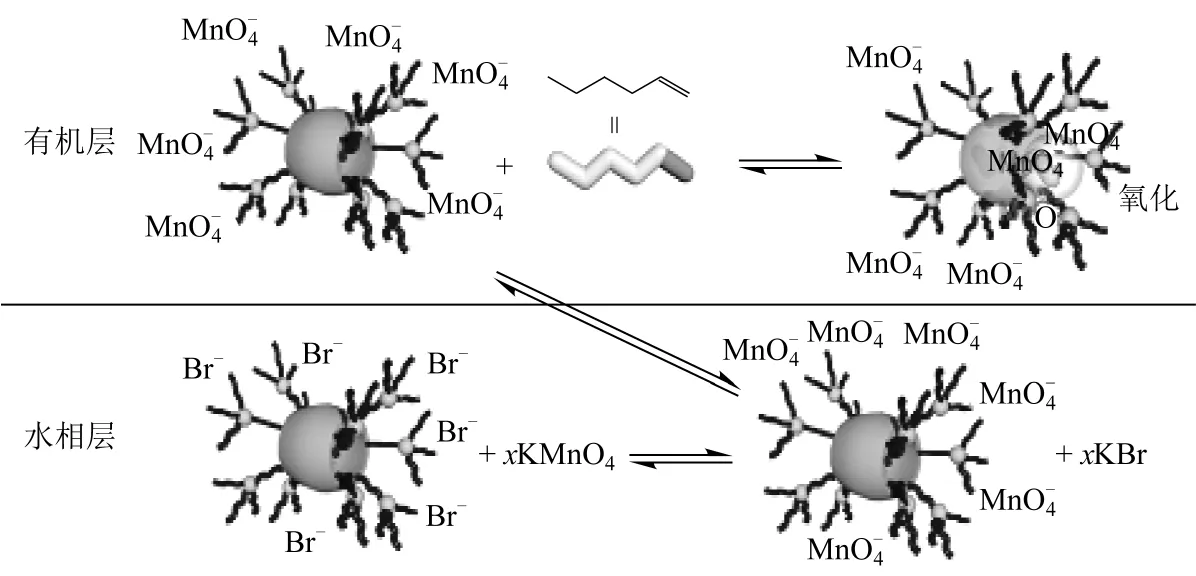
图19 基于主客体化学的PTC 催化氧化反应机理[18]
4 展 望
目前,超分子化学的理论和方法在许多领域发挥的作用越来越重要,如医药、农药、生物、功能性材料、催化等。同时,超分子化学的理论在石油化学中也开始得到应用,孙燕等[53]提出了以分子识别方法脱除燃料油品中硫化物的设想,对β-环糊精与燃料油品中硫醇、硫醚等的包合作用进行了系统研究,并探讨了β-环糊精与硫化物的包合机理,得到很有意义的结果,开拓了超分子化学在石油化工领域的应用。本课题组初步研究了柱芳烃对燃料油品中硫化物、氮化物的包合脱除作用,为获得超低硫、超低氮燃料油品提供了新思路。
柱芳烃的出现为超分子化学的发展提供了更广阔的空间,柱芳烃及其衍生物在分子识别、药物运输、智能材料、分子传感器、生物领域等已经有了广泛的应用。相信未来将会有更多柱芳烃新的超分子体系出现,并将开拓柱芳烃及其衍生物在催化、生物模拟、石油化工等领域的广泛应用。
[1] Ogoshi Tomoki,Kanai Suguru,Sakakibara Fumiyasu,et al. Para-bridged symmetrical pillar[5]arene:Their lewis acid catalyzed synthesis and host-guest property[J]. J. Am. Chem. Soc.,2008,130(15):5022-5023.
[2] Cao Derong,Kou Yuhui,Liang Jianquan,et al. A facile and efficient preparation of pillararenes and a pillarquinone[J]. Angew. Chem. Int. Ed.,2009,48(51):9721-9723.
[3] Gragg Peter J , Sharma Kushal. Pillar[5]arenes : Fascinating cyclophanes with a bright future[J]. Chem. Soc. Rev.,2012,41(2):597-607.
[4] Ogoshi Tomoki,Aoki Takamichi,Kitajima Keisuke,et al. Facile,rapid,and high-yield synthesis of pillar[5]arene from commercially available reagents and its X-ray crystal structure[J]. J. Org. Chem.,2011,76(1):328-331.
[5] Tao Hongqi,Cao Derong,Liu Luzhi,et al. Synthesis and host-guest properties of pillar[6]arenes[J]. Chem. Scichina.,2012,55(2):223-228.
[6] Hu XiaoBo,Chen Zhenxia,Chen Lei,et al. Pillar[n]arenes(n=8-10) with two cavities:Synthesis,structures and complexing properties[J]. Chem. Commun.,2012,48(89):10999-11001.
[7] Ogoshi Tomoki,Ueshima Naosuke,Sakakibara Fumiyasu,et al. Conversion from pillar[5]arene to pillar[6-15]arenes by ring expansion and encapsulation of C60by pillar[n]arenes with nanosize cavities[J]. Org. Lett.,2014,16(11):2896-2899.
[8] Ma Yingjie,Chi Xiaodong,Yan Xuzhou,et al. per-Hydroxylated pillar[6]arene:Synthesis,X-ray crystal structure,and host guest complexation[J]. Org. Lett.,2012,14(6):1532-1535.
[9] Ogoshi Tomoki,Hashizume Masayoshi,Yamagishi Tada-aki,et al. Synthesis,conformational and host-guest properties of water-soluble pillar[5]arene[J]. Chem. Commun.,2010,46(21):3708-3710.
[10] Yu Guocan,Xue Min,Zhang Zibin,et al. A water-soluble pillar[6]arene:Synthesis,host-guest chemistry,and its application in dispersion of multiwalled carbon nanotubes in water[J]. J. Am. Chem. Soc.,2012,134(32):13248-13251.
[11] Li Zhengtao , Yang Jie, Yu Guocan , et al. Water-soluble pillar[7]arene:Synthesis,pH-controlled complexation with paraquat,and application in constructing supramolecular vesicles[J]. Org. Lett.,2014,16(7):2066-2069.
[12] Li Zhengtao,Yang Jie,Yu Guocan,et al. Synthesis of a water-soluble pillar[9]arene and its pH-responsive binding to paraquat[J]. Chem. Commun.,2014,50(22):2841-2843.
[13] Yang Jie,Chi Xiaodong,Li Zhengtao,et al. A water-soluble pillar[10]arene:Synthesis,pH-responsive host-guest complexation,and application in constructing a supra-amphiphile[J]. Org. Chem. Front.,2014,1(6):630-633.
[14] Hu XiaoBo,Chen Lei,Si Wen,et al. Pillar[5]arene decaamine:Synthesis,encapsulation of very long linear diacids and formation of ion pair-stopped[2]rotaxanes[J]. Chem. Commun.,2011,47(16):4694-4696.
[15] Yao Yong,Jie Kecheng,Zhou Yujuan,et al. Water-soluble pillar[6]arene stabilized silver nanoparticles : Preparation and application in amino acid detection[J]. Tetrahedron Letters,2014,55(20):3195-3199.
[16] Ma Yingjie,Ji Xiaofan,Xiang Fei,et al. A cationic water-soluble pillar[5]arene:Synthesis and host-guest complexation with sodium 1-octanesulfonate[J]. Chem. Commun.,2011,47(45):12340-12342.
[17] Chen Wei,Zhang Yanyan,Li Jian,et al. Synthesis of a cationic water-soluble pillar[6]arene and its effective complexation towards naphthalenesulfonate guests[J]. Chem. Commun.,2013,49(72):7956-7958.
[18] Ogoshi Tomoki,Ueshima Naosuke,Yamagishi Tada-aki. An amphiphilic pillar[5]arene as efficient and substrate-selective phase-transfer catalyst[J]. Organic Letters,2013,15(14):3742-3745.
[19] Zhou Jun,Chen Ming,Diao Guowang. Synthesis of the first amphiphilic pillar[6]arene and its enzyme-responsive self-assembly in water[J]. Chem. Commun.,2014,50(80):11954-11956.
[20] Ogoshi Tomoki,Kitajima Keisuke,Aoki Takamichi,et al. Effect of an intramolecular hydrogen bond beltand complexation with the guest on the rotation behavior of phenolic units in pillar[5]arenes[J]. J. Phys. Chem. Lett.,2010,1(5):817-821.
[21] Ogoshi Tomoki , Demachi Kazuki , Masaki Kae , et al. Diastereoselective synthesis of meso-pillar[6]arenes by bridging between hydroquinone units in an alternating up-and-down manner[J]. Chem. Commun.,2013,49(38):3952-3954.
[22] 王凯,杨英威,张晓安. 柱芳烃的合成及主客体化学研究进展[J]. 高等学校化学学报,2012,33(1):1-13.
[23] 张华承,刘召娜,辛飞飞,等. 柱芳烃的合成与应[J]. 有机化学,2012,32(2):219-229.
[24] Chi Xiaodong,Xue Min,Ma Yingjie,et al. A pillar[6]arene with mono(ethylene oxide) substituents:synthesis and complexation with diquat[J]. Chem. Commun.,2013,49(74):8175-8177.
[25] Fan Jiazeng,Deng Hongmei,Li Jian,et al. Charge-transfer inclusion complex formation of tropylium cation with pillar[6]arenes[J]. Chem. Commun.,2013,4 9(56):6343-6345.
[26] Ma Yingjie,Xue Min,Zhang Zibi,et al. Neutral guest capture by a cationic water-soluble pillar[5]arene in water[J]. Tetrahedron,2013,69(23):4532-4535.
[27] Yu Guocan,Zhang Zibin,Xue Min,et al. A non-symmetric pillar[5]arene-based selective anion receptor for fluoride[J]. Chem. Commun.,2012,48(24):2958-2960.
[28] Ogoshi Tomoki,Yamafuji Daiki,Kitajima Keisuke,et al. Selective complexation of n-alkanes with pillar[5]arene dimers in organicmedia[J]. Chem. Commun.,2011,47(37):10290-10292.
[29] Li Chunju,Chen Songhui,Li Jian. Novel neutral guest recognition and interpenetrated complex formation from pillar[5]arenes[J]. Chem. Commun.,2011,47(40):11294-11296.
[30] Han Kang,Zhang Yanyan,Li Jian,et al. Binding mechanisms and driving forces for the selective complexation between pillar[5]arenes and neutral nitrogen heterocyclic compounds[J]. Eur. J. Org. Chem.,2013,2013(11):2057-2060.
[31] Cao Yu,Hu Xiaoyu,Li Yan,et al. Multistimuli-responsive supramolecular vesicles based on water-soluble pillar[6]arene and SAINT complexation for controllable drug release[J]. J. Am. Chem. Soc.,2014,136(30):10762 -10769.
[32] Xia Wei,Hu Xiaoyu,Chen Yong,et al. A novel redox-responsive pillar[6]arene-based inclusion complex with a ferrocenium guest[J]. Chem. Commun.,2013,49(44):5085-5087.
[33] Yang Jie,Yu Guocan,Xia Danyu,et al. A pillar[6]arene-based UV-responsive supra-amphiphile:Synthesis,self-assembly,andapplication in dispersion of multiwalled carbon nanotubes in water[J]. Chem. Commun.,2014,50(30):3993-3995.
[34] Xia Danyu,Yu Guocan,Li Jinying,et al. Photo-responsive self-assembly based on a water-soluble pillar[6]arene and an azobenzene-containing amphiphile in water[J]. Chem. Commun.,2014,50(27):3606-3608.
[35] Zhou Qizhong,Jiang Huajiang,Chen Rener,et al. A triply-responsive pillar[6]arene-based supramolecular amphiphile for tunable formation of vesicles and controlled release[J]. Chem. Commun.,2014,50(73):10658-10660.
[36] Kothur Raghuram Reddy,Hall Jessica,Patel Bhavik Anil,et al. A low pH sensor from an esterified pillar[5]arene[J]. Chem. Commun.,2014,50(7):852-854.
[37] Chi Xiaodong,Xue Min. Chemical-responsive control of lower critical solution temperature behavior by pillar[10]arene-based host-guest interactions[J]. Chem. Commun.,2014,50(89):13754-13756.
[38] Ogoshi Tomoki,Shiga Ryohei,Yamagishi Tada-aki. Reversibly tunable lower critical solution temperature utilizing host-guest complexation of pillar[5]arene with triethylene oxide substituents[J]. J. Am. Chem. Soc.,2012,134(10):4577-4580.
[39] Jie Kecheng,Yao Yong,Chi Xiaodong,et al. A CO2-responsive pillar[5]arene:Self-assembly in water[J]. Chem. Commun.,2014,50(41):5503-5505.
[40] 郭磊. 含柱芳烃聚合物的设计合成及柱芳烃主客体络合行为的研究[D]. 上海:华东师范大学,2014.
[41] 夏斌元. 共聚柱芳烃的合成及其应用[D]. 杭州:浙江大学,2014.
[42] Wang Pi,Yan Xuzhou,Huang Feihe. Host-guest complexation induced emission:A pillar[6]arene-based complex with intense fluorescence in dilute solution[J]. Chem. Commun.,2014,50(39):5017-5019.
[43] Dube L E,Patel B A,Fagan-Murphy A,et al. Detection of clinically important cations by a pillar[5]arene-modified electrochemical sensor[J]. Chem. Sens.,2013,3(18):1-6.
[44] Smolko V A,Shurpik D N,Shamagsumova R V,et al. Electrochemical behavior of pillar[5]arene on glassy carbon electrode and its interaction with Cu2+and Ag+ions[J]. Electrochimica Acta,2014,147(20):726-734.
[45] Sun Shu,Hu Xiaoyu,Chen Dongzhong,et al. Pillar[5]arene-based side-chain polypseudorotaxanes as an anion-responsive fluorescent sensor[J]. Polym. Chem.,2013,4:2224-2229.
[46] Sun Shu,Shi Jianbing,DongYuping,et al. A pillar[5]arene-based side-chain pseudorotaxanes and polypseudorotaxanes as novel fluorescent sensors for the selective detection of halogen ions[J]. Chinese Chemical Letters,2013,24:987-992.
[47] Tian Miaomiao,Chen Daixiong,Sun Yulong,et al. Pillararene- functionalized Fe3O4nanoparticles as magnetic solid-phase extraction adsorbent for pesticide residue analysis in beverage samples[J]. RSC Adv.,2013,3(44):22111-22119.
[48] Yao Yong,Jie Kecheng,Zhou Yujuan,et al. Water-soluble pillar[6]arene stabilized silver nanoparticles : Preparation and application in amino acid detection[J]. Tetrahedron Letters,2014,55(20):3195-3199.
[49] Fang Yuyu,Wu Lei,Liao Jiali,et al. Pillar[5]arene-based phosphine oxides:Novel ionophores for solvent extraction separation of f-block elements from acidic media[J]. RSC Adv.,2013,3(3):12376-12383.
[50] Wu Lei,Fang Yuyu,Jia Yiming,et al. Pillar[5]arene-based diglycolamides for highly efficient separation of americium(III) andeuropium(III)[J]. Dalton Trans.,2014,43(10):3835-3838.
[51] Yu Guocan,Ma Yingjie,Han Chengyou,et al. A sugar-functionalized amphiphilic pillar[5]arene:Synthesis,self-assembly in water,and application in bacterial cell agglutination[J]. J. Am. Chem. Soc.,2013,135(28):10310-10313.
[52] Iwona Nierengarten,Kevin Buffet,Michel Holler,et al. A mannosylated pillar[5]arene derivative:Chiral information transfer and antiadhesive properties against uropathogenic bacteria[J]. Tetrahedron Letters,2013,54(19):2398-2402.
[53] Sun Yan,Xia Daohong,Xiang Yuzhi. A novel method for removing sulfur compounds from light oil by molecular recognition with β-cyclodextrin[J]. Petroleum Science & Tech.,2008,26(17):2023-2032.

