碳热还原二氧化硫制备硫黄的研究进展
冯太,赵希强,张立强,王涛,马春元
(山东大学燃煤污染物减排国家工程实验室,山东省能源碳减排及资源化利用重点实验室,山东 济南 250061)
SO2是目前燃煤烟气中的主要污染物之一,不仅对人体造成危害,还是引起酸雨的重要原因[1-2]。我国广泛采用的石灰石-石膏湿法脱硫技术存在副产物石膏大量堆砌,石灰石开采造成山体挖空等问 题[3-4];活性炭干法脱硫技术可通过吸附-再生过程得到高浓度SO2气体,用于制备高纯度二氧化硫或浓硫酸,但产品的贮存及运输存在困难[5-8]。
碳热还原二氧化硫技术[9-11]使用煤、焦炭、活性炭等含碳物质作为还原剂,脱硫原料可就地取材;主要产物硫黄是重要的工业原料,易于贮存和运输。该技术既减少了二氧化硫的排放,又可以缓解我国硫黄短缺的压力[12],是一种绿色资源化脱硫技术,也是今后SO2治理的重要研究方向,目前已有小规模工业应用[13]。
针对碳热还原SO2制备硫黄的研究进展进行了综述,本文介绍了微波辐照条件下C 还原SO2反应的优势。文章结论对研究C-SO2反应机理、反应条件等具有重要指导作用,为推进碳热还原SO2技术的产业化进程与工业化应用提供了理论依据。
1 碳热还原SO2 的反应机理
1.1 SO2 在碳表面的反应
SO2与C 的反应十分复杂,主要发生以下化学反应[9-10]。
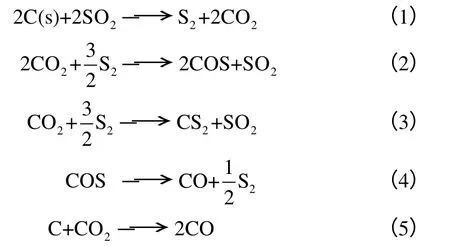
同时发生S2及其同素异形体之间的转化。在有水蒸气存在的条件下还可以发生以下反应。

其中反应(1)为主反应,主要产物为元素硫和CO2,主要副产物包括COS、CS2、H2S、CO 等。
Stacy 等[14]和Abramowitz 等[15]认为SO2与C 的反应包含了氧原子转移的过程,该过程类似于CO2与C 的反应,反应过程如下。
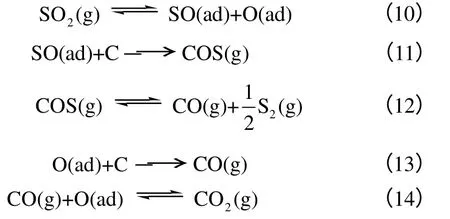
Puri 等[16]认为SO2首先与碳表面的不饱和活性位结合,或通过化学反应取代以CO 形式释放的含氧官能团,形成稳定的表面C-S 化合物;这些C-S化合物常以砜、亚砜、硫化物、氢硫化物等形式存在。Blackwood 等[17]研究表明在800~950℃,SO2与C 反应产物的生成顺序如式(15)。
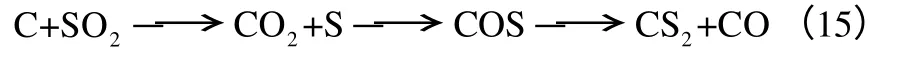
Ratcliffe 等[11]对不同煤种与SO2的反应进行了研究,认为SO2通过化学吸附结合在碳表面,迅速被还原生成热稳定性较高的C-S 化合物,同时释放CO2,C-S 化合物在Ca、Na、K 等碱性矿物质的催化作用下与SO2反应生成CO2和元素硫。Humeres等[18]通过研究C 还原SO2的反应产物,发现含碳产物与含硫产物的物质的量符合式(16)。
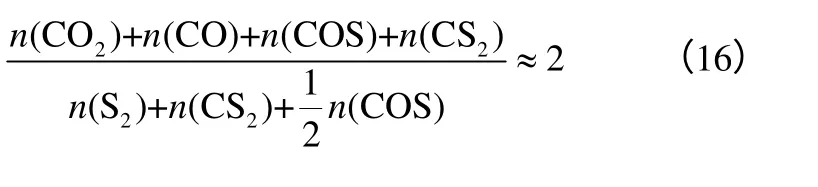
因此得出COS、CS2及CO 等副产物是主反应(1)发生后,主产物CO2和元素硫与C 继续反应的产物。研究还发现与S 蒸气反应后的石墨表面含S 量升高,且与SO2的反应活性降低,原因为S 蒸气与石墨的反应消耗了C-SO2反应所需的表面活性位。在上述研究的基础上,Humeres 等[18-19]提出了SO2与C 反应的反应机理(图1),即吸附在CA位上的SO2与C 发生主反应(1),生成CO2和Sx(以S2为主);CO2在CB位上反应,生成CO;吸附在CC位上的S 可与CO 反应生成COS,也可形成CS2。
Humeres 等[20-23]通过进一步研究,发现SO2可与C 表面活性位反应,释放CO2和S 原子,其中S原子与C 表面结合形成表面环硫化物Ⅰ。环硫化物Ⅰ经过连续结合S 原子,形成表面三硫化物Ⅱ,三硫化物Ⅱ会释放S2并重新形成环硫化物Ⅰ(图2)。
1.2 SO2 与C 的反应动力学
国内外学者对SO2与C 的反应动力学进行了诸多研究。Lepsoe 等[24]的研究表明SO2与C 的反应在1200℃以上主要受气体扩散控制。Abramowitz 等[15]研究发现反应在850℃以下受物质传输和孔内扩散的影响很小,当温度超过960℃时,这两个因素成为主要控制因素。Ratcliffe 等[11]研究了SO2与不同煤种在600~800℃之间的反应,提出SO2与C 的反应分为两个阶段,即受煤种脱挥发分速率控制的反应快速初始阶段和受煤种表面化学性质控制的反应第二阶段,两阶段的反应活化能分别为12.5~29kJ/mol 和134~150kJ/mol,其中第二阶段是整体反应的控制阶段;利用气-固反应模型描述了SO2分别与褐煤、亚烟煤和烟煤的反应动力学,表明反应在600~800℃内主要受化学反应控制。
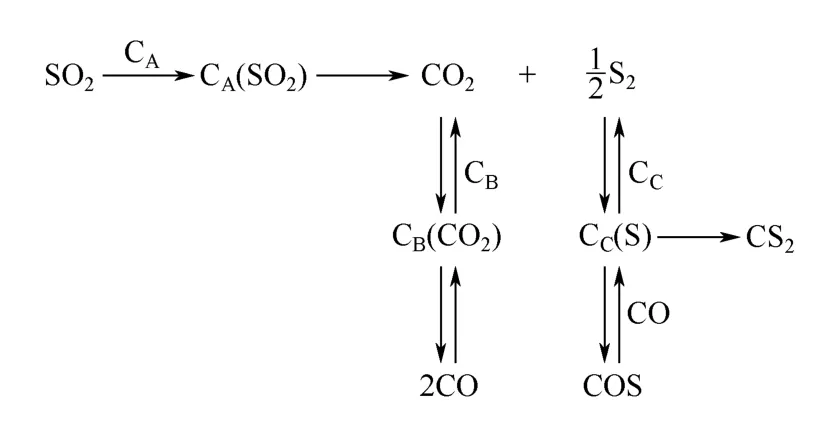
图1 SO2 与C 的反应机理
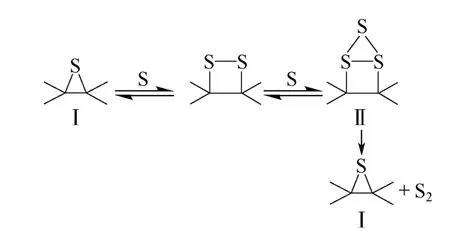
图2 SO2 与C 表面反应机理
Humeres 等[18]利用缩核反应模型描述该反应,研究表明反应在低于700℃时主要受化学反应控制,高于700℃时主要受SO2扩散控制;并提出在稳态、化学反应控制条件下,SO2与C 的反应符合二阶动力学特性,即分别关于C 和SO2的一阶反应。
Bejarano 等[25]通过研究SO2与油砂流化焦在700~950℃之间的反应动力学,得出反应活化能为154 kJ/mol,这与Ratcliffe 等[11]的计算结果基本吻合,反应过程受化学反应和SO2在灰层中的扩散共同控制。
不同学者在C-SO2反应动力学研究方面观点较为一致,即温度较低时主要受化学反应控制,温度较高时气体扩散成为主要控制因素,控制因素发生转变的温度由实际反应条件决定。
2 碳热还原SO2 的影响因素
碳热还原SO2反应主要受C/SO2摩尔比、反应温度、反应时间等因素影响,反应气氛、碳的类型及所含矿物质如碱金属盐类对SO2转化率、元素硫产率及产物分布也有不同程度的影响。
2.1 C/SO2 摩尔比的影响
郑诗礼等[26]利用实验和热力学平衡计算进行对照,研究了C/SO2摩尔比对反应的影响。其中热力学计算得出C/SO2摩尔比为1 时,S 产率最高,偏离该摩尔比时S 产率降低;实验结果得到了与理论计算相似的趋势,最佳C/SO2摩尔比为1.48,与计算值存在偏差的原因为实验中反应未达到稳态。Bejarano 等[27-28]利用热力学计算程序包F*A*C*T计算了碳与SO2在300~900℃之间的反应,得出n(C)/n(SO2)=1 时,SO2几乎完全转化,S 产率达到最高;n(C)/n(SO2)<1 时,SO2转化不完全,副产物生成较少;n(C)/n(SO2)>1 时,SO2转化率变化不大,S 产率因为S 与C 或CO 的反应而下降,副产物CO、COS、CS2等显著增加。
2.2 反应温度的影响
Stacy 等[14]通过实验发现,低于300℃时,SO2在碳表面发生化学吸附,只产生少量的分解产物;在温度高于650℃时,SO2与C 迅速反应生成CO2、CO 和元素硫。Klinzing 等[10]将热力学平衡计算结果与Foster Wheeler公司专利[29]的实验数据进行对比,发现S 产率计算值远低于实验值,原因是实验中反应未达到平衡状态。
Ratcliffe 等[30]通过研究SO2与褐煤的反应,发现褐煤在600℃达到较高的SO2转化率和S 产率(82.9%),700℃时S 产率达到最高(88.8%),温度继续提高,S 产率下降;对比实验结果与热力学计算结果发现,实验测得的SO2转化率和S 产率较大,分析原因为未反应的SO2在反应器出口段与其他反应产物反应生成元素硫。
陈忠等[31]通过热力学计算得出S 产率在600~1100K 之间较高,温度继续升高时S 产率大幅下降。郑诗礼等[26]通过实验验证了陈忠等[31]的计算,但发现温度低于900K 时实际S 产率很低,原因是SO2与C 在较低温度下反应速率较慢,难以达到平衡状态。郑诗礼等[26]和王树森等[32-34]的研究均表明SO2与C 反应的最佳温度为700℃,SO2转化率在温度低于700℃时急剧下降,温度高于700℃时变化不明显;但700℃附近COS 大量生成,导致S 产率较低。刘公召等[35]对活性炭还原SO2的反应进行了研究,得出在700~900℃范围内,SO2转化率保持在95%以上且变化很小,S 产率在700~800℃范围内随温度升高而升高,继续升高温度变化不显著,此时S产率为85%左右。
Bejarano 等[27-28]通过热力学计算得出SO2转化率和S 产率随温度升高而下降。在n(C)/n(SO2)=1,温度低于800℃时,副反应较少,主要发生反应(1),温度高于800℃时,由于发生反应(5),CO 大量生成;n(C)/n(SO2)=3 时,CO 成为主要产物;温度低于800℃时,COS 是主要的含硫产物,温度高于800℃时,CS2是主要含硫产物;实验发现在温度低于600℃时没有元素硫生成,S 产率在700℃时达到最大(95%),700~900℃S 产率均大于90%。
2.3 反应时间的影响
Lepsoe 等[24]使用冶金焦炭作为还原剂,发现当温度升高时,反应所需时间减少,1200℃时,SO2在2.5min 内转化率达到99%。Ratcliffe 等[30]认为SO2在褐煤表面转化非常迅速,可在0.1s 内完全反应。王树森等[32]研究了700℃下SO2通过焦炭床层的反应时间对S 产率和副产物生成的影响,发现随着反应时间的增长,SO2逐渐减少,H2S、COS 等副产物增加,反应时间为11.9s 时,S 产率最大,达到93.9%。Bejarano 等[27]研究发现SO2被油砂流化焦完全转化所需的时间随着温度的升高而减小,700℃时SO2完全反应时间为8s,此时S 产率也达到最佳。由此可见,不同的反应条件对反应所需时间的影响较大。刘公召等[35]研究表明,在800℃条件下,反应时间在12~14s 时,SO2转化率及S 产率随反应时间增加而增加,反应时间继续增加时,效率变化不明显,最大SO2转化率及S 产率分别为95%和85%。
2.4 气氛的影响
Lepseo 等[24]发现O2的加入可使CO 生成量增加,从而促进SO2的还原。Abramowitz 等[14]实验发现增加CO/SO2比对SO2与C 的反应速率常数影响很小。Ratcliffe 等[30]研究了CH4存在时C 与SO2的反应,实验结果表明CH4与SO2反应生成的COS、CS2、H2S 在碱金属盐的催化作用下,一部分转化为元素硫,提高了S 产率,并提出其他烃类物质对反应具有相似的影响。王树森等[33]研究了水蒸气对C与SO2反应过程的影响,发现在700℃时,由于发生反应(17),COS 含量随着H2O/SO2摩尔比的增加而降低,当H2O/SO2摩尔比为0.56 时,只能检测到痕量COS;当H2O/SO2摩尔比超过0.65 时,H2S含量急剧增加,原因为过量H2O 与C 反应产生大量CO 和H2,进而发生反应(18)。Feng 等[36]研究表明反应气体中的H2O 和O2可增强SO2与C 的反应。其中H2O 和O2对S 产率的影响具有两面性:在SO2未完全转化时,可提高S 产率;SO2完全转化时,由于COS 和H2S 的大量生成而使S 产率降低。其原理为O2、H2O 与C 反应生成的CO 和H2与元素硫发生了反应[(18)、(19)]。
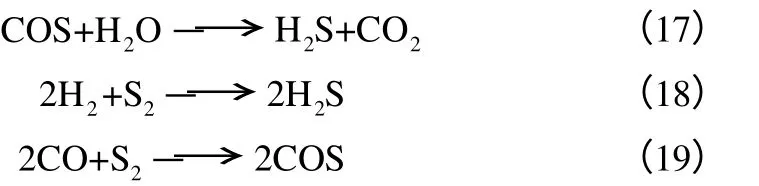
2.5 碳的类型的影响
Ratcliffe 等[30]通过对比褐煤与烟煤分别同SO2的反应,发现褐煤在600℃时将SO2完全转化,烟煤在750℃以上才能使SO2完全转化。其原因为SO2在褐煤孔隙内同碳氢化合物发生反应,反应过程中几乎无挥发分和焦油产生;烟煤产生的挥发分与焦油与SO2发生竞争反应并阻碍SO2向C 表面的扩散。郑诗礼等[26]研究了石墨、木炭、焦炭、活性炭在900℃时与SO2的反应,结果表明活性炭的SO2的转化率最高,焦炭的元素硫产率最高。Humeres等[18]研究了石墨、木炭、焦炭和活性炭分别同SO2的反应,发现SO2同C 的反应活性随着碳结晶度的增加而下降,即石墨<焦炭<木炭,其中焦炭的反应活性随灰分含量升高而升高。
2.6 矿物质的影响
Abramowitz 等[15]研究了Li2CO3、V2O5和Al2O3对C-SO2反应的催化性能,发现后两种物质的加入对反应的催化作用可以忽略,Li2CO3的催化作用随着温度的升高而降低。Ratcliffe 等[11]对比了褐煤与亚烟煤同SO2的反应,认为煤中的矿物质成分,特别是Ca、Na、K 等碱金属的盐类为SO2与C 反应提供了活性位。Humeres 等[21]研究了分别负载Ca2+、Na+、K+的硝酸盐和硫化物的石墨和木炭与SO2的反应,发现矿物质的催化作用只与金属阳离子有关,催化能力为Ca2+>K+>Na+,催化作用可提高反应速率,但不改变反应产物分布;盐类对石墨与SO2反应的催化作用比对木炭更为明显。Humeres 等进一步揭示了盐类存在条件下的催化反应机理,认为盐类的催化作用主要是增强了S 原子从含硫中间产物中释放的能力,具体反应过程为:环硫化物Ⅰ与S2-结合产生二硫化物Ⅲ,二硫化物Ⅲ同S 原子结合产生成三硫化物Ⅳ,三硫化物Ⅳ可转化为硫化物Ⅴ并释放一个S2分子(图3)。
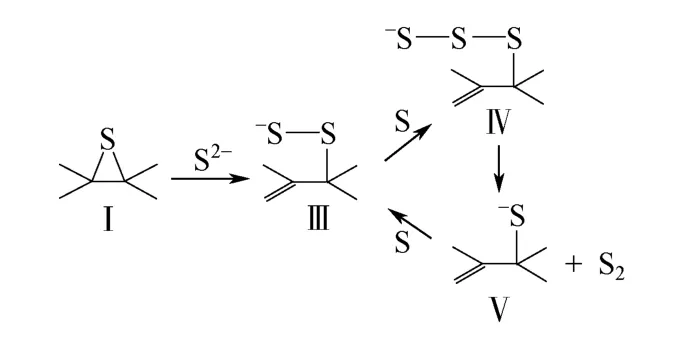
图3 碱金属盐催化作用下SO2 与C 反应机理
3 微波辐照条件下的C-SO2 反应
微波是介于红外和无线电波之间的电磁波谱,波长范围介于1mm~1m,频率在0.3~300GHz,用于热解技术的微波频率固定在 2450MHz 或900MHz。微波加热具有穿透力强,加热效率高,加热迅速,温度均匀等优势,部分学者认为微波辐照存在“非热效应”,对于化学反应具有促进作用。因此,微波辐照在化工领域受到广泛的关注,在C-SO2反应研究中亦有广泛涉及[37-40]。
3.1 微波加热条件下C-SO2 的影响因素
3.1.1 微波功率及炭层温度的影响
研究表明微波加热特定物质的最终温度由微波功率决定,即相同实验条件下微波功率大小可代表反应温度的高低[7-8]。Cha 等[39]研究表明,微波辐照条件下,被焦炭吸附的SO2在脱附过程中被还原为元素硫,其中微波功率550W 时,SO2转化率为87%,当微波功率达到700W 时,SO2转化率上升为94%;张达欣等[40]通过实验发现:当微波功率低于20W时,SO2与C 几乎不发生反应;提高微波功率,SO2转化率增加;当微波功率为100W 时,SO2转化率达到95%,气体出口处观察到硫黄生成。同时提出采用吸附-加微波-吸附-加微波循环处理方法,可在保证高SO2转化率的同时,降低活性炭损耗。
昌晶等[41]研究表明,当微波加热活性炭温度达到470℃时,SO2转化率最高,达到96%;温度高于470℃时,S 蒸气在烟气出口处与O2反应重新生成SO2造成转化率降低。王鑫等[42]通过正交试验表明,微波辐照条件下,活性炭床层温度对SO2转化率影响最大,床层温度为550℃时,转化率几乎达到100%。马双忱等[43-44]通过微波加热活性炭脱除SO2的实验,得出在活性炭床层温度较低温度时(470℃),无催化剂条件下,SO2转化率可达98%;其原因为微波作用于活性炭时,活性炭上附着的极性分子被加热,形成局部热点,在活性炭床层温度较低的情况下,局部热点即可达到较高温度,从而完成活性炭对SO2的还原反应。
3.1.2 碳的类型的影响
Cha 等[45]进而研究了微波加热条件下焦炭和无烟煤与SO2的反应,实验结果表明在微波功率400W,SO2浓度为1200μL/L 时,SO2完全分解所需气流速度分别为6cm/s 和15cm/s,焦炭比无烟煤更易与SO2反应;微波功率对两种碳物质与SO2的反应影响相似,随着微波功率升高,SO2转化率均提高,焦炭完全分解SO2所需微波功率较低。
3.1.3 烟气共存成分的影响
Cha 等[45]研究表明2%~10%的O2对微波辐照条件下C-SO2反应几乎没有影响。马双忱等[46]研究了NO、CO2、O2和H2O 对活性炭与SO2反应的影响,研究表明NO 对C-SO2有促进作用,但效果不明显,两者共存时,C 优先与SO2反应;O2促进了SO2的转化,原因为C 与O2反应生成的CO 还原了部分SO2;H2O 加入降低了SO2转化率,原因为水蒸气吸收了部分微波能量,使炭层温度降低;较低浓度的CO2促进SO2转化,其原理与O2作用机理相同;CO2浓度超过10%时,由于活性炭的大量消耗,SO2转化率下降。
3.1.4 催化剂的影响
多名学者考察了微波加热条件下CuCl 对活性炭与SO2反应的催化效果[42,47],发现CuCl 的加入降低了SO2的转化率。王鑫等[42]认为CuCl 的加入改变了活性炭表面结构;赵毅等[47]认为CuCl 结合CO 生成[CuCl(CO)]2,影响了CO 在反应过程中对SO2的还原,并发现CuCl2、FeCl2、Mn(NO3)2、Zn(NO3)2等均提高了SO2转化率。
3.1.5 微波加热条件下的反应动力学
Ma 等[48]对微波辐照下C-SO2反应动力学研究表明:反应依照时间顺序依次处于缓慢反应阶段、过渡阶段和快速反应阶段,处于快速反应阶段时,反应为一阶反应,处于缓慢反应阶段时为零阶反应;微波功率为420W 时,反应活化能为30.69kJ/mol。可见相比常规加热方式[11,25],微波加热时反应更易进行,因为微波辐照除产生加热作用外,还增加了SO2的分子转动动能,促进了S—O 键断裂,从而对反应起到了催化作用。
3.2 微波诱导等离子体强化C-SO2 反应
微波诱导等离子体技术近年来在烟气净化领域得到了广泛应用[49-50],该方法对C 还原SO2反应具有显著的效果。
Wang 等[51]利用微波诱导等离子体强化C-SO2反应,其中C 既是还原剂,又是微波诱导等离子体的引发物。研究发现试验中3 种碳物质对SO2的还原效率为活性炭>木炭>焦炭,原因可归纳为两点:一方面活性炭的孔隙结构最丰富,比表面积最大,有利于气固两相反应的进行;另一方面活性炭可以更好的吸收微波诱导等离子体系统中的微波能量,使炭层温度升高而促进反应的进行。当微波功率为110W 时,活性炭还原SO2的效率和S 产率分别达到99.6%和99.4%。对含O2条件下反应情况的实验研究表明,O2浓度增加提高了SO2转化率,S 产率呈先增加后降低的趋势,原因是O2与C 反应产生的CO 将部分SO2还原为COS。
3.3 微波辐照条件下碳热还原SO2 技术优势及 问题
相比传统加热方式,微波辐照条件下,炭层形成很高的温度梯度,从炭粒中心向表面,温度逐渐降低,有利于产物气体从炭表面迅速扩散[52];在维持较高SO2转化率的情况下,C 还原SO2的反应活化能及反应所需温度明显降低,有利于克服常规加热时反应温度较高、反应速率较慢的问题,但微波辐照对产物分布情况的影响尚未明确。
碳热还原SO2制备硫黄技术,除受到反应条件制约外,还存在设备尾部硫黄易被重新还原为SO2,碳颗粒易混入产物中影响硫黄纯度,含硫副产物难以处理等工艺难题。张跃等[13,53]通过中试试验发现,经过硫黄回收系统后,尾气中SO2浓度显著增加;煤灰对硫黄纯度有较大影响,且容易堵塞尾部烟道。该系统中所产生的尾气直接排空,未进行有效处理,对环境造成二次污染。可见改进除灰及硫回收工艺,开发适宜的尾气处理技术,是目前工业应用中的难点。现阶段微波的工业化应用范例较少,如何开发高效节能的微波谐振腔,并使之应用于工业生产,是微波辐照碳热还原SO2技术工业化必须解决的问题[54]。
因此对微波辐照条件下,C 与SO2催化反应机理及其副产物生成规律进行探讨,并进行工艺系统及相关设备的设计优化,对微波辐照条件下,碳还原SO2制备硫黄技术的工业化应用具有重要意义。
4 结语及展望
碳热还原SO2制备硫黄是一种绿色资源化的SO2处理技术。本文介绍了SO2与C 的反应机理以及C/SO2摩尔比、反应温度、反应时间、碳的类型、反应气氛及矿物质对该反应的影响,介绍了微波辐照条件下,C 还原SO2的研究进展,得出以下结论。
(1)SO2在C 表面的反应极其复杂,反应过程大致分为以下3 步:①SO2与C 表面活性位结合形成C—S 化合物;②C—S 化合物分解生成元素硫,活性位得到再生;③反应主产物CO2和S2与C 反应生成COS、CS2及CO 等副产物。反应动力学的研究表明SO2与C 的反应在温度较低时为化学反应控制,温度较高时主要受气体扩散控制。
(2)不同反应条件对SO2与C 的反应过程影响较为复杂,在符合化学反应计量比(C/SO2摩尔比为1),温度700℃左右,适宜的反应时间,较低的碳结晶度,碱性矿物质催化等条件下,可同时得到较高的SO2转化率和S 产率;反应温度、反应气氛对SO2转化率、S 产率和产物分布影响最为显著。
(3) 微波辐照近年来在化工领域受到了广泛关注,相比常规加热,微波辐照加热条件下,C 还原SO2的反应具有降低反应活化能及反应温度,提高反应速率等优势。该领域研究成果较少,研究微波辐照条件下,C-SO2反应机理及产物分布规律的影响,并进行工艺系统及相关设备的开发和优化,对于该技术的应用意义深远。
[1] Liu Q L,Wang Q. Pathways to SO2emissions reduction in China for 1995—2010:Based on decomposition analysis[J]. Environmental Science & Policy,2013,33:405-415.
[2] 袁志国,刘有智,宋卫,等. 并流旋转填料床中磷酸钠法脱除烟气中SO2[J]. 化工进展,2014,33(5):1327-1331.
[3] Xiong Y Y,Niu Y Q,Tan H Z,et al. Experimental study of a zero water consumption wet FGD system[J]. Applied Thermal Engineering,2014,63(1):272-277.
[4] 李皎,廖国权,马殿学. 石灰石-石膏湿法脱硫系统节能降耗探讨[J]. 电力科技与环保,2014,30(3):51-54.
[5] 王学海,方向晨,刘忠生. 催化还原二氧化硫为单质硫的研究进展[J]. 化工进展,2010,29(7):1209-1214+1240.
[6] 李兵. 粉末活性炭循环流化床吸附脱除烟气中SO2的实验研究[D].济南:山东大学能源与动力工程学院,2012.
[7] 张立强,蒋海涛,李兵,等. 粉状活性炭流化床吸附SO2的实验研究及吸附动力学分析[J]. 煤炭学报,2012,37(6):1046-1050.
[8] 张立强,蒋海涛,马春元,等. 烟气脱硫活性炭微波再生特性的实验研究[J]. 燃料化学学报,2012,40(11):1366-1371.
[9] Lepose R. Chemistry of sulfur dioxide reduction[J]. Industrial & Engineering Chemistry,1938,30(1):92-100.
[10] Klinzing G E,Walker R J. Equilibrium studies of the direct reduction of sulphur dioxide by coal[J]. Fuel,1984,63(10):1450-1454.
[11] Ratcliffe C T,Pap G. Chemical reduction of sulphur dioxide to free sulphur with lignite and coal. 2. Kinetics and proposed mechanism[J]. Fuel,1980,59(4):244-248.
[12] 邢新艳,肖勇,郭彦霞,等. 添加金属氧化物的V2O5/AC 在烟气脱SO2及脱SO2后H2再生制备硫磺的活性研究[J]. 燃料化学学报,2008,36(3):349-353.
[13] 张跃,杨守明,王国良,等. 用热解还原法生产硫磺的工业实验研究[J]. 硅酸盐通报,2013,32(4):767-771.
[14] Stacy W O,Vastola F J,Walker Jr P L. Interaction of sulfur dioxide with active carbon[J]. Carbon,1968,6(6):917-923.
[15] Abramowitz H,Insigna R,Rao Y K. Kinetics of reaction of sulfur dioxide with carbon[J]. Carbon,1976,14(17):84-86.
[16] Rai Puri B,Singh Hazra R. Carbon-sulphur surface complexes on charcoal[J]. Carbon,1971,9(2):123-134.
[17] Blackwood J D , McCarthy D J. The kinetically effective stoichiometry of reactions in the carbon-sulphur dioxide system[J]. Australian Journal of Chemistry,1973,26(4):723-731.
[18] Humeres E,Moreira R F P M,Peruch M G B. Reduction of SO2on different carbons[J]. Carbon,2002,40(5):751-760.
[19] Humeres E,Moreira R F P M,Castro S C. Catalysis and inhibition of the carbon-sulfur reaction[J]. J. Braz. Chem. Soc.,1994,5(2):69-76.
[20] Humeres E,Peruch M G B,Moreira R F P M,et al. Reactive intermediates of the reduction of SO2on activated carbon[J]. Journal of Physical Organic Chemistry,2003,16(10):824-830.
[21] Humeres E,Peruch M G B,Moreira R F P M,et al. Reduction of sulfur dioxide on carbons catalyzed by salts[J]. International Journal of Molecular Sciences,2005,6(1):130-142.
[22] Humeres E,Castro K M,Moreira R F P M,et al. Reactivity of thethermally stable intermediates of the reduction of SO2on carbons and mechanisms of insertion of organic moieties in the carbon matrix[J]. The Journal of Physical Chemistry C,2008,112(2):581-589.
[23] Humeres E,Castro K M,Smaniotto A,et al. Reactivity of the intermediates of the reduction of SO2. Functionalization of graphite,graphite oxide and graphene oxide[J]. Journal of Physical Organic Chemistry,2014,27(4):344-351.
[24] Lepsoe R. Chemistry of sulfur dioxide reduction,kinetics[J]. Industrial & Engineering Chemistry,1940,32(7):910-918.
[25] Bejarano C,Jia C Q,Chung K H. Mechanistic study of the carbothermal reduction of sulfur dioxide with oil sand fluid coke[J]. Industrial & Engineering Chemistry Research,2003,42(16):3731-3739.
[26] 郑诗礼,杨松青,张宏闻,等. 碳热还原二氧化硫的热力学平衡验证[J]. 环境化学,1997,16(4):300-305.
[27] Bejarano C A,Jia C Q,Chung K H. A study on carbothermal reduction of sulfur dioxide to elemental sulfur using oilsands fluid coke[J]. Environmental Science & Technology,2001,35(4):800-804.
[28] Bejarano C A. Carbothermal reduction of sulfur dioxide using oil-sands fluid coke[D]. Toronto,Ontario,Canada:Department of Chemical Engineering and Applied Chemistry,University of Toronto,2000.
[29] Foster Wheeler. Reduction of SO2with coal:US,4147762[P]. 1979
[30] Ratcliffe C T,Pap G. Chemical reduction of sulphur dioxide to free sulphur with lignite and coal. 1. Steady-state reaction chemistry and interaction of volatile components[J]. Fuel,1980,59(4):237-243.
[31] 陈忠,尹爱君,杨松青,等. 二氧化硫高温还原制取元素硫的热力学平衡计算[J]. 湖南有色金属,1996,12(3):52-55.
[32] 王树森,凌爱莲,王志忠,等. SO2还原为元素硫的条件研究[J]. 北京工业大学学报,1992,18(1):56-61.
[33] 王树森,凌爱莲,王志忠,等. 从含硫废气中回收元素硫[J]. 北京工业大学学报,1991,17(4):76-81,86.
[34] 凌爱莲,王志忠,王树森. 排烟脱硫新方法的研究[J]. 北京工业大学学报,1992,18(2):74-79.
[35] 刘公召,梅晓丹,顾齐欣. 固定床反应器活性炭还原SO2制单质硫的研究[J]. 化学世界,2012,(2):72-74+88.
[36] Feng W,Charles Q J. Influence of O2and H2O on carbothermal reduction of SO2by oil-sand fluid coke[J]. Environ. Sci. Technol.,2005,39(24):9710-9714.
[37] 黄卡玛,杨晓庆. 微波加快化学反应中非热效应研究的新进展[J]. 自然科学进展,2006,16(3):273-279.
[38] 赵伟,刘希涛. 微波-活性炭联合作用在污染控制中的应用[J]. 环境工程学报,2009,3(7):1153-1159.
[39] Cha C Y. Microwave induced reactions of SO2and NOxin the char-bed[J]. Res. Chem. Intermed.,1994;20(1):13–28.
[40] 张达欣,于爱民,金钦汉. 微波-炭还原法处理二氧化硫的研究[J].微波学报,1998,14(4):342-347.
[41] 昌晶,周震峰,徐敏,等. 活性炭加微波还原分解SO2实验研究[J]. 工业安全与环保,2008,34(8):14-16.
[42] 王鑫,闫淑梅,刘皓磊. 微波辐射活性炭脱硫技术的实验研究[J]. 吉林电力,2007,35(2):12-15.
[43] 马双忱,赵毅,马宵颖,等. 微波诱导催化还原脱硫脱硝实验研究[J]. 中国电机工程学报,2006,26(18):121-125.
[44] 马双忱,赵毅,马宵颖,等. 活性炭床加微波辐射脱硫脱硝的研究[J]. 热能动力工程,2006,21(4):338-341+433.
[45] Cha C Y,Kim D S. Microwave induced reactions of sulfur dioxide and nitrogen oxides in char and anthracite bed[J]. Carbon,2001,39(8):1159-1166.
[46] 马双忱,靳义净,金鑫,等. 烟气共存成分对微波辐照活性炭同时脱硫脱硝的影响研究[J]. 燃料化学学报,2011,39(6):460-464. [47] 赵毅,刘威,祝晓雨,等. 微波辐照活性炭同时脱硫脱硝的试验研究[J]. 动力工程学报,2013,33(11):878-882.
[48] Ma S C,Yao J J,Jin X,et al. Kinetic study on desulfurization and denitrification using microwave irradiation over activated carbon[J]. Science China Technological Sciences,2011,54(9):2321-2326.
[49] Ighigeanu D,Martin D,Macarie R. Air pollution control by DC,pulse and microwave discharge[J]. Journal of Environmental Protection and Ecology,2003(4):525-534.
[50] 秦华,徐岩,付俊青. 微波诱导等离子体法对燃煤烟气脱硫的研究[J]. 煤质技术,1999(5):27+29.
[51] Wang X,Wang A,Wang X,et al. Microwave plasma enhanced reduction of SO2to sulfur with carbon[J]. Energy & Fuels,2007,21(2):867-869.
[52] 马双忱,高莉,金鑫,等. 微波辐照活性炭脱硫脱硝技术研究进展[J]. 环境科学与技术,2011,34(8):70-74.
[53] 张跃,扬守明,王国良,等. 低品位硫铁矿生产硫磺的工业实验研究[J]. 无机盐工业,2011,43(2):47-49.
[54] 赵希强,宋占龙,王涛,等. 微波技术用于热解的研究进展[J]. 化工进展,2008,27(12):1873-1877,1881.

