臭氧自体血治疗痛风缓解疼痛的细胞机制研究
曹国庆,李秀华,武百山,倪家骧
臭氧可改善氧气供应,增强免疫,释放血红素氧合酶1(HO-1)、热休克蛋白70(HSP-70),产生超级红细胞,释放干细胞,上调抗氧化酶[1-2]。臭氧自体血治疗是补充性的临床治疗方法,已应用于乙型肝炎、糖尿病、退行性眼病、不同疼痛综合征和缺血性外周血管病的治疗[3]。前期的临床研究显示,臭氧自体血治疗可以有效缓解痛风患者的疼痛,具有镇痛作用,且患者耐受性良好、安全、没有严重不良反应[4]。本研究旨在观察痛风患者经臭氧自体血治疗前后血清免疫球蛋白水平及炎性细胞因子水平的改变,在细胞水平上研究探讨其可能的作用机制。
1 资料与方法
1.1 病例入选与排除标准 入选标准:符合2006年欧洲抗风湿病联盟 (EULAR)诊断痛风标准[4],尿酸>420 μmol/L;急性或慢性痛风男性患者,年龄20~60岁;痛风药物治疗效果不佳或产生严重不良反应;药物治疗有禁忌证。排除标准:不同意臭氧自体血治疗;患心理精神疾病;葡萄糖-6-磷酸脱氢酶 (G-6PD)明显缺陷;严重的过敏体质;应用血管紧张素转化酶抑制剂治疗;患甲状腺功能亢进症、血小板减少症和严重心血管疾病;严重肾功能损害 (血浆肌酐清除率<30 ml/min)。
1.2 一般资料 选择2012年6月—2013年9月首都医科大学宣武医院疼痛门诊符合入选与排除标准的痛风患者10例,均为男性,年龄 24~59岁,平均 (41.3±9.9)岁;疼痛性质为触痛、酸痛或胀痛。患者均进行非随机、非盲开放研究,签署书面知情同意书。患者治疗前的一般资料见表1。
1.3 方法 入室后静脉穿刺,连接输血抗氧化管路,监护仪监测臭氧自体血治疗流程:273 nm分光光度计准确测量臭氧浓度1~100 mg/L,相当于氧气浓度0.1% ~5.0%;抗臭氧的负压瓶内含有3.8%枸橼酸钠20 ml,吸入200 ml静脉血,将所设定浓度的臭氧注入负压瓶与静脉血充分混合后,再回输体内;3次/周,共10次。其中臭氧由医用氧气 (100%)通过德国赫尔曼公司生产的臭氧发生器产生;混合气体中臭氧的浓度为20 mg/L。
分别采集患者治疗前、第5次治疗后和第10次治疗后的静脉血5 ml。血液静止2 h后以3 000 r/min离心10 min(离心半径为3 cm),取血清备用,样品在-80℃条件下储存。采用免疫比浊法检测血清IgA、IgM、IgG和补体C3、C4水平;采用流式细胞微球阵列分析方法 (CBA)检测患者IL-8、IL-12和单核细胞趋化蛋白1(MCP-1)水平。
1.4 统计学方法 采用SPSS 17.0软件进行统计学分析,计量资料以 (±s)表示,采用单因素重复测量方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 10例患者有9例完成全部治疗,1例由于交通原因完成7次治疗。在臭氧自体血治疗后,1例患者的 HBeAb和 HBsAb、1例患者的类风湿因子(RF)、1例患者的抗胰岛素抗体 (ISN-Ab)均由阳性变为阴性。
2.2 患者臭氧自体血治疗前后免疫球蛋白及补体水平的变化 患者治疗前、第5次治疗后和第10次治疗后IgA、IgM、IgG和补体C3、C4水平比较,差异均无统计学意义 (P>0.05,见表2)。
2.3 患者臭氧自体血治疗前后炎性细胞因子水平的变化 患者治疗前后IL-12、MCP-1水平比较,差异无统计学意义 (P>0.05);患者治疗前后IL-8水平比较,差异有统计学意义 (P<0.05)。患者第5次治疗后和第10次治疗后IL-8水平均低于治疗前,差异有统计学意义 (P<0.05,见表3)。
3 讨论
痛风是因嘌呤代谢紊乱和/或尿酸排泄障碍致血尿酸水平升高的一组异质性疾病,高尿酸血症是痛风的危险因素[5-7]。目前,主要治疗策略仍为控制急性发作、控制高尿酸血症形成晶体,因此痛风治疗非常有限[8-11]。本研究结果发现,臭氧自体血治疗后炎性细胞因子IL-8水平下降,提示IL-8可能在痛风的发生发展中起重要作用。

表1 痛风患者治疗前的一般资料Table 1 General information of gouty patients before treatment
表2 痛风患者臭氧自体血治疗前后血清免疫球蛋白及补体水平比较 (±s,g/L)Table 2 Comparison of serum immunoglobulin cytokines and complement before and after ozonated autohemotherapy
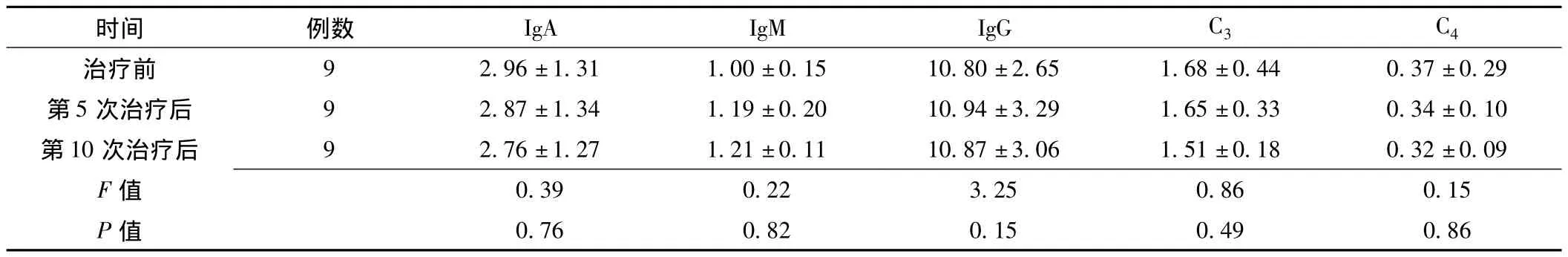
表2 痛风患者臭氧自体血治疗前后血清免疫球蛋白及补体水平比较 (±s,g/L)Table 2 Comparison of serum immunoglobulin cytokines and complement before and after ozonated autohemotherapy
时间 例数 IgA IgM IgG C3 C 4.37 ±0.29第 5 次治疗后 9 2.87 ±1.34 1.19 ±0.20 10.94 ±3.29 1.65 ±0.33 0.34 ±0.10第10 次治疗后 9 2.76 ±1.27 1.21 ±0.11 10.87 ±3.06 1.51 ±0.18 0.32 ±0.09 F治疗前 9 2.96 ±1.31 1.00 ±0.15 10.80 ±2.65 1.68 ±0.44 0 0.39 0.22 3.25 0.86 0.15 P值值0.76 0.82 0.15 0.49 0.86
表3 痛风患者臭氧自体血治疗前后IL-8、IL-12及MCP-1水平比较(±s,ng/L)Table 3 Comparison of IL-8,IL-12 and MCP-1 before and after ozonated autohemotherapy
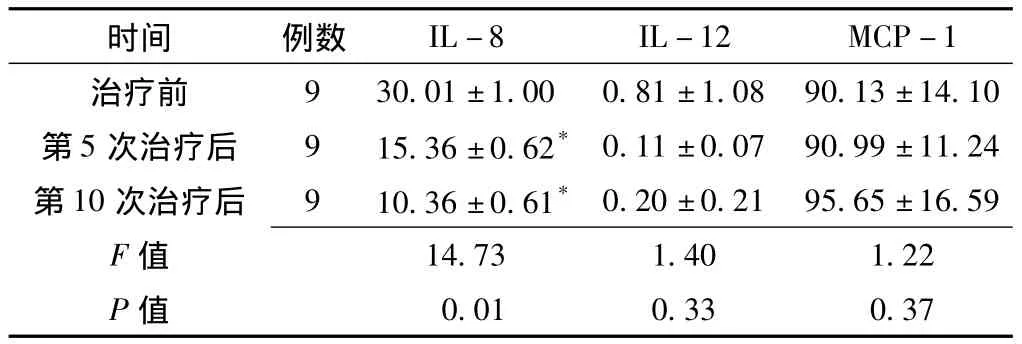
表3 痛风患者臭氧自体血治疗前后IL-8、IL-12及MCP-1水平比较(±s,ng/L)Table 3 Comparison of IL-8,IL-12 and MCP-1 before and after ozonated autohemotherapy
注:MCP-1=单核细胞趋化蛋白1;与治疗前比较,*P<0.05
时间 例数9 30.01 ±1.00 0.81 ±1.08 90.13 ±14.10第5 次治疗后 9 15.36 ±0.62* 0.11 ±0.07 90.99 ±11.24第10 次治疗后 9 10.36 ±0.61* 0.20 ±0.21 95.65 ±16.59 F IL-8 IL-12 MCP-1治疗前14.73 1.40 1.22 P值值0.01 0.33 0.37
Kanevets等[12]发现,IgM抗体的F(ab')2片段与尿酸钠 (MSU)晶体结合,IgM抗体在尿酸溶液中促进MSU晶体沉积,这种沉积作用依赖于IgM的完整结构。本研究结果显示,治疗前后IgM水平无差异,可能的机制是血清IgM抗体可以被特异性识别,在晶体表面起到稳定初始晶体核的作用。臭氧自体血治疗后,1例患者的HBeAb和 HBsAb、1例患者的 RF、1例患者的ISN-Ab均由阳性变为阴性。可能的机制为痛风患者自身免疫功能低下,臭氧激活免疫系统产生干扰素、IL、抗氧化酶,并可以诱导机体产生脐血细胞 (CTL)和自然杀伤细胞 (NK),改善肝脏氧供,激活免疫系统的CD4+和CD8+细胞及自身免疫,从而抵御病毒,攻击和杀死病毒。然而其确切机制还需进一步研究。
IL-8主要来源于单核细胞和吞噬细胞,主要的生物学活性是吸引和激活中性粒细胞,中性粒细胞与IL-8接触后发生形态变化,定向游走到反应部位并释放一系列活性产物;这些作用可导致机体局部的炎性反应,达到杀菌和细胞损伤的目的[13]。IL-8参与单核细胞黏附力的粥样硬化早期阶段。IL-8独特的功能特点是在急性炎症部位t1/2相对较长。在炎性反应早期产生,但是数天和数周甚至更长的时间仍有活性,这与其他许多炎性细胞因子在体内几小时内产生和清除不同[14]。IL-8对氧化物高度敏感,抗氧化物明显减少IL-8的表达[15]。IL-8和其他化学因子调节氧化应激的作用是臭氧自体血治疗痛风的基础,也成为未来潜在治疗痛风的目标。
在家兔急性痛风实验模型上MSU晶体诱导关节炎,注入MSU晶体到膝关节引起明显肿胀,观察滑膜和滑膜液中性粒细胞渗透情况,注射后12~24 h在滑膜衬里发现细胞免疫反应性的蛋白质[16]。Dje N'Guessan等[17]证实,用他汀类药物治疗后氧化修饰低密度脂蛋白 (oxLDL)诱发IL-8和MCP-1分泌减少。本研究结果显示,痛风患者臭氧自体血治疗后IL-8减少,有助于解释该治疗具有抗感染镇痛的作用。
痛风患者的炎性因子紊乱在发病机制中起重要作用。臭氧自体血治疗臭氧浓度为20~55 mg/L,通过活性氧物质 (ROS)和脂质过氧化物 (LOPs)激活免疫系统可能造成大量抗感染性因子〔IL-10、IL-12、IL-13、转化生长因子 (TGF-β)〕释放。Bocci等[18]和Sagai等[19]报道,体外实验臭氧1 min内能短暂性释放IL-8,通过H2O2短暂的上升从细胞外进入细胞液中,激活核因子 (NF)-κB抑制IL-8,清除ROS不能产生IL-8。本研究结果也支持臭氧促进血清IL-8水平降低,IL-8水平升高可能加重患者痛风疼痛的症状或者痛风发作。与此相反,臭氧自体血治疗期间患者均没有痛风急性发作,首先患者疼痛明显减轻后IL-8水平下降。可能慢性痛风患者的急性发作或持续疼痛的炎症机制与IL-8有关,IL-8是痛风的重要递质,也可能是痛风患者急性痛风发作和转归的预测因素。
本研究从细胞水平探讨了臭氧自体血治疗痛风缓解疼痛的可能机制,具有一定的创新性。存在的不足是患者对于治疗后抽血检查的依从性较差,导致研究患者例数较少;且本研究对象是痛风患者,设立正常对照组不符合伦理要求。因此,本研究在获得患者书面知情同意后,采用非随机、非对照、非盲开放的试验设计。
臭氧自体血治疗痛风缓解疼痛的细胞机制可能与抑制IL-8的释放或作用有关,目前尚没有临床试验评估IL-8治疗痛风的有效性;痛风患者的IgM与MSU结合是否促进MSU晶体沉积尚未得出结果。解决以上问题需进行长期、前瞻性和对照研究,且臭氧自体血治疗痛风缓解疼痛的确切机制也有待进一步研究。
[1] Hoffstein S,Weissmann G.Mechanisms of lysosomal enzyme release from leukocytes and interaction of monosodium urate crystals with dogfish and human leukocytes[J].Arthritis Rheum,1975,18(2):153-165.
[2] Quinn MT,Parthasarathy S,Fong LG,et al.Oxidatively modified low density lipoproteins:a potential role in recruitment and retention of monocyte/macrophages during atherogenesis[J].Proc Natl Acad Sci U S A,1987,84(9):2995-2998.
[3] Bocci V,Borrelli E,Travagli V,et al.The ozone paradox:ozone is a strong oxidant as well as a medical drug [J].Med Res Rev,2009,29(4):646-682.
[4] Cao GQ,Li XH,Wu BS,et al.Safety and efficacy of ozonated autologous blood in treatment of patients with gout[J].Chinese General Practice,2014,17(30):3609-3611.(in Chinese)
曹国庆,李秀华,武百山,等.臭氧化自体血治疗痛风患者疼痛的有效性和安全性研究 [J].中国全科医学,2014,17(30):3609-3611.
[5] Wallace KL,Riedel AA,Joseph-Ridge N,et al.Increasing prevalence of gout and hyperuri-cemia over 10 years among older adults in a managed care population [J].J Rheumatol,2004,31(8):1582-1587.
[6] ChoiHK, Ford ES.Prevalenceofthemetabolicsyndromein individuals with hyperuricemia[J].Am J Med,2007,120(5):442-447.
[7] KramerHM, Curhan G.The association between goutand nephrolithiasis:the National Health and Nutrition Examination SurveyⅢ,1988-1994 [J].Am J Kidney Dis,2002,40(1):37-42.
[8] Singh JA,Hodges JS,Toscano JP,et al.Quality of care for gout in the US needs improvement[J].Arthritis Rheum,2007,57(5):822-829.
[9] Fara N,Vazquez Mellado J,Sequeira G,et al.A survey on the current evaluation and treatment of gout in Buenos Aires,Argentina[J].Reumatol Clin,2012,8(6):306-309.
[10] Mikuls TR,Curtis JR,Allison JJ,et al.Medication errors with the use of allopurinol and colchicine:a retrospective study of a national,anonymous Internet-accessible error reporting system [J].J Rheumatol,2006,33(3):562-566.
[11] Neogi T,Hunter DJ,Chaisson CE,et al.Frequency and predictors of inappropriate management of recurrent gout attacks in a longitudinal study [J].J Rheumatol,2006,33(1):104-109.
[12] Kanevets U,Sharma K,Dresser K,et al.A role of IgM antibodies in monosodium urate crystal formation and associated adjuvanticity[J].J Immunol,2009,182(4):1912-1918.
[13] Gimbrone MA Jr, Obin MS, Brock AF, et al.Endothelial interleukin-8:a novel inhibitor of leukocyte-endothelial interactions[J].Science,1989,246(4937):1601-1603.
[14] DeForge LE,Fantone JC,Kenney JS,et al.Oxygen radical scavengers selectively inhibit interleukin 8 production in human whole blood [J].J Clin Invest,1992,90(5):2123-2129.
[15] DeForge LE,Preston AM,Takeuchi E,et al.Regulation of interleukin 8 gene expression by oxidant stress[J].J Biol Chem,1993,268(34):25568-25576.
[16] Nishimura A,Akahoshi T,Takahashi M,et al.Attenution of monosodium urate crystal-induced arthritis in rabbits by a neutralizing antibody against interleukin-8 [J].J Leuko Bio,1997,62(4):444-449.
[17] Dje N'Guessan P,Riediger F,Vardarova K,et al.Statins control oxidized LDL-mediated histone modifications and gene expression in cultured human endothelial cells[J].Arterioscler Thromb Vasc Biol,2009,29(3):380-386.
[18] Bocci V,Valacchi G,Corradeschi F,et al.Studies on the biological effects of ozone:Effects on the total antioxidant status and on interleukin-8 production [J].Mediators Inflammation,1998,7(5):313-317.
[19] Sagai M,Bocci V.Mechanisms of action involved in ozone therapy:is healing induced via a mild oxidative stress? [J].Med Gas Res,2011,20(1):29-31.

