藻毒素的生物降解研究进展
包子云,王沛芳,钱 进,乔 旭
(河海大学 a.浅水湖泊综合治理与资源开发教育部重点实验室; b.环境学院,南京 210098)
藻毒素的生物降解研究进展
包子云a,b,王沛芳a,b,钱 进a,b,乔 旭a,b
(河海大学 a.浅水湖泊综合治理与资源开发教育部重点实验室; b.环境学院,南京 210098)
近年来蓝藻水华污染产生的有毒代谢产物藻毒素对水生生态系统和人类健康构成严重的威胁。生物降解技术尤其是生物滤池由于运行维护费用低并且不产生有毒副产物,已广泛应用于去除藻毒素。然而,水处理过程中可能存在的生物降解多种藻毒素效果的信息少有收集,这在越来越多不同种类的藻毒素能同时在水源地中检测出来的情况下更加重要。综述了目前所有藻毒素生物降解性的相关研究进展,分析了影响藻毒素生物降解的因素,并探讨了目前藻毒素生物降解技术如何在水处理过程中应用优化去除藻毒素效果,为运用生物降解方法控制或去除各种藻毒素提供理论指导。
藻毒素;生物降解性;影响因素;生物降解技术 ;水华污染
近来全球气候变暖和水体富营养化现象加剧,极大地促进蓝藻在河湖水体中的生长[1],使水源地越来越频繁地形成蓝藻水华污染[2-3]。蓝藻水华对饮用水安全最大的威胁是其产生和释放的藻毒素。藻毒素主要分为3类:肝毒素(MC(Microcystin)、CYN(Cylindrospermopsin)和NOD(Nodularin))、神经毒素(ATX(Anatoxin-a)和STX(saxitoxin))及脂多糖内毒素。当前除MC生物降解研究已达到基因层面以外,其他藻毒素的生物降解研究都还相对缺乏。但是,越来越多不同种类的藻毒素能同时在水源地中检测出来[4],由于这些藻毒素结构较稳定以及自身低浓度高毒性的特点,常规水处理工艺很难有效去除,而生物处理方法由于去除藻毒素的运行维护费用低而且不产生有毒副产物而受到广泛关注[5]。本文从蓝藻各种藻毒素的生物降解性、影响生物降解的因素和生物降解技术如何在水处理过程中应用和优化去除藻毒素效果对国内外藻毒素生物降解研究现状及发展趋势进行综述。
1 藻毒素的生物降解性
生物降解藻毒素有成本低、安全性高、利于生态修复等优点, 研究藻毒素的生物降解性是应用生物降解去除藻毒素的前提,以下对蓝藻产生的3类藻毒素进行分类综述。
1.1 肝毒素
1.1.1 微囊藻毒素 (MC)
MC是7个氨基酸基团组成的单环七肽,其中2个氨基酸的可变动性导致MC多样性[6]。当可变动的2个氨基酸为亮氨酸和精氨酸(见图1),就形成了最常见变种MCLR。MC的毒性主要与肽环中Adda氨基酸(见图1)上的共轭二烯有关。生物体一旦摄入一定剂量的MC,就会在肝脏累积然后导致出血甚至几个小时内死亡。
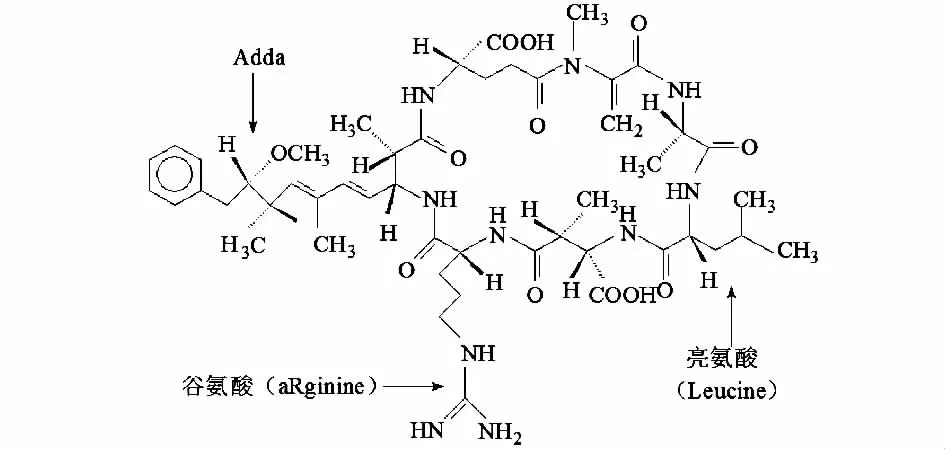
图1 微囊藻毒素LR (MCLR)分子结构
目前分离出的降解MC的微生物主要是鞘氨醇单胞菌属[7-13]。也有研究表明其他菌种降解MC的,如胡梁斌等[14]从被蓝藻水华污染的底泥中分离出一种甲基菌能有效降解MCLR,Manage等[15]鉴别了3种分离菌(节细菌属、短杆菌属和红球菌属)能有效降解MC;益生菌也能生物降解MC,如乳杆菌菌株GG和LC-705[16-17]、乳酸双歧杆菌菌株420和Bb12[17]以及胚芽乳杆菌菌株IS-10506和IS-20506[18]都能降解MC,但是益生菌无法彻底去除MC。现在对MC微生物降解途径已深入到降解基因的研究,如Bourne等[7]在被分离的MC降解菌鞘氨醇单胞菌ACM-3962的基因组中首次发现一个基因群:mlrA,mlrB,mlrC和mlrD涉及MCLR的降解。并认为mlrA基因编码的酶具有裂开或水解MCLR环状结构的特殊功能,然后形成的线性MCLR分子被mlrB和mlrC基因编码的蛋白酶水解,最后mlrD编译形成一个假定转运蛋白将MC降解产物转运出细胞。此后,大量研究通过设计聚合酶链反应(PCR)技术定性分析检测MC降解过程中的这些基因,特别是参与MC环结构裂开的mlrA基因[19-20]。Ho等[21]采用定量实时PCR技术分析检测废水中MCLR在生物砂滤降解过程中降解菌的丰度,Li等[22]也用这种技术分析检测冬季生物膜上的mlrA基因。这2个研究均表明MCLR的生物降解与降解菌丰度直接相关并依靠mlrA基因复制数量。虽然Bourne等[7]假设的MC降解途径已被证明,但是Manage等[15]无法从分离的降解菌中检测到mlr型基因,并认为微生物还存在其他途径或者包含其他基因来降解MC。此外,研究表明MC生物降解的副产物没有毒性。Harada等[8]从鞘氨醇单胞菌B9降解MCLR过程中鉴别出最终产物为Adda,并用蛋白磷酸酶抑制试验和小白鼠生物法确定这种产物不具有毒性。而Hyenstrand等[23]利用放射性同位素示踪法研究水体中 MCLR的生物降解,发现最终矿化产物是CO2。
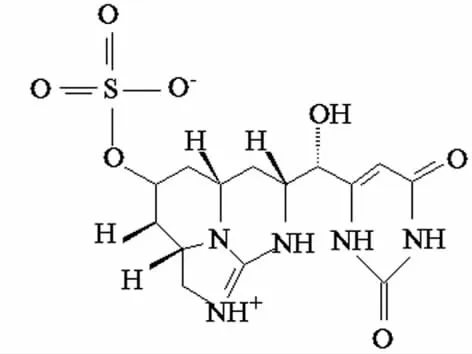
图2 柱孢藻毒素(CYN) 分子结构
1.1.2 柱孢藻毒素(CYN)
CYN是一种三环类生物碱(见图2)。产生CYN的菌株主要有柱孢藻、项圈藻、丝囊藻和束丝藻等[24]。CYN开始只在热带地区被检测出来,现在气候温和地区爆发的报道也增多[25-26]。有报道称用硫酸铜处理蓝藻水华会使蓝藻细胞裂解,释放大量CYN进入水体[27]。CYN会抑制蛋白合成,具有遗传毒性和潜在致癌性质[28]。
Senogles等[29]和Smith等[30]证明CYN可在自然水体中被微生物降解。Smith等[30]还发现初始CYN的浓度与生物降解率呈近似线性关系。Klitzke等[31]观测到沉积物对CYN的降解,并发现预处理的沉积物能加强CYN的生物降解,接着又研究低温和厌氧条件下沉淀中CYN的降解,并发现溶解有机碳会影响CYN生物降解的滞后期[32]。目前只有Mohamed等[33]从蓝藻水华污染地方分离出CYN降解微生物芽孢杆菌菌株(AMRI-03),并且该降解菌可降解MC,这说明该菌株的水解酶具有裂解2种藻毒素环状结构的功能。
1.1.3 节球藻毒素(NOD)
NOD是淡水中泡沫节球藻产生的一种具有强烈肝毒性的环状五肽次生代谢产物[34](见图3)。
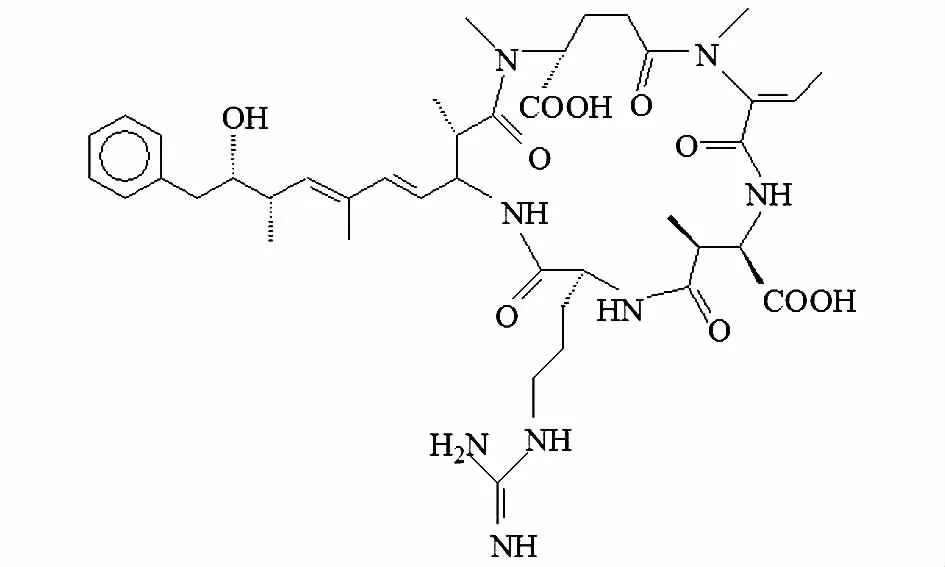
图3 节球藻毒素(NOD)分子结构
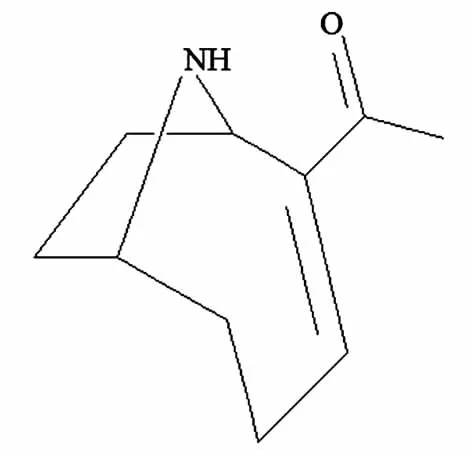
图4 类毒素-a (ATX) 分子结构
NOD能被生物降解且副产物为Adda氨基酸[35],Adda本身无毒, 但其立体结构为肝毒素活性和毒性作用所必需。有研究表明MC的降解微生物也有能力降解NOD[15,36],这是mlrA具有类似的裂解2种藻毒素环状结构的功能。Kato等[37]和Edwards等[38]检测到NOD经生物降解的副产物中含有线状NOD,支持了这一论点。Nodularin等[39]通过液质谱联用仪研究细菌降解NOD的过程,结果也表明降解酶是选择性水解精氨酸(Arg)与Adda肽键作为解开环肽结构初始重要步骤。NOD的毒性主要与其结构中Adda与Arg之间的空间关系有关,水解Arg-Adda肽键保证生物降解产物的无毒性。
1.2 神经毒素
1.2.1 类毒素-a (ATX)
ATX是一种低分子量的生物碱神经毒素,广泛存在于蓝藻生长和暴发的水体中,浓度与MC相当[40]。ATX酷似乙酰胆碱,包含胺和羰基2个基团(见图4),因其缺少酯部分而不易被酶解。ATX可持久刺激肌肉细胞并导致瘫痪,并能抑制呼吸而致死。Fawell等[41]建议ATX低于1 μg/L时可保证饮用水安全。
Rapala等[42]用原位采集的富含微生物的沉淀物对ATX进行降解试验, 证明ATX在自然水体中就能稳定被生物降解,但是应用生物活性滤池比自然状态下降解快。目前仅Kiviranta等[43]分离出一种假单胞菌能以2~10 μg/mL/d的速度降解ATX。
1.2.2 贝类毒素(STX)
STX主要由束丝藻、卷曲鱼腥藻、螺旋藻和柱孢藻产生[44]。STX能阻断神经细胞钠通道并在摄入较多情况下导致死亡。现在约有27种贝类毒素变体,最常见的是C-毒素、膝沟藻毒素(GTX)和贝类毒素(STX)。3种毒素中STX毒性最强(见表1),结构见图5。Fitzgerald等[45]提供STX的警报值为3 μg/L。
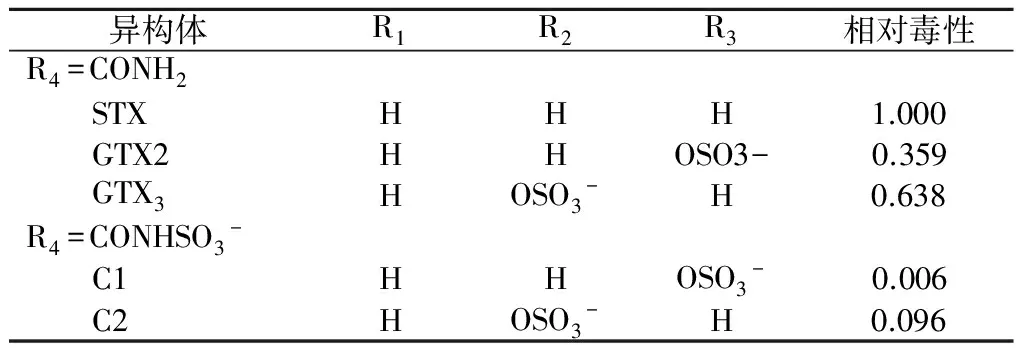
表1 贝类毒素的变种及毒性[46]
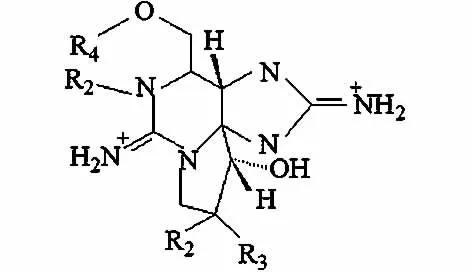
图5 贝类毒素(STX)分子结构图
Donovan等[47]从蓝贻贝的消化道中分离出的7个未知名细菌能够在1~3 d完全降解提取的STX,并且这些分离的细菌降解STX速率遵循一级动力学。但Kotaki等[48]发现某些细菌能转化贝类毒素,分离的一种假单孢菌和弧菌将GTX转化为更毒的STX。Kayal等[46]研究5种贝类毒素变种(C1,C2,GTX2,GTX3和STX) 通过生物活性含有砂和无烟煤滤料滤池时的降解情况,发现毒性较低的毒素C1和C2浓度下降,而毒性较高的另3种毒素浓度增加,而该5种贝类毒素变种通过只含砂的滤池时浓度没什么变化。作者推断无烟煤滤池生物膜内的微生物具有生物转化贝类毒素变种的能力。
1.3 脂多糖内毒素
脂多糖内毒素是蓝藻细胞壁的组成部分,由核心寡糖、脂A和O特异多糖组成。蓝藻脂多糖内毒素的脂A与格兰氏阴性细菌的脂多糖不完全相同,种类更多并且含有少量的磷酸。蓝藻内毒素可激活血管内皮细胞和肝Kupffer细胞等,并诱发炎性细胞因子及氧自由基等化学介质的释放,诱发肝脏等组织器官的严重损伤[49]。
蔡元锋等[50]从铜绿微囊藻培养液中提取脂多糖内毒素,接种太湖水华期微生物富集菌群后,多糖立即开始被降解, 虽然37 d后仍有一部分多糖未能被降解,但说明在自然界中内毒素是可以被微生物降解的。而Zhang Can等[51]发现常规饮用水处理工艺能去除63%的内毒素,高于生物活性炭滤池的去除率,这可能是因为降解其他种类藻毒素的菌种多为革兰氏阴性菌,细菌细胞壁就含有脂多糖内毒素成分,细菌死亡溶解后会释放这种毒素使得去除这种藻毒素的效率下降。
2 藻毒素生物降解的影响因素
藻毒素的生物降解不仅依赖降解微生物类型,其生长环境的影响也很重要。为更好地利用微生物降解藻毒素,还需研究影响微生物降解藻毒素的环境因素,为降解菌创造良好生长条件。
2.1 温 度
温度是各种藻毒素生物降解的一个关键影响因素。有文献表明MC的有效生物降解温度范围为(11~30)℃[20],并且30℃时降解速率最大。金丽娜等[52]也发现提高反应温度可加快MC 的生物降解反应速率。Smith等[29]研究表明CYN生物降解速率在25℃时达到最大,在20℃时明显降低。Ho等[53]测定澳大利亚水源地水样中的STX在24℃下的生物降解速率常数比14℃下的高。从这些研究可以推断在较低温度下的藻毒素生物降解速率会降低,而提高反应温度可以加快反应速率,因为细菌或者细菌产生的酶在较低温度时降解能力被抑制。
2.2 pH值
水体的酸碱性对于藻毒素的生物降解也有影响。Mohamed等[33]研究证明pH对芽孢杆菌AMRI-03降解CYN效能具有显著影响,当pH为7和8时有最大降解效率。陈彩云等[54]研究发现了pH为7时,假单胞菌M-6对MCLR有最大降解效率。而杨静东等[55]研究发现太湖水体中的土著菌群JSM004在弱碱条件下对MC有较强的降解活性。类似的,Okano等[56]在研究MC降解菌C-1在不同pH下降解MC时,发现在pH=10.0时,C-1依然具有降解活性。这些说明菌株在降解藻毒素过程中对环境酸碱度有一定要求,并且在中性及偏碱性环境下具有较高降解活性。
2.3 外加营养元素
营养源是菌体的生长所必需的,外加不同的碳氮源,也会影响菌体生长及对于藻毒素的降解情况。Eleuterio等[57]研究了从生物滤池中分离出的MC降解菌C25220菌,在不加和外加醋酸盐对MC的降解速度分别为13.8 μg/L/d和12.1 μg/L/d,降解速率受到抑制,推测原因是菌培养物更容易利用醋酸盐。Jones等[58]研究发现了在沉积物中加入乙酸盐和葡萄糖可以消除滞后期, 但是降解速率同时会下降。而Holst等[59]发现MCLR可从105 μg/L缺氧降解到13 μg/L(加NO3-),20 μg/L(加葡萄糖)和69 μg/L(不加碳氮源),这表明外加葡萄糖或硝酸盐都可以促进MCLR的缺氧降解。这相矛盾的结果可能是因为降解过程供氧条件不同,厌缺氧条件下微生物生长缓慢,需要外加碳源促进微生物生长,从而提高降解效率。
2.4 天然有机物
以前有研究者认为天然有机物的存在会降低生物降解藻毒素的效率,因为天然有机物一般是mg/L数量级,微生物会选择藻毒素作为次要酶作用物,而优先选择这些有机物作为主要酶作用物。而Ho等[21]却在一个三级废水处理中发现MC降解菌能以MCLR为主要酶作用物,这可能是因为藻毒素与天然有机物结合形成有机物复合物使其矿化作用增强,更易被细菌选择。Klitzke等[31]研究发现水体中存在溶解的天然有机物比蓝藻细胞裂解产生的有机物有较高的CYN降解率,并认为天然有机物可能通过某种底物特异性影响藻毒素的生物降解。Campinas等[60]研究表明分子大小接近MC的丹宁酸相对其他天然有机物对于MC降解的影响大,这进一步揭示天然有机物和藻毒素的竞争机制主要取决于分子大小的接近程度。
2.5 小 结
影响藻毒素生物降解的因素较多,在全球变暖背景下,温度是最主要的外部影响因子。研究温度和其他因素对于藻毒素的生物降解是相互协同还是拮抗作用是一个挑战。也许最佳的解决方案是在基因层面上去研究这些环境因素如何影响降解微生物,是否诱导或抑制合成在降解过程中所涉及的酶及基因的转录,这也将有助于进一步理解藻毒素开始生物降解前滞后期的起源。许多研究表明,微生物预先暴露于藻类毒素后能大幅度减少甚至消除滞后期。如Senogles等[28]研究发现了地表水土著细菌能在30 d内降解CYN到低于检测限且滞后期为15 d,而再次添加CYN到相同的样品后就没观测到滞后期。要理解再次接触藻毒素生物降解滞后期减少的原因就要理解为什么会存在滞后期。关于滞后期起源,有些学者认为是由于负责降解的小种群微生物需要时间增殖到一定数量才能开始有效降解藻毒素,另一些学者认为是需要时间让负责降解的酶被诱导。还可能是因为无机化合物供应不足或微生物优先同化吸收其他有机物等。也可能是上述原因的组合导致滞后期存在。滞后期是生物处理工艺应用,特别是去除瞬态藻毒素的一个主要障碍。需要进一步研究滞后期的起源,从而通过某种环境条件或者运行操作就能消除滞后期。
3 藻毒素生物降解技术
近些年来,利用生物滤池、人工湿地和生态浮床去除藻毒素已取得了显著的效果,但也存在些问题。
3.1 生物滤池
生物滤池是目前最好的利用微生物降解藻毒素方式。应用于生物滤池的媒介主要是砂和活性炭,也涉及其他的媒介如玻璃、多孔陶瓷和塑料等。生物滤池过滤媒介的颗粒大小,表面粗糙程度和物理化学成分等被证明是生物膜生长和生物去除藻毒素的重要影响因子[61-63]。McDowall等[61]认为过滤媒介颗粒越小去除蓝藻有毒代谢产物速率越大,且认为是由于比表面积增大使单位面积附着更多生物膜导致。Wang等[62]发现颗粒活性炭(GAC)是比砂更容易被细菌附着的载体,因为活性炭含有裂缝的粗糙表面能保护新附着的细菌承受较大的剪切力,有利于形成高效生物膜。另一个值得考虑的因素是媒介表面物理化学成分,特别是媒介表面存在的胞外聚合物(EPS)能加强表面细菌的附着从而加快藻毒素降解[63]。此外,生物滤池接触时间和水力负荷也对该工艺产生很大影响,理论上增加接触时间应该增加生物降解效率,但Ho等[64]发现MC通过砂滤池时,接触时间30 min和4 min生物降解情况没什么区别。不过应该指出的是,在2个接触时间下出流都没检测到MC,这掩盖了可能存在的区别。微生物的类型和浓度也直接影响生物滤池工艺去除藻毒素的效果,颗粒活性炭生物滤池凭借吸附和生物降解机制在去除藻毒素方面最具高效,其生物降解效率就取决于温度和初始细菌浓度[62]。McDowall等[63]证明在砂滤池中增加接种蓝藻代谢有臭产物降解菌后加强了对这种代谢产物的去除效率。这种直接采用微生物细胞或将提取的酶作为一种生物催化剂,通过接种达到高效去除藻毒素污染的目的是生物滤池去除藻毒素的优化控制方法。虽然生物滤池应用日臻成熟,但仍存在如下问题:
(1) 生物滤池生物降解产物的安全性,虽然研究证明MC生物降解的副产物没有毒性[7-8],但STX这种藻毒素在生物滤池中会发生生物转化形成更毒的变种,使出水比进水更具有毒性[46]。Zhang Can等[51]发现脂多糖内毒素在经过颗粒活性炭滤池时含量增加。因此,当处理水体中STX或内毒素浓度较大时,需要增设其他处理过程如高级氧化等优化对所有藻毒素的去除效果。
(2) 生物滤池之前不能预加氯,在澳大利亚南部一个饮用水处理厂原先采用的生物滤池能有效去除蓝藻代谢产物,但当加入氯胺进入生物滤池反冲洗水后,蓝藻代谢产物的去除效率立马下降[65],这是因为含氯消毒剂会严重危害过滤媒介上的生物膜,从而削弱甚至消除藻毒素生物降解[63,65]。因此,加氯消毒的步骤应在生物滤池之后的处理阶段。
3.2 人工湿地
人工湿地系统为处理水体中藻毒素提供了一种新思路,湿地中的沙石基质具有类似于活性炭的吸附作用,植物根区附近形成的生物膜有絮凝作用,湿地中丰富的微生物可降解藻毒素。而吴振斌等[66]建立人工湿地系统处理水华污染的城郊鱼塘水,对藻毒素含量0.117 g/L的进水,芦苇-水葱组合系统去除率为68.5%,茭白-石菖蒲组合系统去除率为34.6%。结果表明湿地植物组合对藻毒素的去除效果影响显著,可以通过优化湿地植物组合来提高去除藻毒素效果。此外这种技术还存在如下不足:
(1) 占地面积大,可将人工湿地修建成阶梯式,如我们实验室授权号为CN 1298934C的发明专利,景观型多级阶梯式人工湿地护坡成型方法,可有效节省用地。
(2) 当水力负荷较大时,人工湿地净化藻毒素的效果会不稳定[66]。随着水力负荷的升高,停留时间减少,部分吸附在生物膜表面的藻毒素未被降解即被出水带出,造成去除率下降。应当严格控制进水水力负荷或将该技术用于前处理。
3.3 生态浮床
生态浮床适用于原位修复,从源头治理水华的爆发和抑制藻毒素生成。其除藻毒素机理是通过浮床植物同藻类竞争光和营养物质,或通过根系向水中分泌有机物质来抑制藻类的繁殖,再减少水源中藻毒素的生成量[67]。宋海亮等[68]在太湖湖滨进行的水生植物滤床(HFB)研究结果表明该系统对总MC平均去除率为59.4%,而不同植物组合形式对总MC去除效果无显著差异,在水力负荷1.0~6.0 m3/(m2·d) 范围内,系统去除藻毒素效果也无显著差异,这相对于人工湿地已有很大改进,技术优化主要在于结合其他技术构成复合浮床。如Li X N等[69]采用植物,淡水蚌,生物填料构建复合生态浮床,在水力停留时间为7 d条件下对MC的去除率能达到77.4%,大大提高了生态浮床对于藻毒素的去除效率。该技术存在主要不足是风浪、流速太大会影响浮床床体稳定。可通过增设固定杆和消浪排等提升浮床稳定性,如我们实验室授权号为CN 101811778B的发明专利,一种适用于高泥沙大流速水体的生态浮床。
4 结语与展望
全球气候变暖将加大蓝藻水华的爆发强度和时间,如何高效去除蓝藻的代谢产物藻毒素仍然是热点问题。从目前国内外研究报道分析,采用高效微生物菌种降解是去除各种藻毒素的有效手段,并且合适的环境条件能有效缩短生物降解滞后期,加快降解藻毒素,当前生物滤池是重要的降解藻毒素的方法。根据国内外研究发展趋势,如下几个方面可能是未来研究的重点。
(1) 不同藻毒素的生物降解途径和分子机理:现有研究已揭示肝毒素(MC,CYN和NOD)的一种生物降解途径和分子机理,应通过分离纯化神经毒素(ATX和STX)及内毒素的降解菌中降解酶及其降解中间产物,进一步研究不同藻毒素的生物降解途径和分子机理。
(2) 微生物降解藻毒素滞后期的消除:滞后期的存在延长了生物降解藻毒素的时间,对利用微生物处理藻毒素不利,需研究通过某种环境条件或运行操作有效消除滞后期。
(3) 藻毒素的降解酶与基因:目前只确定了能降解MC的基因,今后应在分离纯化和识别出降解各种藻毒素的酶和基因的基础上,采用现代生物学和基因工程技术强化降解藻毒素基因的表达,在高效去除各种藻毒素基础和应用研究方面具有重要的价值。
[1]PAERL H W, OTTEN T G. Harmful Cyanobacterial Blooms: Causes, Consequences, and Controls[J]. Microbial Ecology, 2013,65(4):995-1010.
[2]PAERL H W,HUISMAN J.Climate Change:A Catalyst for Global Expansion of Harmful Cyanobacterial Blooms[J]. Environmental Microbiology Reports, 2009,1(1):27-37.
[3]PAERL H W, HALL N S, CALANDRINO E S. Controlling Harmful Cyanobacterial Blooms in a World Experiencing Anthropogenic and Climatic-induced Change[J]. Science of the Total Environment, 2011,409(10):1739-1745.
[4]GRAHAM J L,LOFTIN K A,MEYER M T,etal.Cyanotoxin Mixtures and Taste-and-odor Compounds in Cyanobacterial Blooms from the Midwestern United States[J].Environmental Science & Technology,2010,44(19):7361-7368.
[5]WESTRICK J A, SZLAG D C, SOUTHWELL B J,etal. A Review of Cyanobacteria and Cyanotoxins Removal/Inactivation in Drinking Water Treatment[J]. Analytical and Bioanalytical Chemistry, 2010, 397(5): 1705-1714.
[6]谢 平. 微囊藻毒素对人类健康影响相关研究的回顾[J]. 湖泊科学, 2009, 21(5): 603-613.(XIE Ping. A Review on the Studies Related to the Effects of Microcystins on Human Health[J]. Journal of Lake Sciences, 2009, 21(5):603-613. (in Chinese))
[7]BOURNE D G, RIDDLES P, JONES G J,etal. Characterisation of a Gene Cluster Involved in Bacterial Degradation of the Cyanobacterial Toxin Microcystin LR[J]. Environmental Toxicology, 2001,16(6):523-534.
[8]HARADA K,IMANISHI S,KATO H,etal. Isolation of Adda from Microcystin-LR by Microbial Degradation[J]. Toxicon, 2004,44(1):107-109.
[9]PARK H D, SASAKI Y, MARUYAMA T,etal. Degradation of the Cyanobacterial Hepatotoxin Microcystin by a New Bacterium Isolated from a Hypertrophic Lake[J]. Environmental Toxicology, 2001,16(4):337-343.
[10]MARUYAMA T, PARK H D,OZAWA K,etal. Sphingosinicella Microcystinivorans gen. nov., sp. nov., a Microcystin-Degrading Bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2006,56(1):85-89.
[11]ISHII H, NISHIJIMA M, ABE T. Characterization of Degradation Process of Cyanobacterial Hepatotoxins by a Gram-negative Aerobic Bacterium[J]. Water Research,2004, 38(11):2667-2676.
[12]ZHANG M,PAN G,YAN H.Microbial Biodegradation of Microcystin-RR by Bacterium Sphingopyxis USTB-05[J].Journal of Environmental Sciences, 2010,22(2):168-175.
[13]VALERIA A M,RICARDO E J,STEPHAN P,etal.Degradation of Microcystin-RR by Sphingomonas sp. CBA4 Isolated from San Roque Reservoir(Córdoba-Argentina)[J]. Biodegradation, 2006,17(5):447-455.
[14]HU L B,YANG J D, ZHOU W,etal. Isolation of a Methylobacillus that Degrades Microcystin Toxins Associated with Cyanobacteria[J]. New Biotechnology, 2009,26(3):205-211.
[15]MANAGE P M, EDWARDS C, SINGH B K,etal. Isolation and Identification of Novel Microcystin-degrading Bacteria[J]. Applied and Environmental Microbiology, 2009, 75(21):6924-6928.
[16]MERILUOTO J, GUEIMONDE M, HASKARD C A,etal. Removal of the Cyanobacterial Toxin Microcystin-LR by Human Probiotics[J].Toxicon, 2005,46(1):111-114.
[17]NYBOM S M K, SALMINEN S J, MERILUOTO J A O. Specific Strains of Probiotic Bacteria are Efficient in Removal of Several Different Cyanobacterial Toxins from Solution[J]. Toxicon, 2008,52(2):214-220.
[18]SURONO I S, COLLAADO M C, SALMINEN S,etal. Effect of Glucose and Incubation Temperature on Metabolically Active Lactobacillus plantarum from Dadih in Removing Microcystin-LR[J]. Food and Chemical Toxicology, 2008,46(2):502-507.
[19]SAITO T, OKANO K, PARK H D,etal. Detection and Sequencing of the Microcystin LR‐Degrading Gene, MlrA, from new Bacteria Isolated from Japanese Lakes[J]. FEMS Microbiology Letters, 2003,229(2):271-276.
[20]HO L, HOEFEL D, SAINT C P,etal. Isolation and Identification of a Novel Microcystin-Degrading Bacterium from a Biological Sand Filter[J]. Water Research, 2007,41(20):4685-4695.
[21]HO L,HOEFEL D,PALAZOT S,etal.Investigations into the Biodegradation of Microcystin-LR in Wastewaters[J]. Journal of Hazardous Materials, 2010,180(1):628-633.
[22]LI J, SHIMIZU K, MASEDA H,etal. Investigations into the Biodegradation of Microcystin-LR Mediated by the Biofilm in Wintertime from a Biological Treatment Facility in a Drinking-water Treatment Plant[J]. Bioresource Technology, 2012,106:27-35.
[23]HYENSTRAND P, ROHRLACK T, BEATTIE K A,etal. Laboratory Studies of Dissolved Radiolabelled Microcystin-LR in Lake Water[J]. Water Research, 2003,37(14):3299-3306.
[24]胡晨燕,魏金秀,叶 涛.饮用水中柱孢藻毒素与类毒素-A 控制研究进展[J].环境污染与防治,2012,34(12):74-79. (HU Chen-yan,WEI Jin-xiu,YE Tao. Research Progress in the Control of Cylindrospermopsin and Anatoxin-a in Drinking Water[J]. Environmental Pollution and Control, 2012, 34(12):74-79. (in Chinese))
[25]FASTNER J, RÜCKER J, STUEKEN A,etal. Occurrence of the Cyanobacterial Toxin Cylindrospermopsin in Northeast Germany[J]. Environmental Toxicology, 2007,22(1):26-32.
[26]SINHA R, PEARSON L A, DAVIS T W,etal. Increased Incidence of Cylindrospermopsis Raciborskii in Temperate Zones-Is Climate Change Responsible?[J].Water Research, 2012, 46(5):1408-1419.
[27]HAWKINS P R, RUNNEGAR M T, JACKSON A R,etal. Severe Hepatotoxicity Caused by the Tropical Cyanobacterium (Blue-green Alga) Cylindrospermopsis Raciborskii (Woloszynska) Seenaya and Subba Raju Isolated from a Domestic Water Supply Reservoir[J]. Applied and Environmental Microbiology, 1985,50(5):1292-1295.
[28]FROSCIO S M, HUMPAGE A R, BURCHAM P C,etal. Cell-free Protein Synthesis Inhibition Assay for the Cyanobacterial Toxin Cylindrospermopsin[J]. Environmental Toxicology, 2001,16(5):408-412.
[29]SENOGLES P, SMITH M J. Physical, Chemical and Biological Methods for the Degradation of the Cyanobacterial Toxin, Cylindrospermopsin[C]∥ Proceedings of the AWWA Water Quality Technology Conference & Exhibition. American Water Works Association, Seattle, WA, U.S.A., November 10-14, 2002:1-14.
[30]SMITH M J, SHAW G R, EAGLESHAM G K,etal. Elucidating the Factors Influencing the Biodegradation of Cylindrospermopsin in Drinking Water Sources[J]. Environmental Toxicology, 2008,23(3):413-421.
[31]KLITZKE S, APELT S, WEILER C,etal. Retention and Degradation of the Cyanobacterial Toxin Cylindrospermopsin in Sediments: The Role of Sediment Preconditioning and DOM Composition[J]. Toxicon, 2010,55(5):999-1007.
[32]KLITZKE S, FASTNER J. Cylindrospermopsin Degradation in Sediments: The Role of Temperature, Redox Conditions, and Dissolved Organic Carbon[J]. Water Research, 2012, 46(5):1549-1555.
[33]MOHAMED Z A, ALAMRI S A. Biodegradation of Cylindrospermopsin Toxin by Microcystin-degrading Bacteria Isolated from Cyanobacterial Blooms[J]. Toxicon, 2012, 60(8):1390-1395.
[36]LAWTON L, WELGAMAGE A, MANAAGE P,etal. Novel Bacterial Strains for the Removal of Microcystins from Drinking Water[J]. Water Science & Technology, 2011, 63(6): 1137-1142.
[37]KATO H, IMANISHI S Y, TSUJI K,etal. Microbial Degradation of Cyanobacterial Cyclic Peptides[J].Water Research, 2007,41(8):1754-1762.
[38]EDWARDS C, GRAHAM D, FOWLER N,etal. Biodegradation of Microcystins and Nodularin in Freshwaters[J]. Chemosphere, 2008, 73(8): 1315-1321.
[39]IMANISHI S, KATO H, MIZUNO M,etal. Bacterial Degradation of Microcystins and Nodularin[J]. Chemical Research in Toxicology, 2005, 18(3): 591-598.
[40]蔡俊鹏, 程 璐, 吴 冰, 等. 鱼腥藻毒素及其检测, 去除方法研究进展[J]. 水利渔业, 2006, 26(3): 2-6. (CAI Jun-peng, CHENG Lu, WU Bin,etal. Toxins in Anatoxins and the Relevant Measurement and Removal Methods[J]. Reservoir Fisheries, 2006, 26(3):2-6. (in Chinese))
[41]FAWELL J K, MITCHELL R E, HILL R E,etal. The Toxicity of Cyanobacterial Toxins in the Mouse: II Anatoxin-a[J]. Human & Experimental Toxicology,1999,18(3):168-173.
[42]RAPALA J, LAHTI K, SIVONEN K,etal. Biodegradability and Adsorption on Lake Sediments of Cyanobacterial Hepatotoxins and Anatoxin-a[J].Letters in Applied Microbiology, 1994,19(6):423-428.
[43]KIVIRANTA J, SIVONEN K, LAHTI K,etal. Production and Biodegradation of Cyanobacterial Toxins: A Laboratory Study[J].Archiv für Hydrobiologie,1991,121(3):281-294.
[44]刘智勇, 计 融. 麻痹性贝类毒素研究进展[J]. 中国热带医学, 2006, 6(2): 340-344. (LIU Zhi-yong, JI Rong. Advance in the Research of Paralytic Shellfish Poisons[J]. China Tropical Medicine, 2006, 6(2):340-344. (in Chinese))
[45]FITZGERALD D J, CUNLIFFE D A, BURCH M D. Development of Health Alerts for Cyanobacteria and Related Toxins in Drinking Water in South Australia[J]. Environmental Toxicology, 1999,14(1):203-209.
[46]KOTAKI Y. Screening of Bacteria which Convert Gonyautoxin 2, 3 to Saxitoxin[J]. Bulletin of the Japanese Society of Scientific Fisheries,1989,55:1239.
[47]DONOVAN C J, KU J C, QUILLIAM M A,etal. Bacterial Degradation of Paralytic Shellfish Toxins[J].Toxicon,2008, 52(1):91-100.
[48]KAYAL N, NEWCOMBE G, HO L. Investigating the Fate of Saxitoxins in Biologically Active Water Treatment Plant Filters[J]. Environmental Toxicology,2008,23(6):751-755.
[49]DUY T N, LAM P K S, SHAW G R,etal. Toxicology and Risk Assessment of Freshwater Cyanobacterial (Blue-green Algal) Toxins in Water[J]. Reviews of Environmental Contamination and Toxicology, 2000,163:113-186.
[50]蔡元锋, 施丽梅, 李朋富, 等. 与微囊藻胞外多糖降解相关的微生物菌群分析[J]. 湖泊科学, 2009, 21(3): 369-374. (CAI Yuan-feng, SHI Li-mei, LI Peng-fu,etal. Composition of Bacterial Community Related to Degrading the Exopolysaccharide from the Cyanobacterium Microcystis Aeruginosa[J]. Journal of Lake Sciences, 2009, 21(3): 369-374. (in Chinese))
[51]CAN Z, WENJUN L, WEN S,etal. Endotoxin Contamination and Control in Surface Water Sources and a Drinking Water Treatment Plant in Beijing, China[J]. Water Research, 2013, 47(17):3591-3599.
[52]金丽娜, 张维昊, 郑 利, 等. 滇池水环境中微囊藻毒素的生物降解[J]. 中国环境科学, 2002, 22(2): 189-192. (JIN Li-na, ZHANG Wei-hao, ZHENG Li,etal. Biodegradation of Microcystin in Dianchi Lake Aquatic Environment[J]. China Environmental Science, 2002, 22(2):189-192. (in Chinese))
[53]HO L, TANG T, HOEFEL D,etal. Determination of Rate Constants and Half-lives for the Simultaneous Biodegradation of Several Cyanobacterial Metabolites in Australian Source Waters[J]. Water Research, 2012, 46(17):5735-5746.
[54]陈彩云, 苑宝玲, 李艳波, 等. 假单胞菌降解微囊藻毒素的效能及酶作用机理[J]. 水生生物学报, 2009, 33(5): 951-956. (CHEN Cai-yun, YUAN Bao-ling, LI Yan-bo,etal. Biodegradation and Biomechanism of Microcystin-LR by Pseudomonadaceae[J]. Acta Hydrobiologica Sinica, 2009, 33(5): 951-956. (in Chinese))
[55]杨静东, 尹玉芬, 胡梁斌, 等. 微生物菌群 JSM004 对微囊藻毒素的生物降解[J]. 农业环境科学学报, 2009, 28(8): 1669-1675. (YANG Jing-dong, YIN Yu-fen, HU Liang-bin,etal. Biodegradation of Microcystins by Indigenous Mixed Bacterial Population JSM004[J]. Journal of Agro-environment Science, 2009, 28(8): 1669-1675. (in Chinese))
[56]OKANO K, SHIMIZU K, KAWAUCHI Y,etal. Characteristics of a Microcystin-degrading Bacterium under Alkaline Environmental Conditions[J]. Journal of Toxicology, 2009, 22: 1-8.
[57]ELEUTERIO L, BATISTA J R. Biodegradation Studies and Sequencing of Microcystin-LR Degrading Bacteria Isolated from a Drinking Water Biofilter and a Fresh Water Lake[J]. Toxicon, 2010,55(8):1434-1442.
[58]JONES G J, BOURNE D G, BLAKELEY R L,etal. Degradation of the Cyanobacterial Hepatotoxin Microcystin by Aquatic Bacteria[J].Natural Toxins,1994,2(4):228-235.
[59]HOLST T, NIELS O G J, CLAUS J,etal. Degradation of Microcystin in Sediments at Oxic and Anoxic, Denitrifying Conditions[J]. Water Research, 2003, 37(19): 4748-4760.
[60]CAMPINAS M, VIEGAS R, ROSA M J. Modelling and Understanding the Competitive Adsorption of Microcystins and Tannic Acid[J]. Water Research, 2013, 47(15): 5690-5699.
[61]MCDOWALL B, HO L,SAINT C,etal. Removal of Geosmin and 2-methylisoborneol through Biologically Active Sand Filters[J]. International Journal of Environment and Waste Management, 2007,1(4):311-320.
[62]WANG H, HO L, LEWIS D M,etal. Discriminating and Assessing Adsorption and Biodegradation Removal Mechanisms during Granular Activated Carbon Filtration of Microcystin Toxins[J]. Water Research,2007,41(18): 4262-4270.
[63]MCDOWALL B, HOEFEL D, NEWCOMBE G,etal. Enhancing the Biofiltration of Geosmin by Seeding Sand Filter Columns with a Consortium of Geosmin-degrading Bacteria[J]. Water Research, 2009,43(2):433-440.
[64]HO L, MEYN T, KEEGAN A,etal. Bacterial Degradation of Microcystin Toxins within a Biologically Active Sand filter[J]. Water Research, 2006,40(4):768-774.
[65]MCDOWALL B, HO L, SAINT C P,etal. Biological Removal of MIB and Geosmin Through Rapid Gravity Filters: A Biologically Active Sand Filter can Reduce Taste and Odour[J]. Journal of the Australian Water Association, 2007, 34(7): 48-54.
[66]吴振斌,陈辉蓉,雷腊梅,等.人工湿地系统去除藻毒素研究[J].长江流域资源与环境,2000,9(2):242-247.(WU Zhen-bin,CHEN Hui-rong,LEI La-mei,etal.Research on Removal of Algal Toxins by Artificial Wetland[J]. Resources and Environment in the Yangtze Basin, 2000, 9(2): 242-247. (in Chinese))[67]王伟涛. 饮用水中微囊藻毒素去除技术研究进展[J]. 贵州化工, 2009, 34(6):40-43.(WANG Wei-tao. Research Development on Technology of Removing Microcystins from Drinking Water[J]. Guizhou Chemical Industry, 2009, 34(6):40-43. (in Chinese))
[68]宋海亮, 李先宁, 吕锡武, 等. 水生植物滤床去除富营养化湖泊水中微囊藻毒素的研究[J]. 生态环境, 2006, 15(6): 1146-1150. (SONG Hai-liang, LI Xian-ning, LV Xi-wu,etal. Removal of Microcystins from Eutrophic Lake Water by Using Hydrophyte Filter Bed Eco-system[J]. Ecology and Environment, 2006, 15(6): 1146-1150. (in Chinese))
[69]LI X N, SONG H L, LI W,etal. An Integrated Ecological Floating-bed Employing Plant, Freshwater Clam and Biofilm Carrier for Purification of Eutrophic Water[J]. Ecological Engineering, 2010, 36(4): 382-390.
(编辑:赵卫兵)
Research Progress in Biodegradation of Cyanobacterial Toxins
BAO Zi-yun1,2, WANG Pei-fang1,2, QIAN Jin1,2, QIAO Xu1,2
(1.Key Laboratory of Integrated Regulation and Resources Development on Shallow Lakes of Ministry of Education, Hohai University, Nanjing 210098, China; 2.College of Environment, Hohai University, Nanjing 210098, China)
In recent years, toxic metabolites produced by pollution of cyanobacterial blooms pose a serious threat to aquatic ecosystem and human health. Biodegradation technologies especially biological filtration have been widely used to remove algal toxins due to low cost of operation and maintenance with no potentially harmful by-products. However, there is little information gathered with respect to the effectiveness of biological treatment for all kinds of cyanobacterical toxins. It is especially important due to multiple kinds of cyanobacterical toxins been detected simultaneously in water sources. In this paper, the research progress published to date on the biodegradation of cyanobacterial toxins in water is reviewed, and the factors which have impact on the biodegradation of these toxins are analysed. Moreover, this article also offers insights into how biological treatment options can be applied to get optimum effect of removing cyanobacterial toxins, in particular through biological filtration process. This research is aimed at providing a theoretical guidance for the application of biodegradation technologies to remove cyanobacterial toxins.
cyanobacterial toxin; biodegradation; influence factor; biodegradation technology; algal bloom pollution
2014-02-10;
2014-04-20
国家重大基础“973”研究项目(2010CB429006);国家水体污染控制与治理科技重大专项(2012ZX07101-008)
包子云(1989-),男,江苏常州人,硕士研究生,从事水环境保护与生态修复研究,(电话)15151845873 (电子信箱)baoziyun1024@163.com。
王沛芳(1973-),女,河北保定人,教授,从事水环境保护与生态修复研究,(电话)13701475568(电子信箱)pfwang2005@hhu.edu.cn。
10.3969/j.issn.1001-5485.2015.05.006
2015,32(05):28-36
X524
A
1001-5485(2015)05-0028-09

