中国丽赤壳属Calonectria真菌物种及遗传多样性
陈帅飞,刘倩丽,李洁琼,李国清,刘菲菲
(国家林业局桉树研究开发中心,广东 湛江 524022)
中国丽赤壳属Calonectria真菌物种及遗传多样性
陈帅飞,刘倩丽,李洁琼,李国清,刘菲菲
(国家林业局桉树研究开发中心,广东 湛江 524022)
丽赤壳属(Calonectria)真菌中含有一些在世界范围内分布广且危害大的病原菌。通过基于多基因序列的系统发育分析并结合形态学特征,我国共发现并鉴定了28个丽赤壳属物种,其中27个种是在桉树人工林叶片、桉树林下土壤或者桉树苗上发现。本文对我国丽赤壳属真菌的物种多样性以及遗传多样性进行了概述,对各个物种的形态特征、菌落特点、寄主范围、分布地域和危害特点等进行了详细的描述,并对未来我国丽赤壳属真菌的物种分类以及引起病害的防控研究提供了思路。
真菌病害;丽赤壳属;帚梗柱孢属;物种多样性;遗传多样性;桉树;病害防控
丽赤壳属真菌(属名 Calonectria,之前沿用Cylindrocladium-帚梗柱孢属作为其无性属名)隶属子囊菌门(Ascomycota)盘菌亚门(Pezizomycotina)粪壳菌纲(Sordariomycetes)肉座菌亚纲(Hypocreomycetidae)肉座菌目(Hypocreales)从赤壳科(Nectriaceae)[1-2]。丽赤壳属真菌中含有一些世界范围内广泛分布于不同气候类型和不同植物寄主上的病原菌[3-4]。丽赤壳属病原菌可以引起木本植物以及草本植物的一系列病害[3-4]。引起木本植物包括根系腐烂、茎干腐烂、叶部病斑及焦枯、叶部腐烂等病害的症状;引起草本植物尤其是农作物以及园艺植物包括根系或地下果实腐烂、茎部腐烂、叶部病斑及叶部腐烂等病害的症状[3-4]。
对病原菌物种进行准确的分类鉴定是病害防控的基础[1,5]。我国针对丽赤壳属真菌的分类鉴定研究比较有限,由于很多研究仅借助形态学特征对病原菌进行鉴定,导致不同种病原菌的鉴定混淆甚至出现错误,这在一定程度上阻碍我国丽赤壳属真菌的分类研究,并无法形成有针对性的病害防控措施。
目前,在世界范围内,主要采用多基因序列的系统发育分析,并结合形态学特征比较分析对丽赤壳属真菌物种进行分类鉴定[6-10]。进行系统发育比较分析的基因序列主要包括 ACT(actin)、BT(β -tublin)、CMDA(calmodulin)、HIS3(histon H3)、ITS(internal transcribed spacer)、LSU(28S large subunit RNA)和TEF-1α(translation elongation factor1-alpha)等基因序列[7-12];进行形态学比较的对象包括无性阶段结构和有性阶段结构,无性阶段结构主要包括分生孢子梗大小和分枝数,延伸梗长度,囊泡形状和大小,瓶梗大小和形状,无性孢子的类型、大小以及隔的数量;有性阶段结构主要包括子囊壳颜色,子囊形状和大小,子囊内子囊孢子数量,子囊孢子的大小以及隔的数量等[4,6-12]。
1 我国丽赤壳属真菌的物种多样性
目前,世界范围内通过多基因序列并结合形态学特征进行分类鉴定的丽赤壳属真菌共有 111个种,其中鉴定于我国的有28个种,包括我国桉树上的27个种以及睡莲上的1个种[6,8-9,11-12](表1)。丽赤壳属真菌分类中形态学比较关键结构包括囊泡形状,大无性孢子大小及隔的数量,子囊内子囊孢子数量,子囊孢子大小及隔的数量等。一般情况下,丽赤壳属真菌的无性阶段结构相对于有性阶段结构易于诱导产生,所以无性阶段的形态学比较普遍。对于丽赤壳属的无性阶段,囊泡的形状是对丽赤壳属真菌进行初步分类的最关键特征之一,我国丽赤壳属真菌的囊泡形状包括细棍棒形(Narrow clavate)、倒梨形(Obpyriform)、梨形(Pyriform)、宽棍棒形(Broadly clavate)、椭圆形(Ellipsoidal)以及球形(Sphaeropedunculate to globose)等[1,6,8-9]。而这些囊泡形状中,最易鉴别的是细棍棒形以及球形。根据囊泡的形状,可把我国丽赤壳属真菌归为3类:细棍棒状囊泡丽赤壳(Clavate Vesicle Calonectria spp.),球状囊泡丽赤壳(Sphaeropedunculate Vesicle Calonectria spp.);倒梨形囊泡丽赤壳(Obpyriform Vesicle Calonectria spp.)。本文中把梨形、宽棍棒形以及椭圆形囊泡丽赤壳真菌均归类至倒梨形囊泡丽赤壳真菌中。
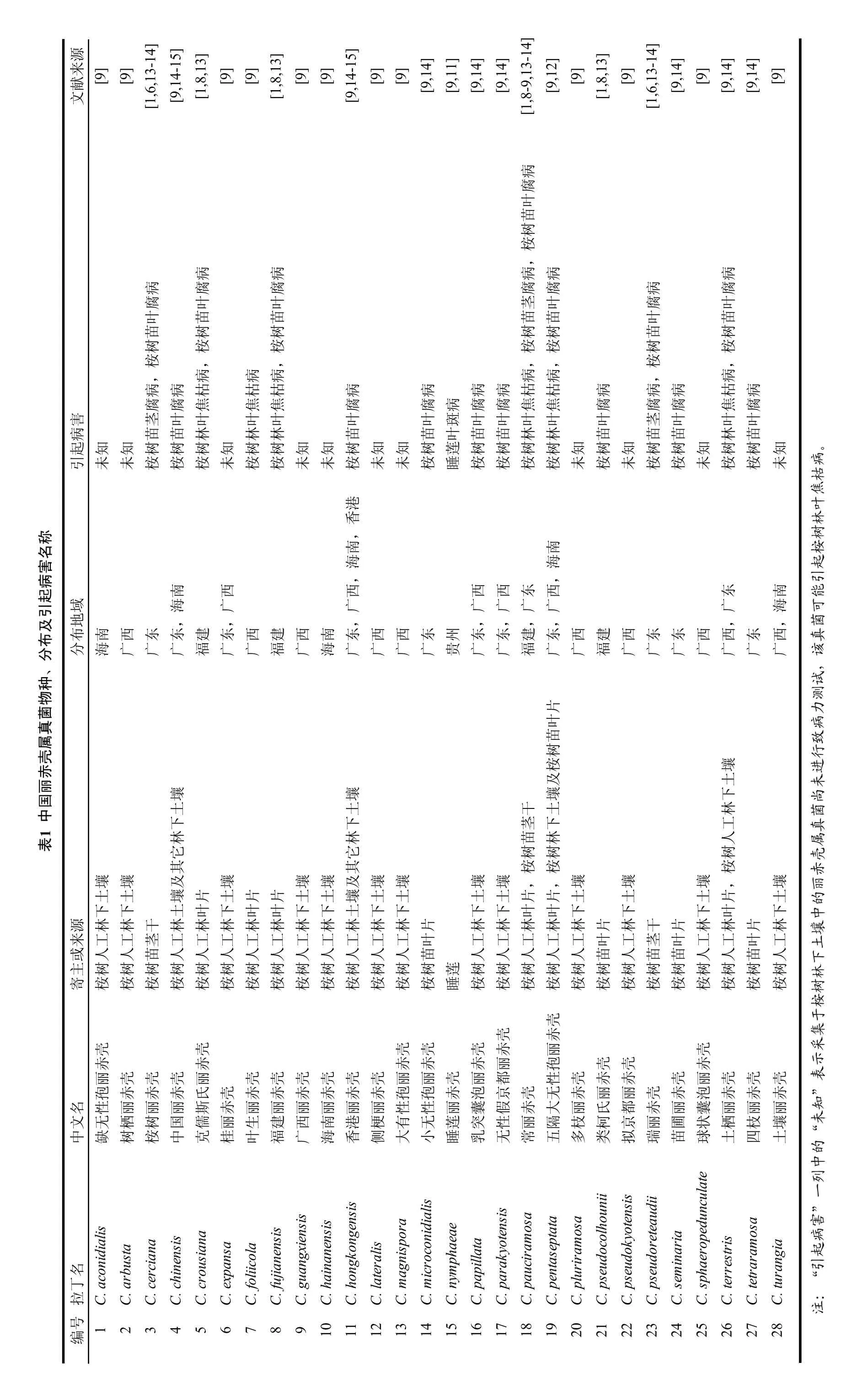
源来[9] [9] [9] [9] [9] [9] [9] [9] [9] [9] [9]文献[9] [1,6,13-14] [9,14-15] [1,8,13][1,8,13][9,14-15] [9,14][9,11][9,14][9,14][1,8-9,13-14] [9,12][1,8,13][1,6,13-14] [9,14][9,14][9,14]病腐叶苗树桉,病病病病病病腐腐腐腐病腐腐叶叶茎叶腐叶叶苗苗苗苗叶苗苗树树树树树苗树树桉桉桉桉桉桉桉,,,病,病,病,病,病病病病枯枯枯病病病病枯枯病病病枯病腐腐腐焦焦焦腐病腐焦焦腐腐腐焦腐害茎腐叶叶叶叶叶叶斑叶叶叶叶叶茎叶叶叶病苗苗林林林苗苗叶苗苗林林苗苗苗林苗起知知树树树知树树知知树知知树莲树树树树知树知树树知树树知引未未桉桉桉未桉桉未未桉未未桉睡桉桉桉桉未桉未桉桉未桉桉未港香,南南海海,,南西西西西东西东南域海广广广广广广广海地布,,,,,,,西建西东东西,西东,西分南海西广东广东广建福东广西广建福西广南海东广西广西广东广州贵东广东广建福东广广福广广广广广广广片叶苗树桉及壤土壤壤壤下土下土下干茎土下林工林人它林它苗树林树树桉其桉桉壤壤其壤及壤壤壤壤,,壤壤壤,壤土壤土及壤片壤土片片土土壤土土土土片片土土土片土下下土叶下叶叶下下土下下下下叶叶下下下叶下源林林干林林林林林林林林林林片林林林林林片林干片林林片林来或工工茎工工工工工工工工工工叶工工工工工人叶苗工人茎苗叶苗工人工人叶苗工人主人人苗人人人人人人人人人人苗人人人人树树树树树树树树树寄树桉树桉树桉树桉树桉树桉树桉树桉树桉树桉树桉树桉树桉树桉莲睡树桉树桉树桉树桉桉桉桉桉桉桉桉桉桉壳壳赤壳壳壳壳壳赤丽壳赤赤赤赤赤丽孢壳壳赤丽壳壳壳丽壳壳壳壳壳壳丽丽壳丽都性壳赤赤壳丽壳壳壳名孢赤赤赤氏壳赤赤赤赤赤赤孢孢赤泡京壳无赤丽丽氏丽都壳赤赤丽泡囊赤丽赤丽赤丽文性丽丽丽斯赤丽丽丽丽丽丽性性丽囊假赤大枝柯京丽圃状栖枝壤中C.aconidialis缺无C.arbusta树栖树桉C.chinensis中国C.crousiana克儒C.expansa桂丽C.foliicola叶生C.fujianensis福建西广C.hainanensis海南C.hongkongensis香港C.lateralis侧梗有大icroconidialis小无phaeae睡莲C.papillata乳突C.parakyotensis无性C.pauciramosa常丽隔五球土土名inaria苗丁agnispora拉C.cerciana C.guangxiensis C.mC.mC.nymC.pentaseptata C.pluriramosa多C.pseudocolhounii类C.pseudokyotensis拟C.pseudoreteaudii瑞C.semC.sphaeropedunculate C.terrestris C.tetraramosa四C.turangia号编1 2 3 4 5 6 7 8 9 10111213141516171819202122232425262728
基于多基因序列的分子系统发育分析结果表明囊泡形状相近的丽赤壳真菌具有相近的遗传进化关系[7,9-10]。本文进一步支持这一结论,通过四段基因序列的分子系统发育分析,结果表明在我国发现的28个丽赤壳属真菌根据囊泡形状归属于3个不同的囊泡形态组,而这 3个囊泡形态组内的各个物种相互之间进化地位相近,分属于 3个不同的分子系统进化组。其中包括Calonectria crousiana,C. fujianensis, C. microconidialis,C. nymphaeae,C. pentaseptata,C. pseudocolhounii以及C. pseudoreteaudii在内的7个种归属于细棍棒状囊泡丽赤壳(图 1);C. cerciana, C. foliicola, C. papillata, C. pauciramosa, C. seminaria, C. terrestris以及C. tetraramosa 共7个种属倒梨形囊泡丽赤壳(图2);其余14个种属于球形囊泡丽赤壳(图3)。
2 我国丽赤壳属真菌的危害
在我国已经鉴定的28个丽赤壳种分布于广东、广西、贵州、福建以及海南(表1)。野外病害调查和致病力测试结果表明大部分丽赤壳属真菌能导致相应寄主产生感病症状(表1),其中睡莲丽赤壳(C. nymphaeae)可引起睡莲叶部病斑[11];发现于桉树上的丽赤壳属真菌引起的桉树病害主要包括:桉树人工林叶焦枯病(图4),桉树苗茎腐病(图5)以及桉树苗叶腐病(图6)。
桉树人工林叶焦枯病广泛分布于广东、广西、福建以及海南等省区,是我国桉树人工林的重大病害之一[1,13,16-17]。很多情况下,丽赤壳属病原菌与其他叶部病原菌特别是畸腔菌科(Teratosphaeriaceae)以及球腔菌科(Mycosphaerellaceae)病原菌共同侵染桉树叶片,引起桉树人工林叶片严重感染(图4C),进而影响桉树的生长。桉树苗茎腐病和苗叶腐病主要分布于苗圃中,在育苗期、高温高湿的气候条件下,若桉树苗摆放过于密集引起通风不良则苗木极易感染该病害,丽赤壳属病原菌可以侵染生长旺盛的桉树苗的茎干基部引起桉树苗茎腐病,并很快引起苗木茎干坏死并最终导致苗木死亡(图5);丽赤壳属病原菌也可侵染健康叶片(包括苗木顶端的幼嫩叶片),导致叶片短期内腐烂,进而影响苗木生长和苗木质量,甚至导致苗木成片死亡(图6)。
3 我国丽赤壳属真菌物种简介
目前,在我国通过多基因序列并结合形态学特征进行分类鉴定的丽赤壳属真菌共有28个种,本文对我国丽赤壳属真菌的形态特征、菌落特点、寄主范围、分布地域和危害特点等进行了概述。
3.1 Calonectria aconidialis L. Lombard, Crous & S.F. Chen
病原中文名称:缺无性孢丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015(80):167-Figure 3[9].
形态特征:(1)有性阶段:子囊壳独生至两个簇生,橙色,成熟后呈橙棕色;子囊壳纵切显示基部红褐色,顶端和果体橙色,子囊壳近球形至卵形,高297 ~ 366 μm,横向直径232 ~ 304 μm;在3% KOH中,子囊壳壳体呈暗橙色至暗红色,基部暗红褐色;子囊壳壁粗糙,不光滑,由两层壁构成,外层壁呈球胞组织,厚37 ~ 75 μm,内层壁细胞呈挤压状,呈角胞组织,厚16 ~ 23 μm,内层细胞的细胞壁逐渐变薄而呈透明状;外层细胞大小为14–45×12–35 μm,内层细胞10–25×3–7 μm;子囊壳基部宽至150 μm,由暗红色、角形细胞聚合构成,基部以上形成独立突发的子座;子囊壳外层球胞组织细胞与子座的拟薄壁组织细胞连接。子囊含8个子囊孢子,棍棒状,111–113×15–18 μm,自上而下逐渐变细,下部成为一个细柄。子囊孢子聚生在子囊上端1/3部位,透明,表面有斑点,纺锤形,端部钝圆,子囊孢子笔直或者轻微弯曲,具1隔,有时孢子有隔部位轻微缢缩,(28–)32–40(–44)×5–7 μm (平均值:36×6 μm)。通过同宗配合产生有性孢子。(2)无性阶段:超大分生孢子、大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,温度24℃条件下,菌落生长快,菌丝向MEA培养基内部生长,培养基表面不产孢;7 d后菌落正面及背面呈白色至浅黄色。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,海南省。
标本信息:海南省,2009年8月,主模式标本:CBS H-21481,主模式标本上分离的菌株:CMW 35174 = CBS 136086 = CERC1850。
其他信息:尝试诱导C. aconidialis的无性态,未成功。C. aconidialis在MEA、SNA及MSA培养基上生长16 d内即产生子囊壳,子囊壳形成于培养基表面或埋生于培养基内部,20 d后释放出成熟的子囊孢子。
3.2 Calonectria arbusta L. Lombard, Crous & S.F. Chen
病原中文名称:树栖丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015(80):168-Figure 4[9].
形态特征:(1)有性阶段:子囊壳独生,橙色,成熟后呈橙棕色;子囊壳纵切显示基部红褐色,顶端和果体橙色,子囊壳近球形至卵形,高357 ~ 444 μm,横向直径276 ~ 391 μm;在3% KOH中,子囊壳壳体呈暗橙色至暗红色,基部暗红褐色;子囊壳壁粗糙,不光滑,由两层壁构成,外层壁呈球胞组织,厚37 ~ 66 μm,内层壁细胞呈挤压状,呈角胞组织,厚18 ~ 20 μm,内层细胞的细胞壁逐渐变薄而呈透明状;外层细胞大小为34–71×34–55 μm,内层细胞23–32×6–9 μm;子囊壳基部宽至137 μm,由暗红色、角形细胞聚合构成,基部以上形成独立突发的子座;子囊壳外层球胞组织细胞与子座的拟薄壁组织细胞连接。子囊含8个子囊孢子,棍棒状,97–119×16–19 μm,自上而下逐渐变细,下部成为一个细柄。子囊孢子聚生在子囊上端1/3部位,透明,表面有斑点,纺锤形,端部钝圆,子囊孢子笔直或者轻微弯曲,具1隔,孢子有隔部位轻微缢缩,(30–)35–41(–43)×5–7(–8) μm (平均值:38×7 μm)。通过同宗配合产生有性孢子。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,40–133×6–10 μm;组合体延伸梗具隔,笔直或者弯曲,长134 ~ 196 μm,终端隔处宽3 ~ 6 μm;终端具一球状囊泡,直径7 ~13 μm;横轴上(与主轴垂直)的组合体延伸梗量极大。产孢组合束长54 ~ 108 μm,宽58 ~ 151 μm;初级分枝无隔,18–42×5–8 μm;次级分枝无隔,10–27×4–7 μm;三级分枝无隔,9–18×3–6 μm;分枝可达到五级,均无隔,10–20×3–6 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,9–15×2–4 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(41–)42–48(–52)×4–6 μm (平均值:45×5 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量白色至浅黄色的气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广西区防城港市。
标本信息:广西区,2009年3月,主模式标本:CBS H-21482,主模式标本上分离的菌株:CMW 31370 = CBS 136079 = CERC 1705。
其他信息:与C. kyotensis相比,C. arbusta的产孢组合束、子囊孢子及大分生孢子均较大。
3.3 Calonectria cerciana L. Lombard, M.J. Wingf. & Crous
病原中文名称:桉树丽赤壳
引起病害名称:桉树苗Calonectria茎腐病,桉树苗Calonectria叶腐病
信息来源:陈帅飞.桉树科技,2014,31(1):51-52.[1]
3.4 Calonectria chinensis (Crous) L. Lombard, M.J. W ingf. & Crous
病原中文名称:中国丽赤壳
引起病害名称:桉树苗Calonectria叶腐病,可能引起桉树林Calonectria叶焦枯病
信息来源:Crous P W,Groenewald J Z,Risede J M,et al.Studies in Mycology,2004(50):421-Figure 11, 12.[15]
形态特征:(1)有性阶段:未发现。(2)无性阶段:分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,40–150×6–7 μm;组合体延伸梗具隔,笔直或者弯曲,长120 ~ 150 μm,终端隔处宽2.5 ~ 3.5 μm;终端具一球状囊泡,直径6 ~ 9 μm;延伸梗常见,与总梗垂直。产孢组合束长40 ~ 60 μm,宽40 ~ 60 μm;初级分枝无隔或具1隔,20–30×5–6 μm;次级分枝无隔,15–30×4–6 μm;三级分枝无隔,10–20×4–5 μm,每个终端分枝产2 ~ 4个产孢瓶梗,瓶梗长翁形或尿囊形,透明,无隔,10–20×3–4 μm,顶端呈轻微穹状并平周增厚,具不明显项领。分生孢子圆柱状,两端钝圆,孢子直线型,(38–)41–48(–56)×(3.5–)4(–4.5) μm (平均值:45×4 μm),具1隔,隔处不具明显可见的缢痕,分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,菌落生长快,在培养基表面形成大量白色至淡黄色的簇状气生菌丝;菌落表面呈赭色,菌落背面边缘处呈淡黄色,内部呈赭色,靠近中心处呈锈色。在MEA培养基上,温度25℃黑暗条件下,7 d后菌落直径达51 ~ 72 mm。
中国分离来源:桉树人工林(未知种或无性系)及其他一未知树木林下土壤。
中国寄主以及分布:桉树未知种,广东省、海南省;土壤,中国某一不详地区。
标本信息:中国,土壤,2000年,主模式标本:CBS 9887,主模式标本上分离的菌株:CPC 4101 = CBS 114827。
其他信息:Calonectria chinensis属于 Cylindrocladium floridanum组合体,仅发现于中国(包括香港)。可通过一系列的形态学特征将 C. chinensis与其他种进行区分,即该种具中等大小的分生孢子(平均值:45×4 μm),其产孢组合束分枝最多达三级,且其横轴上组合体延伸梗常见。
3.5 Calonectria crousiana S.F. Chen, L. Lombard, M.J. Wingf. & X.D. Zhou
病原中文名称:克儒斯氏丽赤壳
引起病害名称:桉树林Calonectria叶焦枯病,桉树苗Calonectria叶腐病
信息来源:陈帅飞.桉树科技,2014,31(1): 54-55.[1]
3.6 Calonectria expansa L. Lombard, Crous & S.F. Chen
病原中文名称:桂丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in M ycology,2015(80):169-Figure 5[9].
形态特征:(1)有性阶段:子囊壳独生,橙色,成熟后呈橙棕色;子囊壳纵切显示基部红褐色,顶端和果体橙色,子囊壳近球形至卵形,高310 ~ 520 μm,横向直径270 ~ 435 μm;在3% KOH中,子囊壳壳体呈暗橙色至暗红色,基部暗红褐色;子囊壳壁粗糙,不光滑,由两层壁构成,外层壁呈球胞组织,厚37 ~ 64 μm,内层壁细胞呈挤压状,呈角胞组织,厚13 ~ 25 μm,内层细胞的细胞壁逐渐变薄而呈透明状;外层细胞大小为13–31×9–20 μm,内层细胞9–18×3–5 μm;子囊壳基部宽至150 μm,由暗红色、角形细胞聚合构成,基部以上形成独立突发的子座;子囊壳外层球胞组织细胞与子座的拟薄壁组织细胞连接。子囊含8个子囊孢子,棍棒状,107–146×16–21 μm,自上而下逐渐变细,下部成为一个细柄。子囊孢子聚生在子囊上端1/3部位,透明,表面有斑点,纺锤形,端部钝圆,子囊孢子笔直或者轻微弯曲,具1隔,有时孢子有隔部位轻微缢缩,(33–)36–41(–44)×(4–)5–7 μm (平均值:39 ×6 μm)。通过同宗配合产生有性孢子。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,61–169×5–10 μm;组合体延伸梗具隔,笔直或者弯曲,长124 ~ 216 μm,终端隔处宽3 ~ 7 μm;终端具一球状囊泡,直径8 ~ 16 μm;横轴上(与主轴垂直)的组合体延伸梗量极大。产孢组合束长45 ~ 82 μm,宽26 ~ 116 μm;初级分枝无隔,18–29×5–7 μm;次级分枝无隔,12–22×4–7 μm;三级分枝无隔,9–16×3–6 μm;分枝可达到五级,均无隔,12–18×3–5 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,10–18×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(44–)48–52(–57)×4–6 μm (平均值:52×5 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的白色气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广东省、广西区。
标本信息:广西区,2009年3月,主模式标本:CBS H-21483,主模式标本上分离的菌株:CMW 31392 = CBS 136247 = CERC1727。
其他信息:与C. arbusta及C. kyotensis相比,C. expansa的大分生孢子较大,组合体延伸梗较长,通过以上特点可将C. arbusta与其余两个种区分开来。
3.7 Calonectria foliicola L. Lombard, Crous & S.F. Chen
病原中文名称:叶生丽赤壳引起病害名称:桉树林Calonectria叶焦枯病信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015,80:170-Figure 6[9].
形态特征:(1)有性阶段:未发现。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,47–190×6–12 μm;组合体延伸梗具隔,笔直或者弯曲,长 140 ~ 215 μm,终端隔处宽4 ~ 6 μm;终端具一倒梨形至椭圆形囊泡,直径6 ~ 13 μm。产孢组合束长59 ~ 130 μm,宽76 ~ 180 μm;初级分枝无隔,17–37×5–8 μm;次级分枝无隔,16–30×4–7 μm;三级分枝无隔,11–23×4–6 μm;分枝可达七级,均无隔,9–20×3–6 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,8–13×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(41–)44–50(–52)× (3–)4–5(–6) μm (平均值:47×5 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的白色气生菌丝和一些孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:尾巨桉(E. urophylla × E. grandis)人工林叶片。
中国寄主以及分布:尾巨桉,广西区。
标本信息:广西区,2009年3月,主模式标本:CBS H-21472,主模式标本上分离的菌株:CMW 31393 = CBS 136641 = CERC 1728。
其他信息:Calonectria foliicola与C. brasiliensis及C. sulawesiensis亲缘关系极近,C. foliicola的分生孢子梗分枝可达七级,通过该特征可将其与以上两个种区分开来。C. foliicola的大分生孢子相较于C. brasiliensis的大,较C. sulawesiensis的略小。
3.8 Calonectria fujianensis S.F. Chen, L. Lombard, M.J. W ingf. & X.D. Zhou
病原中文名称:福建丽赤壳
引起病害名称:桉树林Calonectria叶焦枯病,桉树苗Calonectria叶腐病
信息来源:陈帅飞.桉树科技,2014,31(1):55-56.[1]
3.9 Calonectria guangxiensis L. Lombard, Crous & S.F. Chen
病原中文名称:广西丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015(80):171-Figure 7[9].
形态特征:(1)有性阶段:子囊壳独生至两个簇生,橙色,成熟后呈橙棕色;子囊壳纵切显示基部红褐色,顶端和果体橙色,子囊壳近球形至卵形,高 295 ~ 435 μm,横向直径 265 ~ 355 μm;在3%KOH中,子囊壳壳体呈暗橙色至暗红色,基部暗红褐色;子囊壳壁粗糙,不光滑,由两层壁构成,外层壁呈球胞组织,厚32 ~ 80 μm,内层壁细胞呈挤压状,呈角胞组织,厚14 ~ 22 μm,内层细胞的细胞壁逐渐变薄而呈透明状;外层细胞大小为13–26×10–15 μm,内层细胞11–15×4–5 μm;子囊壳基部宽至175 μm,由暗红色、角形细胞聚合构成,基部以上形成独立突发的子座;子囊壳外层球胞组织细胞与子座的拟薄壁组织细胞连接。子囊含8个子囊孢子,棍棒状,83–146×15–23 μm,自上而下逐渐变细,下部成为一个细柄。子囊孢子聚生在子囊上端1/3部位,透明,表面有斑点,纺锤形,端部钝圆,子囊孢子笔直或者轻微弯曲,具1隔,孢子有隔部位轻微缢缩,(23–)32–40(–42)×5–7(–8) μm (平均值:36×6 μm)。通过同宗配合产生有性孢子。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,91–182×7–9 μm;组合体延伸梗具隔,笔直或者弯曲,长175 ~ 193 μm,终端隔处宽5 ~ 7 μm;终端具一球状囊泡,直径11 ~ 14 μm;横轴上(与主轴垂直)的组合体延伸梗量极少。产孢组合束长55 ~ 85 μm,宽31 ~ 95 μm;初级分枝无隔,17–26×4–7 μm;次级分枝无隔,10–19×3–6 μm;三级分枝无隔,9–17×2–5 μm;分枝可达四级,均无隔,12–16×3–5 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,8–19×3–7 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(42–)45–49(–52)×4–6 μm (平均值:47×5 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面的菌落边缘形成大量白色至淡黄色的气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广西区。
标本信息:广西区,2009年8月,主模式标本:CBS H-21484,主模式标本上分离的菌株:CMW 35409 = CBS 136092 = CERC 1900。
其他信息:Calonectria guangxiensis分生孢子梗分枝较少且横轴上组合体延伸梗量极少,易与 C. kyotensis组合体中的其他种进行区分。C. guangxiensis的大分生孢子相较于 C. expansa和 C. kyotensis的略小,较C. arbusta的略大。
3.10 Calonectria hainanensis L. Lombard, Crous & S.F. Chen
病原中文名称:海南丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in M ycology,2015(80):172-Figure 8[9].
形态特征:(1)有性阶段:子囊壳独生,橙色,成熟后呈橙棕色;子囊壳纵切显示基部红褐色,顶端和果体橙色,子囊壳近球形至卵形,高300 ~ 455 μm,横向直径230 ~ 385 μm;在3%KOH中,子囊壳壳体呈暗橙色至暗红色,基部暗红褐色;子囊壳壁粗糙,不光滑,由两层壁构成,外层壁呈球胞组织,厚30 ~ 64 μm,内层壁细胞呈挤压状,呈角胞组织,厚10 ~ 16 μm,内层细胞的细胞壁逐渐变薄而呈透明状;外层细胞大小为16–42×13–42 μm,内层细胞23–39×8–10 μm;子囊壳基部宽至262 μm,由暗红色、角形细胞聚合构成,基部以上形成独立突发的子座;子囊壳外层球胞组织细胞与子座的拟薄壁组织细胞连接。子囊含8个子囊孢子,棍棒状,91–110×15–22 μm,自上而下逐渐变细,下部成为一个细柄。子囊孢子聚生在子囊上端1/3部位,透明,表面有斑点,纺锤形,端部钝圆,子囊孢子笔直或者轻微弯曲,具1隔,有时孢子有隔部位轻微缢缩,(24–)30–38(–42)×(4–)5–7 μm (平均值:34×6 μm)。通过同宗配合产生有性孢子。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,66–106×8–14 μm;组合体延伸梗具隔,笔直或者弯曲,长 112 ~ 186 μm,终端隔处宽4 ~ 11 μm;终端具一球状囊泡,直径7 ~ 14 μm;横轴上(与主轴垂直)的组合体延伸梗量极大。产孢组合束长41 ~ 80 μm,宽54 ~ 119 μm;初级分枝无隔,18–28×5–9 μm;次级分枝无隔,12–21×5–8 μm;三级分枝无隔,10–19×3–6 μm;分枝可达五级,均无隔,9–15×3–5 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,10–17×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(41–)43–49(–52)×4–6 μm (平均值:46×5 μm),具 1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量白色至浅黄色的气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,海南省。
标本信息:海南省,2009年8月,主模式标本:CBS H-21480,主模式标本上分离的菌株:CMW 35187 = CBS 136248 = CERC 1863。
其他信息:Calonectria hainanensis与C. malesiana,两者的形态特征极其相似。C. hainanensis在培养时易产生大量可育的子囊壳,而 C. malesiana不具备这个特征。此外,与C. malesiana相比,C. hainanensis的分生孢子梗分枝较少,大分生孢子也较C. malesiana的略小。
3.11 Calonectria hongkongensis Crous
病原中文名称:香港丽赤壳
引起病害名称:桉树苗Calonectria叶腐病,可能引起桉树林Calonectria叶焦枯病
信息来源:Crous P W,Groenewald J Z,Risede J M,et al.Studies in Mycology,2004(50):423-Figure 23-29.[15]
形态特征:(1)有性阶段:子囊壳独生至三个簇生,橙色,成熟后呈红棕色;子囊壳纵切显示基部红褐色,顶端和果体橙色,子囊壳近球形至卵形,高 350 ~ 550 μm,横向直径 300 ~ 450 μm;在3%KOH中,子囊壳壳体呈红色,基部暗红褐色;子囊壳壁粗糙,不光滑,由两层壁构成,外层壁呈球胞组织,厚20 ~ 40 μm,内层壁细胞呈挤压状,呈角胞组织,厚10 ~ 15 μm,内层细胞的细胞壁逐渐变薄而呈透明状;外层细胞大小为 15–30×10–20 μm,内层细胞8–15×3–6 μm;子囊壳基部宽至150 μm,由暗红色、角形细胞聚合构成,基部以上形成独立突发的子座;子囊壳外层球胞组织细胞与子座的拟薄壁组织细胞连接。子囊含8个子囊孢子,棍棒状,80–140×14–20 μm,自上而下逐渐变细,下部成为一个细柄。子囊孢子聚生在子囊上端1/3部位,透明,表面有斑点,纺锤形,端部钝圆,子囊孢子笔直或者轻微弯曲,具1隔,孢子有隔部位具缢缩,(25–)28–35(–40)×(4–)5–6(–7) μm (平均值:31 ×6 μm)。通过同宗配合产生有性孢子。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,40–60×5–6 μm;组合体延伸梗具隔,笔直或者弯曲,长100 ~ 200 μm,终端隔处宽3 ~ 4 μm;终端具一球状囊泡,直径8 ~ 14 μm;横轴上(与主轴垂直)的组合体延伸梗量极大。产孢组合束长70 ~ 100 μm,宽70 ~ 120 μm;初级分枝无隔或具1隔,17–25×4–7 μm;次级分枝无隔,15–20×3–5 μm;三级分枝无隔,10–15× 3–5 μm;分枝可达八级,均无隔,8–15×3–4 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,9–15×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(38–)45–48(–53)×4(–4.5) μm (平均值:46.5×4 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:菌落边缘不规则呈羽状,培养基表面形成大量白色至赭色的气生菌丝;菌落表面呈铁锈色至淡白色。在MEA培养基上,温度25℃黑暗条件下,7 d后菌落直径达15 ~ 30 mm。
中国分离来源:桉树人工林(未知种或无性系)林下土壤,其他一未知树木林下土壤。
中国寄主以及分布:桉树未知种,广东省、海南省、广西区;一树木未知种,香港。
标本信息:香港,主模式标本:CBS 9886,主模式标本上分离的菌株:CPC 4670 = CBS 114828。
其他信息:Calonectria hongkongensis的产孢组合束分枝较多,可达8级,其产孢组合束长宽均可达100 μm。
3.12 Calonectria lateralis L. Lombard, Crous & S.F. Chen
病原中文名称:侧梗丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015(80):173-Figure 9[9].
形态特征:(1)有性阶段:未发现。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,55–185×4–8 μm;组合体延伸梗具隔,笔直或者弯曲,长 150 ~ 225 μm,终端隔处宽4 ~ 6 μm;终端具一球状囊泡,直径9 ~ 13 μm;横轴上(与主轴垂直)的组合体延伸梗量极大。产孢组合束长41 ~ 104 μm,宽43 ~ 138 μm;初级分枝无隔,17–28×4–7 μm;次级分枝无隔,11–26×3–7 μm;三级分枝无隔,8–20×3–6 μm;分枝可达六级,均无隔,8–17×3–5 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,7–13×2–4 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(35–)37–41(–44)×4–5 μm (平均值:39×4 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量白色至赭色的气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广西区防城港市。
标本信息:广西区,2009年8月,主模式标本:CBS H-21469,主模式标本上分离的菌株:CMW 31412 = CBS 136629 = CERC 1747。
其他信息:Calonectria lateralis与 C. hongkongensis,两者亲缘关系极近,与C. hongkongensis相比,C. lateralis的大分生孢子较小,组合体延伸梗较长,通过该特征可将其与C. hongkongensis区分开来。
3.13 Calonectria magnispora L. Lombard, Crous & S.F. Chen
病原中文名称:大有性孢丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in M ycology,2015(80):174-Figure 10[9].
形态特征:(1)有性阶段:子囊壳独生,橙色,成熟后呈橙棕色;子囊壳纵切显示基部红褐色,顶端和果体橙色,子囊壳近球形至卵形,高390 ~ 495 μm,横向直径315 ~ 410 μm;在3%KOH中,子囊壳壳体呈暗橙色至暗红色,基部暗红褐色;子囊壳壁粗糙,不光滑,由两层壁构成,外层壁呈球胞组织,厚53 ~ 91 μm,内层壁细胞呈挤压状,呈角胞组织,厚16 ~ 20 μm,内层细胞的细胞壁逐渐变薄而呈透明状;外层细胞大小为16–28×10–18 μm,内层细胞9–20×3–6 μm;子囊壳基部宽至166 μm,由暗红色、角形细胞聚合构成,基部以上形成独立突发的子座;子囊壳外层球胞组织细胞与子座的拟薄壁组织细胞连接。子囊含8个子囊孢子,棍棒状,91–125×14–17 μm,自上而下逐渐变细,下部成为一个细柄。子囊孢子聚生在子囊上端1/3部位,透明,表面有斑点,纺锤形,端部钝圆,子囊孢子笔直或者轻微弯曲,具1隔,孢子有隔部位无缢缩,(33–)36–44(–49)×5–7(–8) μm (平均值:40×6 μm)。通过同宗配合产生有性孢子。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,57–139×7–11 μm;组合体延伸梗具隔,笔直或者弯曲,长161 ~ 278 μm,终端隔处宽4 ~ 7 μm;终端具一球状囊泡,直径9 ~18 μm;横轴上(与主轴垂直)的组合体延伸梗量适中。产孢组合束长47 ~ 80 μm,宽47 ~ 95 μm;初级分枝无隔,18–35×5–9 μm;次级分枝无隔,13–23 ×3–7 μm;三级分枝无隔,10–19×3–5 μm;分枝可达四级,均无隔,12–16×3–5 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,8–16×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(46–)49–55(–60)×4–6(–7) μm (平均值:52×5 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的白色气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广西区。
标本信息:广西区,2009年8月,主模式标本:CBS H-21471,主模式标本上分离的菌株:CMW 35184 = CBS 136249 = CERC 1860。
其他信息:与 C. arbusta、C. expansa、C. guangxiensis、C. hainanensis及C. kyotensis相比,C. magnispora具较大子囊孢子和大分生孢子,其组合体延伸梗也较长,从而易与以上各个种进行区分。
3.14 Calonectria microconidialis L. Lombard, Crous & S.F. Chen
病原中文名称:小无性孢丽赤壳
引起病害名称:桉树苗Calonectria叶腐病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015(80):176-Figure 11[9].
形态特征:(1)有性阶段:未发现。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,59–195×7–11 μm;组合体延伸梗具隔,笔直或者弯曲,长 175 ~ 441 μm,终端隔处宽4 ~ 7 μm;终端具一窄形棍棒状囊泡,直径3 ~ 7 μm。产孢组合束长35 ~ 95 μm,宽26 ~ 92 μm;初级分枝无隔或具1隔,23–34×5–7 μm;次级分枝无隔,16–28×3–6 μm;三级分枝无隔,14–24×3–6 μm,每个终端分枝产1 ~ 3个产孢瓶梗,瓶梗圆柱状或尿囊形,透明,无隔,12–25 ×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(69–)78–98(–113)×7–9(–10) μm (平均值:88×8 μm),具4 ~ 6(–7)隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。小型分生孢子梗组合体具一些简单平行分枝,由总梗,扫帚状或近轮生状可育多分枝产孢组合束组成。组合体总梗具隔,透明光滑,53–86×7–8 μm;初级分枝无隔,呈直线型,19–26×4–5 μm;终端分枝产1 ~ 3个产孢瓶梗,瓶梗圆柱状或尿囊形,12–27×4–5 μm,顶端呈轻微穹状并平周增厚,具项领。小分生孢子圆柱状,直线型,孢子顶端钝圆,基部扁平,(23–)31–47(–58)×4–6(–7) μm (平均值:39×5 μm),具1 ~ 3隔,小分生孢子靠无色黏液聚集形成分生孢子束。超大分生孢子未见。
菌落特点:在MEA培养基上,菌落在温度24℃下生长缓慢,菌丝向培养基内部生长,形成白色至琥珀色边缘不规则的菌落,培养基表面产生大量孢子;7 d后培养基背面呈赭色至棕色。未发现厚垣孢子。
中国分离来源:尾巨桉幼苗叶片。
中国寄主以及分布:尾巨桉,广东省湛江市。
标本信息:广东省,2009年3月,主模式标本:CBS H-21473,主模式标本上分离的菌株:CMW 31487 = CBS 136638 = CERC 1822。
其他信息:Calonectria microconidialis属于C. reteaudii组合体(Lombard et al. 2010d, Crous et al. 2012)。C. microconidialis通过培养能够产生小型分生孢子梗组合体及小分生孢子,从而可以与 C. pentaseptata、C. queenslandica和C. terrae-reginae进行区分。C. microconidialis的小分生孢子和大分生孢子较C. reteaudii的略大,较C. pseudoreteaudii的略小。
3.15 Calonectria nymphaeae Yong Wang bis, S.Y. Qin, P. Tan & K.D. Hyde
病原中文名称:睡莲丽赤壳
引起病害名称:睡莲Calonectria叶斑病
信息来源:Xu J J,Qin S Y,Hao Y Y,et al.Mycotaxon,2012(122):182-Figure 2[11].
形态特征:(1)有性阶段:子囊壳独生至两个簇生,橙色至红色,成熟后呈橙棕色;子囊壳纵切显示基部红褐色,顶端和果体黄色至橙色,子囊壳近球形至卵形,高360 ~ 450 μm,横向直径320 ~ 380 μm;子囊壳壁粗糙,不光滑,由两层壁构成,外层壁呈球胞组织,厚30 ~ 60 μm,内层壁细胞呈挤压状,呈角胞组织,厚13 ~ 16 μm,内层细胞的细胞壁逐渐变薄而呈透明状;外层细胞大小为 28–35× 10–18 μm,内层细胞10–13×5–7 μm;子囊壳基部宽至90 ~ 100 μm,由暗红色、角形细胞聚合构成,基部以上形成独立突发的子座;子囊壳外层球胞组织细胞与子座的拟薄壁组织细胞连接。子囊含4个子囊孢子,棍棒状,100–145×12–16 μm,自上而下逐渐变细,下部成为一个细柄。子囊孢子聚生在子囊上端1/3部位,透明,表面有斑点,纺锤形,端部钝圆,子囊孢子笔直或者轻微弯曲,具 2 ~ 3隔,孢子有隔部位无缢缩或轻微缢缩,51–71× 5.5–6.5 μm (平均值:66×6.0 μm)。通过同宗配合产生有性孢子。(2)无性阶段:分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,250–300×3–4.5 μm;组合体延伸梗具隔,笔直或者弯曲,长120 ~ 240 μm,终端隔处宽3 ~ 5 μm;终端具一棍棒状囊泡,直径3 ~ 5 μm。产孢组合束长50 ~ 100 μm,宽30 ~ 70 μm;初级分枝无隔或具1隔,18–28×4–5 μm;次级分枝无隔,9–15×3–4 μm;三级分枝无隔,6–12×2.5–3.5 μm;每个终端分枝产2 ~ 4个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,9–12×2.5–3 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,55–63×5.3–6.3 μm (平均值:61×5.9 μm),具3 ~ 4隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。
中国分离来源:睡莲叶片。
中国寄主以及分布:睡莲,贵州省贵阳市。
标本信息:贵州省,贵阳市,2010年7月,主模式标本:HGUPd 100003,主模式标本上分离的菌株:HGUP 100003,CBS 131802。
其他信息:Calonectria nymphaeae与 C.colhounii组合体内的种极其相似,均具有黄色的子囊壳,子囊孢子具1 ~ 3隔,且无性阶段的囊泡均呈棍棒状。C. nymphaeae的形态学特征与 C. pseudocolhounii及C. fujianensis极其相似。然而,C. nymphaeae 的 大 分 生 孢 子 相 较 于 C. pseudocolhounii(平均值:60×4.5 μm)和 C. fujianensis(平均值:52.5×4.5 μm)的略大,其子囊孢子较C. pseudocolhounii(平均值:56×6.5 μm)和C. fujianensis(平均值:55.5×6.8 μm)的更长,更窄。此外,C. pseudocolhounii与C. fujianensis均分离自陆生寄主植物[邓恩桉(E. dunnii)和尾巨桉],然而C. nymphaeae分离自水生植物。
3.16 Calonectria papillata L. Lombard, Crous & S.F.Chen
病原中文名称:乳突囊泡丽赤壳
引起病害名称:桉树苗Calonectria叶腐病,可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015(80):177-Figure 12[9].
形态特征:(1)有性阶段:子囊壳独生,橙色,成熟后呈橙棕色;子囊壳纵切显示基部红褐色,顶端和果体橙色,子囊壳近球形至卵形,高425 ~ 455 μm,横向直径345 ~ 395 μm;在3%KOH中,子囊壳壳体呈暗橙色至暗红色,基部暗红褐色;子囊壳壁粗糙,不光滑,由两层壁构成,外层壁呈球胞组织,厚49 ~ 57 μm,内层壁细胞呈挤压状,呈角胞组织,厚21 ~ 22 μm,内层细胞的细胞壁逐渐变薄而呈透明状;外层细胞大小为25–52×21–38 μm,内层细胞11–21×5–9 μm;子囊壳基部宽至200 μm,由暗红色、角形细胞聚合构成,基部以上形成独立突发的子座;子囊壳外层球胞组织细胞与子座的拟薄壁组织细胞连接。子囊含8个子囊孢子,棍棒状,106–112×16–20 μm,自上而下逐渐变细,下部成为一个细柄。子囊孢子聚生在子囊上端1/3部位,透明,表面有斑点,纺锤形,端部钝圆,子囊孢子笔直或者轻微弯曲,具1隔,孢子有隔部位轻微缢缩,(27–)32–40(–46)×5–6(–7) μm (平均值:36×6 μm)。通过同宗配合产生有性孢子。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,54–245×6–11 μm;组合体延伸梗具隔,笔直或者弯曲,长 163 ~ 218 μm,终端隔处宽4 ~ 7 μm;终端具一倒梨形至椭圆形囊泡,囊泡顶端具乳状突起,直径8 ~ 14 μm。产孢组合束长33 ~ 82 μm,宽45 ~ 114 μm;初级分枝无隔,18–32×5–9 μm;次级分枝无隔,11–25×4–7 μm;三级分枝无隔,8–19×2–5 μm;分枝可达四级,均无隔,9–12×3–4 μm;每个终端分枝产2 ~ 4个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,7–16 ×3–4 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(40–)43–47(–50)×(3–)4–5 μm (平均值:45×4 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的白色气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广东省,广西区。
标本信息:广东省,2009年8月,主模式标本:CBS H-21487,主模式标本上分离的菌株:CMW 37976 = CBS 136097 = CERC 1939。
其他信息:Calonectria papillata组合体延伸梗终端的囊泡顶端具乳状突起,该特征可将其与 C. cerciana及C. terrestris进行区分。此外,C. papillata属同宗配合,而C. cerciana和C. terrestris均不具备这一特性。
3.17 Calonectria parakyotensis L. Lombard, Crous & S.F. Chen
病原中文名称:无性假京都丽赤壳
引起病害名称:桉树苗Calonectria叶腐病,可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al.Studies in Mycology,2015(80):178-Figure 13[9].
形态特征:(1)有性阶段:未发现。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,42–125×5–9 μm;组合体延伸梗具隔,笔直或者弯曲,长 135 ~ 210 μm,终端隔处宽4 ~ 6 μm;终端具一球状囊泡,直径10 ~ 14 μm;横轴上(与主轴垂直)的组合体延伸梗量极少。产孢组合束长41 ~ 84 μm,宽49 ~ 98 μm;初级分枝无隔,15–34×5–8 μm;次级分枝无隔,10–17×4–7 μm;三级分枝无隔,9–17×3–6 μm;分枝可达四级,均无隔,11–18×4–6 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,10–18×2–6 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(39–)42–46(–49)×4–5(–6) μm (平均值:44×5 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的白色气生菌丝和孢子;7 d后培养基背面呈赭色至肉桂色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广东省、广西区。
标本信息:广东省,2009年8月,主模式标本:CBS H-21470,主模式标本上分离的菌株:CMW 35169 = CBS 136085 = CERC 1845。
其他信息:Calonectria parakyotensis的分生孢子梗分枝较少且横轴上组合体延伸梗量极少,该特征可以将其与 C. kyotensis组合体中亲缘关系较近的几个种区分开来。
3.18 Calonectria pauciramosa C.L Schoch & Crous
病原中文名称:常丽赤壳
引起病害名称:桉树林Calonectria叶焦枯病,桉树苗Calonectria茎腐病,桉树苗Calonectria叶腐病
信息来源:陈帅飞.桉树科技,2014,31(1):53.[1]
3.19 Calonectria pentaseptata L. Lombard, M.J. Wingf., P.Q. Thu & Crous
病原中文名称:五隔大无性孢丽赤壳
引起病害名称:桉树林Calonectria叶焦枯病,桉树苗Calonectria叶腐病
信息来源:Crous P W,Shivas R G,Wingfield M J,et al.Persoonia,2012(29):156.[12]
形态特征:(1)有性阶段:未发现。(2)无性阶段:分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,47–133×6–10 μm;组合体延伸梗具隔,笔直或者弯曲,长 168 ~ 350 μm,终端隔处宽3 ~ 6 μm;终端具一窄棍棒状囊泡,直径2 ~ 6 μm。产孢组合束长70 ~ 99 μm,宽23 ~ 90 μm;初级分枝无隔或具1隔,19–31×4–7 μm;次级分枝无隔,16–34×4–7 μm;三级分枝无隔,14–22 ×4–6 μm,每个终端分枝产1 ~ 3个产孢瓶梗,逐一挑起,瓶梗呈圆柱状、尿囊形至倒梨形,透明,无隔,15–24×4–6 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(75–)87–109(–115)×(5–)6–8(–10) μm (平均值:98×7 μm),具5 ~ 8隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的气生菌丝和孢子;24℃黑暗条件下,1周后培养基表面呈赭色至黑砖色,背面呈乌贼棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)叶片、林下土壤以及桉树苗(未知种或无性系)。
中国寄主以及分布:桉树未知种,广西区,广东省,海南省。
标本信息:越南,河内,2011年9月,主模式标本:CBS H-21062,主模式标本上分离的菌株:CBS 133349。
其他信息:依据形态学特征及系统发育推论,将 C. pentaseptata归属于 C.reteaudii组合体。C. pentaseptata的大分生孢子(平均值:98×7 μm)相较于C. pseudoreteaudii(平均值:104×8 μm)的略小,较 C. queenslandica(平均值:69×6 μm)、C. reteaudii(平均值:84×6.5 μm)及C. terrae-reginae(平均值:76×6 μm)的略大。如C. queenslandica及C. terrae-reginae一样,C. pentaseptata不能产生小型分生孢子梗组合体和小分生孢子,而 C. pseudoreteaudii和C. reteaudii在培养基上极易产生该结构,因此通过该特征可将C. pseudoreteaudii和C. reteaudii与以上几种真菌区分开来.
3.20 Calonectria pluriramosa L. Lombard, Crous & S.F. Chen
病原中文名称:多枝丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al.Studies in Mycology,2015(80):179-Figure 14[9].
形态特征:(1)有性阶段:未发现。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,47–185×6–12 μm;组合体延伸梗具隔,笔直或者弯曲,长 140 ~ 215 μm,终端隔处宽4 ~ 6 μm;终端具一球状囊泡,直径6 ~ 13 μm;横轴上(与主轴垂直)的组合体延伸梗量极少。产孢组合束长59 ~ 127 μm,宽76 ~ 177 μm;初级分枝无隔或具1隔,17–37×5–8 μm;次级分枝无隔,16–30×4–7 μm;三级分枝无隔,11–23× 4–6 μm;分枝可达七级,均无隔,9–20×3–6 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,8–13×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(41–)44–50(–52)× (3–)4–5(–6) μm (平均值:47×5 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的白色至赭色气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广西区防城港市。
标本信息:广西区,2009年3月,主模式标本:CBS H-21485,主模式标本上分离的菌株:CMW 31440 = CBS 136976 = CERC 1775。
其他信息:Calonectria pluriramosa与 C. kyotensis和C. pseudokyotensis亲缘关系极近,因C. pluriramosa分生孢子梗具大量分枝,且其大分生孢子较C. kyotensis的大,利用以上特征可将其与C. kyotensis及C. pseudokyotensis进行区分。此外,与以上两个种不同的是,C. pluriramosa在培养时不能产生可发育的子囊壳。
3.21 Calonectria pseudocolhounii S.F. Chen, L. Lombard, M.J. Wingf. & X.D. Zhou
病原中文名称:类柯氏丽赤壳
引起病害名称:桉树苗Calonectria叶腐病
信息来源:陈帅飞.桉树科技,2014,31(1): 56-57.[1]
3.22 Calonectria pseudokyotensis L. Lombard, Crous & S.F. Chen
病原中文名称:拟京都丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al.Studies in M ycology,2015(80):180-Figure 15[9].
形态特征:(1)有性阶段:未发现。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,85–205×6–10 μm;组合体延伸梗具隔,笔直或者弯曲,长 145 ~ 320 μm,终端隔处宽5 ~ 7 μm;终端具一梨形至球状囊泡,直径10 ~ 13 μm;横轴上(与主轴垂直)的组合体延伸梗量适中。产孢组合束长76 ~ 109 μm,宽42 ~ 103 μm;初级分枝无隔或具1隔,24–40×5–8 μm;次级分枝无隔,14–32×5–7 μm;三级分枝无隔,13–25×4–6 μm;分枝可达四级,均无隔,14–24 ×4–6 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗长翁形、翁形至尿囊形,透明,无隔,10–20×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(43–)45–51(–53)×5–7 μm (平均值:48×6 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的白色气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广西区防城港市。
标本信息:广西区,2009年3月,主模式标本:CBS H-21774,主模式标本上分离的菌株:CMW 31439 = CBS 137332 = CERC 1774。
其他信息:与 C. kyotensis相比,C. pseudokyotensis的分生孢子梗可育分枝较少,组合体延伸梗较长;此外,C. pseudokyotensis的组合体延伸梗终端具一梨形至球状的囊泡,而未 C. kyotensis具球状囊泡。
3.23 Calonectria pseudoreteaudii L. Lombard, M.J. W ingf. & Crous
病原中文名称:瑞丽赤壳
引起病害名称:桉树苗Calonectria茎腐病,桉树苗Calonectria叶腐病
信息来源:陈帅飞.桉树科技,2014,31(1):53-54.[1]
3.24 Calonectria seminaria L. Lombard, Crous & S.F. Chen
病原中文名称:苗圃丽赤壳
引起病害名称:桉树苗Calonectria叶腐病
信息来源:Lombard L,Chen S F,Mou X,et al.Studies in Mycology,2015(80):181-Figure 16[9].
形态特征:(1)有性阶段:未发现。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,39–101×6–10 μm;组合体延伸梗具隔,笔直或者弯曲,长 105 ~ 185 μm,终端隔处宽4 ~ 7 μm;终端具一倒梨形至椭圆形囊泡,直径6 ~ 11 μm。产孢组合束长36 ~ 72 μm,宽31 ~ 155 μm;初级分枝无隔或具1隔,13–27×3–6 μm;次级分枝无隔,8–19×2–5 μm;三级分枝无隔,10–20×2–6 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,7–14×2–4 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(42–)45–49(–52)×3.5–4.5(–7) μm (平均值:47×5 μm),具 1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的白色气生菌丝和孢子;7 d后培养基背面呈琥珀色至乌贼棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:尾巨桉幼苗叶片。
中国寄主以及分布:尾巨桉,广东省湛江市。
标本信息:广东省,2009年3月,主模式标本:CBS H-21475,主模式标本上分离的菌株:CMW 31450 = CBS 136632 = CERC 1785。
其他信息:Calonectria seminaria属于 C. candelabra组合体,与C. pauciramosa及C. polizzii亲缘关系极近。C. seminaria的大分生孢子较 C. pauciramosa的略小,较C. polizzii的略大。
3.25 Calonectria sphaeropedunculata L. Lombard, Crous & S.F. Chen
病原中文名称:球状囊泡丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015(80):182-Figure 17[9].
形态特征:(1)有性阶段:子囊壳独生至两个簇生,橙色,成熟后呈橙棕色;子囊壳纵切显示基部红褐色,顶端和果体橙色,子囊壳近球形至卵形,高 470 ~ 575 μm,横向直径 345 ~ 465 μm;在3%KOH中,子囊壳壳体呈暗橙色至暗红色,基部暗红褐色;子囊壳壁粗糙,不光滑,由两层壁构成,外层壁呈球胞组织,厚40 ~ 80 μm,内层壁细胞呈挤压状,呈角胞组织,厚14 ~ 21 μm,内层细胞的细胞壁逐渐变薄而呈透明状;外层细胞大小为22–36×14–22 μm,内层细胞13–32×6–8 μm;子囊壳基部宽至216 μm,由暗红色、角形细胞聚合构成,基部以上形成独立突发的子座;子囊壳外层球胞组织细胞与子座的拟薄壁组织细胞连接。子囊含8个子囊孢子,棍棒状,82–144×11–23 μm,自上而下逐渐变细,下部成为一个细柄。子囊孢子聚生在子囊上端1/3部位,透明,表面有斑点,纺锤形,端部钝圆,子囊孢子笔直或者轻微弯曲,具1隔,孢子有隔部位不缢缩,(31–)33–40(–42)×5–7(–8) μm(平均值:37×6 μm)。通过同宗配合产生有性孢子。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,62–183×7–12 μm;组合体延伸梗具隔,笔直或者弯曲,长152 ~ 253 μm,终端隔处宽4 ~ 8 μm;终端具一球状囊泡,直径10 ~ 14 μm;横轴上(与主轴垂直)的组合体延伸梗量适中。产孢组合束长 40 ~111 μm,宽63 ~ 144 μm;初级分枝无隔或具1隔,18–36×4–10 μm;次级分枝无隔,11–29×5–9 μm;三级分枝无隔,14–23×5–8 μm;分枝可达六级,均无隔,9–19×4–7 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,9–17 ×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(40–)43–47(–49)×4–6 μm(平均值:46×5 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量白色至肉桂色的气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广西区。
标本信息:广西区,2009年3月,主模式标本:CBS H-21486,主模式标本上分离的菌株:CMW 31390 = CBS 136081 = CERC 1725。
其他信息:与C. kyotensis和C. pluriramosa相比,C. sphaeropedunculata的组合体延伸梗较长,但短于C. pseudokyotensis的组合体延伸梗。以上三个种的大分生孢子均大于C. sphaeropedunculata的大分生孢子。
3.26 Calonectria terrestris L. Lombard, Crous & S.F. Chen
病原中文名称:土栖丽赤壳
引起病害名称:桉树林Calonectria叶焦枯病,桉树苗Calonectria叶腐病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015(80):183-Figure 18[9].
形态特征:(1)有性阶段:未发现。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,35–185×6–10 μm;组合体延伸梗具隔,笔直或者弯曲,长 147 ~ 228 μm,终端隔处宽4 ~ 7 μm;终端具一倒梨形、梨形至宽棍棒形囊泡,直径5 ~ 12 μm。产孢组合束长35 ~ 102 μm,宽35 ~ 89 μm;初级分枝无隔,21–35 ×5–8 μm;次级分枝无隔,15–27×4–7 μm;三级分枝无隔,10–18×4–6 μm;分枝可达四级,均无隔,9–14×3–6 μm;每个终端分枝产2 ~ 4个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,8–12×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(33–)36–40(–41)×(3–)4–5 μm (平均值:38.5×4.5 μm),具 1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量白色至浅黄色的气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤,桉树林叶片。
中国寄主以及分布:桉树未知种,广东省,广西区。
标本信息:广东省,2009年8月,主模式标本:CBS H-21478,主模式标本上分离的菌株:CMW 35180 = CBS 136642 = CERC 1856。
其他信息:Calonectria terrestris可以通过囊泡的形状与C. cerciana及C. papillata进行区分,C. terrestris具倒梨形、梨形至宽棍棒形囊泡,而 C. cerciana的囊泡呈纺锤形至倒梨形,C. papillata具倒梨形至椭圆形囊泡,且囊泡顶端具一乳状突起。与C. cerciana和C. papillata的大分生孢子相比,C. terrestris的大分生孢子略小。
3.27 Calonectria tetraramosa L. Lombard, Crous & S.F. Chen
病原中文名称:四枝丽赤壳
引起病害名称:桉树苗Calonectria叶腐病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015(80):184-Figure 19[9].
形态特征:(1)有性阶段:未发现。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,47–109×6–9 μm;组合体延伸梗具隔,笔直或者弯曲,长 102 ~ 253 μm,终端隔处宽3 ~ 6 μm;终端具一倒梨形囊泡,直径4 ~ 10 μm。产孢组合束长36 ~ 75 μm,宽54 ~95 μm;初级分枝无隔,15–29×4–7 μm;次级分枝无隔,10–20×3–6 μm;三级分枝无隔,9–15×3–6 μm;分枝可达四级,均无隔,10–13×3–4 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗长翁形至尿囊形,透明,无隔,8–14×3–5 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(45–)46.5–49.5(–51)× (4–)4.5–5.5(–6) μm (平均值:48×5 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的白色气生菌丝和孢子;7 d后培养基背面呈琥珀色至乌贼棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:尾巨桉幼苗叶片。
中国寄主以及分布:尾巨桉,广东省湛江市。
标本信息:广东省,2009年3月,主模式标本:CBS H-21477,主模式标本上分离的菌株:CMW 31474 = CBS 136635 = CERC 1809。
其他信息:Calonectria tetraramosa属于 C. candelabra组合体,与C. pauciramosa、C. polizzii及C. seminaria亲缘关系极近。C. tetraramosa产孢组合束具四级分枝,而其他三个种无四级分枝。此外,C. tetraramosa的大分生孢子相较于 C. pauciramosa的略小,较C. polizzii的略大,与C. seminaria的最接近。且与该三个种相比,C. tetraramosa组合体延伸梗的长度更长。通过以上特征均能将C. tetraramosa与其余三个种区分开来。
3.28 Calonectria turangicola L. Lombard, Crous & S.F. Chen
病原中文名称:土壤丽赤壳
引起病害名称:可能引起桉树林Calonectria叶焦枯病
信息来源:Lombard L,Chen S F,Mou X,et al. Studies in Mycology,2015(80):185-Figure 20[9].
形态特征:(1)有性阶段:未发现。(2)无性阶段:大型分生孢子梗组合体由总梗,扫帚状可育多分枝产孢组合束,组合体延伸梗和延伸梗终端的囊泡组成。组合体总梗具隔,透明光滑,45–122×6–9 μm;组合体延伸梗具隔,笔直或者弯曲,长 133 ~ 195 μm,终端隔处宽4 ~ 6 μm;终端具一球状囊泡,直径8 ~ 12 μm;横轴上(与主轴垂直)的组合体延伸梗量极大。产孢组合束长35 ~ 86 μm,宽48 ~ 110 μm;初级分枝无隔,16–30×4–7 μm;次级分枝无隔,10–18×3–6 μm;三级分枝无隔,9–17×3–5 μm;分枝可达五级,均无隔,10–16×3–5 μm;每个终端分枝产2 ~ 6个产孢瓶梗,瓶梗翁形或尿囊形,透明,无隔,8–16×3–7 μm,顶端呈轻微穹状并平周增厚,具不明显项领。大分生孢子圆柱状,两端钝圆,孢子直线型,(40–)42–46(–47)×3–5 μm (平均值:44×4 μm),具1隔,隔处不具明显可见的缢痕,大分生孢子平行排列靠无色黏液聚集形成分生孢子束。超大分生孢子及小分生孢子未见。
菌落特点:在MEA培养基上,最适生长温度24℃下,菌落生长快,在培养基表面形成大量的白色至赭色气生菌丝和孢子;7 d后培养基背面呈赭色至棕色。菌落成熟后,产生大量厚垣孢子,并有微菌核生成。
中国分离来源:桉树人工林(未知种或无性系)林下土壤。
中国寄主以及分布:桉树未知种,广西区、海南省。
标本信息:广西区,2009年3月,主模式标本:CBS H-21488,主模式标本上分离的菌株:CMW 31411 = CBS 136077 = CERC 1746。
其他信息:Calonectria turangicola的大分生孢子相较于C. hongkongensis的略小,较C. lateralis的略大。
4 讨论
对病原菌进行准确的分类鉴定是病害病原菌的生物性状、病原菌种群结构、传播途径、流行规律以及病害综合防控等后续研究的基础。近年来,通过对我国桉树丽赤壳属真菌进行初步采集,并借助分子生物学结合形态学特征的方法,我国桉树丽赤壳属真菌得到了初步系统化的分类和鉴定[1,6,8-9,11-13,18]。
目前,在我国发现并鉴定的丽赤壳属真菌共有28个种,其中27个种分布于桉树上[6,8-9,11-12]。丽赤壳属真菌给世界桉树人工林带来的危害比较严重,特别是南美以及东南亚地区[19-20]。目前我国桉树人工林面积已经达到460万hm2,由丽赤壳属病原菌引起的桉树叶焦枯病是我国桉树人工林的重大病害之一,丽赤壳属病原菌对我国桉树人工林危害程度之大可能与其在我国的物种多样性高具有一定的相关性,因病原菌对寄主的致病性是病原菌与寄主之间长期相互作用的结果,丽赤壳属真菌在我国可能已经进化相当长的时间,对丽赤壳属病原菌的研究应予足够的重视。
林木病害的防控是一个复杂的系统工程。目前我国桉树由丽赤壳属真菌引起的病害有桉树人工林叶焦枯病、桉树苗茎腐病和桉树苗叶腐病。前期研究表明丽赤壳属某些病原菌可在苗圃和人工林之间交叉侵染桉树,同时引起多种病害,如C. cerciana和C. pseudoreteaudii可引起桉树苗茎腐病和苗叶腐病,C. crousiana, C. fujianensis, C. pentaseptata和C. terrestris可引起桉树林叶焦枯病和桉树苗叶腐病,C. pauciramosa可引起桉树林叶焦枯病、桉树苗茎腐病以及苗叶腐病。因此,要避免病原菌在苗圃和人工林之间的传播[21]。在野外调查中发现不同桉树无性系对丽赤壳属病原菌的感病性具有明显差异,前期研究也发现不同桉树无性系叶片对丽赤壳属病原菌的抗性具有显著差异[14],这为抗丽赤壳属病原菌无性系的选育提供了理论基础。未来,抗病桉树无性系的选育是防控桉树人工林叶焦枯病的一条有效途径。研究表明,一些杀菌剂可明显抑制丽赤壳属病原菌的生长[22-25],且不同杀菌剂对丽赤壳属病原菌的抑制效果差异显著[22-25],因此,选择合适的杀菌剂是对丽赤壳属真菌引起的植物苗期病害包括桉树苗茎腐病以及叶腐病进行防控的措施之一。
在我国,除了桉树上发现的 27个丽赤壳属物种[6,8-9],仅有C. nymphaeae被分离于贵州省的睡莲叶片上[11]。在世界范围内,丽赤壳属具有广泛的寄主,我国也有一些针对丽赤壳属病原菌在其他寄主上的报道,这些针对丽赤壳属病原菌的鉴定大多仅仅依据形态学[26-29]。多基因序列的分子系统发育分析为病原菌物种的准确比较和鉴定提供了一条有效途径,未来有必要强化分子生物学手段在我国丽赤壳属病原菌分类鉴定上的应用,进而为特定病原菌引起特定病害的防控提供依据。
丽赤壳属真菌包含了一些在世界范围内分布广、危害大的病原菌,而我国针对丽赤壳属病原菌的研究相对有限。未来需要对丽赤壳属真菌在我国的分布进行系统的调查,阐明不同地域不同寄主上的物种多样性及分布,这是防控丽赤壳属病原菌对农作物以及林木危害的前提和基础。针对由丽赤壳属真菌在我国桉树上引起的重要病害,有必要对分布于我国桉树上的丽赤壳属病原菌进行大空间区域内的系统采集,了解病原菌的物种多样性和种群多样性,揭示物种差异以及种群差异对其寄主致病性的影响特点,并进一步深入了解分布广且危害大的丽赤壳属病原菌致病基因与寄主抗病性之间的互作效应,进而指导抗病桉树无性系的选育,并整合以上研究成果制定病害防控的综合策略。
[1] 陈帅飞.中国桉树真菌病原汇录:2006—2013[J].桉树科技,2014,31(1):37–64.
[2] Lombard L,Merwe N A van der,Groenewald J Z,et al.Generic concepts in Nectriaceae[J].Studies in Mycology,2015(80):189–245.
[3] Crous P W.Taxonomy and pathology of Cylindrocladium(Calonectria) and allied genera[M].St. Paul,M innesota, U.S.A.:APS Press,2002.
[4] Lombard L,Crous P W,Wingfield B D,et al.Species concepts in Calonectria (Cylindrocladium)[J].Studies in Mycology,2010,66(1):1–14.
[5] Wingfield M J,Roux J,Slippers B, et al.Established and new technologies reduce increasing pest and pathogen threats to Eucalypt plantations[J].Forest Ecology and Management,2013(301):35–42.
[6] Lombard L,Zhou X D,Crous P W,et al.Calonectria species associated w ith cutting rot of Eucalyptus[J]. Persoonia, 2010,24(1):1–11.
[7] Lombard L,Crous P W,Wingfield B D,et al.Phylogeny and systematics of the genus Calonectria[J].Studies in Mycology,2010,66(1):31–69.
[8] Chen S F,Lombard L,Roux J, et al.Novel species of Calonectria associated w ith Eucalyptus leaf blight in Southeast China[J].Persoonia,2011(26):1–12.
[9] Lombard L,Chen S F,Mou X T,et al.New species, hyper-diversity and potential importance of Calonectria spp. from Eucalyptus in South China[J].Studies in Mycology,2015(80):151–188.
[10] Alfenas R F,Lombard L,Pereira O L,et al.Diversity and potential impact of Calonectria species in Eucalyptus plantations in Brazil[J].Studies in Mycology,2015(80): 89–130.
[11] Xu J J,Qin S Y,Hao Y Y,et al.A new species of Calonectria causing leaf disease of water lily in China [J].Mycotaxon,2012(122):177–185.
[12] Crous P W,Shivas R G,Wingfield M J,et al.Fungal Planet description heets:128–153[J].Persoonia,2012(29):146–201.
[13] 李国清,陈帅飞,吴志华,等.中国桉树焦枯病病原菌多样性及致病力初步分析[J].热带作物学报,2014,35(6):1183–1191.
[14] 李国清,李洁琼,刘菲菲,等.12种桉树焦枯病病原菌对10种桉树无性系致病力初步分析[J].桉树科技,2014,31(4): 1–7.
[15] Crous P W,Groenewald J Z,Rised J,et al.Calonectria species and their Cylindrocladium anamorphs: species w ith sphaeropedunculate vesicles[J].Studies in Mycology, 2004(50):415–430.
[16] 蒙美琼.桉树的严重病害—焦枯病[J].广西林业,1993 (6):20.
[17] 朱建华,郭文硕,吴建勤,等.桉树焦枯病防治技术研究[J].福建林业科技,2011,38(3):41–47,87.
[18] 陈全助,郭文硕,叶小真,等.福建省桉树焦枯病菌分类鉴定[J].福建林学院学报,2013,33(2):176–182.
[19] Rodas C A,Lombard L,Gryzenhout M,et al. Cylindrocladium blight of Eucalyptus in Colombia[J]. Australasian Plant Pathology,2005(34):143–149.
[20] Old K M,Wingfield M J,Yuan Z Q. A Manual of Diseases of Eucalypts in South-East Asia[M].Indonesia:Centre for International Forestry Research,2003.
[21] 陈帅飞.林木病原菌的传播途径概述[J].桉树科技,2014, 31(2):50–56.
[22] 李国清,陈帅飞,刘菲菲,等.6种杀菌剂对不同桉树焦枯病病原菌的室内毒力测定[J].桉树科技,2014,31(2):1–9.
[23] Henricot B,Gorton C,Denton G,et al.Studies on the control of Cylindrocladium buxicola using fungicides and host resistance[J].Plant Disease,2008,92(9):1273–1279.
[24] Aiello D,Cirvilleri G,Polizzi G,et al.Effects of fungicide treatments for the control of epidemic and exotic Calonectria diseases in Italy[J].Plant Disease,2013,97(1):37–43.
[25] LaMondia J A.Management of Calonectria pseudonaviculata in boxwood w ith fungicides and less susceptible host species and varieties[J].Plant Disease,2015,99(3):363–369.
[26] 郑晓慧,戚佩坤,姜子德.广州地区天南星科观赏植物上的几种新真菌病害—Ⅱ[J].华南农业大学学报,2001, 22(2):39–41.
[27] 庄文远,吴志珍,曾忠坚.枇杷根腐病的发生与防治技术[J].广西植保,2002,15(1):8–9.
[28] Ma Z H,Zhang Z D,Wang Y X,et al.Cylindrocladium crotalariae causing red crown rot of soybean in China[J].Plant Pathology,2004,53(4):537.
[29] 谢昌平,洪玉凤.鹤望兰叶斑病的鉴定及生物学特性[J].热带作物学报,2005,26(3):91–95.
Species and Genetic Diversity of Calonectria spp. in China
CHEN Shuai-fei, LIU Qian-li, LI Jie-qiong, LI Guo-qing, LIU Fei-fei
(China Eucalypt Research Centre, Zhanjiang 524022, Guangdong, China)
Species of the genus Calonectria include important pathogens of many plant hosts worldwide. Based on multiple-gene phylogenetic analyses and morphological characteristics, 28 species of Calonectria were identified and reported in China, and 27 of them were associated with Eucalyptus species. In this study, the species and genetic diversity of these Calonectria species are summarized. For each of the 28 species, a concise description is provided of its: morphological characteristics; culture morphology; host range; geographical distribution and damage characteristics. Furthermore, the methods for further identification of Calonectria species as well as disease control of Eucalyptus spp. caused by Calonectria spp. are briefly discussed.
fungal disease; Calonectria; Cylindrocladium; species diversity; genetic diversity; Eucalyptus; disease management and control
S718.81
A

