诺和锐短期强化治疗肝功能失代偿期肝源性糖尿病的临床疗效及安全性
杨梦华 汪才侠 余彩霞

[摘要] 目的 探讨诺和锐(门冬胰岛素注射液)短期强化治疗肝功能失代偿期肝源性糖尿病的临床疗效及安全性。方法 进行为期2周的随机、开放性比较研究。将100例患者随机分为治疗组和对照组各50例。两组均采用内科常规治疗,对照组给予诺和灵30R每日早、晚餐前皮下注射方案,治疗组给予诺和锐每日早、中、晚餐前三次皮下注射强化方案。测定短期强化治疗前后两组患者空腹血糖(FBG)、餐后2 h血糖(2hPG)、糖化血红蛋白(HbA1c)、胰岛素(Ins)、C肽(C-P)、低血糖事件及肝功能指标(ALT、ALB及TBIL),并计算β细胞功能(HOMA-β)和胰岛素抵抗指数(HOMA-IR),同时比较两组治疗前后各指标的变化。 结果 两组治疗后FBG、2hPG、HbA1c、HOMA-IR及肝功能指标均较治疗前降低(P<0.05),治疗组低血糖发生次数显著低于对照组(P<0.05),且组间比较差异有统计学意义(P<0.05)。 结论 诺和锐短期强化治疗肝功能失代偿期肝源性糖尿病能有效降低血糖,减少低血糖事件,改善肝功能恢复状况和减轻胰岛素抵抗,具有更好的临床疗效及安全性。
[关键词] 诺和锐;肝功能失代偿;肝源性糖尿病
[中图分类号] R587.1 [文献标识码] B [文章编号] 1673-9701(2015)11-0115-04
[Abstract] Objective To investigate the efficacy and safety of short-term intensive insulin aspart injection (Novorapid) therapy hepatogenic diabetes with liver decompensation patients. Mothods A two weeks randomized,open-label, confrolled trial comparing Novolin 30R with short-term intensive Novorapid was performed. 100 cases were randomly divided into treatment group and control group, 50 cases for each. The two groups were given traditional medical treatment, while the control group received Novolin 30R twice per day,the treatment group received Novorapid thrice per-day. The indicators such as FBG,2hPG,HbA1c, Ins,C-P,hypoglycemia incidence and liver function (ALT, AST,ALB and TBIL)were evaluated,β-cell function(HOMA-β)and insulin resistance index(HOMA-IR) were calculated. The changes of above indicators before and after therapy were compared between two groups. Results After the treatment,the FBG,2hPG,HbA1c,HOMA-IR and liver function of two groups were respectively lower than those before(P<0.05),hypoglycemia incidence of the treatment group were lower than those of the control group(P<0.05),while the differences between two groups was significant(P<0.05). Conclusion Short-term intensive Novorapid therapy for hepatogenic diabetes with liver decompensation can reduce FBG and 2hPG,reduce the incidence of hypoglycemia, improve liver function,and also reduce insulin resistance. Meanwhile,the therapy is a more effective and safer therapy.
[Key words] Novorapid;Liver decompensation;Hepatogenic diabetes
肝源性糖尿病(hepatogenic diabetes,HD)是各种慢性肝病导致肝实质损害所继发的糖尿病,表现为空腹血糖接近正常或轻微增高、而餐后血糖明显升高为特征的糖代谢紊乱,临床表现以慢性肝病的症状为主,如乏力、纳差、恶心等,而糖尿病“三多一少”的症状不明显,常继发于慢性肝炎性、酒精性及其他原因性肝病,其中约35%最终发展为肝源性糖尿病[1],进而促进各种肝病肝纤维化的进程,并增加肝硬化及肝癌的发生[2,3]。因此及早诊断和正确治疗肝源性糖尿病十分重要。本文现将我科2011年6月~2014年6月收治的肝源性糖尿病病例总结并报道如下。
1 资料与方法
1.1 一般资料
2011年6月~2014年6月我院收治的412例慢性肝病患者中合并肝功能失代偿期肝源性糖尿病者100例,发病率为24.3%,肝功能Child-Pugh分级,A级53例,B级33例,C级14例,其中男62例,女38例,年龄21~65岁,平均年龄(40.7±2.7)岁;慢性肝炎者60例,酒精性肝病者26例,其他原因未明肝病者14例。随机将100例HD患者分为治疗组和对照组各50例,两组患者在性别、年龄、病因及Child-Pugh分级等方面比较,差异无统计学意义(P>0.05)。
1.2 诊断标准
慢性肝病诊断符合2000年西安会议修订的《病毒性肝炎防治方案》的诊断标准[4]。糖尿病符合2010年版中国2型糖尿病防治指南诊断标准[5]:FBG≥7.0 mmol/L,和(或)2hPG≥11.1 mmol/L。肝源性糖尿病诊断标准[6]:糖尿病发病前有慢性肝病史;无糖尿病既往史和家族史;血糖的变化与肝功能的改变多呈一致性;糖尿病的并发症极少;除外垂体、胰腺、肾上腺疾病及药源性原因引起的继发糖尿病。
1.3 治疗方法
两组均在控制饮食的基础上,给予护肝、抗肝纤维化、营养支持、必要时予抗病毒及防治肝硬化并发症等常规内科治疗,静脉注射葡萄糖时,每3~4 g葡萄糖加入1 U胰岛素对抗治疗。对照组予诺和灵30R(精蛋白生物合成人胰岛素注射液,丹麦诺和诺德公司,国药准字J20070046)每日早、晚餐前皮下注射方案,治疗组采用诺和锐(门冬胰岛素注射液,丹麦诺和诺德公司)每日早、中、晚三餐前三次皮下注射强化方案。两组胰岛素起始剂量按(0.3~0.5)U/(kg·d),根据监测血糖调节胰岛素用量直至血糖达标。观察两组治疗前后空腹血糖(FBG),餐后2h血糖(2hPG)、糖化血红蛋白(HbA1c)、低血糖事件、肝功能指标及疗效。
1.4 观察指标
观察两组治疗前后FBG、2hPG、HbA1c、Ins、C-P及肝功能指标(ALT、ALB及TBIL)的变化,计算HOMA-β=20×FIns/(FPG-3.5)和HOMA-IR=FPG×FIns/22.5,记录低血糖发生情况。
1.5 疗效标准
肝功能恢复:ALT≤40 U/L,TBIL≤20 μmol/L,ALB≥35 g/L。糖尿病控制:FBG(4.4~7.0)mmol/L,2hPG(4.4~10.0)mmol/L。显效:血糖及肝功能指标达到上述达标要求;有效:血糖及肝功能指标均比治疗前好转;无效:血糖及肝功能指标未改善或恶化。总有效率=显效率+有效率。
1.6 统计学分析
所有统计采用SPSS14.0软件进行分析,计量资料以(x±s)表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗效果比较
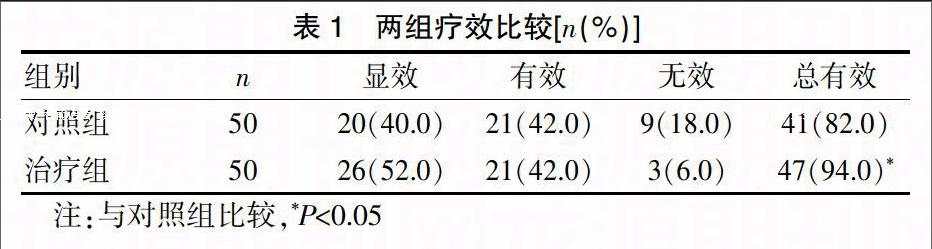
治疗组显效26例,有效21例,无效3例,总有效率94.0%;对照组显效20例,有效21例,无效9例,总有效率82.0%。治疗组总有效率明显优于对照组,两组比较差异有统计学意义(P<0.05)。见表1。
2.2 两组临床资料及生化指标比较
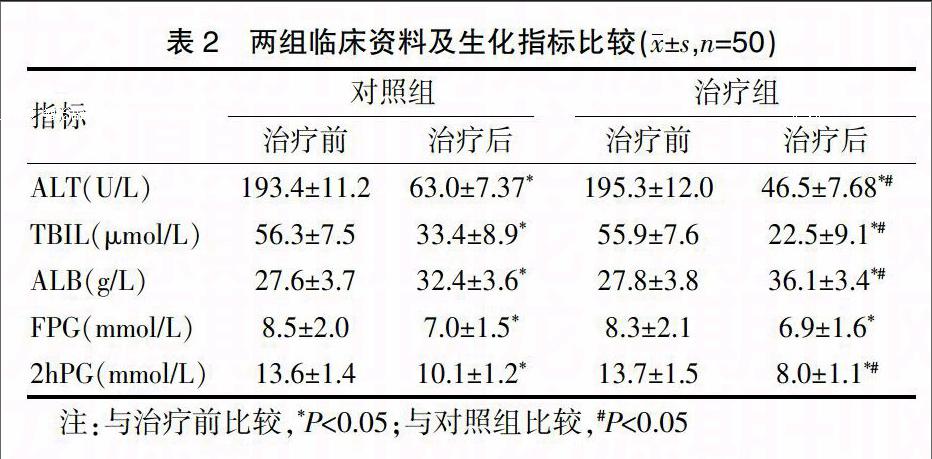
两组治疗后ALT、TBIL、ALB、FBG及2hPG均较治疗前明显改善(P<0.05),治疗后ALT、TBIL、ALB、2hPG组间比较差异有统计学意义(P<0.05)。见表2。
2.3 两组治疗前后HbA1c、HOMA-β及HOMA-IR比较
两组治疗后HbA1c较治疗前下降,HOMA-β水平较治疗前升高,但治疗前后比较差异无统计学意义(P>0.05),HOMA-IR较治疗前明显下降,治疗前后比较差异有统计学意义(P<0.05),但组间比较差异无统计学意义(P>0.05)。见表3。
2.4 低血糖事件
治疗组发生低血糖5例(8例次)占16%,对照组发生低血糖10例(14例次)占28%,两组比较差异有统计学意义(P<0.05)。两组发生的均为轻度低血糖,随时调整胰岛素用量,给予对症治疗后缓解,未出现其他严重不良反应。
3 讨论
肝源性糖尿病(hepatogenic diabetes)是与各种肝病相关的血糖代谢异常,特别是当慢性肝病发展到肝硬化阶段,约20%~60%并发肝源性糖尿病,血糖的异常增加了慢性肝病合并感染、进展性肝纤维化等并发症的危险[7]。肝源性糖尿病的发病机制尚未完全阐明,普遍认为胰岛素抵抗可能是最主要的原因[8]。有研究发现,肝源性糖尿病患者餐后2hPG及胰岛素抵抗指数(insulin resistence index,HOMA-IR)显著高于其它的2型糖尿病患者[9]。慢性肝病时肝细胞数目减少,肝细胞功能减退,对胰岛素灭活减少,同时因门-腔静脉分流而部分胰岛素绕过肝脏直接进入体循环,导致高胰岛素血症[10]。胰岛素水平的增高引起肝、脂肪和肌肉细胞等外周组织胰岛素受体数目减少,同时血浆胰高血糖素、生长激素及糖皮质激素等生糖激素的肝脏灭活下降,从而造成胰岛素抵抗,胰岛素β细胞不能相应增加足够的胰岛素分泌,胰岛素分泌相对缺乏,在肝源性糖尿病发病早期出现糖耐量减低[11]。长期的胰岛β细胞代偿性分泌增加,导致胰岛β细胞功能衰竭,胰岛素分泌绝对不足,最终形成肝源性糖尿病。肝功能失代偿时,肝内葡萄糖激酶、糖原合成酶活动失常,影响葡萄糖的利用和转化,和(或)肝炎病毒及其免疫复合物通过免疫介导损伤了胰岛β细胞,也是造成肝源性糖尿病的可能发病机制[12,13]。特别是病程发展到肝硬化阶段,绝大多数肝源性糖尿病患者β细胞损害是不可逆转的[14],提示患者预后不良,部分患者有待肝移植后肝源性糖尿病可能会好转,因此此时胰岛素替代治疗是最佳的治疗方案。本研究采用两种不同规格的胰岛素替代治疗肝源性糖尿病,均取得了明显疗效,肝功能指标及胰岛素抵抗指数也得到了明显改善,与治疗前及组间比较差异有统计学意义;虽然糖化血红蛋白(HbA1c)有所降低,胰岛β细胞功能(HOMA-β)有所改善,但由于是短期治疗,差异无统计学意义。
肝源性糖尿病的糖代谢异常使已受损的肝细胞能量代谢进一步受损,脂肪细胞的脂解作用增强,葡萄糖异生作用加强,游离脂肪酸增加,导致脂肪性肝炎的发生。这种脂毒性进一步加剧了肝纤维化的发生,不利于肝功能的恢复,而且增加了终末期肝病的死亡率[14,15]。失代偿期肝源性糖尿病的肝酶常大于正常两倍以上,多数口服降糖药是禁忌的,如磺脲类降糖药加速胰岛β细胞功能的衰竭,双胍类易发生乳酸性酸中毒,α-葡萄糖苷酶抑制剂易引起腹胀、腹泻等消化道不良反应。因此,失代偿期肝源性糖尿病治疗上应尽早使用胰岛素,但患者由于肝糖原储备障碍,血糖波动大,不易掌握胰岛素用量,因此应尽量选用短效胰岛素,剂量由小到大,并注意监测血糖的变化,以调整胰岛素用量,以免发生低血糖事件。对易发生低血糖事件的患者,应短期降低血糖达标目标值,防止低血糖事件对肝脏的进一步损害。诺和锐(门冬胰岛素注射液)是将人胰岛素分子B链第28位的脯氨酸用门冬氨酸取代,使门冬胰岛素以单体和二聚体的混合物存在,类似于胰岛β细胞中胰岛素前体,故皮下注射可迅速解离并迅速发挥作用[16,17],达峰时间的个体内变异性显著减少;皮下注射后,10~15 min内起效,最大作用时间为注射后1~3 h,作用持续时间为3~5 h。胰岛素具有促进蛋白质合成,抑制蛋白质分解作用,与胰高血糖素合用可促进肝细胞再生,因此可应用于重症肝病的治疗。肝源性糖尿病多发生于肝功能失代偿期,以空腹血糖正常或偏高、餐后血糖明显升高为特征的糖代谢异常[18]。本研究显示,与诺和灵30R相比,采用诺和锐短期强化胰岛素治疗方案,降糖起效快,达峰更高,更好地控制餐后血糖,低血糖发生少,两组比较差异有统计学意义。
综上所述,采用诺和锐短期强化治疗失代偿期肝源性糖尿病,能更好地控制餐后血糖、减轻胰岛素抵抗指数、改善肝功能指标和较少的低血糖事件,是值得临床推广应用的方案之一。由于本研究所选患者均为住院患者,观察时间短,有待长期随访观察这两种胰岛素治疗方案的远期疗效和安全性。
[参考文献]
[1] Shetty A,Wilson S,Kuo P,et al. Liver transplantation improves cirrhosis associated impaired oral glucose tolerance[J].Transplantation,2000,69(11):2451-2454.
[2] Berzigotti A,Abraldes JG. Impact of obesity and insulin-resistance on cirrhosis and portal hypertension[J]. Gastroenterol Hepatol,2013,36: 527-533.
[3] Garcia-Compean D,Jaquez-Qaintanu JO,Maldonado-Garza H. Hepatogenous diabetes.Current views of an ancient problem[J]. Ann Hepatol,2009,8(1):13-20.
[4] 贺军,张玉香,张金用. 中华医学会传染病与寄生虫病学分会、肝病分会.病毒性肝炎防治方案[J]. 中华肝脏病杂志,2000,8(6):326.
[5] 中华医学会糖尿病病学分会. 2010年版中国2型糖尿病防治指南[J]. 中国糖尿病杂志 ,2012,20: S1-S37.
[6] 张霞,沈鼎明. 肝源性糖尿病的研究进展[J]. 中华肝脏病杂志,2002,10(6):476-477.
[7] 杨春,陈文,吴刚,等. 肝源性糖尿病对HBV相关慢性肝衰竭患者临床特征的影响[J]. 世界华人消化杂志,2014,22(32): 5036-5040.
[8] 涂盛,邵安文,叶真,等. 肝源性糖尿病发病机制研究进展[J]. 中华肝脏病杂志,2014,(22):78-80.
[9] Kim MG,Choi WC. Differential diagnosis of diabetes mellitus caused by liver cirrhosis and other type 2 diabetes mellitus[J]. Korean J Hepatol,2006,12(4):524-529.
[10] Raddatz D,Rosbach C,Buchwald A,et al. Fasting hyperglucagonemia in patients with transjugular intrahepatic portosystemic shunts(TIPS)[J]. Exp Clin Endocrinol Diabetes,2008,116(8):461-467.
[11] Nielsen MF,Caumo A,Aagaard NK,et al. Contribution of defects in glucose uptake to carbohydrate intolerrance in liver cirrhosis:assessment during physiological glucose and insulin concentrations[J]. Am J,2005,288(6):1135-1143.
[12] Yoffe B,Bums OK,Bhatt HS,et al. Extrahepatic hepatitis B virus DNA sequences in patients with acute hepatitis B infection[J]. Hepatology,1990,12(2):187-192.
[13] Takumi K,Tatsiua I,Eitraro T,et al. Clearance of HCV improves insulin resistance,beta cell function,and hepatic expression of insulin receptor substrate 1 and 2[J].Am J Gastroenterol,2007,102(3):570-576.
[14] Perseghin G,Mazzaferro V,Sereni LP,et al. Contribution of reduced insulin sensitivity and secretion to the pathogenesis of liver transplantation[J]. Hepatology,2000,31:694-703.
[15] Demarco R,Locatelli F,Zoppini G,et al. Cause-specificmortality in type 2 diabetes:The verona diabetes study[J].Diabetes Care,1999,22:756-761.
[16] Gundling F,Schepp W,Schumm-Draeger PM. Hepatogenous diabetes in cirrhosis:Academic sport or a neglected disease?[J]. Exp Clin Endocrinol Diabetes,2012,120: 469-471
[17] 骆成林,王少峰,马春涛. 甘精胰岛素对肝源性糖尿病血糖控制的疗效[J]. 世界华人消化杂志,2014,22(27): 4210-4213.
[18] 张霞,沈薇,沈鼎明. 肝病伴糖代谢异常患者的临床分析[J]. 中华肝脏病杂志,2006,14(4):289-292.
(收稿日期:2015-01-08)

