重组大肠埃希菌外膜蛋白OmpT 的载体构建和 表达条件优化及多克隆抗体制备
刘祥,俱雄,陈春琳
(陕西理工学院生物科学与工程学院,陕西 汉中 723001)
大肠埃希菌(Escherichia coli)广泛存在于自然环境中,按其致病机理可分为产肠毒素性、肠道侵袭性、肠道致病性、肠集聚黏附性和肠出血性5种[1],可引起人畜共患病[2],包括腹泻[3]、脑膜炎[4]、尿道感染[5]、食物中毒[6]等;由其导致的奶牛乳房炎发病率呈逐年上升趋势,给奶制品生产及品质带来重大影响[7–8]。大肠埃希菌外膜蛋白酶 T(outer membrane protease T, OmpT)位于细菌外膜,是大肠埃希菌的主要毒力相关因子之一[9],可提高细菌抵抗宿主免疫系统的能力[10–11],也是细菌进入中枢神经的黏附因子[4],并介导细菌在尿路上皮细胞的定植[12]。此外,OmpT具有很高的免疫原性,能有效提高小鼠对致病性大肠埃希菌的免疫抵抗能力[13],所以,OmpT有望成为候选的蛋白亚单位疫苗。本研究中利用分子克隆方法获得大肠埃希菌OmpT蛋白表达菌株;纯化OmpT蛋白,免疫小鼠,制备小鼠OmpT抗血清;通过正交试验确定OmpT适宜的表达条件与培养条件,旨在为OmpT工业发酵与疫苗开发提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
E. coli K12菌株、E. coli DH5a菌株、E. coli BL21菌株和pET–32a质粒均由陕西理工学院生物化学与分子生物学实验室保存。
1.1.2 主要试剂
DNA聚合酶、连接酶及内切酶购于大连宝生生物工程公司;质粒提取试剂盒、胶回收试剂盒均购于上海生物工程有限公司;IPTG购于BBI公司;二抗购于Sigma公司,基因测序在北京奥科鼎盛生物科技有限公司进行。引物由北京奥科鼎盛生物科技有限公司合成。其他试剂均为国产,分析纯。
1.2 方法
1.2.1 重组载体的构建
依据GenBank数据库公布的E. coli K12的全基因组序列设计 ompT 基因引物。引物序列为Sense和Anti– sense Primer(5′–gctctcgagttaaaatgtgtactta ag–3′)(下划线分别表示限制性内切酶的位点BamHⅠ和Xho Ⅰ)。PCR反应体系(25 μL):PCR缓冲液2.5 μL,10 mmol/L dNTP 2 μL,25 μmol/L引物各1 μL,模板DNA 10 μL,Taq 酶0.2 μL,补水至25 μL。PCR循环参数:94℃预变性3min,然后进行30个循环(94℃变性45 s,55℃退火45 s,72℃延伸90 s),最后72℃充分延伸10min,4℃保温。用PCR产物和pET–32a质粒载体进行双酶切,用连接酶连接后转化E. coli DH5a,并对重组质粒进行双酶切和测序鉴定,最后将重组质粒转化E. coli BL21表达菌株,进行OmpT表达[14]检测。
1.2.2 重组蛋白的表达检测与纯化
选取经鉴定后的重组菌接入LB(Amp)液体培养基中过夜培养,以1∶100转接到新鲜LB培养基中,待OD600nm约为0.5时,加入终浓度0.5 mmol/L 的IPTG,37℃诱导5 h,收集菌体,用蛋白电泳检测OmpT表达情况。利用SDS–PAGE电泳方法[15]对OmpT进行蛋白纯化。
1.2.3 小鼠多克隆抗体制备
将每只昆明鼠免疫OmpT蛋白50μg,第1次采用弗氏完全佐剂,免疫14 d后进行第2次免疫,第2次免疫7 d后,进行第3次免疫。第3次免疫7 d后于小鼠眼部取血,将血清置于4℃冰箱中过夜析出,离心取上清,–80℃冰箱中保存备用[15]。
1.2.4 蛋白抗体的效价与特异性检测
用ELISA法检测抗血清效价,主要步骤为:将OmpT蛋白溶解至0.05μg/μL,在对应的96孔板中加入100 μL抗原,37℃孵育3 h;倒空液体,清洗3次,加入300 μL封闭液,37℃孵育2 h,加100 μL不同稀释度小鼠抗血清(每种稀释度均有3个重复),37℃孵育30min;充分洗涤后加入100 μL二抗(1∶3 000稀释),37℃孵育30min;充分洗涤后,每孔加入50 μL底物A与50 μL底物B的混合液,37℃避光显色10min,迅速加入终止液,酶标仪[16]450 nm读数。
采用Western blotting方法检测OmpT小鼠抗血清特异性[17],主要步骤为:将大肠埃希菌过夜培养,收集菌体,SDS–PAGE蛋白电泳,转NC膜,加入不同稀释度的小鼠抗血清(对照加入阴性抗血清),洗涤后,加入二抗(1∶3 000稀释)孵育,洗涤后DAB显色。
1.2.5 OmpT 蛋白氨基酸序列系统进化树
利用NCBI数据库中已公布的细菌OmpT氨基酸序列,通过 MEGA5.02 软件进行聚类分析,并采用Neighbour–Joining 方法[14]构建系统发生树。
1.2.6 重组蛋白诱导表达条件的优化
选用L9(34)正交试验确定蛋白诱导表达的适宜条件。正交试验分为培养条件与蛋白诱导表达条件两部分[18],试验的因子与水平见表1和表2。

表1 表达菌株培养条件正交试验的因子与水平 Table 1 Factors and levels of orthogonal experiment for cultural condition of strain expression
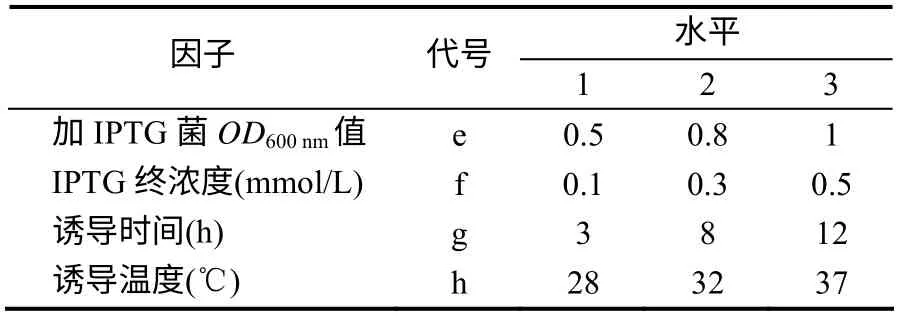
表2 蛋白诱导条件正交试验的因子与水平 Table 2 Factors and levels of orthogonal experiment for protein induced condition
OmpT表达菌株培养条件优化的正交试验:将重组菌株置于LB(Amp)液体培养基中过夜培养,以1∶100(体积)转接入新鲜培养基,按照正交试验模型要求培养,并记录所得菌液的OD600nm。
OmpT表达菌株诱导条件优化的正交试验:根据表达菌适宜培养条件试验结果,依照正交试验模型要求的不同条件培养至合适OD600nm,加入不同终浓度的IPTG诱导相应时间。分别吸取1mL菌液离心,将沉淀加入200 μL的2×SDS 上样缓冲液中,沸水煮样,并上样10 μL 进行SDS–PAGE电泳。使用Phoretix 1D软件对获得的蛋白电泳条带进行光密度分析。
2 结果与分析
2.1 重组载体的构建结果
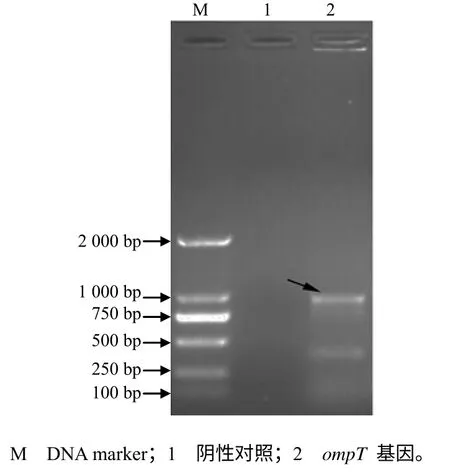
图1 大肠埃希菌ompT基因的PCR扩增电泳结果 Fig.1 PCR amplification electrophoresis of E. Tgene
从大肠埃希菌基因组中PCR扩增到约1 000 bp的片段,片段大小与预期大小一致(图1)。将由PCR 扩增得到的目的基因与pET–32a质粒进行双酶切,通过连接酶连接转化DH5a菌株,提取重组质粒,双酶切,获得约1 000 bp的片段,片段大小与预测大小一致(图2)。基因测序结果表明,构建的ompT基因的序列与NCBI公布的序列相同,证明重组质粒克隆成功。

图2 重组质粒的双酶切结果 Fig.2 Results of recombinant plasmid digested by restriction enzyme
2.2 重组蛋白的表达与纯化结果
为检测重组蛋白的表达情况,将重组菌株经IPTG诱导,蛋白电泳获得相对分子质量约56 000的蛋白条带,其中包含约35 000的OmpT蛋白和20 400 的融合蛋白标签,其大小与预期大小一致;采用SDS–PAGE蛋白电泳切胶纯化获得的OmpT蛋白如图3所示。
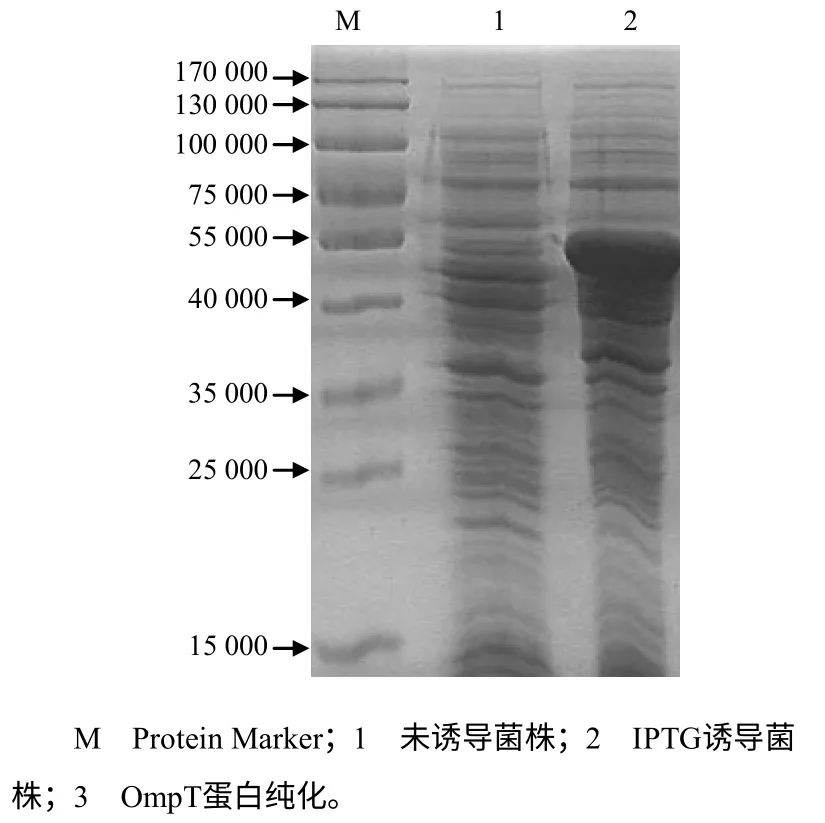
图3 OmpT蛋白的表达与纯化电泳图谱 Fig. 3 Expression and purification electrophoresis of OmpT protein
2.3 小鼠抗血清效价与特异性检测结果
对获得的小鼠OmpT抗血清采用ELISA法检测,发现其抗体效价可以达到1∶1 600(图4)。Western blotting方法的分析结果表明,不同稀释度OmpT抗血清出现明显条带,而对照无对应条带(图5),表明OmpT抗血清可与OmpT蛋白特异性结合,OmpT蛋白小鼠多克隆抗体被成功制备。
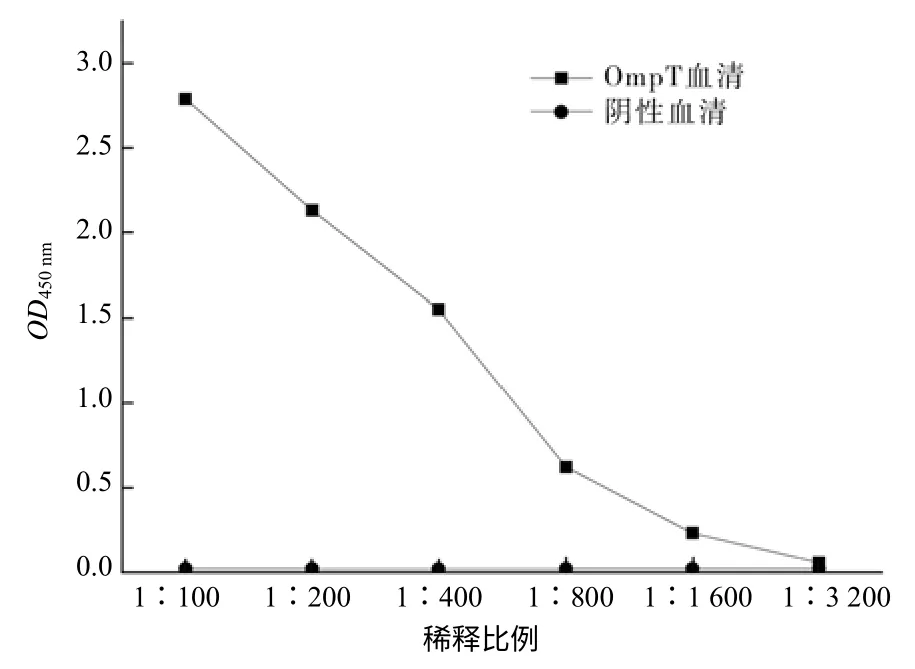
图4 OmpT 多克隆抗体效价的测定结果 Fig.4 Polyclonal antibody titer of the OmpT

图5 OmpT 多克隆抗体特异性的Western blotting 检测结果 Fig.5 Specificity of OmpT polyclonal antibody identification using Western blotting
2.4 OmpT 蛋白氨基酸序列系统进化分析
由图6可见,不同种大肠埃希菌有聚在一起的趋势,间接说明OmpT蛋白在不同种大肠埃希菌间具有同源性,可能存在交叉的免疫保护作用。
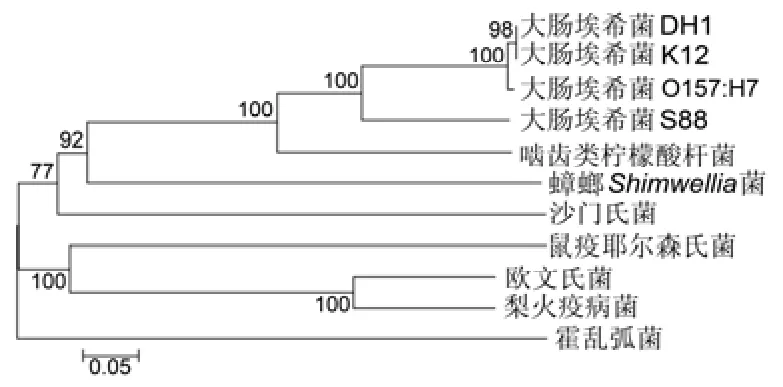
图6 OmpT 氨基酸序列系统进化树 Fig.6 Phylogenetic tree from OmpT amino acid sequences
2.5 重组菌株的诱导表达
2.5.1 菌株最适培养条件的正交试验结果
由正交试验结果(表3)的极差值(表4)可以看出,各因子对表达菌株生长的影响从大到小依次为培养基装液量、葡萄糖浓度、转速。由极差分析获得的表达菌培养的最优组合为a1b3c1(葡萄糖浓度为0,转速为230 r/min,培养基装液量为50mL)。表5方差分析结果显示,葡萄糖浓度、转速及装液量对表达菌株培养的影响达到显著水平。

表3 表达菌株的培养结果 Table 3 Results of the cultural experiment for strain expression

表4 表达菌株培养条件的极差分析结果 Table 4 Range results of cultural condition for strain expression

表5 表达菌株不同培养条件下OD600 nm 的方差分析结果 Table 5 Variance analysis of cultural condition for strain expression
2.5.2 OmpT 蛋白适宜诱导表达条件的正交试验结果
将正交试验获得的表达菌株进行SDS–PAGE电泳(图7),用Phoretix 1D软件分析电泳条带图谱,获得蛋白条带的光密度值如表6所示。由表7中的极差分析结果可知,各因子对OmpT蛋白诱导表达的影响从大到小依次为诱导温度、IPTG诱导时菌体OD600nm、IPTG诱导终浓度、诱导时间。由极差分析获得最适宜OmpT蛋白表达的组合为e3f2g2h2(加IPTG诱导菌液的OD600nm为1.0,IPTG终浓度为0.3 mmol/L,诱导时间为8 h,诱导温度为32℃)。表8中的方差分析结果显示,加IPTG菌液浓度、IPTG诱导浓度及诱导温度3个因子对OmpT蛋白表达的影响达到显著水平。
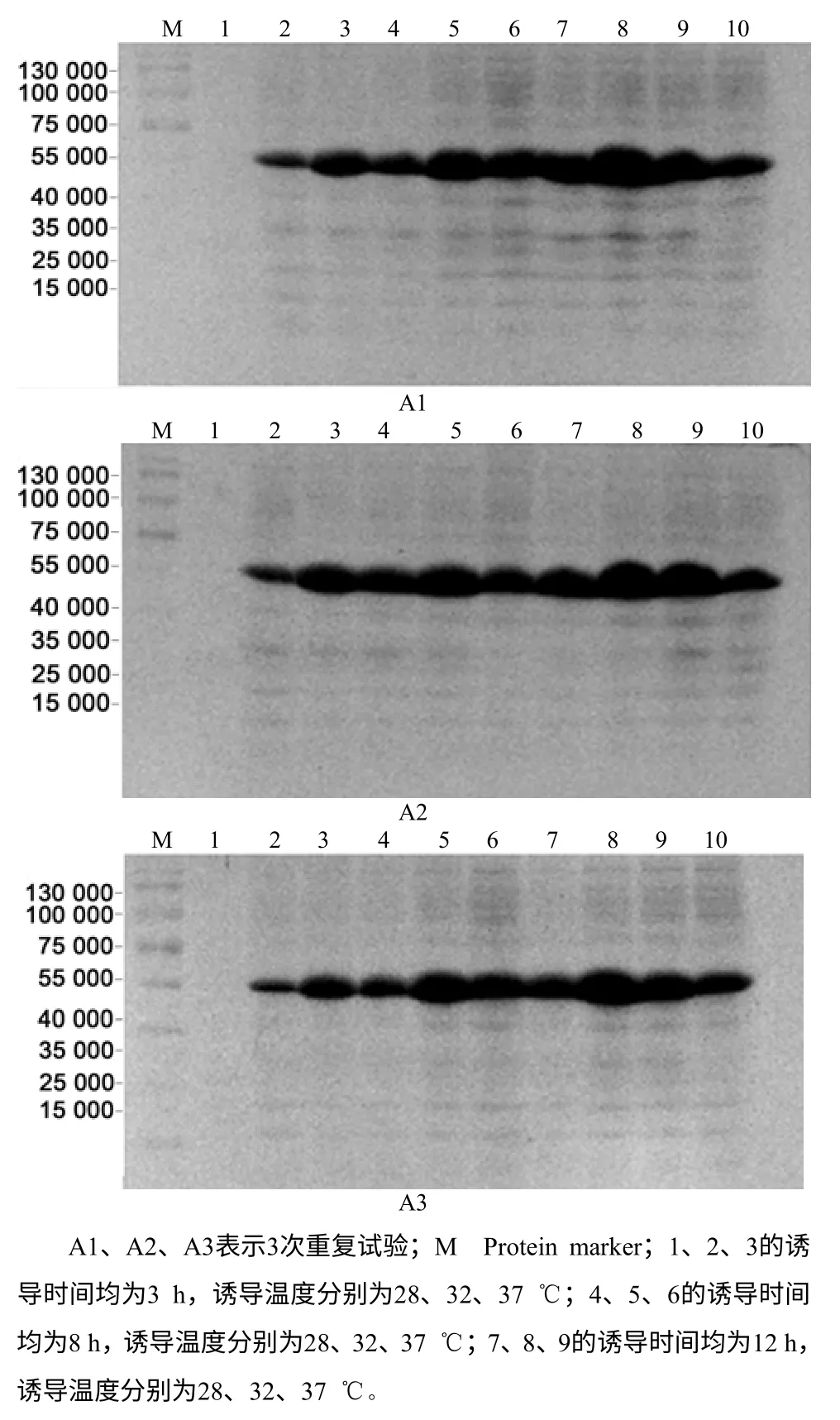
图7 正交试验获得的OmpT 表达菌株SDS–PAGE 电泳图谱 Fig.7 SDS–PAGE electrophoresis of OmpT strain expression from orthogonal experiment

s表6 OmpT 蛋白表达各试验的光密度值 Table 6 Value of optical density from different expression experiments of OmpT protein

表7 OmpT 蛋白表达各试验光密度值的极差分析结果 Table 7 Range analysis on the value of optical density from different expression experiments of OmpT protein
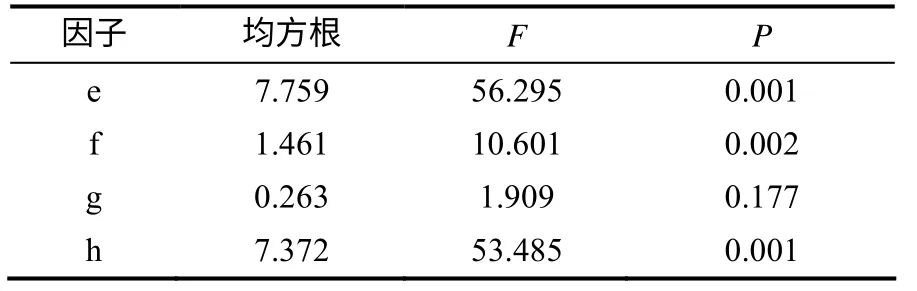
表8 OmpT 蛋白表达各因子光密度值的方差分析结果 Table 8 Variance analysis on the value of optical density from different expression experiments of OmpT protein
3 结论与讨论
大肠埃希菌是导致奶牛乳房炎疾病的主要细菌之一,给奶制品业带来的损失巨大[7–8]。OmpT蛋白是大肠埃希菌主要的外膜蛋白之一,具有显著的免疫保护作用[13],有望制备成奶牛乳房炎疾病的候选蛋白疫苗。本研究中构建大肠埃希菌OmpT表达菌株,获得纯化的OmpT蛋白,免疫小鼠制备了特异性较好的OmpT多克隆抗体,为OmpT功能研究奠定基础。此外,本研究发现OmpT氨基酸序列在不同种类大肠埃希菌间具有同源性,可能为不同种类的大肠埃希菌感染提供交叉免疫保护作用。
本试验结果表明:未诱导时,菌体适宜培养条件为葡萄糖浓度0 %,转速230 r/min,装液量50mL。有研究发现充足的氧气以及合适的转速有利于菌体的生长[19]。这与本实验证实提高培养基转速,减少装液量,可增加细菌对氧气、营养的充分吸收结果一致。在菌株IPTG诱导后,适宜OmpT蛋白诱导条件为:诱导时IPTG菌液OD600nm为1.0,IPTG终浓度0.3 mmol/L,诱导时间8 h,诱导温度32℃。IPTG是β–半乳糖苷酶的活性诱导物质,高浓度的IPTG具有一定的细胞毒性,抑制蛋白的表达[20–21]。本试验结果进一步证实低浓度IPTG(0.3 mmol/L)有利于蛋白的表达。
[1] Rosano G L,Ceccarelli E A.Recombinant protein expression in Escherichia coli : Advances and challenges[J].Fronties in Microbiology,2014,5:172.
[2] Hussein A H,Ghanem I A,Eid A A,et al.Molecular and phenotypic characterization of Escherichia coli isolated from broiler chicken flocks in Egypt[J].Avian Dis Avian,2013,57(3):602–611.
[3] Premjani V , Tilley D , Gruenheid S , et al. Enterohemorrhagic Escherichia coli OmpT regulates outer memb biogenesis[J].FEMS Microbiol Lett,2014,355(2):185–192.
[4] Wan L,Guo Y,Hui C Y,et al.The surface protease ompT serves as Escherichia coli K1 adhesin in binding to human brain micro vascular endothelial cells[J].Pak J Pharm Sci, 2014,27(3):617–624.
[5] Obaid J M,Mansour S R,Elshahedy M S,et al. Uropathogenic Escherichia coli isolates with different virulencegenes content exhibit similar pathologic influence on Vero cells[J].Pol J Microbiol,2014,63(1):43–49.
[6] Rawa S V,Sarreal C Z,Mandrell R E. Strain differences in fitness of Escherichia coli O157:H7 to resist protozoan predation and survival in soil[J]. PloS One,2014,9(7):e102412.
[7] 余婷,安慧慧,吴聪明,等.奶牛乳房炎分离大肠杆菌的耐药性及脉冲场凝胶电泳分型研究[J].中国兽医杂志,2013,49(9):6–11.
[8] 徐继英,刘俊林,李先波,等.我国部分地区奶牛乳房炎源大肠杆菌生物学特性及耐药性分析[J].农业生物技术学报,2012,20(9):1035–1041.
[9] 惠长野,郭研,吴书驰,等.大肠杆菌 K1 致病株外膜蛋白 T 体外功能[J].微生物学报,2010,50(1):48–53.
[10] Hui C Y,Guo Y,He Q S,et al.Escherichia coli outer membrane protease OmpT confers resistance to urinary cationicpeptides[J] . Microbiol Immunol ,2010,54(8):452–459.
[11] Koprivnjak T , Peschel A . Bacterial resistance mechanismanginst host defense peptides[J].Cell Mol Life Sci,2011,68(13):243–2254.
[12] Premjani V , Tilley D , Gruenheid S , et al. Enterohemorrhagic Escherichia coli OmpT regulates outer membrane vesicle biogenesis[J].FEMS Microbiol Lett,2014,355(2):185–192.
[13] 佟春玉,李润婷,呼瑞,等.重组大肠杆菌外膜蛋白OmpT 对小鼠免疫保护作用的研究[J].中国预防兽医学报,2013,35(8):658–662.
[14] 刘祥.福氏志贺菌2型外膜蛋白A的原核表达及多克隆抗体的制备[J].动物医学进展,2015,36(5):6–10.
[15] 陈春琳,刘祥,王成富,等.重组铜绿假单胞菌外膜蛋白 OprI 的原核表达及多克隆抗体制备[J].生物技术,2015,25(1):23–27.
[16] 刘祥,陈春琳,王扬科,等. 小鼠骨桥蛋白的原核表达及多克隆抗体的制备与鉴定[J].中国蓄牧兽医,2015,42(5):1069–1075.
[17] 刘祥,陈春琳,牟欢,等.重组人骨硬化蛋白的表达、纯化及多克隆抗体制备[J].生物技术,2014,24(6):68–72.
[18] 刘祥.溶藻弧菌附着定植因子ACFA 原核载体构建、表达条件优化及多克隆抗体制备[J].华北农学报,2015,30(1):35–41.
[19] Xua M , Suna Q , Sua J , et al . Microbial transformation ofgeniposide in Gardenia jasminoides Ellis intogenipin by Penicillium nigricans[J].Enzyme and Microbial Technology,2008,42(5):440–444.
[20] Yildirim N,Mackey M C.Feedback regulation in the lactose operon:A mathematical modeling study and comparison with experimental data[J] . Biophysical Journal,2003,84(5):2841–2851.
[21] 刘祥.铜绿假单胞菌外膜蛋白 F 原核载体构建、表达条件优化及免疫保护作用研究[J].中国现代医学杂志,2015,25(11):12–16.

