干旱胁迫对2种速生树种叶绿素荧光特性的影响
白晶晶,吴俊文,李吉跃,何 茜,邱 权,潘 昕
(华南农业大学 林学院,广东 广州510642)
水分是植物生长发育过程中的关键因子[1],因此高产速生林的高耗水问题引起广泛关注[2],筛选耐旱速生树种是林业领域的研究热点[3-6].植物受到水分胁迫后光反应中心受损,发生一系列生理生态变化,其中探讨光合作用受损原理一直是植物抗逆研究的重点.近年来叶绿素荧光分析技术受到广大学者关注[7-8],它是研究光系统受损的主要途径,并且具有反应“内在性”的特点,因此被视为研究植物光合作用与环境关系的内在探针[9-10].目前,对叶绿素荧光动力学的研究已经成为热点,在干旱、盐胁迫、低温、强光、施肥过量等抗逆生理研究中得到了广泛应用[11-13].
由于叶绿素荧光参数能够诊断植物体内光合机构运转状况[14-17],所以叶绿素荧光动力学参数在植物抗旱生理和抗旱植物选育方面具有重要意义[18-19].国内许多学者已将叶绿素荧光技术应用于农业、园艺作物抗旱研究中,而应用于林木水分胁迫相对不多[20].胡杨Populus euphratica、灰叶胡杨P.pruinosa、八棱海棠Malus micromalus、平邑甜茶Malus hupehensis、香椿Toona sinensis、金太阳杏Armeniaca vulgaris 等植物会出现光合速率下降,并有不同程度的叶绿体结构的损坏.胡杨、灰叶胡杨、八棱海棠、平邑甜茶、杂交鹅掌楸 Liriodendron chinense×L.tulipifera、金太阳杏和香椿随着干旱胁迫加剧,PSⅡ最大光化学效率(Fv/Fm)、光量子产量(Yield)、表观光合电子传递速率(ETR)、光化学淬灭系数(qP)均呈下降趋势,而各树种初始荧光(F0)均有不同程度的上升[21-24].
竹柳(bamboo willow)又名美国竹柳,是由美国寒竹、朝鲜柳、筐柳组合杂交选育的优良品系.尾巨桉Eucalyptus urophylla×E.grandis 是尾叶桉E.urophylla 和巨桉E.grandis 的杂交种,也是我国南方速生丰产林的首选树种[25,12].对于干旱胁迫下尾巨桉和竹柳的叶绿素荧光参数的研究鲜见报道.本研究利用OS5P 脉冲调制式叶绿素荧光仪(美国)对这2个树种的叶绿素荧光特性[Yield、ETR、qP、非光化学淬灭系数(qN)、F0、最大荧光(Fm)和Fv/Fm这7 个参数]进行了比较研究,旨在为华南地区选育优良的抗旱树种提供理论支持和科学依据.
1 材料与方法
1.1 试验材料与干旱处理
试验材料为盆栽竹柳和尾巨桉1年生苗木各30株,平均苗高、地径分别为:竹柳(0.45 ±0.07)m、(9.10±2.12)mm,尾巨桉(0.40 ±0.03)m、(3.92 ±0.65)mm.于2011年5月在华南农业大学林学院温室内盆栽培育,花盆规格为25 cm×30 cm(上口径×高),盆栽土壤为华南农业大学树木园内林地赤红壤,土壤田间持水量为(26.87 ± 2.07)%,容重为(1.34 ±0.07)g·cm-3.于2011年7月1日浇透水后停止浇水,让其自然干旱.
1.2 叶绿素荧光参数测定
对每株植株中生长位置和叶片朝向相同、大小相似的5~8 片叶片进行挂牌标记,并于7月1日进行第1 次测量,作为对照(正常水分条件),之后在干旱第3~24 天每天进行测量,同树种每次测3 株,共3 个重复,试验开始后每2 d 从2 种苗木中分别选定5 株,用波兰Easy Test 公司生产的便携式土壤湿度、温度和盐度计(FOM/mts-波兰)进行土壤水分测量,测定苗木盆内土壤的含水量.
测量前,叶片暗适应20 min,利用美国OPTI-sciences 公司脉冲调制式叶绿素荧光仪(OS5P-美国)进行F0、Fm、可变荧光(Fv,Fv=Fm-F0)、Fv/Fm、qP,qN 及Yield 共7 个指标的测定.
1.3 干旱胁迫程度划分
土壤含水量占田间持水量80%以上为正常水平,50%~70% 为轻度干旱,30%~50% 为中度干旱,低于30%为重度干旱[26-27].将试验时间按干旱胁迫程度划分如表1.
1.4 数据处理
用Microsoft Excel 2003 对试验数据进行统计,并用SPSS19.0 进行相关性分析.
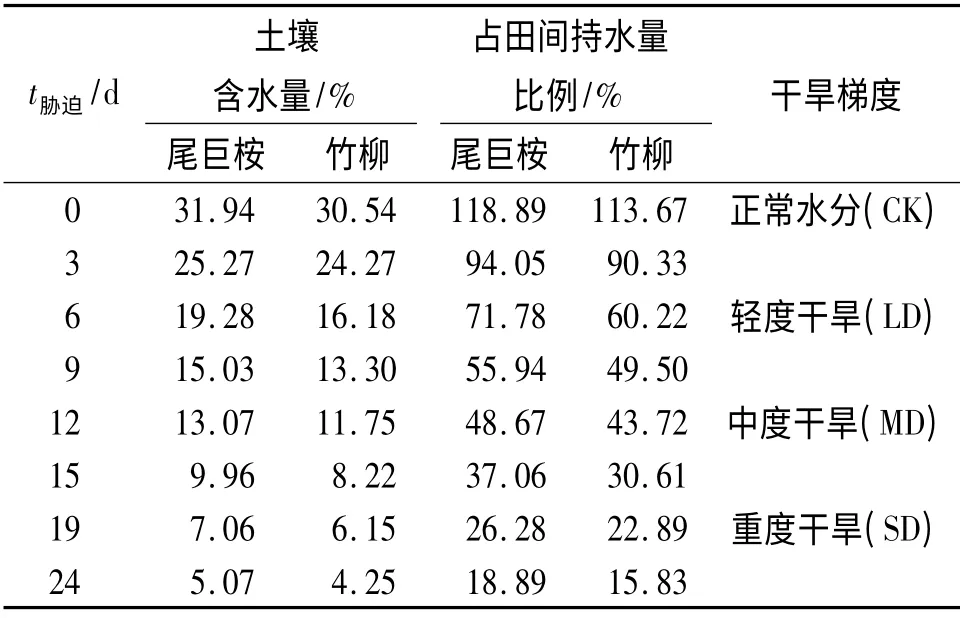
表1 不同干旱胁迫程度划分Tab.1 Divisions of drought stress severity
2 结果与分析
2.1 干旱胁迫对实际光量子产量的影响
Yield 能够反映PSⅡ反应中心在部分关闭情况下的实际原初光能捕获效率,用来衡量植物光合电子传递的量子产量,可以作为植物叶片光合电子传递速率快慢的相对指标[28].正常条件下尾巨桉和竹柳的Yield 分别为:(0.791 ± 0.02)和(0.779 ±0.026)μmol·m-2·s-1(表2),干旱胁迫第8 天之前,两树种Yield 降幅较小,降幅分别为7.33% 和7.79%,比较平稳,到第12 天,尾巨桉依旧平稳(降幅10.66%),而竹柳自第8 天后开始呈现急剧下降趋势,干旱胁迫第24 天,尾巨桉和竹柳的Yield 较对照分别下降63.51%和61.70%,两者降幅相差较小,据表2 可知,对照和最后处理之间出现极显著差异(P<0.01).以上结果表明在轻度干旱胁迫时期,尾巨桉和竹柳的Yield 受影响较小,严重干旱胁迫时期,2 种植物的Yield 均出现显著抑制.
2.2 干旱胁迫条件下表观光合电子传递速率的变化
ETR 在一定程度上可以反应PSⅡ反应中心的电子捕获效率.随着干旱胁迫的加剧,尾巨桉和竹柳的ETR 均呈现下降趋势(表2),在干旱胁迫第24 天,尾巨桉和竹柳的ETR 分别下降为正常水分条件下的48.02% 和25.12%.尾巨桉的ETR 降幅明显大于竹柳(表2).
2.3 干旱胁迫条件下荧光淬灭分析
荧光淬灭包括qP 和qN,qP 表示PSⅡ天线色素吸收的光能用于光化学电子传递的份额[29].要保持高的光化学淬灭系数就要使PSⅡ反应中心处于“开放”状态,所以光化学淬灭系数又在一定程度上反应了PSⅡ反应中心开放程度[30-32].尾巨桉和竹柳的qP在轻度干旱胁迫时期降幅较小,到第12 天2 个树种分别较正常水分条件下降了13.50%和10.55%,竹柳和尾巨桉的qP 分别在第12 和第16 天开始急剧下降,到干旱胁迫第24 天,分别下降为正常水分条件下的43.88%和49.45%,胁迫末期与对照相比,竹柳的降幅(49.80%)小于尾巨桉(58.67%),PSⅡ的光合电子传递活性受到严重影响.
非光化学淬灭是PSⅡ天线色素吸收的光能不能用于光合电子传递,以热形式耗散掉的光能部分,其热耗散能力可以用qN 表示[33].就供试树种而言,qN随干旱程度逐渐增加(表2),干旱胁迫第16 天,尾巨桉和竹柳qN 分别为0.45 和0.38,至干旱末期尾巨桉和竹柳 qN 上升幅度分别为 217.59% 和146.40%.竹柳qN 上升幅度较尾巨桉小,表明在受到干旱胁迫时,竹柳PSⅡ反应中心的开放程度较尾巨桉低.
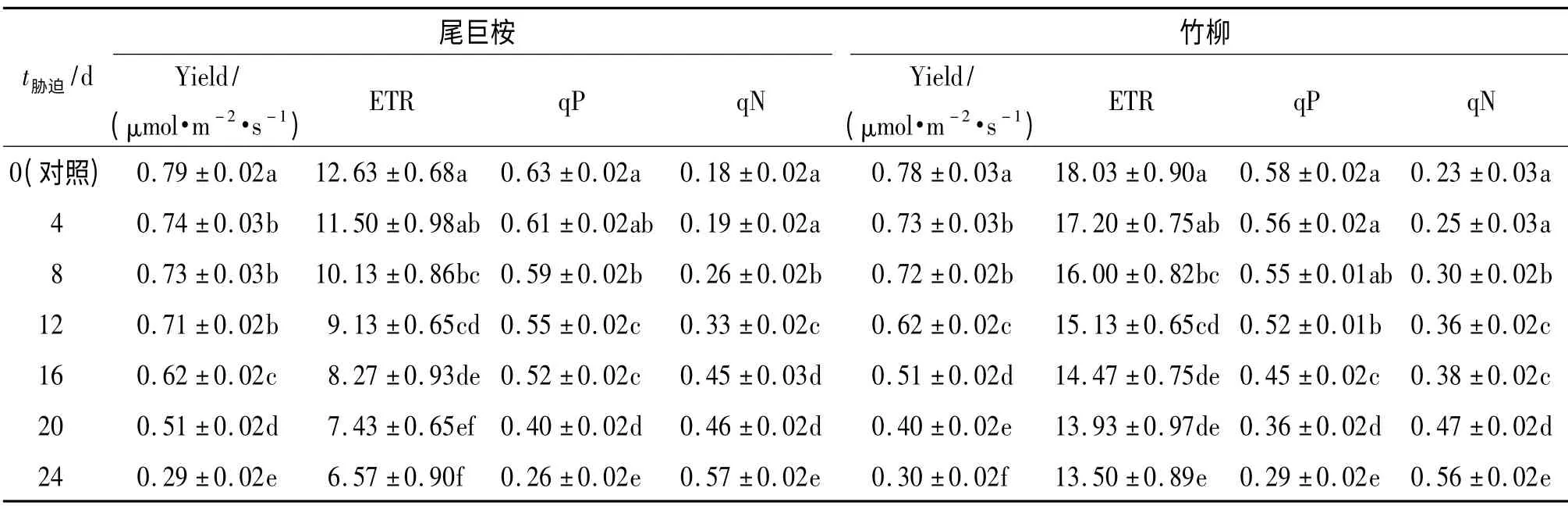
表2 不同水分条件下叶绿素荧光参数方差分析和多重比较结果1)Tab.2 Variance analyses and multiple comparisons of chlorophyll fluorescence characteristics under drought stress
2.4 干旱胁迫对叶绿素荧光动力学参数Fm、F0、Fv/Fm的影响
F0是指PSⅡ反应中心处于完全开放时的荧光产量.F0大小主要与PSⅡ天线色素内的最初激子密度、天线色素以及PSⅡ反应中心的激发能传递速率的结构状态及叶绿素含量有关,而与光合作用光化学反应无关[34].随着干旱条件的加剧,尾巨桉和竹柳的F0均呈上升趋势(表3),到干旱胁迫末期,上升幅度分别为92.03%和49.11%,说明尾巨桉和竹柳在干旱胁迫条件下PSⅡ反应中心均受到一定程度的破坏,且尾巨桉PSⅡ反应中心受到破坏的程度大于竹柳.SD 和CK 间均有显著差异(P<0.05).
Fm是指PSⅡ反应中心完全关闭时荧光的产量,其反映PSⅡ电子传递情况[35].随着干旱程度加剧,尾巨桉和竹柳的Fm不断下降(表3),到SD 期,其Fm分别为1 323 和1 645.尾巨桉的下降幅度(23.42%)高于竹柳(11.26%).
Fv/Fm是反映PSⅡ反应中心原初光能转化效率的一个重要指标,其在受到光抑制和胁迫时明显降低[21,36].从表3 中可以看出:CK 期,尾巨桉和竹柳的初始Fv/Fm分别为0.81 ±0.01 和0.76 ±0.02,随着干旱程度加重,其值均呈下降趋势;到SD 期,下降幅度分别为31.55%和21.84%,SD 和CK 间有显著差异(P<0.05).尾巨桉下降幅度明显大于竹柳,说明尾巨桉在干旱程度加剧时,更易出现光抑制,因此良好的水分条件有助于尾巨桉保持较高的光合生产力,保证其正常生长.
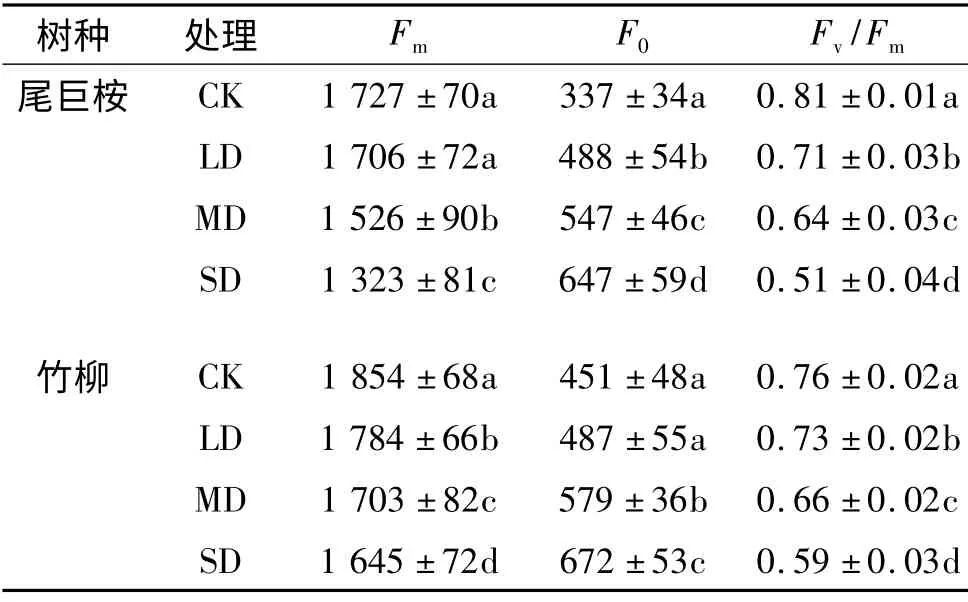
表3 不同干旱处理下叶绿素荧光动力学参数方差分析和多重比较结果1)Tab.3 Variance analyses and multiple comparisons(Duncan's)of the kinetic parameters of chlorophyll fluorescence under drought stress
2.5 土壤干旱胁迫与荧光参数相关性分析
从表4 可以看出,尾巨桉的土壤质量含水量与ETR 呈极显著正相关(P<0.01,r=0.940),与F0呈极显著负相关(P<0.01,r=-0.925),与Fm和Fv/Fm呈显著正相关(P<0.05).叶绿素荧光参数间均呈极显著相关(P<0.01).
表5 显示,竹柳的土壤质量含水量与ETR、Fm和Fv/Fm均呈极显著正相关(P<0.01),相关系数分别为:r=0.961、r=0.960、r=0.877;与Yield 和qP呈显著正相关(P<0.05),与F0和qN 呈显著负相关(P<0.05).叶绿素荧光参数间均呈极显著相关(P<0.01).
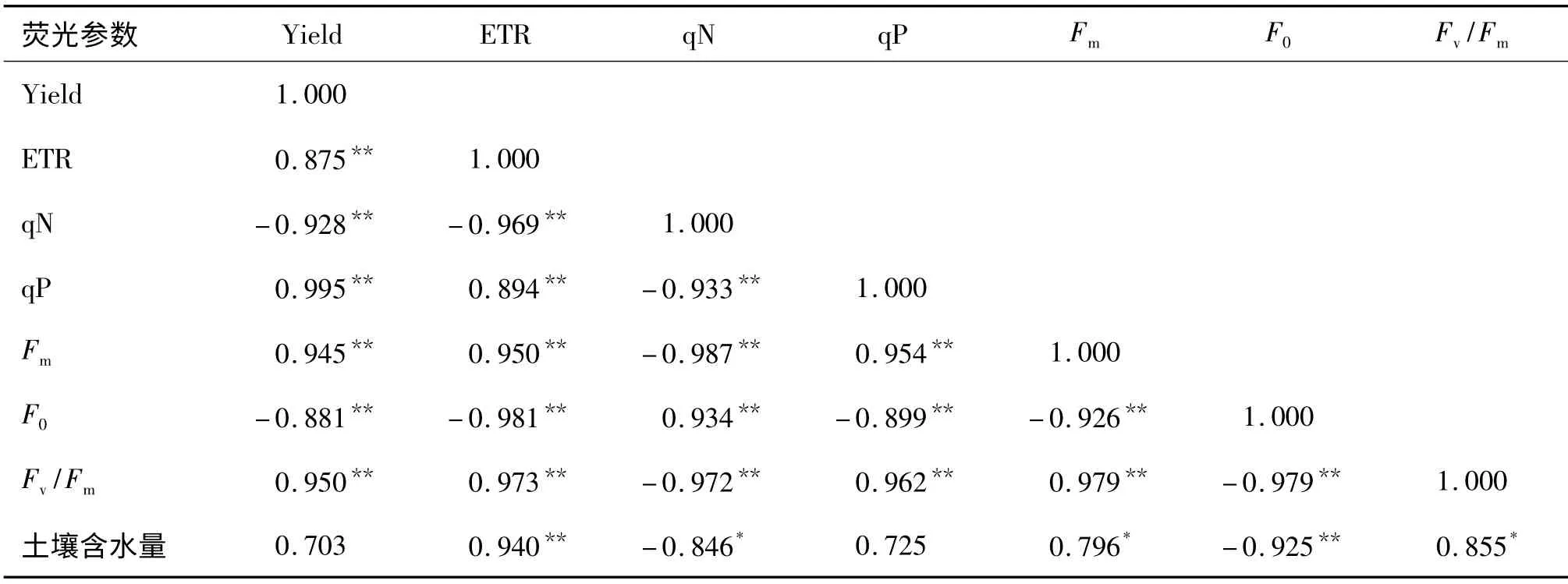
表4 尾巨桉叶绿素荧光参数与土壤含水量的相关性1)Tab.4 Correlation coefficients concerning chlorophyll fluorescence parameters of Eucalyptus urophylla×E.grandis and soil moisture
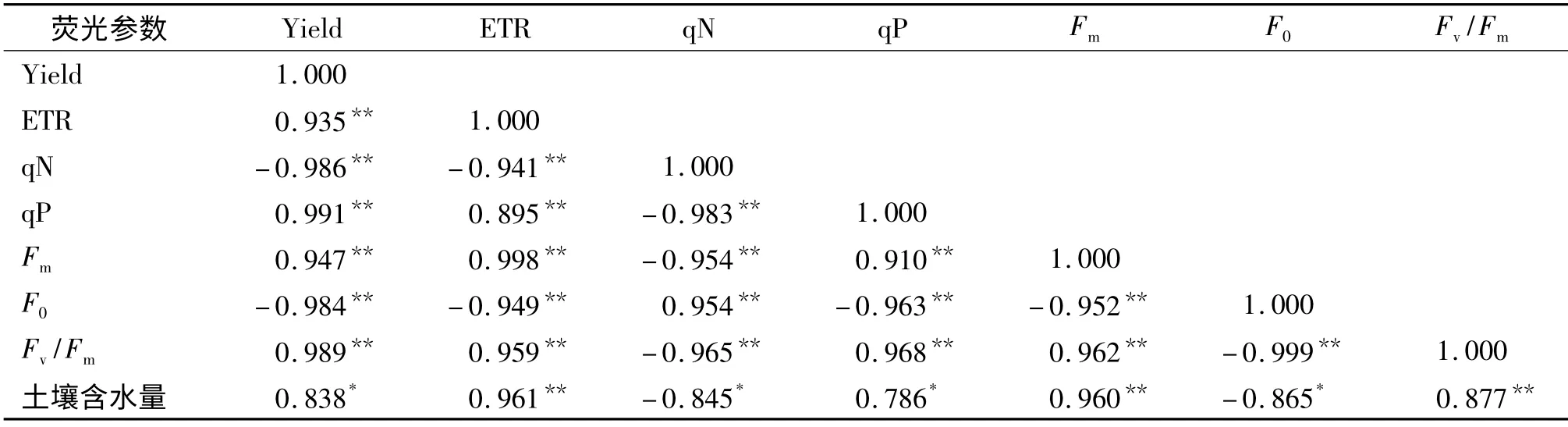
表5 竹柳叶绿素荧光参数与土壤含水量的相关系数1)Tab.5 Correlation coefficients concerning chlorophyll fluorescence parameters of bamboo willow and soil moisture
3 讨论与结论
干旱胁迫下,尾巨桉和竹柳Yield 均呈现先平稳后显著下降的趋势.但在胁迫初期,尾巨桉平稳时期较长,表明轻度干旱下尾巨桉比竹柳实际光能捕获效率高,在胁迫后期,两树种Yield 均下降,表明光合程度受到强烈抑制.孙景宽等[37]研究的干旱胁迫下沙枣和孩儿拳头Yield 变化趋势也与本研究呈现相似的结果.ETR 均呈下降趋势,且尾巨桉下降幅度显著大于竹柳,表明竹柳PSⅡ反应中心的电子捕获效率高,光合能力显著大于尾巨桉.李春霞等[22]也发现随着干旱胁迫,平邑甜茶和八棱海棠ETR 均呈现下降趋势.qP 的大小反映了PSⅡ开放中心的数目,其值越大,表明PSⅡ的电子传递活性越高,尾巨桉和竹柳的qP 随干旱胁迫的加强而不断下降,胁迫初期下降趋势缓慢,尾巨桉比竹柳在抗旱初期表现更强的电子传递活性,而胁迫后期竹柳的下降幅度小于尾巨桉,在重度干旱下,竹柳抗旱性优于尾巨桉.qN是PSⅡ反应中心对天线色素吸收过量光能后的热耗散能力,是一种保护机制,干旱胁迫下,竹柳的qN 上升幅度显著大于尾巨桉,非辐射热能耗散能力优于尾巨桉,对光合系统的破坏亦小.F0增加是PSⅡ反应中心出现不可逆失活和破坏的表现,其值下降表明光合色素热耗散增加[27].在干旱胁迫下,竹柳F0的上升幅度小于尾巨桉,不可逆破坏程度低于尾巨桉,因此耐旱能力大于尾巨桉.尾巨桉和竹柳Fm随着干旱胁迫不断加强而呈下降趋势,尾巨桉的下降幅度大于竹柳,电子传递更易受到胁迫影响.正常条件下,尾巨桉和竹柳的Fv/Fm分别为:0.81 ±0.01 和0.76 ±0.02,随着干旱程度加重,Fv/Fm均呈下降趋势,且尾巨桉下降幅度明显大于竹柳,说明尾巨桉在受到干旱胁迫时出现更严重的光抑制.本试验对叶绿素荧光动力学参数F0、Fm和Fv/Fm的研究结果与李志军等[21]相符.
在土壤含水量与各叶绿素荧光参数的相关性上,桉树和竹柳的表观光合电子传递速率(ETR)均呈极显著相关(P<0.01),其中,土壤含水量与尾巨桉的F0呈极显著负相关,与Fm以及Fv/Fm均显著相关(P<0.05),因此,两树种ETR 对干旱胁迫敏感性较高.李志军等[21]对胡杨和灰叶胡杨的叶绿素荧光参数间相关性的研究表明,各参数间有连锁相关关系,与本研究结果相似.
综上所述,在轻度干旱下,尾巨桉在Yield、qP 上表现出优于竹柳的抗旱性,而在重度干旱下,竹柳在ETR、qN、F0、Fm和Fv/Fm的指标上,均比尾巨桉表现较强的适应性,ETR 对两树种干旱响应较敏感.生产上可在轻度干旱区栽植尾巨桉,在重度干旱区栽植竹柳.但由于叶绿素荧光参数受环境影响较大,各个指标的变化还需要进一步的研究和论证.
[1]李吉跃,周平,招礼军.干旱胁迫对苗木蒸腾耗水的影响[J].生态学报,2002,22(9):1380-1386.
[2]方晓娟,李吉跃,聂立水.毛白杨杂种无性系生长及耗水特性研究[J].西北林学院学报,2010,25(5):12-17.
[3]郭春芳,孙云,唐玉海,等.水分胁迫对茶树叶片叶绿素荧光特性的影响[J].中国生态农业学报,2009,17(3):560-564.
[4]周平,李吉跃,招礼军.北方主要造林树种苗木蒸腾耗水特性研究[J].北京林业大学学报,2002,24(5):50-55.
[5]赵燕,李吉跃,刘海燕,等.水分胁迫对5 个沙柳种源苗木水势和蒸腾耗水的影响[J].北京林业大学学报,2008,30(5):19-25.
[6]陈阳,曾福礼.黄瓜叶片光合电子传递对水分胁迫的响应[J].西北植物学报,2001,21(3):456-461.
[7]MAXWELL K,JOHNSON G N.Chlorophyll fluorescence:A practical guide[J].J Exp Bot,2000,51(345):659-668.
[8]吴家森,宋福强,陈荣,等.3 种七叶树属植物叶片气体交换特征和叶绿素荧光特性比较[J].植物研究,2008,28(4):438-441.
[9]KRAUS G H,WEIS E.Chlorophyll fluorescence and photosynthesis:The basics[J].Annu Rev Plant Biol,1991,42(1):313-349.
[10]ZHANG S R.A discussion on chlorophyll fluorescence kinetics parameters and their significance[J].Chin Bull Bot,1999,16(4):444-448.
[11]王力朋,晏紫伊,李吉跃,等.氮素指数施肥对3 个楸树无性系光合特性的影响[J].林业科学研究,2013,26(1):46-51.
[12]王文成,郭艳超,李克晔,等.盐胁迫对竹柳种苗形态及生理指标的影响[J].华北农学报,2011,26(S1):143-146.
[13]应叶青,郭璟,魏建芬,等.水分胁迫下毛竹幼苗光合及叶绿素荧光特性的响应[J].北京林业大学学报,2009,31(6):128-133.
[14]MISRA A N,SRIVASTAVA A,STRASSERR J,et al.Utilization of fast chlorophyll a fluorescence technique in assessing the saltion sensitivity of mung bean and Brassica seedlings[J].J Plant Physiol,2001,158(9):1173-1181.
[15]郝海坤,彭玉华,黄志玲,等.广西不同产地翅荚木叶绿素荧光特性[J].林业科技开发,2013,27(5):37-40.
[16]张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16(4):444-448.
[17]姚晓蕊,潘存德,李冬梅,等.11 种人工栽培树木叶绿素荧光特征比较[J].干旱区研究,2009,26(4):555-560.
[18]王磊,胡楠,丁圣彦.干旱和复水对大豆(Glycine max)叶片光合及叶绿素荧光的影响[J].生态学报,2007,27(9):3630-3636.
[19]云建英,杨甲定,赵哈林.干旱和高温对植物光合作用的影响机制研究进展[J].西北植物学报,2006,26(3):641-648.
[20]史胜青,袁玉欣,张金香,等.不同水分胁迫方式对核桃苗叶绿素荧光动力学特性的影响[J].河北农业大学学报,2003,26(2):20-24.
[21]李志军,罗青红,伍维模,等.干旱胁迫对胡杨和灰叶胡杨光合作用及叶绿素荧光特性的影响[J].干旱区研究,2009,26(1):45-52.
[22]李春霞,曹慧.干旱对苹果属植物叶绿素荧光参数的影响[J].安徽农业科学,2008,36(31):13536-13538.
[23]杨玉珍,陈刚,彭方仁.干旱胁迫对不同种源香椿主要叶绿素荧光参数的影响[J].东北林业大学学报,2010,38(7):49-51.
[24]蒲光兰,周兰英,胡学华,等.干旱胁迫对金太阳杏叶绿素荧光动力学参数的影响[J].干旱地区农业研究,2005,23(3):44-48.
[25]吕德文.竹柳引种试验初报[J].防护林科技,2011(5):42-43.
[26]韩刚,赵忠.不同土壤水分下4 种沙生灌木的光合光响应特性[J].生态学报,2010,30(15):4019-4026.
[27]张仁和,郑友军,马国胜,等.干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J].生态学报,2011,31(5):1303-1311.
[28]徐建伟,席万鹏,方憬军,等.水分胁迫对葡萄叶绿素荧光参数的影响[J].西北农业学报,2007,16(5):175-179.
[29]张杰,邹学忠,杨传平,等.不同蒙古栎种源的叶绿素荧光特性[J].东北林业大学学报,2005,33(3):20-21.
[30]OXBOROUGH K.Imaging of chlorophyll a fluorescence:Theoretical and practical aspects of an emerging technique for the monitoring of photosynthetic performance[J].J Exp Bot,2004,55(40):1195-1205.
[31]VAN KOOTEN O,SNEL J F H.The use of chlorophyll fluorescence nomenclature in plant srress physiology[J].Photo Synth Res,1990,25(4):147-150.
[32]曹玲,王庆成,崔东海.土壤镉污染对四种阔叶树苗木叶绿素荧光特性和生长的影响[J].应用生态学报,2006,17(5):769-772.
[33]BADER M R,VON CAEMMERER S,RUUSKA S,et al.Electron flow to oxygen in higher plants and algae:Rates and control of direct photoreduction(Mehler reaction)and rubisco oxygenase[J].Philos Trans R Soc Lond B Biol Sci,2000,355(142):1433-1446.
[34]DEMMIG B,BJORKMAN O.Comparison of the effect of excessive light on chlorophyll fluorescence(77K)and photon yield of O2evolution of leaves of higher plants[J].Planta,1987,171(2):171-184.
[35]JI X B,HOLLOCHER T C.Reduction of nitrite to nitric oxide by enteric bacteria[J].Biochem Biophys Res Commun,1988,157(1):106-108.
[36]史胜青,袁玉欣,杨敏生,等.水分胁迫对4 种苗木叶绿素荧光的光化学淬灭和非光化学淬灭的影响[J].林业科学,2004,40(1):168-173.
[37]孙景宽,张文辉,陆兆华,等.干旱胁迫下沙枣和孩儿拳头叶绿素荧光特性研究[J].植物研究,2009,29(2):216-223.

