光谱法研究洛索洛芬钠与牛血清白蛋白的相互作用及共存金属离子的影响
刘里,成飞翔
(曲靖师范学院 化学化工学院,云南 曲靖 655011)
光谱法研究洛索洛芬钠与牛血清白蛋白的相互作用及共存金属离子的影响
刘里,成飞翔
(曲靖师范学院 化学化工学院,云南 曲靖 655011)
目的 研究洛索洛芬钠(LS)和牛血清白蛋白(BSA)的相互作用及共存金属(Mn2+、Cu2+、Cr3+、Mg2+、Fe3+)离子对LS与BSA相互作用的影响。方法 在模拟人体生理条件下,用紫外-可见吸收光谱法和荧光光谱法研究LS与BSA的相互作用。298.5、308.5、318.5 K温度下,根据 S-V方程计算出猝灭常数(KSV)和速率常数(Kq);根据L-B双倒数方程,计算出静态猝灭结合常数(KLB);根据双对数方程,计算出结合常数(Kb)和结合位点数(n);根据热力学公式,计算出焓变(ΔH)、熵变(ΔS)和吉布斯自由能变(ΔG);根据Hill方程计算出 Hill系数(nH)。结果 3个温度下的BSA荧光强度随着LS浓度升高,有规律地降低; KSV、Kq、KLB和nH值随着温度升高而降低;ΔG<0,ΔH<0,ΔS>0;n约等于1;nH小于1。结论 LS对BSA的荧光有猝灭作用,其猝灭过程属于静态猝灭。其相互作用主要靠静电作用力。LS可以被BSA运输,结合位置位于BSA的亚螺旋域ⅡA中,结合位点偏向于酪氨酸。Mg2+、Cu2+、Mn2+和Fe3+对LS与BSA结合产生竞争作用,可提高药效;Cr3+对LS与BSA结合产生促进作用,可减弱药物毒性。
洛索洛芬钠;相互作用;金属离子;牛血清白蛋白;光谱法
与人血清白蛋白相似的牛血清白蛋白(BSA),是生命体中含量最丰富的蛋白质,能与金属离子、酶、代谢物等许多物质相作用,具有贮运内源代谢产物和外源药物小分子(离子)等重要生理功能[1]。洛索洛芬钠(简称LS)是2-[4-(2-氧代环戊烷-1-基甲基)苯基]丙酸钠二水合物,由日本三共株式会社首先研制,现在日本为非甾体抗炎药中销量第一的品种,已被日本药局方收载,我国已进口并已列入国家九五和2010年新品开发推荐试制品种之一[2]。与同类药物相比,其特点主要体现在:更强(临床效果好)、更快(口服30 min血浆浓度即达峰值)、更安全(副作用小)。另一类特点是适应症广,临床上可广泛用于类风湿性关节炎、腰痛、肩周炎等的抗炎镇痛、手术、外伤后及拔牙后的镇痛消炎和急性上呼吸道炎症的解热镇痛等[3]。目前对LS的研究大多集中在临床及药代动力学研究以及测定含量方面[2-3],对于光谱法研究LS与BSA的相互作用至今还没有报道,而且以往研究药物与蛋白质的相互作用主要集中在对猝灭机理的探讨上[4-5]。本文旨在从更多角度研究LS与BSA的结合反应,从常规作用机理的判断,到深入探讨结合力类型、结合位点、药物之间的协同性、结合位置、对蛋白质构象的影响以及金属离子对结合反应的影响,希望这些研究对于阐明LS在机体内的传输、代谢过程及药理作用能提供有益的参考。
1 材料与方法
1.1 仪器与试剂 荧光光谱仪:F-4600型,日本日立公司,狭缝宽度 10.0 nm,负电压为400 V;紫外可见光谱仪:Cary 50型,美国瓦里安技术中国有限公司;精密酸度计:pHS-3C型,上海虹益仪器仪表有限公司。牛血清白蛋白:北京奥博星生物技术有限责任公司,配制1.0×10-5mol/L的溶液;洛索洛芬钠:百灵威科技有限公司,含量98%,配制0.003549 mol/L的溶液;其它试剂为分析纯,超纯水作为试验用水。
1.2 实验方法 依次加入0.50 mol/LNaCl溶液2.0 mL;0.10 mol/L,pH 7.40的Tris-HCl缓冲溶液1.0 mL;1.0×10-5mol/L的BSA 1.0 mL和不同体积0.003549 mol/L的LS溶液,在比色管中,定容至10 mL。分别在298.5、308.5、318.5 K温度下,测定荧光光谱,记录LS不存在时体系的荧光强度F0和LS存在时体系的荧光强度F。其最大激发波长(λex)和最大发射波长(λem)位于280 nm/345 nm 处。扫描Δλ=15 nm和Δλ=60 nm时体系的同步荧光光谱。以相应的LS溶液作为参比,记录BSA-LS体系的吸收光谱。按照上述条件,在LS-BSA体系中加入浓度都为1×10-3mol/L金属离子(Mn2+、Cu2+、Cr3+、Mg2+、Fe3+)0.1 mL,测其荧光光谱。
2 结果
2.1 猝灭光谱 在模拟人体生理条件下,当把药品LS加入到BSA溶液中充分反应后,蛋白质的内源荧光被猝灭,并在λex/λem=280/345 nm处其荧光强度明显有规律地降低(见图1),表明LS与BSA之间存在着相互作用,且荧光猝灭程度与LS的浓度成正比。
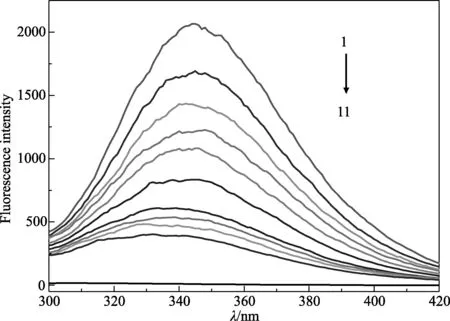
图1 LS对BSA的猝灭光谱Fig.1 Quenching spectra of LS as BSA1→10 CBSA= 1.0×10-6mol/L, CLS=(0, 7.098~113.568) ×10-5mol/L; 11:CLS= 7.098×10-5 mol/L
2.2 猝灭机理的探讨 实际上任何一个荧光猝灭过程是同时包含动态和静态猝灭的混合过程,但是2者在反应过程中有主次之分[6],所以正如通常所说的猝灭机理分为动态猝灭机理和静态猝灭机理。动态猝灭遵从S-V方程[7]:F0/F=1+Kqτ0[C]=1+Ksv[C],式中Kq为双分子猝灭过程的速率常数;τ0为生物大分子荧光寿命,在10-8s数量级左右[7];Ksv为S-V猝灭常数;[C]为LS浓度。按照实验方法在298.5、308.5、318.5 K时,作F0/F-CLS图(见图2、表1)。
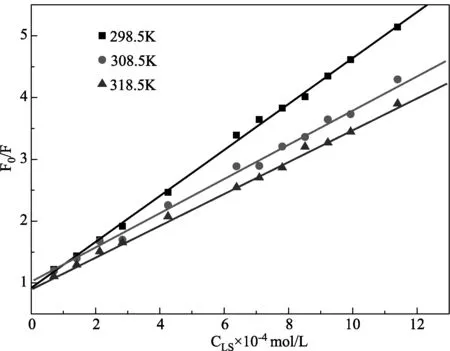
图2 不同温度下LS对BSA的S-V曲线 Fig.2 S-V plots of LS as BSA at different temperatures
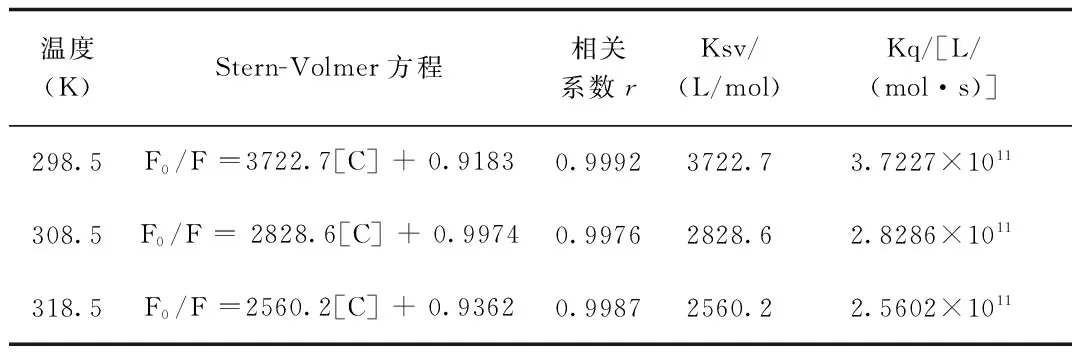
温度(K)Stern-Volmer方程相关系数rKsv/(L/mol)Kq/[L/(mol·s)]298.5F0/F=3722.7[C]+0.91830.99923722.73.7227×1011308.5F0/F=2828.6[C]+0.99740.99762828.62.8286×1011318.5F0/F=2560.2[C]+0.93620.99872560.22.5602×1011
若LS对BSA为静态猝灭,更应符合L-B方程[8]: (F0-F)-1=F0-1+(KLBF0[C])-1式中KLB为静态猝灭结合常数。(F0-F)-1-[C]-1作不同温度下的L-B曲线,结果见表2。

表2 L-B 线性回归方程的相关参数
为了确定猝灭机理,测定了LS、BSA和不同浓度LS与BSA作用的吸收光谱图(见图3)。
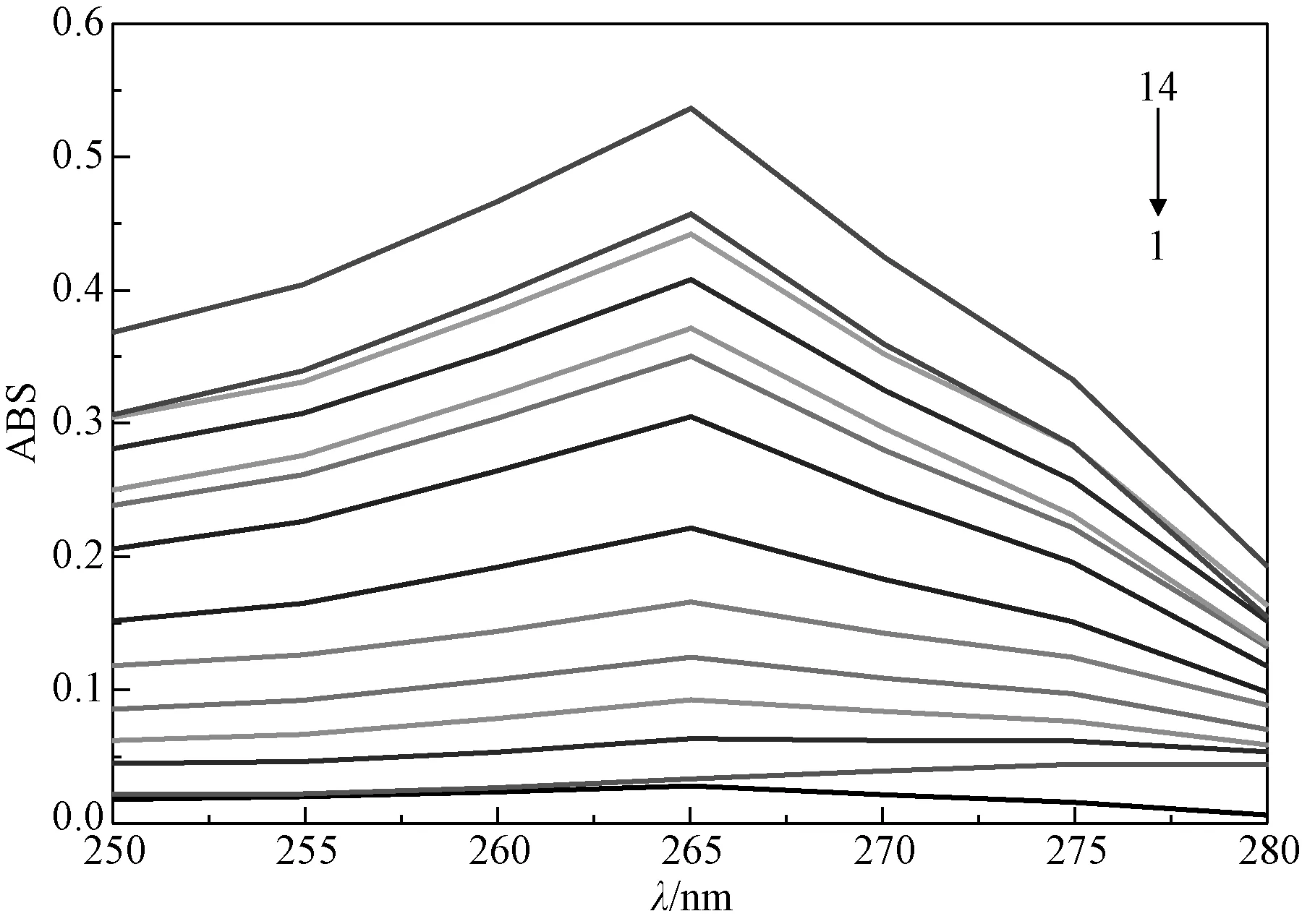
图3 LS(1)、BSA(2)和LS-BSA(3-14)紫外吸收光谱C BSA=1.0×10-6,CLS=7.1×10-5~11.3568×10-4 mol/L Fig.3 UV adsorption spectra of LS ,BSA and LS -BSA solutions
2.3 结合位点数n以及结合常数KbBSA大分子与LS小分子结合的表观结合常数Kb与结合位点数n由lg[(F0-F)/F]=lgKb+nlg[C]公式求出[9]。分别在298.5、308.5、318.5K以lg(F0-F)/F对lg[C]作图,见图4。计算得Kb和n,列于表3中。
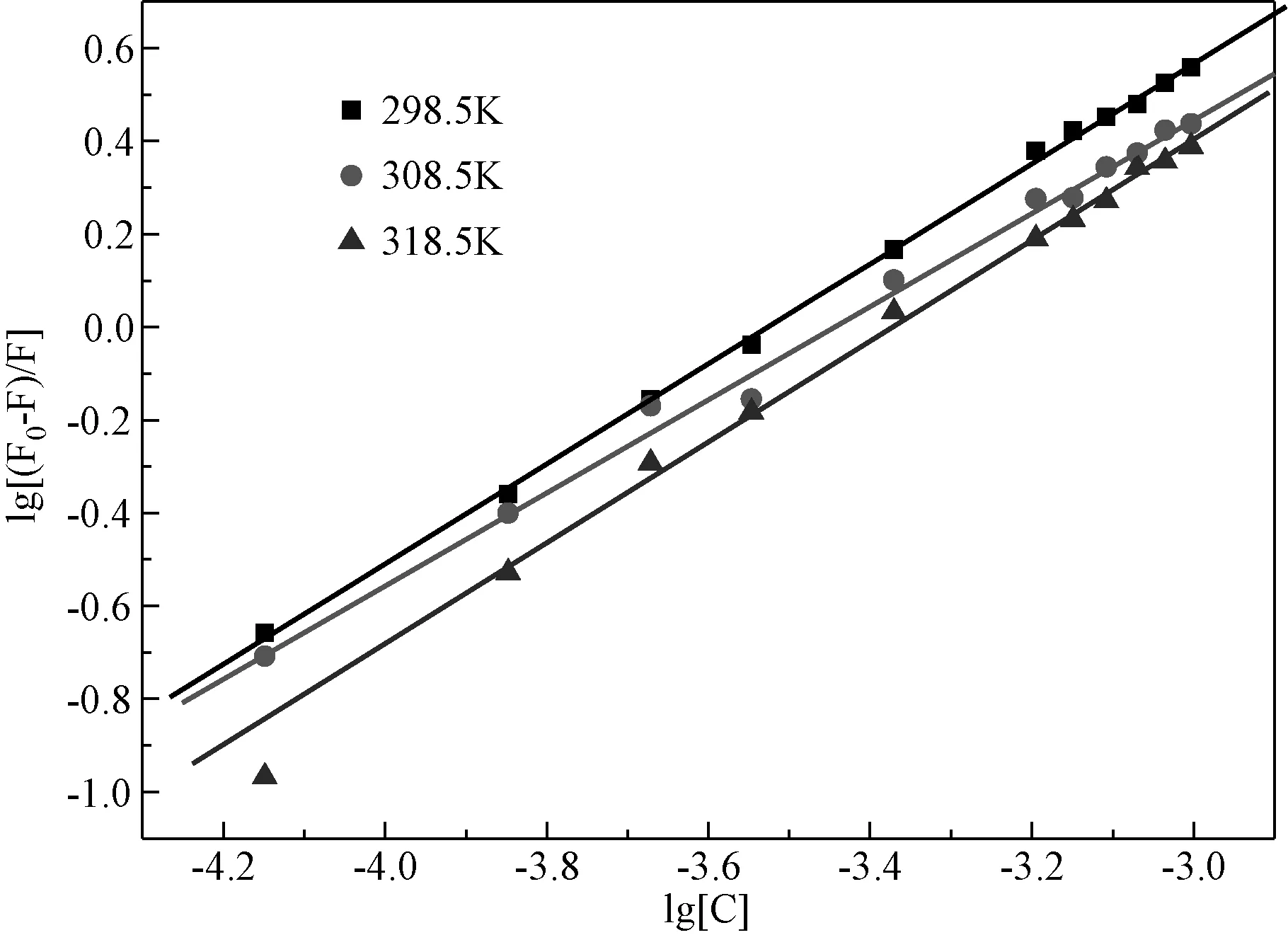
图4 不同温度下 lg[(F0-F)/F]与 lg CLS关系曲线Fig.4 lg[(F0-F)/F] vs.lg CLS plots at different temperatures
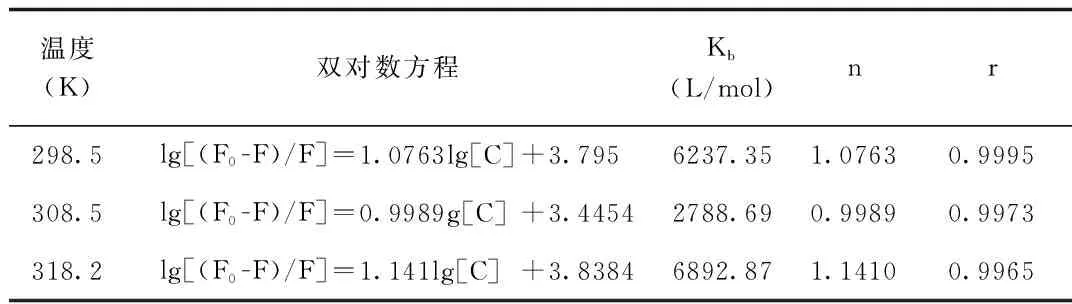
温度(K)双对数方程Kb(L/mol)nr298.5lg[(F0-F)/F]=1.0763lg[C]+3.7956237.351.07630.9995308.5lg[(F0-F)/F]=0.9989g[C]+3.44542788.690.99890.9973318.2lg[(F0-F)/F]=1.141lg[C]+3.83846892.871.14100.9965
2.4 作用力类型 当温度相差不大时,可以把焓变看成一个常数,由不同温度下的Kb,可根据热力学方程[9]算出反应焓变ΔH、自由能变ΔG和熵变ΔS,计算结果见表4。由表4可知,LS与BSA的热力学参数ΔG<0,ΔH<0,ΔS>0表明LS与BSA为自发的,吸热反应。根据Ross等[10]总结出的判断规律,推断出LS与BSA的作用力为静电作用力。
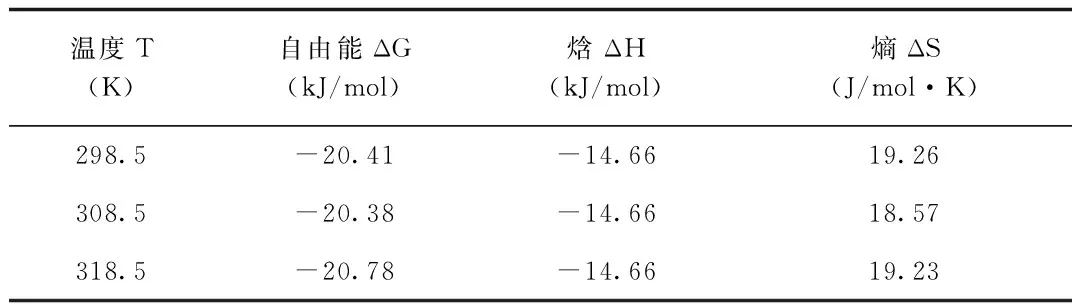
表4 LS-BSA的热力学参数值
2.5 结合部位的确定 与人血清白蛋白相似,BSA含有3个ɑ-螺旋域(Ⅰ-Ⅲ) ,每个ɑ-螺旋域包含2个亚螺旋域 A 和 B。为确定药物小分子与BSA具体结合的位置,考察在2者的作用过程中色氨酸和酪氨酸残基的实际参与情况,应用Sulkowska和刘保生等[11-14]提出的方法,即比较波长在280 nm 和 295 nm 激发时LS-BSA体系荧光程度的降低变化(见图5)。
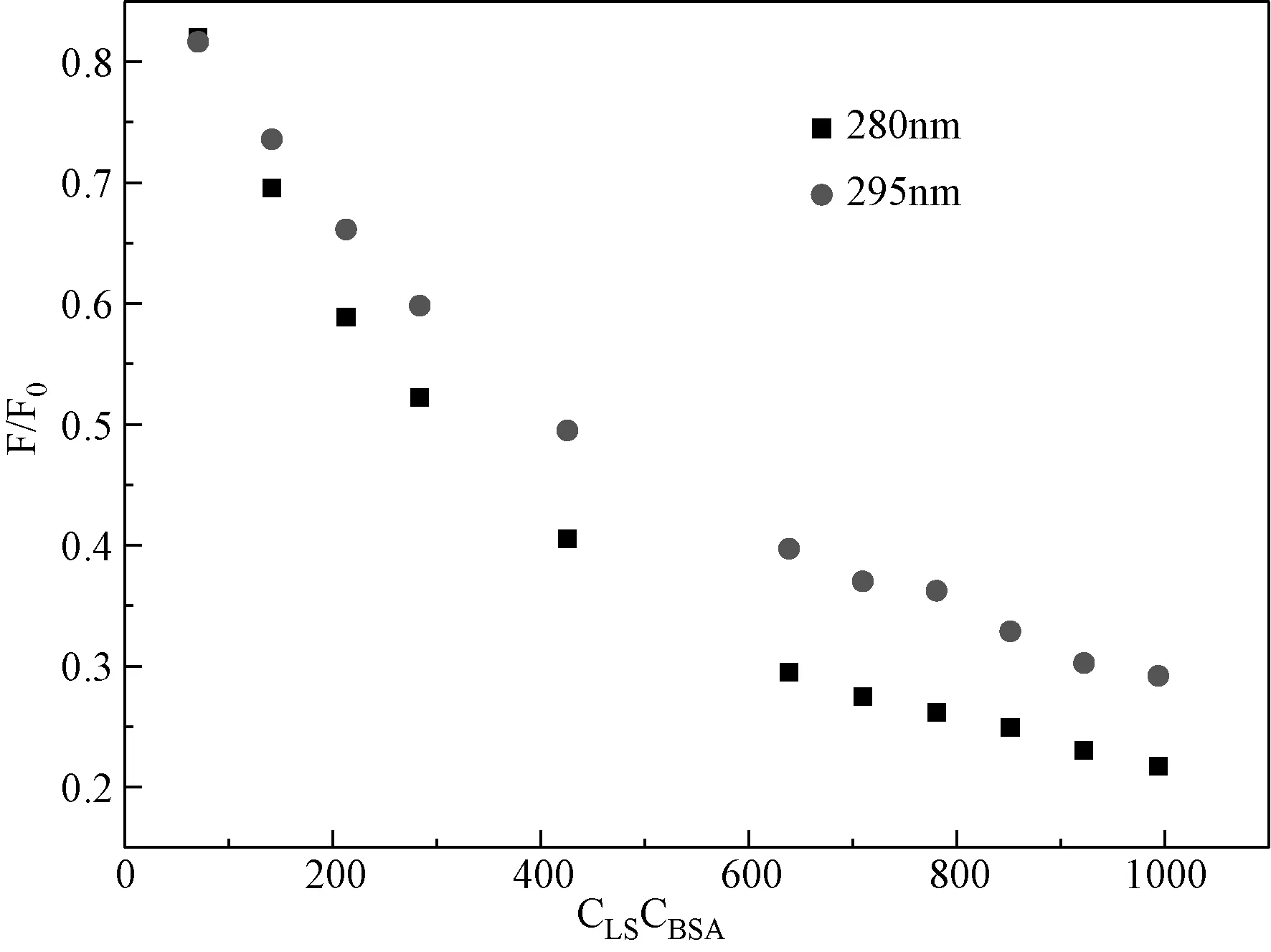
图5 λex为 280 nm 和 295 nm 时,LS-BSA荧光光谱Fig.5 Fluorescence spectra of LS-BSA at λex=280 and 295 nmC BSA= 1.0×10-6 mol/L,CLS=7.1×10-5~9.94×10-4 mol/L
2.6 药物协同性 BSA具有多重结合部位,药物与BSA结合时,BSA各结合部位之间存在相互影响作用,这种相互影响作用称为药物的协同作用[11-14],可用Hill方程[11-14]进行分析:lgD/(1-D)=lgK+nHlg[C],式中,D为结合饱和分数,K为结合常数,nH为Hill系数。在荧光实验中:D/(1-D)=B/(Bm-B),其中,B=(F0-F)/F0;1/Bm是1/B对1/[C]作图的截距。LS-BSA的nH值的计算结果见表5。

表5 不同温度下的nH值
2.7 同步荧光研究LS对BSA构象的影响 蛋白质的构象变化通常用同步荧光光谱来分析,根据λem的变化来确定[11-14]其荧光猝灭主要由何种氨基酸残基起主导作用,而且氨基酸残基的λem移动方向与其所处的疏水性也紧密相关[11-14]。Δλ=60nm和Δλ=15nm分别显示色氨酸和酪氨酸残基的荧光特征[11-14]。在Δλ=15 nm和Δλ=60 nm条件下测LS加入BSA之后的同步荧光光谱(见图6)。
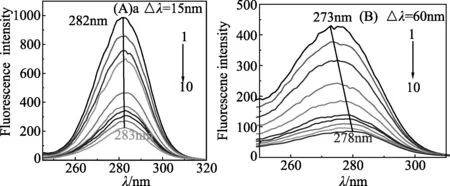
图6 LS猝灭BSA的同步荧光光谱图Fig.6 Synchronous fluorescence spectrometry of BSA as LSCBSA= 1.0×10-5 mol/L, CLS=(0, 7.1, 14.196,28.392, 42.588, 63.882, 70.98, 85.176, 99.372, 113.568 ×10-5 mol/L)
2.8 金属离子的影响 金属离子的存在会直接影响药物与血清白蛋白的结合[14-16],有2种不同的影响:一是对药物与蛋白质结合有增强作用;二是对药物与蛋白质结合有减小作用[14-16]。因此,研究了MgSO4、CrCl3、CuSO4、FeCl3和MnCl2对LS与BSA的结合作用的影响,结果见表6。
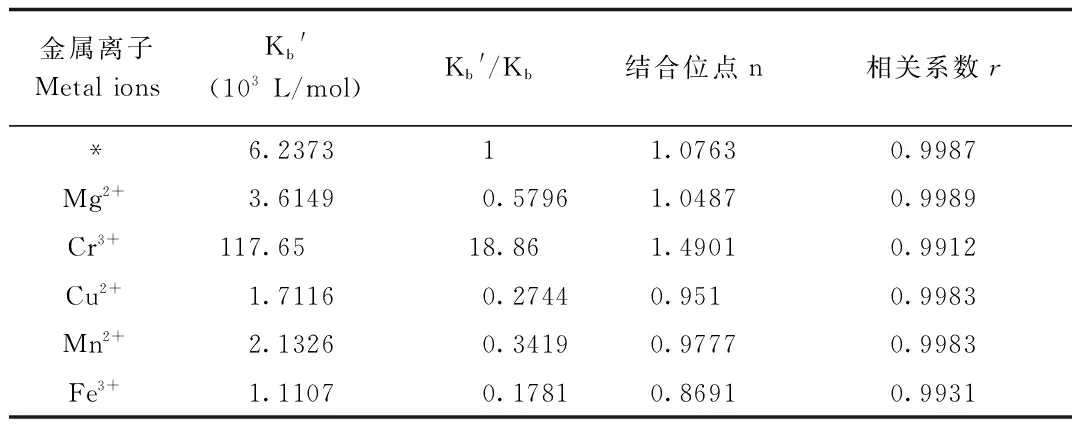
表6 金属离子对结合作用的影响
表中的Kb和Kb′分别表示LS与BSA在金属离子不存在和存在时的结合常数,“*”代表不加任何金属离子
3 讨论
由图2可知,3个温度下的S-V曲线均呈良好的线性关系,且随着温度的升高,直线斜率减小,即Ksv减小,正好与静态猝灭机理相吻合。按Kq=Ksv/τ0可求出不同温度下的Kq值,结果列于表1中。表中所有温度下的Kq值都大于最大动态猝灭速率常数2.0×1010L/(mol·s)[7],说明LS对BSA是静态猝灭。
从表2可以看出,3个温度下的相关系数都在0.995以上,其KLB值都在103数量级,而且KLB随着温度升高而降低,表明LS与BSA的结合是符合静态猝灭特征的。
图3中曲线1(LS),曲线2(BSA)和曲线3-14(LS-BSA)对比表明随着LS不断加入BSA溶液中,峰形与峰位(265 nm红移到275 nm)以及吸收强度都发生了改变,这表明LS与BSA发生像静态猝灭那样因为生成新的物质而改变紫外光谱[8],而不是LS与BSA激发态分子之间发生动态猝灭,不改变吸收光谱的结果,所以3种方法最终确定LS-BSA的作用机理为静态猝灭。
由表3可知,当低于温度308.5 K时,Kb和n随温度的增加而减小;当温度高于308.5 K时,Kb和n随温度的增加而增大;在308.5 K时Kb和n达到最小值;3个温度下,n≈1,可形成一个结合位点。表明Kb和n对温度变化不太敏感,即蛋白质对药物的运输受温度的影响较小。
由表4可知,LS与BSA的热力学参数ΔG<0,ΔH<0,ΔS>0表明LS与BSA为自发的,吸热反应。根据Ross等[10]总结出的判断规律,推断出LS与BSA的作用力为静电作用力。
由图 5可知,在波长在280 nm和295 nm激发下,LS对BSA的猝灭程度曲线是分开独立的,说明色氨酸和酪氨酸残基都参与其中,对比这2种波长下的荧光猝灭程度可知,在280 nm激发时的程度要荧光降低程度更大些,这一现象说明在LS与BSA的结合过程中,结合位点主要位于亚螺旋域ⅡA。
表5中3个温度下的nH<1,表现为负协同作用[15-16],说明LS与BSA结合过程中,随着LS不断的结合到BSA位点上,使得后续LS对BSA的亲和性减弱,即前一个药物分子结合到BSA位点上后,对后一个药物分子与BSA的结合起到阻碍作用。虽然随着温度的变化,nH变化不大,但也随温度升高而减小,说明温度的提升对LS药物小分子之间的协同作用不利。
由图6可知出,随LS浓度的增大,这2种氨基酸残基的λem均向长波移动,说LS的加入改变了BSA的构象,使其疏水结构增大,引起肽链的伸展程度增大,导致BSA腔内疏水环境的极性增强,疏水性减弱。因色氨酸的λem向长波移动的程度小于酪氨酸,表明色氨酸残基所处的微环境疏水性降低得更多[11-14]。酪氨酸的猝灭程度大于色氨酸,表明LS与BSA相结合的位点偏向于酪氨酸。
由表6可知,金属离子不同,Kb′和n也不同,其原因可能是由于金属元素本身的原子结构不同,才导致结合力和结合位点的差异;Mg2+、Cu2+、Fe3+和Mn2+的加入后,Kb和n都减小了,即金属离子对药物与蛋白质的结合产生了抑制作用,其中Fe3+对体系影响最大。原因可能是金属离子对LS与BSA结合产生了竞争作用,缩短了LS在血液中的停留时间,提高了药效。但Cr3+的加入与其它4种离子所产生的效果相反,增大了原本的Kb和n值,促进了BSA与药物的结合作用,延长了LS在血液中的停留时间,减弱了药物毒性。原因可能是金属离子通过桥联作用或形成“离子架桥”[14-16]方式参与其中导致的。以上这些不同恰好也说明不同人的血液中金属离子含量不同,产生的药效也不同。
综上所述,用荧光和紫外光谱法证明了LS对BSA荧光产生静态猝灭,2者靠静电作用力相互作用;通过计算求得了Kb和n值的大小,表明LS可以被BSA运输;2者结合位置位于BSA的ⅡA亚螺旋域中;在LS与BSA结合过程中,药物分子之间有负协同性;同步荧光光谱表明LS使BSA构象产生了影响,疏水性减弱,结合位点离酪氨酸更近。详细研究了Mn2+、Cu2+、Cr3+、Mg2+、Fe3+对药物与蛋白质结合的影响。 Mg2+、Cu2+、Mn2+和Fe3+对LS与BSA结合产生竞争作用,缩短了LS在血液中的停留时间,可提高药效;Cr3+对LS与BSA结合产生促进作用,可减弱药物毒性。
[1] 汪世龙.蛋白质化学[M].第一版.同济大学出版社.上海,2012:16.
[2] 张爱琴.洛索洛芬钠速释缓释双层片药动学及其体内外相关性研究[J].海峡药学,2011,23(7):42-44.
[3] 张玥,刘玫.紫外分光光度法测定洛索洛芬钠片中洛索洛芬钠的含量[J].天津药学,2011,23(2):28-29.
[4] 裘兰兰,李悦,林锐,等.光谱法研究山柰酚与牛血清白蛋白的相互作用[J].中国生化药物杂志,2014,34(6):175-178.
[5] 崔艳花,郭春梅,孙明忠,等.系列黄酮化合物与血清白蛋白结合及其结构相关性[J].中国生化药物杂志,2012,32(6):728-730.
[6] Lakowicz, J.R.Principles of Fluorescence Spectroscopy 3rd ed[M]. Springer Press, New York, 2006:280.
[7] 许金钩,王尊本.荧光分析法[M].3版.北京:科学出版社,2006:64-70.
[8] 刘里,彭洪生,伏云红.荧光光谱法研究头孢孟多酯与牛血清白蛋白的相互作用[J].中国测试,2014,40(3):64-67.
[9] 蔡向阳,谢勇平,蔡碧琼,等.采用荧光法研究烟酸与牛血清白蛋白的相互作用[J].福建农林大学大学学报(自然科学版),2013,42(1):44-47.
[10] Ross DP, Subramantan S.Thermodynamics of protein association reactions: forcrs cont ributing to stability[J].Biochemstry,1981,20(11):3096-3102.
[11] Sulkowska AMaciazek-Jurczyk MBojko Bet al.Competitive binding of phenylbutazone and colchicine to serum albumin in multidrug therapy[J].J Mol Struct,2008,881(1-3): 97-106.
[12] Bojko B,Sulkowska A,Maciazek-Jurczyk M, et al.The influence of dietary habits and pathological conditions on the binding of theophylline to bovine serum albumin[J].Journal of Pharmaceutical and Biomedical Analysis,2009,52(3):384-390.
[13] 王晶.分子光谱法研究某些食用合成色素及药物与蛋白结合的反应机理[D].河北大学.2011.
[14] 刘保生,杨超,王晶,等.头孢匹胺钠与牛血清白蛋白相互作用机理及共存金属离子的影响[J].发光学报,2012,33(9):1021.
[15] 王旭,吴淑春,王家学,等.水杨酸与牛血清白蛋白的相互作用研究及共存铜离子的影响[J].中国现代应用药学,2013,30(10):1066-1070.
[16] 领小,乌云索德,包力尔.胡椒酸乙酯与牛血清白蛋白的相互作用及金属离子的影响[J].发光学报,2012,33(11):1265-1274.
(编校:吴茜)
Study on the interaction between loxoprfen sodium with bovine serum albumin and effect of coexistent metal ion on the reaction by spectroscopic methods
LIU li,CHENG fei-xiang
(College of Chemistry and Chemical Engineering, Qujing Normal University, Qujing 655011, China)
ObjectiveTo investigate the interaction between loxoprfen sodium (LS)and bovine serum albumin (BSA)and discuss the effect of metal ions (Mn2+,Cu2+,Cr3+,Mg2+,Fe3+)on the interaction of LS with BSA.The theoretical basis was provided for further research on non-steroidal anti-inflammatory drugs and the further study of the inner mechanism and biological effect in organism of LS and the proteins.MethodsUnder the simulation of the human body physiological conditions,the interaction between LS and BSA was studied with UV-visible absorption spectra and fluorescence spectra.At 298.5,308.5,318.5 K, quenching constant(KSV)and speed constant(Kq)were calculated by S-V curves.Static quenching constant (KLB)was obtained by L-B double reciprocal equation.Double logarithmic equation was used to calculate the binding constants (Kb)and the number of binding site (n).Thermodynamic equation was used to obtain ΔH, ΔS, ΔG.Hill’s coefficients (nH)was obtained by Hill equation.ResultsAt different three temperatures, with LS concentration increasing, fluorescence intensity of BSA decreased regularly.The value of KSV,Kq,KLBandnHdecreased with the temperature increasing.ΔH and ΔG were lower than 0.ΔS was higher than 0.N was approximately equal to 1 andnH<1. ConclusionThe fluorescence of BSA was quenched by LS, which was a static quenching process.The interaction was mainly driven by electrostatic force.LS could be transported by BSA and the binding site was located at sub-domain ⅡA of BSA.The binding site was near by tyrosine residue.Mg2+,Cu2+,Mn2+and Fe3+competed with the interaction of LS with BSA, increasing medical effectiveness.Cr3+promoted on the interaction and reduced toxicology.
loxoprfen sodium; interaction; metal ions; bovine serum albumin; spectroscopy
国家自然科学基金资助项目(21261019)
刘里,女,讲师,研究方向:药物化学和分子发光学理论与应用研究,E-mail:18908746298@163.com。
O657.3
A
1005-1678(2015)01-0021-05

