caspase-3表达与血管内皮细胞凋亡在子痫前期发病机制中的作用
李延辉梁媚珍蒋洁珊.广东省东莞市石碣医院病理科,广东东莞590;.广东省东莞市石碣医院妇产科,广东东莞590;.广东省东莞市石碣医院手术室,广东东莞590
caspase-3表达与血管内皮细胞凋亡在子痫前期发病机制中的作用
李延辉1梁媚珍2蒋洁珊3
1.广东省东莞市石碣医院病理科,广东东莞523290;2.广东省东莞市石碣医院妇产科,广东东莞523290;3.广东省东莞市石碣医院手术室,广东东莞523290
[摘要]目的 探讨子痫前期患者胎盘组织中血管内皮细胞凋亡及凋亡相关基因caspase-3表达的关系。 方法 选择我院住院治疗的子痫前期孕妇45例为观察组,正常孕妇45例为对照组。收集两组的胎盘组织标本,采用免疫组化法检测两组胎盘组织中凋亡相关基因caspase-3的表达,并应用TUNEL方法检测胎盘血管内皮细胞的凋亡情况。 结果 观察组胎盘血管内皮细胞AI为(0.89%±0.08%),对照组胎盘血管内皮细胞AI为(0.28%±0.04%)。两组的胎盘组织中血管内皮细胞AI比较,观察组AI显著高于对照组,差异有统计学意义(t=7.59,P<0.05),随病情加重,轻度子痫前期组、重度子痫前期组血管内皮细胞AI呈上升趋势,其值分别为(0.76%±0.06%),(1.04%±0.02%),两组之间比较,差异有统计学意义(t=6.29, P<0.05)。观察组胎盘血管内皮细胞中caspase-3蛋白的阳性表达率为62.2%,而对照组胎盘血管内皮细胞中caspase-3蛋白的阳性表达率为4.4%,观察组显著高于对照组,差异有统计学意义(x2=11.65,P<0.01)。轻度子痫前期组、重度子痫前期组胎盘血管内皮细胞中caspase-3蛋白表达呈上升趋势,两组之间比较,差异有统计学意义(x2=9.91,P<0.01)。 结论 胎盘血管内皮细胞凋亡及caspase-3表达上调在子痫前期的形成过程中起重要作用。
[关键词]子痫前期;caspase-3;血管内皮细胞;凋亡
子痫前期是妊娠期特有的疾病,可累及全身多器官功能损害或功能衰竭,严重影响母婴健康。子痫前期的发病机制多年来一直是产科界研究的热点问题,但迄今为止其病因仍未明确[1]。因此,明确其发病机制,采取有效的预防治疗措施,降低孕产妇、围生儿死亡率,改善其预后,已成为一项十分有益的课题。目前许多研究普遍认为,血管内皮细胞受损、结构及功能发生改变,甚至发生凋亡,是子痫前期发病至关重要的环节[2]。目前细胞凋亡分子生物学研究发现caspase(cysteinyl aspartate specific proteinase,含半胱氨酸的天冬氨酸蛋白水解酶)家族参与了凋亡的调控过程,其中caspase-3 是caspase家族中参与细胞凋亡调控的关键蛋白酶[3-4]。本研究通过应用免疫组织化学方法(SP法)及TUNEL法[terminal dexynucleotidyl transferase (TdT)-mediated Dutp nick end labeling],脱氧核糖核苷酸末端转移酶介导的缺口末端标记法)检测45例子痫前期患者的胎盘组织中血管内皮细胞凋亡情况及caspase-3的表达,旨在进一步探讨子痫前期患者胎盘血管病变发生机制,为其治疗提供新的思路。
1 资料与方法
1.1一般资料
选择于我院住院治疗的子痫前期孕妇45例为观察组(轻度子痫前期21例,重度子痫前期24例),正常孕妇45例为对照组,均为剖宫产终止妊娠,子痫前期诊断标准参考第6版《妇产科学》[5],排除有多胎妊娠、高血压、心脏病、肾脏病、慢性肝病等病史以及输血和免疫治疗史的病例。两组的年龄、孕周等一般资料比较,差异无统计学意义(P>0.05),具有可比性。收集两组的胎盘组织标本,避开出血、坏死及钙化区,均置入10%中性缓冲甲醛溶液中固定,常规石蜡包埋,连续切片,厚度约3μm。
1.2主要试剂
SP法(streptavidin-perosidase,两步法)试剂盒购自福建迈新生物技术有限公司,caspase-3山羊抗人多克隆抗体(工作浓度1∶50)均购自美国cell signal公司。TUNEL检测细胞凋亡试剂盒购自德国Boehringer Mannheim公司。
1.3方法
1.3.1TUNEL方法检测胎盘血管内皮细胞的凋亡 常规石蜡切片置于60℃烤箱内烘干60min,常规二甲苯脱蜡,梯度酒精脱水。新鲜配制3% H2O2灭活处理,新鲜稀释ProteinaseK 37℃消化,加TUNEL反应液(含TdT和Bio-21-dUTP),置湿盒37℃标记2h,加封闭液50μL/片,甩掉封闭液,加入1∶100稀释生物素化抗地高辛抗体,湿盒37℃ 30min,最后加入1∶100稀释SABC,湿盒37℃ 30min。0.01mol/L TBS洗4次后DAB显色,苏木素轻度复染,水洗,脱水,透明,封片,光镜下观察。结果判定:光镜下凋亡细胞核呈棕黄色,高倍镜(放大400倍)下随机观察10个不同视野,算出血管内皮细胞凋亡指数(apoptosis index,AI),AI=血管内皮细胞染色阳性细胞数/血管内皮细胞总数×100%。
1.3.2免疫组织化学染色 采用免疫组化SP法检测两组胎盘血管内皮细胞中caspase-3的表达。操作程序:石蜡切片置于60℃烤箱内烘干60min,常规二甲苯脱蜡,梯度酒精脱水,缓冲液冲洗。将切片采用微波炉行抗原修复,置于3% H2O2灭活内源性过氧化氢酶,滴加封闭用正常山羊血清工作液,37℃温箱孵育。caspase-3抗体按 1∶100稀释,滴加稀释的caspase-3工作液,湿盒4℃过夜。缓冲液冲洗后滴加Ⅱ抗工作液,湿盒37℃孵育。滴加辣根酶标记链酶卵白素工作液,湿盒37℃孵育。缓冲液冲洗后采用DAB显色,苏木素复染,梯度酒精脱水,透明,封片,光镜下观察。染色结果判断:光镜下显示caspase-3定位于胞浆和胞膜内,呈黄色或棕色颗粒。每张切片随机选择检查5个视野,计数100个细胞,根据阳性细胞百分率数综合判定,计数阳性细胞数,计算阳性细胞率。0%~5%为(-);5%~10%为(+);20%~35%为(++);35%~50%为(+++)。(+)~(+++)记为阳性。
1.4统计学方法
应用SPSS13.0版统计软件进行分析,计数资料采用x2检验法,计量资料采用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1两组胎盘血管内皮细胞凋亡情况比较
观察组胎盘血管内皮细胞AI为(0.89%±0.08%),对照组胎盘血管内皮细胞AI为(0.28%±0.04%)。两组的胎盘组织中血管内皮细胞AI比较,观察组AI显著高于对照组,差异有统计学意义(t=7.59,P<0.05),随病情加重,轻度子痫前期组、重度子痫前期组血管内皮细胞AI呈上升趋势,其值分别为(0.76%±0.06%),(1.04%±0.02%),两组之间比较,差异有统计学意义(t=6.29,P<0.05)。见表1。
表1 两组胎盘血管内皮细胞凋亡情况比较(±s)
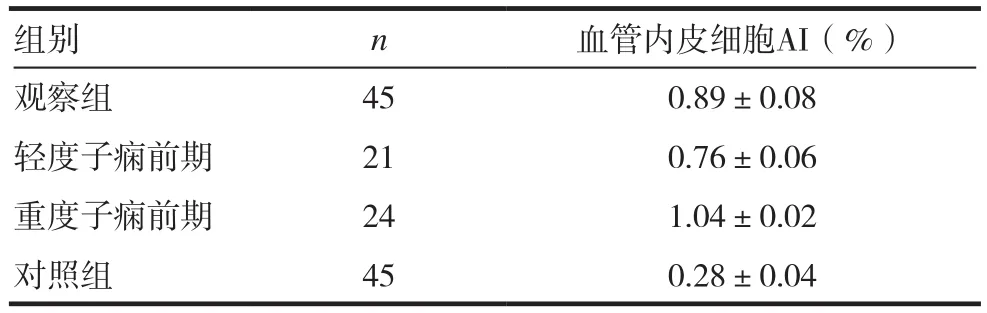
表1 两组胎盘血管内皮细胞凋亡情况比较(±s)
组别 n 血管内皮细胞AI(%)观察组 45 0.89±0.08轻度子痫前期 21 0.76±0.06重度子痫前期 24 1.04±0.02对照组 45 0.28±0.04
2.2两组胎盘血管内皮细胞中caspase-3蛋白表达比较
观察组胎盘血管内皮细胞中caspase-3蛋白的阳性表达率为62.2%,而对照组胎盘血管内皮细胞中caspase-3蛋白的阳性表达率为4.4%,两组caspase-3蛋白阳性表达率比较,观察组显著高于对照组,差异有统计学意义(x2=11.65,P<0.01)。随病情加重,轻度子痫前期组、重度子痫前期组胎盘血管内皮细胞中caspase-3蛋白表达呈上升趋势,两组之间比较,差异有统计学意义(x2=9.91,P<0.01),见表2。

表2 两组胎盘血管内皮细胞中caspase-3蛋白表达比较
3 讨论
子痫前期发病机制尚不清楚,一直是产科领域的研究热点。现公认为其病理起源为胎盘,其中血管内皮细胞受损、结构及功能发生改变,甚至发生凋亡,是子痫前期发病至关重要的环节[6]。血管内皮细胞为覆盖于血管内表面的单层扁平上皮细胞,是血管内血液和血管平滑肌之间的重要屏障,具有调节平滑肌张力、屏障作用、免疫功能、合成多种结缔组织等功能。血管内皮细胞发生损伤后,细胞间隙被破坏,致使蛋白以及液体更容易渗透出血管,进一步促进凝血系统发生DIC,造成细胞之间联接被破坏,使血管内蛋白和液体的外渗[7-8];激活凝血系统造成DIC,激活并释放血管活性因子和血管收缩因子,同时抑制血管舒张因子的分泌与激活,使机体内血管调节细胞因子失衡,促进血管收缩的因子起主要作用,从而血压升高,全身各系统各脏器血液灌流量减少,最终导致器官病理改变,出现子痫前期[9-10],但目前血管内皮细胞受损、结构及功能发生改变,甚至发生凋亡的具体机制仍然不清楚[11]。
本研究采用TUNEL法对子痫前期患者和正常孕妇胎盘血管内皮细胞发生凋亡的情况进行检测,结果发现子痫前期患者胎盘血管内皮细胞的AI为0.89%,正常孕妇胎盘血管内皮细胞AI为0.28%,子痫前期患者胎盘血管内皮细胞AI显著高于正常孕妇胎盘血管内皮细胞AI(P<0.05),说明胎盘血管内皮细胞凋亡可能参与了子痫前期的发生过程。本组研究中发现随病情加重,轻度子痫前期组、重度子痫前期组血管内皮细胞AI呈上升趋势(P<0.05),也进一步验证了胎盘血管内皮细胞发生凋亡可能与子痫前期的发生和发展过程密切相关。
caspase-3是参与调控凋亡发生的关键蛋白酶,细胞在外界各种刺激和诱因作用下,caspase-3被释放并活化,caspase-3激活后具有切断肽键的作用,致使细胞质、细胞核及细胞骨架的重要蛋白质降解失活,从而诱导凋亡的发生。研究证实,血管内皮细胞的两条凋亡信号传导通路最终都是通过激活caspase-3而引起凋亡的。Du HJ等[12]通过体外血管内皮细胞培养实验发现,在血管内皮细胞凋亡过程中,caspase-3表达量明上调。在Zhao JF等[13]的试验中发现caspase-3控制的凋亡信号通路是血管内皮细胞发生凋亡的主要作用机制。FarberA等[14]研究应用caspase-3抑制剂作用于体外培养的血管内皮细胞中,发现caspase-3的活性被抑制后,发生凋亡的血管内皮细胞数目减少。尹晓敏等[15]实验也发现槟榔碱刺激血管内皮血细胞下,caspase-3表达和活性均明显增高,血管内皮细胞也随之发生大幅度凋亡。
本研究应用免疫组织化学法观察子痫前期患者和正常孕妇胎盘血管内皮细胞中caspase-3的表达情况,结果显示子痫前期患者胎盘血管内皮细胞中caspase-3蛋白的阳性表达率为62.2%,而正常孕妇胎盘血管内皮细胞中caspase-3蛋白的阳性表达率为4.4%,子痫前期患者显著高于正常孕妇(P<0.01)。提示caspase-3可能在子痫前期形成过程中发挥着重要作用。随病情加重,轻度子痫前期组、重度子痫前期组胎盘血管内皮细胞中caspase-3蛋白表达呈上升趋势(P<0.01),进一步证实了caspase-3蛋白表达上调可能是子痫前期患者胎盘血管病变发生机制之一。推测caspase-3上调可使血管内皮细胞的胞浆、细胞核及细胞骨架的重要蛋白质降解失活,从而诱导凋亡的发生,因此可以认为caspase-3是血管内皮细胞凋亡的关键执行者,他的裂解活化是血管内皮细胞凋亡进入不可逆阶段标志[16]。
综上所述,胎盘血管内皮细胞发生凋亡及caspase-3表达增高在子痫前期的发生发展过程中起重要作用,相信深入探讨胎盘血管内皮细胞发生凋亡及caspase-3表达增高的调控机制, 针对caspase-3表达的抑制剂研发及应用,将对减缓子痫前期的形成及发展具有重要的临床价值,这也将是今后研究的新方向。
[参考文献]
[1] Moonen M,Legrand D,Lancellotti P.2011 European guidelines for the management of cardiovascular diseases during pregnancy.PartⅡ[J].Rev Med Liege,2012,67(12):509-512.
[2] 李莉,胡继芬.子痫前期血管内皮细胞损伤机制的研究进展[J].医学综述,2006,12(18):1099-1101.
[3] Shikha Snigdha,Erica D Smith,G Aleph Prieto,et al.Caspase-3 activation as a bifurcation point between plasticity and cell death [J].Neurosci Bull,2012,28(1):14-24.
[4] D'Amelio M,CavalluCCi V,Middei S,et al.Caspase-3 triggers early synaptiC dysfunCtion in a mouse model of AIzheimer's disease[J].Nat NeurosCi,2O11,14(5):69-76.
[5] 乐杰.妇产科学[M].第6版.北京:人民卫生出版社,2004:126.
[6] 李朝曦,苏放明.子痫前期血管内皮损伤与其相关物理检查预测子痫前期的研究进展[J].医学综述,2011,17(24):3726-1729.
[7] Filho EV,Mohr C,Filho BJ,et al.Flow-mediated dilatation in the differential diagnosis of preeclampsia syndrome[J].Arq Bras Cardiol,2010,94(2):182-186,195-200,185-189.
[8] Gebb J,Dar P.Colour Doppler ultrasound of spiral artery blood flow in the prediction of preeclampsia and intrauterine growth restriction[J].Best Pract Res Clin Obstet Gynaecol,2011,25(3):355-366.
[9] 李玉林,文继舫,唐建武.病理学[M].北京:人民卫生出版社,2012:17-20.
[10] 任思佳,王冬梅.子痫前期血管内皮损伤的研究与进展[J].中国优生与遗传杂志,2010,18(9):127-134.
[11] Roberts JM,Hubel CA.The two stange model of preeclampsia:variations on the theme[J].Placenta,2009,30(Suppl A):532-537.
[12] Du HJ,Hui YN,Wang YS,et al.Caspase-3 a Ctivityduring dauno rubiCin induCed human retinal pigment epithelineum Cell apoptosis[J].Disi Junyi Daxue Xuebao,2001,22(7):609-611.
[13] Zhao JF,Sun AH,Ruan P,et al.Vibrio vulnifiCus Cytolysin induCes apoptosis in HUVEC,SGC-7901 and SMM C-7721 Cells via Caspase-9/3-dependent pathway[J].MiCrob Pathog,2009,46(4):194-200.
[14] Farber A,Kitzmiller T,Morganelli PM,et al.A Caspase inhibitor deCreases oxidized low-density lipoproteininduCed apoptosis in bovine endothelial Cells[J].J Surg Res,1999,85(2):323-330.
[15] 尹晓敏,彭解英,高义军,等.丹参对槟榔碱诱导血管内皮细胞凋亡和活性的影响[J].中国现代医学杂志,2005,9(6):1368-l370.
[16] 范静,曾凤蓉,李会琴,等.妊娠期高血压疾病患者胎盘细胞凋亡与caspase-3和bcl-2蛋白表达的关系[J].中国妇产科临床杂志,2013,14(3):267-268.
[中图分类号]R714.2
[文献标识码]A
[文章编号]2095-0616(2015)23-31-04
[基金项目]广东省东莞市医疗卫生科技计划一般项目(2015105101214)。
收稿日期:(2015-09-15)
Role of caspase-3 expression and vascular endothelial cells apoptosis in the pathogenesis of preeclampsia
LI Yanhui1LIANG Meizhen2JIANG Jieshan3
1.Department of Pathology, Dongguan Shijie Hospital, Dongguan 523290, China; 2 Department of Gynecology and Obstetrics, Dongguan Shijie Hospital, Dongguan 523290, China; 3.The Operating Room, Dongguan Shijie Hospital, Dongguan 523290, China
[Abstract]Objective To explore the correlation of vascular endothelial cells apoptosis and apoptosis-related gene caspase-3 expression in placental tissue of patients with preeclampsia. Methods 45 pregnant women with preeclampsia who were hospitalized in our hospital were selected as the observation group and 45 healthy pregnant women were selected as the control group. Samples of placental tissue of two groups were collected. Apoptosisrelated gene caspase-3 expressions in placental tissue in two groups were detected by immunohistochemical method and vascular endothelial cells apoptosis of placenta were detected by TUNEL method. Results Vascular endothelial cells AI of placenta of the observation group and the control group were (0.89%±0.08%) and (0.28%±0.04%) respectively. Vascular endothelial cells AI of placenta of the observation group was significantly higher than that of the control group and the difference was statistically significant (t=7.59,P<0.05). With the aggravation of disease, vascular endothelial cells AI of the mild preeclampsia group and severe preeclampsia group were (0.76%±0.06%) and (1.04%±0.02%) respectively which showed an increasing trend. The difference between two groups was statistically significant (t=6.29, P<0.05). The positive expression rate of caspase-3 protein of vascular endothelial cells of placenta in the observation group was 62.2%, significantly higher than that in the control group 4.4% (x2=11.65,P<0.01). Expressions of caspase-3 protein of vascular endothelial cells of placenta in mild preeclampsia group and severe preeclampsia group showed an increasing trend. The difference was statistically significant when two groups were compared (x2=9.91, P<0.01). Conclusion Vascular endothelial cells apoptosis of placenta and overexpressions of caspase-3 play important roles in formation process of preeclampsia.
[Key words]Preeclampsia; Caspase-3; Vascular endothelial cells; Apoptosis

