醋酸甲酯加氢反应的热力学计算与分析
孙成伟,郭翠梨,叶陈良,秦宏云
(天津大学 化工学院,天津300072)
专题报道
醋酸甲酯加氢反应的热力学计算与分析
孙成伟,郭翠梨,叶陈良,秦宏云
(天津大学 化工学院,天津300072)
对醋酸甲酯加氢制乙醇反应体系进行了热力学分析。计算了各独立反应的标准摩尔反应吉布斯自由能,分析了温度、压力、氢气与醋酸甲酯的摩尔比(氢酯比)对反应体系平衡组成的影响以及对醋酸甲酯转化率和乙醇选择性的影响。计算和分析结果表明,各独立反应在423~723 K内的标准摩尔吉布斯自由能均大于0,没有适宜的压力和氢酯比反应将很难进行;较低的温度有利于乙醇的生成和抑制副产物的产生,适宜的温度为423~550 K;在压力低于2.0 MPa时,醋酸甲酯转化率和乙醇选择性均随压力的升高而快速增加,适宜的压力为2.0~3.0 MPa;在氢酯比低于10时,醋酸甲酯转化率和乙醇选择性均随氢酯比的增大而快速增加,适宜的氢酯比为10~20。
醋酸甲酯;加氢;乙醇;热力学分析;吉布斯自由能
乙醇作为重要的化工产品,在燃料领域消费量非常大。在汽油中加入一定比例的乙醇可作为车用燃料,乙醇汽油能有效降低汽车尾气中的CO含量,减少对大气环境的污染,同时部分代替石油能源,因此燃料乙醇成为21世纪车用燃料的重要替代产品[1]。2009年,我国燃料乙醇的消费量为1.493 Mt/a,成为继美国和巴西之后第三大生物燃料乙醇生产国。根据国家规划,2020年我国生物燃料乙醇的利用量将达到10 Mt/a,可见我国乙醇市场潜力巨大[2]。
与我国乙醇市场发展相矛盾的是乙醇生产成本较高,我国生产乙醇的方法主要是发酵法(占96.5%),随着粮食价格的上涨,发酵法生产乙醇受到越来越大的限制。近年来,随着醋酸行业的产能扩张,我国醋酸行业出现严重的产能过剩[3],用醋酸生产乙醇既能缓解醋酸产能的过剩,也能降低乙醇的生产成本。直接用醋酸加氢合成乙醇所需催化剂一般为铂催化剂,其成本较高;再者醋酸具有强腐蚀性,对设备材质要求也较高。而醋酸酯加氢使用较廉价的铜基催化剂,反应条件温和,对设备无腐蚀,因此受到越来越广泛的关注。目前针对醋酸酯加氢制乙醇工艺的研究多集中在催化剂改性方面[4-7],而针对反应热力学计算和分析的报道较少。
本工作对醋酸甲酯加氢制乙醇反应过程进行了热力学计算和分析, 以期为相应催化剂的研发以及反应工艺条件的优化提供理论依据。
1 热力学计算方法
1.1 独立反应数的确定
在复杂的反应体系中,一般存在多个串联或平行反应,因此确定反应物和产物后首先应确定反应体系的独立反应数,并结合实际反应过程得到化学计量方程,从而明确各组分的消耗量和生成量之间的关系[8]。目前用于醋酸甲酯加氢反应的催化剂多为铜基催化剂,该类催化剂可以很好地抑制乙醇脱水反应,因此,醋酸甲酯加氢反应体系中主要存在醋酸甲酯、氢、甲醇、乙醇、乙醛、醋酸乙酯等6种物质[9]。采用原子矩阵法计算其独立反应数[10],可得出独立反应数为3。结合实际反应过程[9]可列出如下3个独立反应:

(1)

(2)

(3)
其中,反应(1)是主反应,反应(2)和(3)是副反应。求得独立反应数后就可以对反应体系进行热力学计算。
1.2 吉布斯自由能的计算
对复杂反应体系吉布斯自由能的计算,有助于从宏观角度估计该反应体系的热力学可行性、反应方向及各反应的进程等多方面的信息。根据醋酸甲酯加氢反应体系中各物质的热力学数据(见表1)[11]进行以下计算。
(4)
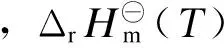
(5)
(6)
ΔrCp m=Δa+ΔbT+ΔcT2+ΔdT3
(7)
根据式(4)~(7)及表1中的数据可计算出反应(1)~(3)在不同温度下的标准摩尔反应吉布斯自由能。
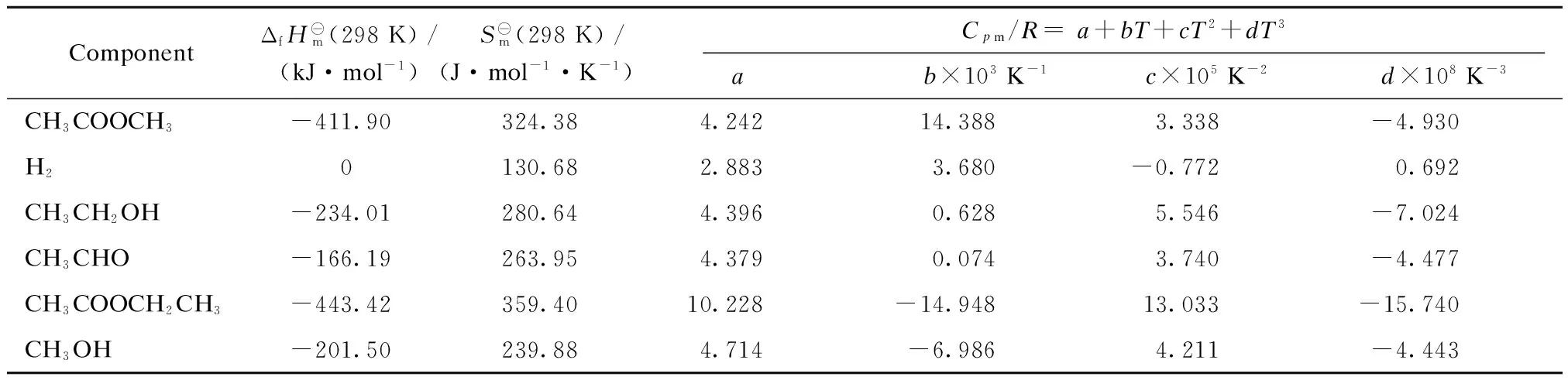
表1 醋酸甲酯加氢反应体系中各物质的基本热力学数据
1.3 平衡组成及转化率和选择性的计算
为便于计算反应体系的平衡组成,做如下假设:1)起始反应体系中只有气态醋酸甲酯和氢气;2)反应在恒温恒压下进行;3)反应(1)~(3)达到了平衡,且没有其他反应发生。
本工作采用平衡常数法[13]计算醋酸甲酯加氢反应体系的平衡组成。设反应体系的压力为p,温度为T,起始的氢气与醋酸甲酯的摩尔比(氢酯比)为r,反应开始时以1 mol醋酸甲酯为基准,平衡时反应(1)生成了ζ1mol的乙醇,反应(2)生成了ζ2mol的乙醛,反应(3)生成了ζ3mol的乙酸乙酯,根据化学计量方程可得出化学平衡时体系的组成,见表2。

表2 醋酸甲酯加氢反应体系的平衡组成
r: the molar ratio of hydrogen to methyl acetate(MA);ζ1: ethanol generated by reaction (1);ζ2: acetaldehyde generated by reaction (2);ζ3: MA generated by reaction (3).
标准平衡常数与标准摩尔反应吉布斯自由能之间的关系如下:
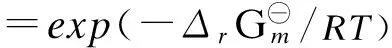
(8)
反应体系达到平衡时总的气体的物质的量为
n=1+r-ζ1-ζ3
(9)
反应(1)~(3)均达到了化学平衡,则
(10)
(11)
(12)
用式(8)计算出反应(1)~(3)的标准平衡常数后,结合式(9)~(12)即可得到醋酸甲酯加氢反应体系的平衡组成,由平衡组成可计算出醋酸甲酯的转化率和乙醇的选择性。
2 结果与讨论
2.1 吉布斯自由能的分析
醋酸甲酯加氢反应体系中各独立反应的标准摩尔反应吉布斯自由能随温度的变化见图1,其中,各曲线的斜率表示各反应的标准摩尔反应吉布斯自由能随温度变化的敏感度。由图1可看出,在423~723 K内,反应(1)~(3)的标准摩尔反应吉布斯自由能均大于0,若没有适当的反应压力和氢酯比,醋酸甲酯的转化率将会很低;反应(1)和(3)的标准摩尔反应吉布斯自由能均随温度的升高而增大,且对温度的敏感度大致相同,说明降低温度有利于反应(1)和(3)的进行;反应(2)的标准摩尔反应吉布斯自由能随温度的升高而降低,因此升高温度会促进副产物乙醛的生成。
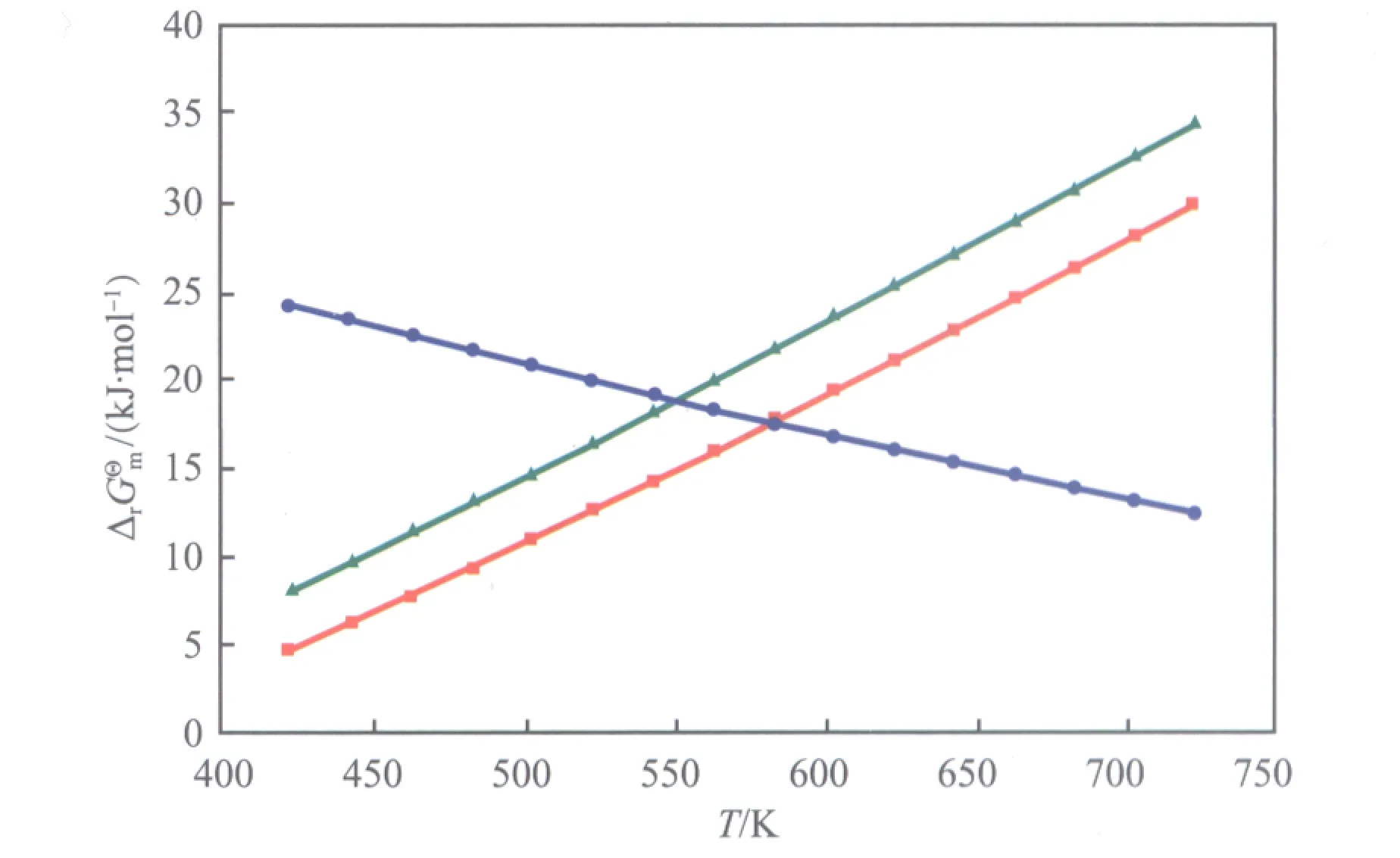
图1 醋酸甲酯加氢反应体系中各独立反应的标准摩尔反应吉布斯自由能随温度的变化
reactions in the MA hydrogenation system vs. temperature(T).
■ Reaction (1);● Reaction (2);▲ Reaction (3)
2.2 平衡组成及转化率和选择性的分析
2.2.1 温度的影响
不同温度下醋酸甲酯加氢反应体系的平衡组成(不考虑氢气)见图2。从图2可看出,醋酸甲酯含量随温度的升高而增加,在温度低于650 K时,醋酸甲酯含量随温度的升高明显增加;当温度高于650 K后,其含量随温度的升高增幅趋缓。乙醇含量随温度的升高而下降,且温度越高其下降速度越快。甲醇含量随温度的升高呈缓慢下降趋势。乙醛含量随温度的升高而增加,在温度低于550 K时,乙醛含量非常低;温度高于550 K后,乙醛含量开始快速增加;当温度达到725 K时,副产物乙醛的含量超过了乙醇。乙酸乙酯含量随温度的升高略有增加,当温度高于600 K后,其含量趋于稳定。
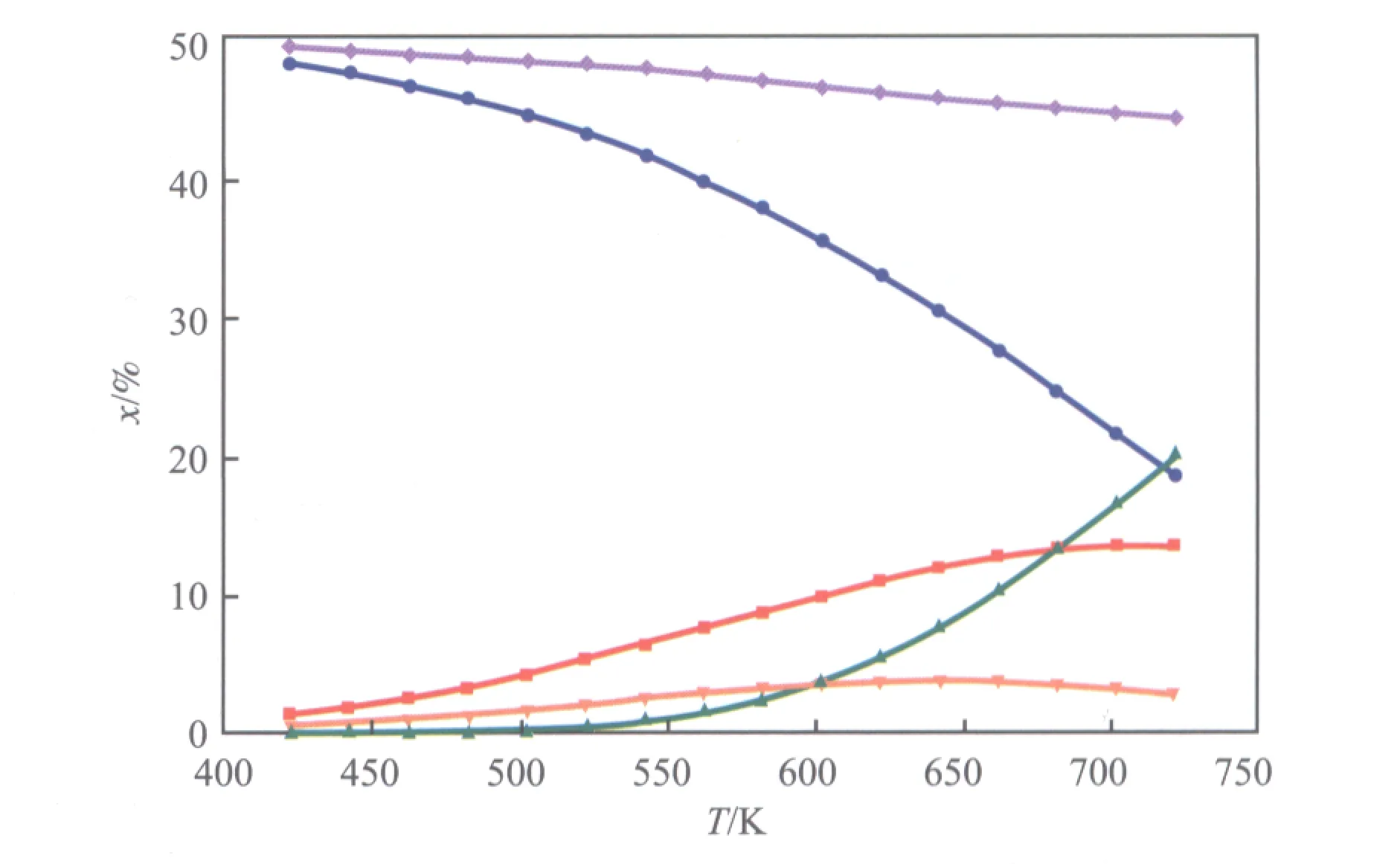
图2 不同温度下醋酸甲酯加氢反应体系的平衡组成
不同温度下的醋酸甲酯转化率和乙醇选择性见图3。从图3可看出,醋酸甲酯转化率和乙醇选择性均随温度的升高而降低。在温度低于550 K时,醋酸甲酯转化率随温度的升高下降较快;随温度的进一步升高,醋酸甲酯转化率降幅趋缓。在温度低于550 K时,乙醇选择性随温度的升高下降较慢;当温度高于550 K后,乙醇选择性随温度的升高快速下降;温度达到700 K时,乙醇选择性不足50%。
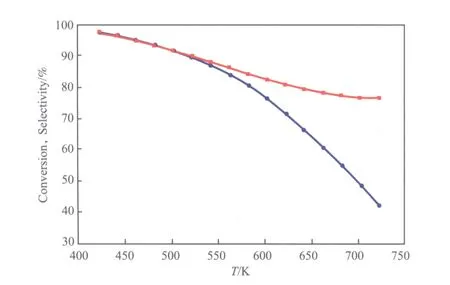
图3 不同温度下的醋酸甲酯转化率和乙醇选择性
由以上分析可知,对于醋酸甲酯加氢反应体系,低温有利于提高醋酸甲酯转化率和乙醇含量,同时可降低副产物的含量。所以从热力学方面分析,低温有利于醋酸甲酯加氢制乙醇反应的进行,适宜的反应温度为423~550 K。
2.2.2 压力的影响
不同压力下醋酸甲酯加氢反应体系的平衡组成见图4。

图4 不同压力下醋酸甲酯加氢反应体系的平衡组成
从图4可看出,醋酸甲酯含量随压力的升高而降低,在压力低于2.0 MPa时,这种趋势尤为明显;当压力高于2.0 MPa后,醋酸甲酯含量随压力的升高降幅趋缓。乙醇含量随压力的升高而增加,在压力低于2.0 MPa时,乙醇含量随压力的升高快速增加;当压力高于2.0 MPa后,乙醇含量随压力的升高增幅趋缓。乙醛和乙酸乙酯的含量均随压力的升高而降低,说明升高压力有利于降低副产物乙醛和乙酸乙酯的含量。在压力低于1.0 MPa时,甲醇含量随压力的升高而明显增加;压力超过1.0 MPa后,甲醇含量维持在49%(x)左右。
不同压力下的醋酸甲酯转化率和乙醇选择性见图5。从图5可看出,醋酸甲酯转化率和乙醇选择性均随压力的升高而增加,在压力为0.1 MPa时,醋酸甲酯转化率和乙醇选择性均不足70%,说明醋酸甲酯加氢制乙醇的反应不宜在常压下进行;当压力达到2.0 MPa后,醋酸甲酯转化率和乙醇选择性均接近95%;随压力的进一步升高,醋酸甲酯转化率和乙醇选择性的增幅趋缓。

图5 不同压力下的醋酸甲酯转化率和乙醇选择性
由以上分析可知,在醋酸甲酯加氢反应体系中,升高压力在有助于提高乙醇产量的同时能有效减少副产物;但当压力高于2.0 MPa时,反应体系的组成随压力的升高变化不明显。因此,醋酸甲酯加氢反应压力维持在2.0~3.0 MPa较适宜。
2.2.3 氢酯比的影响
不同氢酯比下醋酸甲酯加氢反应体系的平衡组成见图6。从图6可看出,醋酸甲酯含量随氢酯比的增加而降低,在氢酯比小于10时,醋酸甲酯含量随氢酯比的增加快速降低;氢酯比超过10后,醋酸甲酯含量随氢酯比的增加缓慢下降;氢酯比达到30时,醋酸甲酯含量小于1%(x)。乙醇含量随氢酯比的增加而增大,氢酯比大于10后,乙醇含量随氢酯比的增加缓慢提高;氢酯比达到30时,乙醇含量超过49%(x)。在温度470 K、压力2 MPa下,该反应体系中乙醛含量几乎为零,乙酸乙酯含量随氢酯比的增加而降低。在氢酯比低于7时,甲醇含量随氢酯比的增加而快速提高;当氢酯比大于7后,甲醇含量趋于稳定(超过49%(x))。
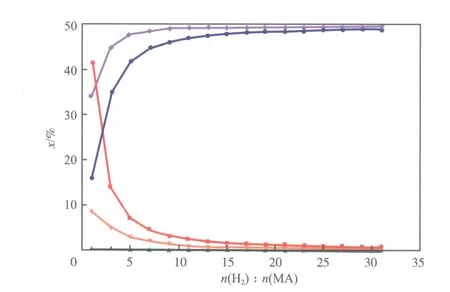
图6 不同氢酯比下醋酸甲酯加氢反应体系的平衡组成
不同氢酯比下的醋酸甲酯转化率和乙醇选择性见图7。
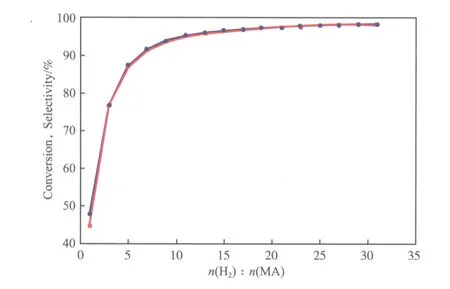
图7 不同氢酯比下的醋酸甲酯转化率和乙醇选择性
从图7可看出,醋酸甲酯转化率和乙醇选择性均随氢酯比的增加而提高。当氢酯比小于10时,醋酸甲酯转化率和乙醇选择性均随氢酯比的增加快速提高;氢酯比超过10后,醋酸甲酯转化率和乙醇选择性随氢酯比的增加缓慢提高;当氢酯比达到20时,醋酸甲酯转化率和乙醇选择性均超过97%。
由以上分析可知,醋酸甲酯加氢反应体系应维持适当的氢酯比,氢酯比太低不利于醋酸甲酯的转化和乙醇的生成,氢酯比太高则会造成原料氢气的浪费,适宜的氢酯比为10~20。
3 结论
1)在423~723 K的温度范围内,醋酸甲酯加氢反应体系3个独立反应的标准摩尔反应吉布斯自由能均大于0,若没有适当的反应压力和氢酯比,醋酸甲酯的转化率将会很低。
2)低温有利于乙醇的生成,同时能减少副产物,为获得较高的乙醇收率,反应温度不宜过高,但温度过低可能会使反应速率太慢。适宜的反应温度为423~550 K。
3)升高压力有助于提高乙醇的产量,同时能有效减少副产物,当压力大于2.0 MPa时,反应体系的组成随压力的升高变化不明显,因此反应压力维持在2.0~3.0 MPa较适宜。
4)增大氢酯比有利于提高醋酸甲酯转化率和乙醇选择性,但过高的氢酯比会造成原料氢气的浪费,因此氢酯比维持在10~20较适宜。
符 号 说 明
a,b,c,d系数
Cp m摩尔定压热容,J/(mol·K)
ΔrCp m反应过程的摩尔定压热容变,J/(mol·K)
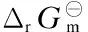

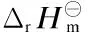
K⊖标准平衡常数
n物质的量,mol
p压力,MPa
R气体常数,8.314 J/(mol·K)
r氢气与醋酸甲酯的摩尔比
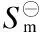
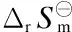
T温度,K
ζ反应产物的生成量,mol
[1] 李振宇,黄格省,杨延翔,等. 燃料乙醇生产技术路线分析及产业发展建议[J]. 现代化工,2011,31(8):1-5.
[2] 孙陆晶. 燃料乙醇产业前景[J]. 化学工业,2011,29(1):8-11.
[3] 周颖霏,钱伯章. 醋酸生产技术进展及市场分析[J]. 化学工业,2010,28(9):19-45.
[4] Claus P, Lucas M, Liicke B. Selective Hydrogenolysis of Methyl and Ethyl Acetate in the Gas Phase on Copper and Supported Group Ⅷ Metal Catalysts[J].ApplCatal,A, 1991, 79(1): 1-18.
[5] Scheur F T, Staala L H. Effects of Zinc Addition to Silica Supported Copper Catalysts for the Hydrogenolysis of Esters[J].ApplCatal,A, 1994, 108(1): 63-83.
[6] Brands D S, Poels E K, Bliek A. Ester Hydrogenolysis over Promoted Cu/SiO2Catalysts[J].ApplCatal,A, 1999, 184(2): 279-289.
[7] 雷陈明,顾顺超,阎建民,等. Cu/SiO2的表征及其在乙酸乙酯加氢合成乙醇中的催化性能[J]. 石油化工,2013,42(6):615-619.
[8] 刘业奎,王黎,侯栋,等. 二氧化碳加氢合成低碳烯烃反应平衡体系热力学研究[J]. 催化学报,2004,25(3):210-218.
[9] Santiago M A N, Castillo M A S, Cortright R D, et al. Catalytic Reduction of Acetic Acid, Methyl Acetate, and Ethyl Acetate over Silica-Supported Copper[J].JCatal, 2000, 193(1): 16-28.[10] 王凡,郑丹星. 甲烷氧化偶联制烯烃的热力学平衡限度[J]. 燃料化学学报,2006,34(1): 71-74.
[11] 马沛生,李永红. 化工热力学[M]. 2 版. 北京:化学工业出版社,2009:288-305.
[12] 尹安远,戴维林,范康年. 草酸二甲酯催化加氢合成乙二醇过程的热力学计算与分析[J]. 石油化工,2008,37(1):62-66.
[13] 朱开宏,袁渭康. 化学反应工程分析[M]. 北京: 高等教育出版社, 2002: 3-20.
(编辑 安 静)
敬告读者:为庆祝天津大学建校一百二十周年,《石油化工》自2015年第1期开始在 “专题报道”栏目连续刊登天津大学化工学院的系列报道。主要针对天津大学化工学院在分离技术、医药 结晶技术、生物加工技术、先进燃料技术、新型催化剂与反应技术、能源及资源的高效清洁转化利用、功能导向物质的设计与绿色合成等方面的领先技术成果进行报道 。敬请广大读者给予关注。
专题报道:燃料乙醇作为一种清洁能源,已经成为21世纪车用燃料的重要替代品。鉴于我国醋酸产能的严重过剩,醋酸酯加氢制燃料乙醇具有重大前景。天津大学化工基础实验中心针对醋酸甲酯加氢制乙醇过程中的热力学问题进行了研究。通过吉布斯自由能探究了醋酸甲酯加氢制乙醇反应的可行性;确定了反应温度、压力和氢酯比等工艺条件对醋酸甲酯转化率和乙醇选择性的影响。该研究结果将为相应催化剂的研发以及反应工艺条件的优化提供理论依据。见本期409-414页。
天津大学化工学院化工基础实验中心简介:天津大学化工学院化工基础实验中心(简称“实验中心”)于2006年成为首批国家级化学化工实验教学示范中心;拥有自己研制的教学设备100多套,形成的“全方位、立体化、开放式”的实验教学体系及相应的设备已被同行广泛认可,作为主要完成人获得了国家级教学成果一等奖1项、二等奖3项。实验中心下属的“绿色能源课题组”长期从事新能源综合利用技术的研究,在条形平面镜聚光、建筑一体化供暖和制冷、太阳电池热电联用、聚光光伏液浸散热、多风轮风力发电等方面取得显著的成果,完成建筑一体化供暖和制冷项目建筑面积达百万平方米。实验中心下属的“化工过程强化课题组”长期围绕国家与企业的重大需求,致力于多相化工过程的多尺度特性研究,研发功能新材料、过程强化新装备以及流程工业清洁生产新工艺,以实现能源、化工、制药等工业过程的节能减排、技术升级,已在化工过程强化、高效混合方面建成2个校企联合工程中心,搭建了良好的产学研相结合的科研成果转化平台,形成的成果已在数百家企业应用。实验中心已培养博士、硕士研究生200多名,将继续秉承人才培养与学科前沿紧密结合的理念,不断研发新材料、新技术,为我国流程工业的可持续性发展提供技术支撑。
Thermodynamic Analysis for Hydrogenation of Methyl Acetate
SunChengwei,GuoCuili,YeChenliang,QinHongyun
(The School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China)
The thermodynamics of methyl acetate hydrogenation system was studied and the Gibbs free energies of the reactions in the system were calculated. The effects of temperature, pressure and the molar ratio of hydrogen to methyl acetate on the equilibrium composition, methyl acetate conversion and ethanol selectivity were investigated. The results showed that the standard Gibbs free energies of all the reactions were more than 0 when the reaction temperature was in the range of 423-723 K, so the reactions should be carried out under suitable pressure and the appropriate molar ratio. Low temperature is beneficial to the production of ethanol and can inhibit the generation of by-products, and the suitable reaction temperature is in the range of 423-550 K. The conversion of methyl acetate and the selectivity to ethanol quickly increased with the pressure rise while the pressure is less than 2.0 MPa, so the suitable reaction pressure is in the range of 2.0-3.0 MPa. The conversion of methyl acetate and the selectivity to ethanol are very sensitive to the molar ratio of hydrogen to methyl acetate at the ratio less than 10, so the suitable molar ratio is in the range of 10-20.
methyl acetate; hydrogenation; ethanol; thermodynamics analysis; Gibbs free energy
2014-12-02;[修改稿日期]2015-01-06。
孙成伟(1989—),男,山东省泰安市人,硕士生。联系人:郭翠梨,电话022-27404495,电邮gcl@tju.edu.cn。
1000-8144(2015)04-0409-06
TQ 013.1
A

