促红细胞生成素对外伤性颅脑损伤大鼠神经丝的保护作用
刘健,高佳星,汪叶松
(1.四川省绵阳市人民医院 脑外科,四川 绵阳 621000;2.四川省绵阳市人民医院 妇产科,四川 绵阳 621000;3.浙江大学医学院附属第二医院 脑外科,浙江 杭州 310000)
促红细胞生成素对外伤性颅脑损伤大鼠神经丝的保护作用
刘健1,高佳星2,汪叶松3
(1.四川省绵阳市人民医院 脑外科,四川 绵阳 621000;2.四川省绵阳市人民医院 妇产科,四川 绵阳 621000;3.浙江大学医学院附属第二医院 脑外科,浙江 杭州 310000)
目的 观察促红细胞生成素(erythropoietin EPO)对创伤性颅脑损伤(traumatic brain injury,TBI)大鼠脑皮质中神经丝的影响,并探讨其意义。方法 45只Wistar大鼠按随机原则分为9组,正常对照组、颅脑损伤组(各组于建模后6、12、24、72 h取标本),EPO处理组(各组于建模后6、12、24、72 h取标本),每组5只,采用Myneurolab脑立体定向仪和Benchmark颅脑损伤撞击器制作创伤性颅脑损伤模型。应用免疫组化法观察上述时间点损伤灶周围皮层神经丝的形态改变,Western blot检测各时间点中神经丝蛋白H(neurofilament H,NF-H)的表达变化。结果 免疫组化结果显示:正常对照组NF-H含量丰富,呈棕黄色丝状结构,在脑皮质的大椎体细胞层、小椎体细胞层,海马区,胼胝体中表达尤为明显,而颅脑损伤组于脑外伤后6 h见NF-H较正常组稀疏,部分结构中断,6~24 h内可见神经丝数目进一步减少,排列紊乱加重,至24 h破坏程度达到高峰,72 h时上述情况有所缓解,外伤后EPO处理组神经丝数量在各个时间点均比外伤组多,且排列较外伤组整齐。神经丝的密集程度在12 h达到高峰,然后逐渐降低。Western blot显示:与正常组相比,颅脑损伤组损伤后 6h可见 NF-H 的表达减少(P<0.05)。6~12 h内NF-H蛋白表达持续减少(P<0.05),24 h 后达最低值(P<0.01),72 h时升高(P< 0.05)。但与颅脑损伤各组比较,EPO处理组NF-H的表达升高(P<0.05)。结论 EPO对脑具有保护作用,其可能机制为抑制神经丝蛋白降解。
促红细胞生成素;创伤性脑损伤;神经丝
颅脑损伤发生率居高不下,目前护脑药物疗效不确切,寻找新的治疗药物成为当务之急[1]。神经丝三联蛋白NF-L,NF-M,NF-H,是神经细胞的骨架蛋白,对于维持神经细胞的结构稳定,信号转导,轴浆运输等方面有重要作用。神经细胞骨架在脑损伤后15 min即可在损伤灶同侧及对侧检测到有轻微的形态改变,并在24 h内降解逐渐加重[2]。通常在脑损伤后,三联蛋白中神经丝蛋白H(neurofilament H,NF-H)的降解最为严重,因此常将其作为评价早期脑损伤程度的标志物[3]。近年来,多项细胞和动物实验证实促红细胞生成素(erythropoietin,EPO)可以减轻脑损伤,发挥神经保护作用,但其保护机制尚未完全明确[4]。美国国立卫生研究院(NIH)等多处研究机构进行临床试验的验证EPO能否减轻颅脑损伤以及帮助患者获得康复[5]。对于EPO的脑保护作用的研究多有报道[6-10],脑损伤后神经丝降解这一重要的病理生理机制的论述也常见,而对于EPO对神经丝的保护作用及其机制却鲜有研究。因此,本文旨在观察促红细胞生成素对创伤性颅脑损伤(traumatic brain injury,TBI)大鼠脑皮质中神经丝的影响,并探讨其意义。
1 材料与方法
1.1 实验动物及分组 SPF级健康雄性Wistar 大鼠45只,8周龄,体质量(220±20)g,许可证号2003-0004,由湖北省疾控中心提供。按随机原则分为9组,正常对照组、颅脑损伤组(各组于建模后6、12、24、72 h取标本),EPO处理组(各组于建模后6、12、24、72 h取标本),每组各5只,本实验遵循《实验动物保护条例》。
1.2 主要仪器及耗材 大鼠脑立体定向仪,电动颅钻、BenchmarkTM电磁颅脑损伤撞击器(美国Myneurolab公司);明胶海绵、骨蜡(武汉大学人民医院);LS-50HJ不锈钢压力锅(广州罡然机电设备有限公司);MSE微量电子天平(上海亚津电子科技有限公司);GT10-1台式高速离心机(北京时代北利离心机有限公司);DZF-6050干燥箱(北京北方利辉试验仪器设备有限公司);GSS/DSS不锈钢切片架(北京桑翌实验仪器研究所);YD-202A切片机(广州晟龙实验仪器有限公司);OLYMPUS BX51显微镜(上海泽仕光电科技有限公司);水浴箱(常州中捷实验仪器制造有限公司);SW-CJ-2D超净工作台(深圳市超杰实验仪器有限公司);电化学发光(ECL)系统(美国Pierce公司)。
1.3 主要试剂 EPO[沈阳三生制药股份有限公司,国药准字(2000)沈三生s-01号];NF-H 鼠抗人多克隆抗体(Santa Cruz公司,sc-56575);辣根过氧化物酶(HRP)标记羊抗鼠二抗、SP 试剂盒、DAB 显色试剂盒(武汉博士德);GAPDH(Santa Cruz 公司);4%多聚甲醛、PBS液(武汉大学基础医学院);胰蛋白酶(美国Amresco公司)。
1.4 方法 颅脑损伤模型的建立[11]:将实验大鼠在室温(23±2) ℃,湿度60%~80%的环境中适应性喂养2 d,用新配制的10%水合氯醛(4 mL/kg体质量) 腹腔注射麻醉,俯卧位,头部固定于脑立体定向仪上,沿中线剪开头皮,暴露右顶骨,用牙科钻在冠状缝后 1.5 mm、矢状线旁2.5 mm处钻孔并扩大为一直径5 mm骨窗,注意保持硬脑膜完整。正常对照组骨窗造好后用骨蜡封闭,然后缝合头皮。颅脑损伤组用同样方法制造骨窗,然后用BenchmarkTM电磁颅脑损伤撞击器撞击硬脑膜(深度为2.0 mm,撞击面直径2.0 mm,撞击速度为4 m/s),致右顶叶脑挫裂伤,保持硬脑膜完整,骨蜡封闭骨窗。造模好后供给饲料和饮水,分笼饲养。
EPO处理组如上方法造模成功后10 min,大鼠腹腔注射EPO,剂量为5000 U/kg,然后分笼饲养,常规供给饲料和饮水。
术后未见死亡大鼠,外伤后6、12、24、72 h时间段处死大鼠5只,取大鼠脑组织。
1.5 检测指标 Western blot检测NF-H的表达:将组织样品按每10 mg组织加入 50 μL裂解液的比例加入裂解液,用玻璃匀浆器在冰浴中匀浆,直至组织充分裂解。裂解后10000 r/min 4 ℃ 离心5 min,取上清。取适量上清加入5×SDS loading buffer,沸水煮5~10 min 冷却至室温后上样电泳。分别配制8%和12%的PAGE胶,各样品取等量上样电泳。GAPDH用12%的PAGE 胶;NF-H 用8%的PAGE分离胶。80 V电压开始电泳,待溴酚蓝跑过积层胶后将电压升高至120 V,根据预染marker显示,判断目的蛋白充分分离后,停止电泳。以同一样品中各目的蛋白OD值/GAPDH OD值的比值作为检测蛋白的相对含量。用 Image-Pro Plus 6.0软件进行图象分析。
免疫组化法观察NF-H的表达:把本实验中固定好的的脑部石蜡切片置于65 ℃烘箱中,烘片2 h,脱蜡至水,用 PBS(pH7.4)冲洗3次,每次5 min;高压热修复;室温下孵育;甩去PBS液,一抗1:200浓度稀释,4 ℃过夜;甩去PBS液,用的二抗,浓度1:200每张切片加50~100 μL稀释液,室温下孵育30~60 min;显色;自来水冲洗,复染,0.1%盐酸分化,PBS冲洗返蓝;切片经过梯度酒精(70%~100%)脱水干燥,透明,封固。PBS液代替一抗作为阴性对照。在200倍镜下拍照观察各组NF-H表达变化情况。
2 结果
2.1 NF-H的免疫组化结果 正常对照组 NF-H的免疫组化结果:NF-H在组织切片上含量丰富,呈棕黄色丝状结构,在脑皮质的大椎体细胞层、小椎体细胞层,海马区,胼胝体中表达尤为明显。NF-H在大椎体细胞层中,大部分呈微细平行的丝状排列,少部分交织成网状(见图1)。

图1 正常对照组NF-H的免疫组化结果(×200)Fig.1 The immunohistochemical results of NF-H in normal control group(×200)
颅脑损伤组NF-H的免疫组化结果:脑外伤后6 h见神经丝较正常组稀疏,部分结构中断,6~24 h内可见神经丝数目进一步减少,排列紊乱加重,至24 h破坏程度达高峰,72 h时上述情况有所缓解(见图2)。

图2 大鼠创伤性颅脑损伤后不同时间NF-H的免疫组化结果(×200)Fig.2 The immunohistochemical results of NF-H after traumatic brain injury at different time(×200)
EPO处理组的免疫组化结果:EPO 处理组与正常对照组相比,神经丝数量减少。但是在各个时间点均比外伤组的数量多,且排列较外伤组整齐。神经丝的密集程度在12h达到高峰,然后逐渐降低(见图3)。
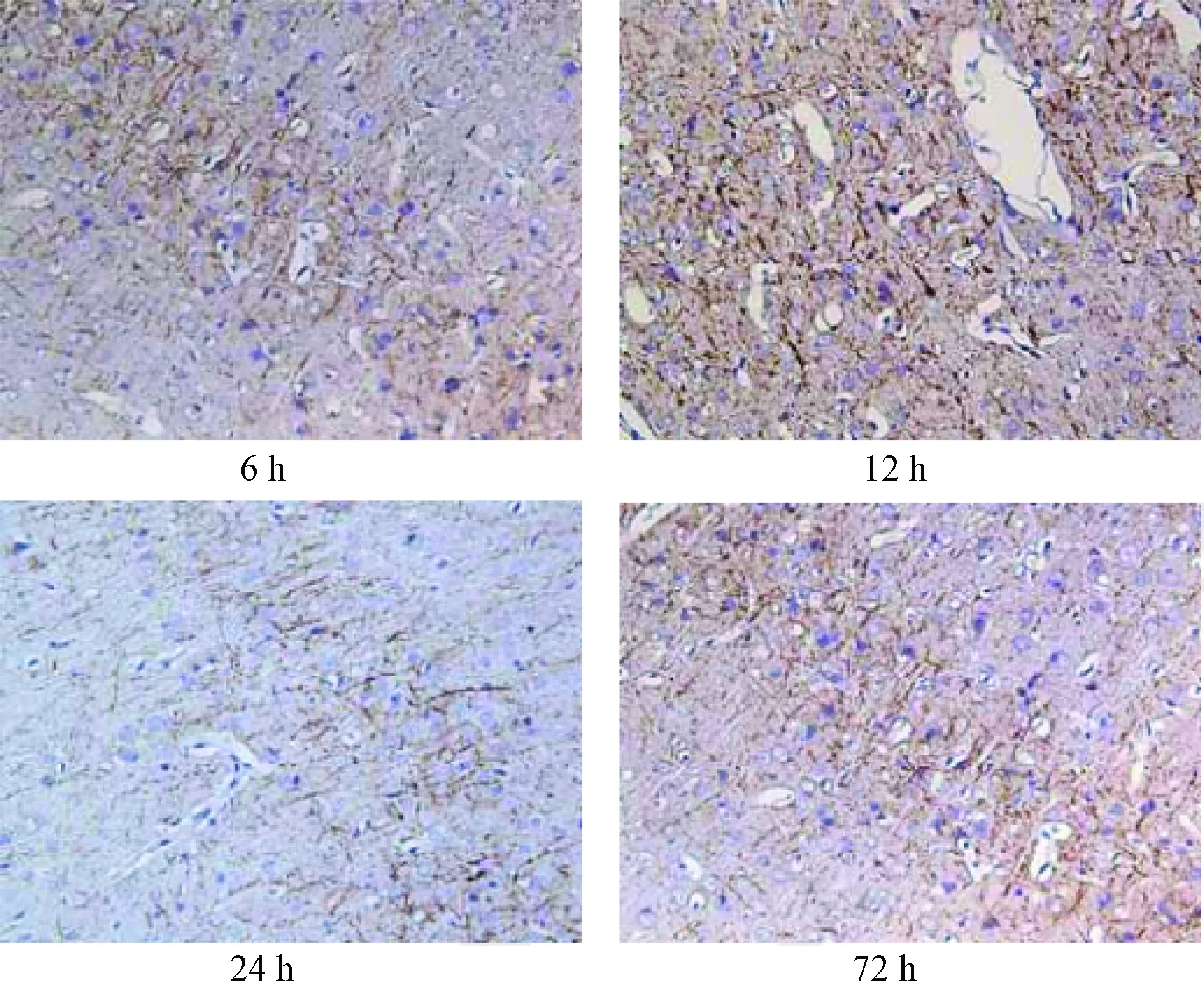
图3 大鼠创伤性颅脑损伤使用EPO后不同时间NF-H的免疫组化结果(×200)Fig.3 The immunohistochemical results of NF-H after given EPO in rats with traumatic brain injury at different time(×200)
2.2 NF-H的Western blot免疫印迹结果 与对照组比较,颅脑损伤各组脑损伤后6 h即可见NF-H的表达减少(P<0.05)。6 h至12 h内NF-H蛋白表达持续性减少,24 h 后达最低值(P<0.01)。72 h时升高,但差异仍具有统计学意义(P< 0.05)。与颅脑损伤相同时间点比较,EPO处理组显著提高了NF-H的表达(P<0.05),见表1。
表1 Western blot检测NF-H蛋白表达量Tab.1 The expression levels of NF-H protein detected by Western ±s)
**P<0.01,*P<0.05,与对照组比较,compared with control group;#P<0.05,与TBI组比较,compared with TBI group
3 讨论
近年来,多项体内外实验证实促红细胞生成素可以发挥神经保护作用,目前研究表明其机制可能为:减少兴奋性氨基酸毒性的作用、抗氧化作用、抗炎作用、抗凋亡作用、稳定细胞代谢、促进血管形成等[11]。神经丝三联蛋白NF-L,NF-M,NF-H,是神经细胞的骨架蛋白,对于维持神经细胞的结构稳定、信号转导、轴浆运输等起重要作用。神经丝蛋白的降解会导致神经细胞的崩解,信号传导障碍,及神经细胞功能紊乱,宏观则表现为神经功能的缺失。国外研究表明NC证实脑损伤后NF-H的表达量会有明显改变[12-14]。
本实验将NF-H作为评价早期脑损伤的指标。和对照组比较:免疫组化表明,脑损伤后神经丝结构发生紊乱,损伤后6 h即可见神经丝较正常组稀疏,部分结构中断,6~24 h内可见神经丝排列紊乱加重,至24 h破坏程度达到高峰;Western blot表明6、12、24、72 h各时段颅脑损伤组均较对照组NF-H量减少(P<0.01)。由此提示神经丝在脑损伤后会发生降解,且在早期即有明显的改变。将脑损伤组和EPO处理组比较:脑损伤使用EPO之后,神经丝排列较外伤组整齐,神经丝的密集程度在12 h达到高峰,然后逐渐降低;Western blot表明各时段用药组均较外伤组NF-H数量多(P<0.05),且在12 h和24 h更加明显(P<0.01)。以上结果提示EPO具有保护细胞骨架抑制其降解的功能。尤其需要注意的是外伤用药后12 h的神经丝更加密集,神经丝蛋白的表达量也是用药后的最高值,表明EPO早期的脑保护作用更强。由于原发性脑损伤主要是由于受伤本身及伤后早期的病理生理演变所致,结合本实验可以进一步推测EPO通过抑制神经丝蛋白的降解,从而对原发性脑损伤有较好的减轻作用。
本实验通过脑立体定向仪和电磁颅脑损伤撞击器制作创伤性颅脑损伤模型,致伤部位、范围、深度、撞击速度等参数都进行数字化设定,避免了常规颅脑损伤模型中的致伤程度不一致,重复性差的缺陷,较精确地模拟了临床创伤性颅脑损伤的致伤特点,为实验研究奠定了基础。本试验将NF-H作为评价脑损伤程度的指标,检测不同的干预措施对NF-H的形态和量的改变,来评价干预措施对脑的影响。同时设定不同的观察时间点,有利于进一步明确NF-H的变化趋势。NF-H作为评价脑损伤程度的指标已经被广泛使用,敏感性好,特异性高,同时通过免疫组化检测的图像直观清晰,具有其他检测指标无法替代的优势。
综上所述,创伤性颅脑损伤后,给予外源性EPO能抑制神经丝降解,达到保护神经作用。其通过何种途径发挥抑制作用则需要进一步研究。
[1] Siren A,Fratelli M,Brines M,et al.Erythropoietin prevents neuronal apoptosis after cerebral ischemia and metabolic stress[J].Proc Natl Acad Sci,2001,98(7):4044-4049.
[2] 刘玲,董强.缺血性神经元损害中非谷氨酸依赖的钙离子毒性机制,神经损伤与功能重建[J],2007,2(3):133-138.
[3] Zhang Y,Xiong Y,Mahmood A,et al.Therapeutic effects of erythropoietin on histological and functional outcomes following traumatic brain injury in rats are independent of hematocrit[J].Brain Res,2009,1294(9):153-164.
[4] 王双坤,刘佰运,郝淑煜,等.创伤性脑损伤的动物实验模型[J].中国交通医学杂志,2005,19(4):327-329.
[5] Siren A,Fratelli M,Brines M,et al.Erythropoietin prevents neuronal apoptosis after cerebral ischemia and metabolic stress[J].Proc Natl Acad Sci,2001,98(7):4044-4049.
[6] Pina NC,Detloff MR,Bobroski WF,et al.Cytoskeletal protein degradation and neurodegener- ation evolves differently in males and females following experimental head injury[J].Exp Neurol, 2003,180(1):55-73.
[7] Saatman KE,Creed J,Raghupathi R,et al.Calpain as a therapeutic target in traumatic brain injury[J].Neurotheraputics,2010,7(1):31-42.
[8] Sinor AD,Greenberg DA.Erythropoietin protects cultured cortical neurons,but not astroglia,from hypoxia and AMPA toxicity[J].Neurosci Lett,2000,290(3):213-215.
[9] Ruscher K,Freyer D,Karsch M,et al.Erythropoietin is a paracrine mediator of ischemic tolerance in the brain:evidence from an in vitro mode1[J].J Neurosci,2002,22(23):10291-10301.
[10] Kumral A,Genc S,Ozer E,et al.Erythropoietin down regulates Bax and DP5 pro-apoptotic gene expression in neonatal hypoxic-ischemic brain injury[J].Biol Neonate,2005,89(3):205-210.
[11] 王双坤,刘佰运,郝淑煜,等.创伤性脑损伤的动物实验模型[J].中国交通医学杂志,2005,19(4):327-329.
[12] Brines M,Cerami A.Erythropoietin-mediated tissue protection:reducing collateral damadge from the primary injury response[J].J Inter Med,2008,264(5):405-432.
[13] Nagai A,Nakagawa E,Choi HB,et al.Erythropoietin and erythropoietin receptors in human CNS neurons,astrocytes,microglia,and oligodendrocytes grown in culture[J].J Neuropathol Exp Neurol,2001,60(4):386-392.
[14] Grasso G,Sfacteria A,Cerami A,et al.Erythropoietin as a tissue-protective cytokine in brain injury:what do we know and where do we go?[J].Neuroscientist,2004,10(2):93-98.
(编校:王俨俨)
Neuroprotective effect of EPO on neurofilaments in rats with traumatic brain injury
LIU Jian1,GAO Jia-xing2,WANG Ye-song3
(1.Department of Neurosurgery, Mianyang City People’s Hospital, Mianyang 621000, China; 2.Department of Obstetrics and Gynecology, Mianyang City People’s Hospital, Mianyang 621000, China; 3.Department of Cerebral Surgery, The Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310000, China)
ObjectiveTo observe the erythropoietin (EPO) on neurofilaments in rats traumatic brain injury(TBI) and its significance.Methods45 Wistar rats were divided into nine groups: normal control group, brain injury(6, 12, 24, 72 h after brain injury), and EPO treatment after brain injury(6, 12, 24, 72 h after brain injury).The Myneurolab of stereotactic apparatus and the Benchmark of traumatic brain injury impactor were used to produce TBI model.The morphologic changes of neurofilament were observed by immunohistochemistry in lesion peri cortex,and the expressions of neurofilament H(NF-H) were detected by Western blot at the above time points.ResultsThe immunohistochemistry result showed that in normal control group, NF-H was abundant in tissue section with the tan filamentous structure, and existed in big cones, small cones, hippocampus, especially obvious in corpus callosum of cerebral cortex layer; in brain injury group, NF-H was sparse with part of the structure interrupted after traumatic brain injury of 6h, further nerve filament number reduced with disordered arrangement after 6~24 h, the damage reached its peak after 24 h, and the above situation eased after 72 h.The number of neurofilaments in EPO treatment group at each time point was higher than that in brain injury group after trauma, arranged neatly and the intensity of neurofilament reached the peak at 12 h, then gradually reduced.Western blot result showed that compared with normal group, the expression of NF-H reduced after traumatic brain injury of 6h (P<0.05), within 6~12 h NF-H protein expression persistent decrease (P< 0.05), reached the lowest after 24 h (P<0.01), and elevated after 72 h (P<0.05).But compared with groups of brain injury, the expression of NF - H decreased in EPO treatment group (P<0.05). Conclusion EPO has a neuroprotective effect, and its possible mechanism is to inhibit the degradation of neurofilament protein.
traumatic brain injury; erythropoietin;neurofilaments
2012年浙江省医药卫生科技计划(2012KYB096)
刘健,男,本科,主治医师,研究方向:脑外伤,E-mail:lj1104881684@163.com。
R3
A
1005-1678(2015)02-0063-04

