二磷酸盐对骨癌痛模型小鼠趋化因子CXCL1及受体CXCR2表达影响的研究
李宾,张卉,张辉
(1.河南黄淮学院 生物工程系,河南 驻马店 463000;2.河南黄淮学院 护理学系,河南 驻马店 463000;3.驻马店市中心医院 泌尿外科,河南 驻马店 463000)
二磷酸盐对骨癌痛模型小鼠趋化因子CXCL1及受体CXCR2表达影响的研究
李宾1,张卉2,张辉3
(1.河南黄淮学院 生物工程系,河南 驻马店 463000;2.河南黄淮学院 护理学系,河南 驻马店 463000;3.驻马店市中心医院 泌尿外科,河南 驻马店 463000)
目的 分析趋化因子CXCL1及受体CXCR2在小鼠骨癌痛模型中的作用,并探讨二磷酸盐对小鼠骨癌痛模型的干预机制。方法 60只小鼠随机分为3组:对照组、模型组和治疗组。股骨远端骨髓腔注射NCTC2742细胞复制小鼠股骨痛模型,治疗组给予二磷酸盐治疗,对照组和模型组给予等量生理盐水。Real-time PCR分析各组中趋化因子CXCL1和CXCR2mRNA的表达,Western blot检测CXCL1、CXCR2蛋白及肿瘤坏死因子TNF-α以及细胞凋亡蛋白Bax/Bcl2以及Caspase-3的表达。结果 模型组小鼠的机械缩爪阈值较对照组有显著的增高(P<0.05,P<0.01),而药物治疗组对模型组小鼠的升高的阈值有显著的改善作用(P<0.01);与对照组比较,骨癌痛模型小鼠趋化因子CXCL1及受体CXCR2表达明显增强(P<0.01),二磷酸盐可以显著抑制CXCL1及CXCR2的表达(P<0.01);与对照组比较,骨癌痛模型小鼠肿瘤坏死因子TNF-α、促细胞凋亡蛋白Bax及Caspase-3的表达明显增高,凋亡蛋白Bcl2的表达明显降低(P<0.01),而二磷酸盐可以显著改善上述指标表达(P<0.01)。结论 二磷酸盐通过下调骨癌痛模型小鼠趋化因子CXCL1及受体CXCR2表达、促进细胞凋亡发挥治疗骨癌痛模型小鼠的作用。
二磷酸盐;骨癌痛;趋化因子;细胞凋亡;受体
骨癌是发生于骨骼及其附属组织的恶性肿瘤,临床上进展迅速、预后不佳、死亡率高[1-3]。骨癌临床上表现为功能障碍、肿胀或肿块以及压迫症状,但其早期出现的主要症状为疼痛[4-5]。但是,目前对骨癌的发病机制尚未完全阐明。临床上治疗骨癌主要采用手术切除、化疗及放疗方法。本研究采用股骨远端骨髓腔注射NCTC2742细胞复制小鼠股骨痛模型,分析趋化因子CXCL1及受体CXCR2在小鼠骨癌痛模型中的参与作用,并探讨二磷酸盐对小鼠骨癌通模型的干预机制。同时研究也分析了TNF-α及细胞凋亡的参与机制,以期为临床相关治疗机研究提供借鉴。
1 材料与方法
1.1 动物及分组 实验用昆明小鼠购自上海斯莱克实验动物中心[合格证号SZXK(上)20080033],体质量22~25 g。小鼠于(22±2)℃、湿度(50±5)%适应性饲养1周,自由饮水。60只小鼠随机分为3组:对照组、模型组和治疗组(n=20)。所有操作均符合《实验动物保护条例》。
1.2 仪器与试剂 mRNA提取及逆转录试剂盒:大连宝生物工程有限公司;SYBR Premix Ex Taq:大连宝生物工程有限公司;荧光定量PCR仪:ABI7700,美国ABI公司;引物合成:上海生工生物有限公司;脱脂奶粉:内蒙古伊利乳业有限公司;HRP标记的羊抗小鼠/羊抗兔的二抗:北京中杉金桥生物技术有限公司;一抗购自美国Santa Cruz公司和Abcam公司(详见1.5); PVDF膜:美国Amersham公司;电泳槽、电泳仪及蛋白转移系统:美国ABI公司;戊巴比妥钠购自国药集团化学试剂有限公司(批号20130906);凝胶成像系统购自美国UVP公司。
1.3 骨癌通模型复制 骨癌通模型复制参照马正良等[6]报道的方法:小鼠用戊巴比妥钠麻醉后行右膝关节切开术,并将NCTC细胞(约2×105个)注入股骨远端骨髓腔中,然后将伤口用手术线缝合后于适宜环境下饲养。对照组仅接种MEM培养基。按照文献[6]的方法分析各组动物的机械缩爪阈值。实验结束后取各组小鼠右侧股骨标本于液氮中保存。
1.4 Real-time PCR检测趋化因子CXCL1和CXCR2 mRNA的表达 mRNA的提取及纯化按照说明书进行。Real-time PCR的扩增体系:2×qPCR Mix 5 μL,上游和下游引物各10 pmol,模板cDNA 2 μL,dH2O 1 μL,共10 μL。PCR扩增的反应条件为:95 ℃10 s,60 ℃40 s,共28个循环。采用熔解曲线鉴定qRT-PCR产物,并用公式(ΔCt)进行定量分析。ΔCt=目的基因Ct-内参基因Ct。引物由大连宝生物合成,引物序列见表1。

表1 Real-time PCR引物序列Tab.1 Primer sequences for Real-time PCR
1.5 Western blot检测CXCL1、CXCR2、TNF-α、Bax/Bcl2及Caspase-3蛋白表达 各组动物股骨标本组织充分匀浆,总蛋白提取严格按照说明书操作(蛋白提取试剂盒购自南京建成生物工程研究所)。考马斯亮蓝法蛋白定量后以等量蛋白进行SDS-PAGE和半干法转膜。转至硝酸纤维素膜上后5%脱脂牛奶封闭2h。然后与一抗[CXCL1一抗购自美国Abcam公司(工作浓度1:300);CXCR2蛋白一抗购自美国Santa Cruz公司(工作浓度1:500);TNF-α(工作浓度1:400)、Bax(工作浓度1:500)/Bcl2(工作浓度1:200)及Caspase-3(工作浓度1:300)均购自美国Abcam公司]温孵过夜,PBS漂洗3次后与HRP标记二抗(1:200)室温反应1 h漂洗后ECL混合液显色、曝光、显影、定影,用凝胶成像分析系统测定光密度,以β-actin作为参照,进行蛋白表达的定量分析。
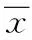
2 结果
2.1 二磷酸盐对骨癌痛模型小鼠机械缩爪阙值影响的分析 本研究发现,模型组小鼠的机械缩爪阈值较对照组有显著的增高(P<0.05,P<0.01),而药物治疗组对模型组小鼠的升高的阈值有显著的改善作用(P<0.05),见图1。

图1 二磷酸盐对骨癌痛模型小鼠机械缩爪阙值影响的分析#P<0.05,##P<0.01,与对照组相比;**P<0.01,与模型组相比Fig.1 The effect of diphosphate on cancer pain threshold in bone pain model and drug interventions#P<0.05,##P<0.01,compared with control group;**P<0.01,compared with model group
2.2 二磷酸盐对骨癌痛模型小鼠CXCL1表达的影响 本研究发现,与对照组比较,骨癌痛模型小鼠趋化因子CXCL1的表达明显增高(P<0.01),而二磷酸盐可以显著抑制上调的CXCL1的表达(P<0.01),见图2。
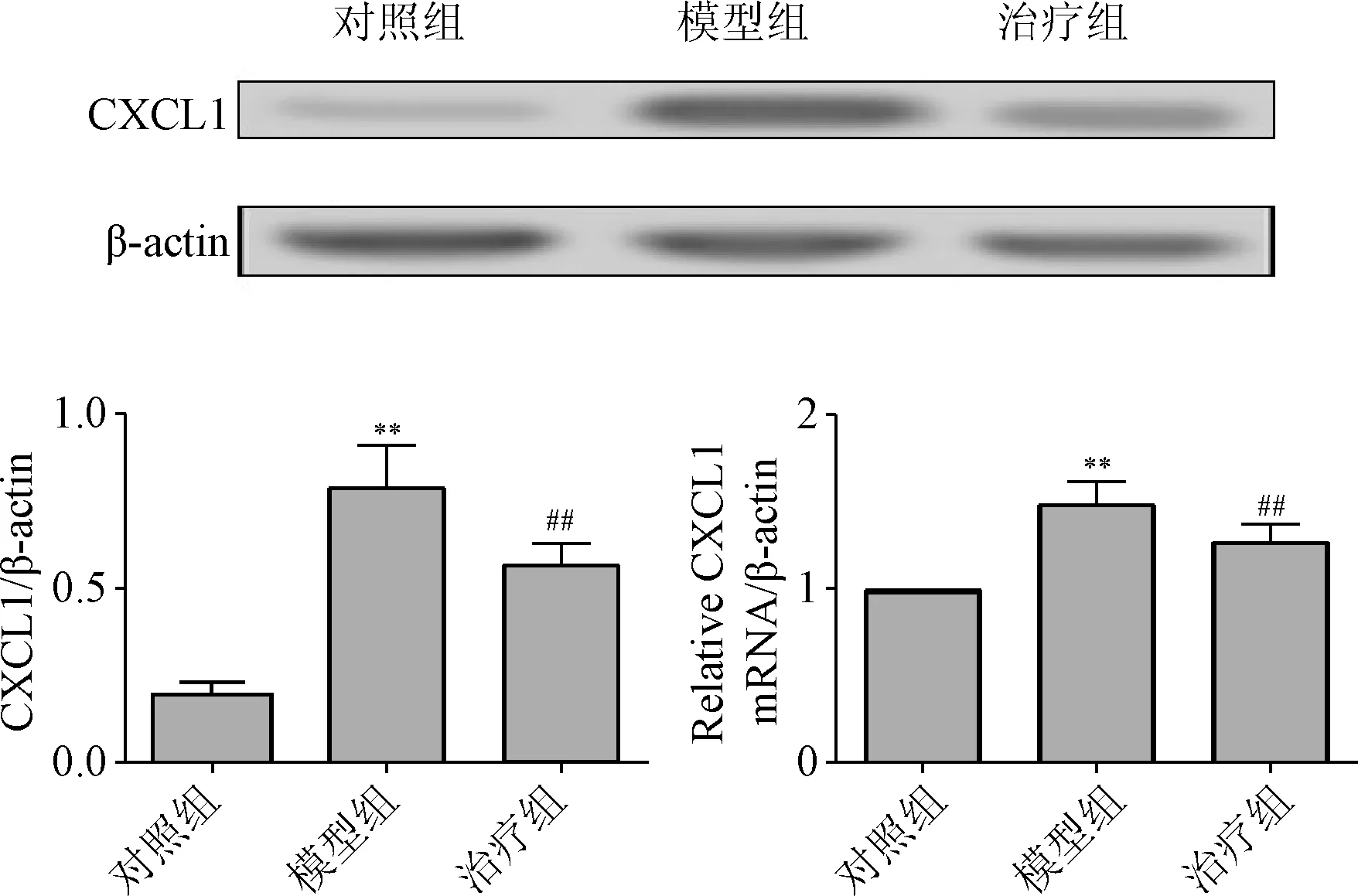
图2 二磷酸盐对骨癌痛模型小鼠CXCL1表达的影响的分析##P<0.01,与对照组相比;**P<0.01,与模型组相比Fig.2 The increased expression of CXCL1 in bone pain model and drug interventions##P<0.01,compared with control group;**P<0.01,compared with model group
2.3 二磷酸盐对骨癌痛模型小鼠 CXCR2受体表达的影响 本研究发现,骨癌痛模型小鼠趋化因子CXCR2的表达明显增高(P<0.01),且与对照组有显著的统计学差异性,而二磷酸盐可以显著抑制上调的CXCR2的表达(P<0.01),见图3。

图3 二磷酸盐对骨癌痛模型小鼠CXCR2表达的影响的分析##P<0.01,与对照组相比;**P<0.01,与模型组相比Fig.3 The increased expression of CXCR2 in bone pain model and drug interventions##P<0.01,compared with control group;**P<0.01,compared with model group
2.4 TNF-α表达分析及二磷酸盐干预作用 本研究发现,骨癌痛模型小鼠肿瘤坏死因子TNF-α的表达明显增高(P<0.01),且与对照组有显著的统计学差异性,而二磷酸盐可以显著抑制上调的TNF-α的表达(P<0.01),见图4。
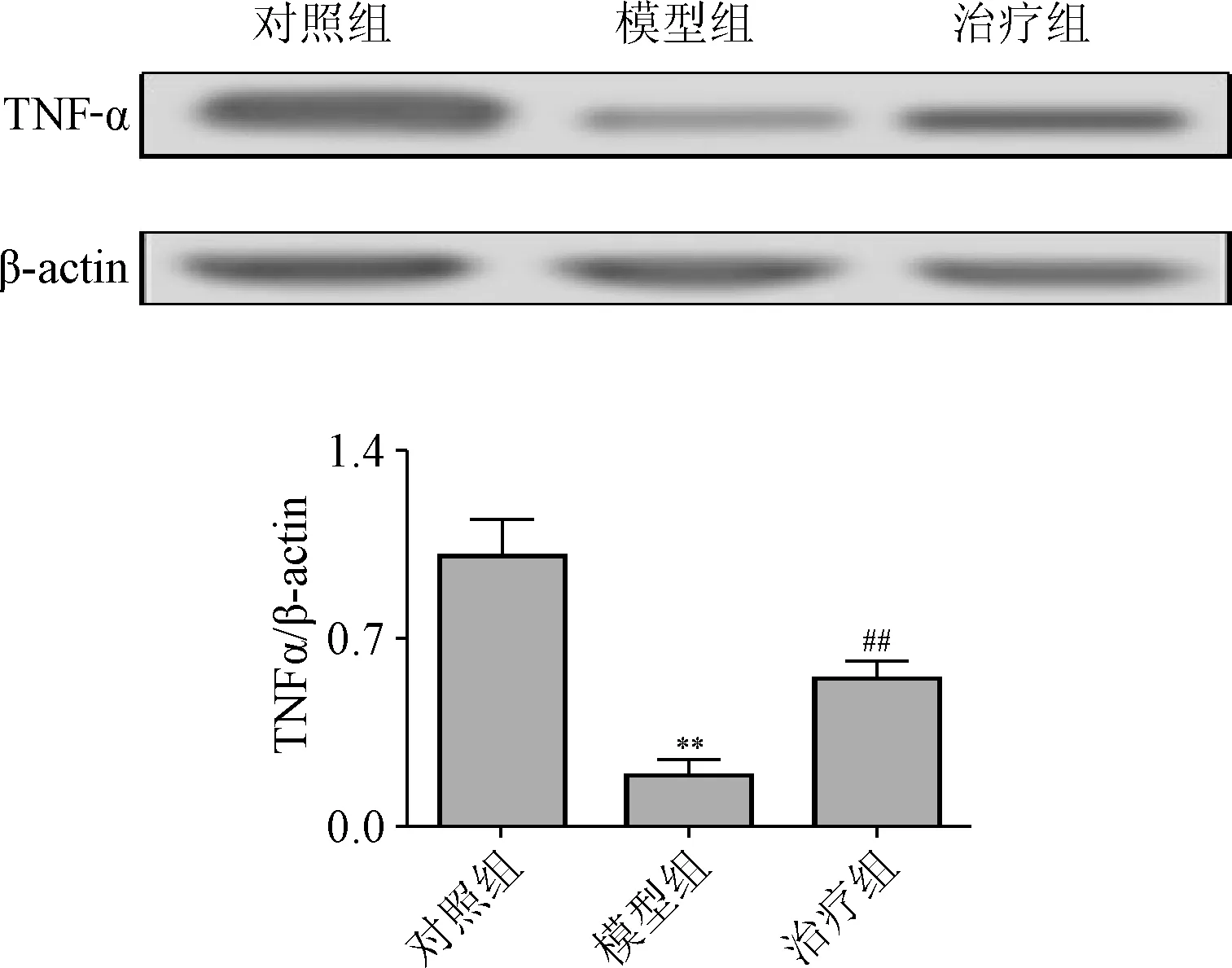
图4 二磷酸盐对骨癌痛模型小鼠TNF-α表达的影响的分析##P<0.01,与对照组相比;**P<0.01,与模型组相比Fig.4 The increased expression of TNF-α in bone pain model and drug interventions##P<0.01,compared with control group;**P<0.01,compared with model group
2.5 细胞凋亡相关蛋白表达及药物干预作用 本研究发现,骨癌痛模型小鼠促细胞凋亡蛋白Bax及Caspase-3的表达明显增高,而抑制凋亡蛋白Bcl2的表达明显降低(P<0.01),且与对照组有显著的统计学差异性,而二磷酸盐可以显著改善上述蛋白的异常表达(P<0.01),见图5。

图5 二磷酸盐对骨癌痛模型小鼠细胞凋亡相关蛋白表达的影响的分析##P<0.01,与对照组相比;**P<0.01,与模型组相比Fig.5 The increased expression of Bax and Caspase-3 as well as decreased expression of Bcl2 in bone pain model and drug interventions##P<0.01,compared with control group;**P<0.01,compared with model group
3 讨论
骨癌是临床上常见的肿瘤之一,进展迅速,其发病率和死亡率有逐年升高的趋势。骨癌有原发性骨癌和继发性骨癌。如临床上前列腺癌患者容易发生骨转移,严重影响患者的生活质量。目前,骨癌模型通常采用跟骨、胫骨等建立模型,股骨由于骨髓腔较大,容易操作[7-9],因此本研究采用股骨建立骨癌模型,分析趋化因子CXCL1及受体CXCR2在小鼠骨癌痛模型中的参与作用。研究发现,模型组小鼠CXCL1及受体CXCR2表达明显增强,同时TNF-α以及促细胞凋亡蛋白Bax和Caspase-3表达下调,而抑制凋亡蛋白Bcl2的表达上调。二磷酸盐治疗组上述蛋白的异常表达得到部分恢复。因此,二磷酸盐通过下调骨癌痛模型小鼠趋化因子CXCL1及受体CXCR2表达、促进细胞凋亡发挥治疗骨癌痛模型小鼠的作用。
骨癌痛是临床上骨癌早期最主要的症状之一,早期症状较轻,而随着病情的加重疼痛度逐渐增加。骨癌痛发展多为持续性发病,在夜间疼痛容易加剧。已有的研究证实,趋化因子及其受体在疼痛的发生及加剧过程中有广泛的参与性,如CCL2/CCR2、CXCL1/CXCR2、CX3CL1/CR1[10-11]。研究证实,骨癌痛患者CCL2与脊髓胶质细胞活化密切相关,且参与了骨癌痛的发生及发展过程[12]。在研究大鼠足底炎性疼痛的研究中也证实,趋化因子IP-10参与完全弗氏佐剂诱导的足底炎症疼痛,而且JNK激酶能够调控佐剂诱导的疼痛和IP-10的表达[13]。以往研究也证实,炎性疼痛中模型中单核细胞趋化因子及其受体信号通路通过增强模型中外周DRG痛觉神经元的兴奋性发挥 调节疼痛病理过程的作用[14]。同时,姜黄素通过下调大鼠脊髓背角和背根节CXCR1的表达缓解神经病理性疼痛[15]。本研究中也证实,小鼠骨癌痛模型组中趋化因子CXCL1及受体CXCR2表达明显增强,而二磷酸盐可以显著下调其表达,提示其可能是通过抑制趋化因子的上调表达缓解NCTC细胞诱导的骨癌痛。
细胞凋亡是细胞的程序化死亡过程,广泛参与了多种病理过程的发展及发展,是由多种促凋亡蛋白和抑制凋亡蛋白所调节的。研究证实,蛇毒复方制剂能够显著下调W256细胞诱导的骨癌痛大鼠组织破骨细胞数量,并促进其细胞凋亡过程,上调骨组织中骨保保护素的表达,发挥对破骨细胞数量和活性的保护作用[16]。同时,在骨癌痛大鼠的镇痛效应研究中也发现,Caspase-3基本的过表达可以诱导神经细胞和非神经细胞的凋亡,而不依赖于外源或上游信号刺激,进而缓解骨癌痛的发展[17]。本研究中也证实,肿瘤坏死因子TNF-α以及细胞凋亡蛋白Bax以及Caspase-3的表达在模型组明显下调,而抑制凋亡蛋白Bcl2的表达却明显下调,而二磷酸盐可以显著改善细胞凋亡蛋白的异常表达,表明细胞凋亡过程参与了NCTC细胞诱导的骨癌痛过程,二磷酸盐主要通过调节趋化因子表达进而促进组织中细胞凋亡过程的发生而发挥缓解骨癌痛模型小鼠的作用。
因此,二磷酸盐通过下调骨癌痛模型小鼠趋化因子CXCL1及受体CXCR2表达、促进细胞凋亡发挥治疗骨癌痛模型小鼠的作用。
[1] 张欣,徐洁,张锦华,等.趋化因子CXCL1及受体CXCR2在骨癌痛小鼠背根神经节中的表达变化[J].神经解剖学杂志,2013,8(6):603-608.
[2] 刘思兰,杨建平,王丽娜,等.鞘内注射NF-κ B抑制剂对骨癌痛大鼠的抗伤害效应[J].中国疼痛医学杂志,2014,9(5):299-303.
[3] 徐振华,杨建平,胡计嬅,等.趋化因子受体CCR2拮抗剂在大鼠骨癌痛治疗中的可能机制[J].中国药理学通报,2014,3(4):510-513.
[4] 邹旭丽,宫本航,张孟元,等.前扣带皮层吻侧部注射NR2B受体阻断剂Ifenprodil对骨癌痛大鼠伴随痛厌恶情绪体验的影响[J].山东大学学报(医学版),2014,8(7):28-31.
[5] 董岩,杨长江,毛应启梁,等.大鼠骨癌痛模型中血-脊髓屏障通透性的变化[J].中国医药导报,2013,1(1):8-11.
[6] 马正良,夏小萍,朱巍,等.小鼠骨癌痛模型的建立及痛行为学和骨损害的观察[J].中国疼痛医学杂志,2007,13(5):288-292.
[7] 桂琦,陈豫,于世英.不同骨癌痛动物模型拟合临床特征的研究[J].华中科技大学学报(医学版),2013,9(3):299-303.
[8] 张中军,邹俊,杨建平,等.Walker256乳腺癌肉瘤细胞接种建立大鼠胫骨骨癌痛模型[J].江苏医药,2013,11(15):1754-1756.
[9] 龚琴,区锦燕,廖荣宗,等.鞘内注射PI3K特异性抑制剂LY294002对小鼠骨癌痛的影响[J].肿瘤学杂志,2010,1(1):46-49.
[10] 徐幼苗,申文,陈晏,等.趋化因子CCL2中和抗体在大鼠胫骨癌痛治疗中的作用[J].临床麻醉学杂志,2012,2(1):81-83.
[11] 高永静,张志军,曹德利.趋化因子介导的神经炎症反应和神经病理性疼痛[J].中国细胞生物学学报,2014,4(3):297-307.
[12] 汪洋,王家林.趋化因子配体及其抗体对骨癌痛患者脊髓胶质细胞活化的影响及与骨癌痛的相关性[J].中国老年学杂志,2013,6(2):421-422.
[13] 朱鸣镝,钱丽玲,朱俐,等.IP-10和JNK介导CFA诱导的大鼠足底炎性疼痛[J].南京医科大学学报(自然科学版),2009,14(12):1698-1702.
[14] 焦英甫.大鼠CFA炎症模型中MCP-1对疼痛产生及维持的作用[D].第二军医大学,2010.
[15] 郑晋伟,郑昌健,曹红,等.姜黄素下调神经病理性疼痛大鼠脊髓背角和背根节CX3CR1的表达[J].中国中药杂志,2011,19(18):2552-2556.
[16] 严继贵,王迎新,杨宇清,等.蛇毒复方制剂对W256癌细胞诱导的骨癌痛大鼠破骨细胞的影响[J].中成药,2012,13(7):1216-1220.
[17] 陈莎莎.重构型自发活化Caspase-3基因的构建及其在骨癌痛大鼠的镇痛效应研究[D].华中科技大学,2010.
(编校:王俨俨)
Effect of diphosphate on expression of CXCL1 and its receptor CXCR2 in bone cancer pain mice
LI Bin1,ZHANG Hui2,ZHANG Hui3
(1.College of Biological Engineering, Huanghuai University, Zhumadian 463000; 2.The Henan huanghuai College Nursing Department of Zhumadian 463000; 3.Department of Urinary Surgery, Zhumadian City Center Hospital, Zhumadian 463000)
ObjectiveTo explore the involvement of CXCL1 and CXCR2 in the pathogenesis of bone cancer pain and the interventions of diphophated.Methods60 mice were divided into 3 groups randomly: control, model and diphosphated group.The bone cancer pain mice were duplicated by injection of NCTC742 cell while control mice were received same dose of NS.Diphosphate group mice were received diphosphate while control group were received same dose of NS.The expressions of CXCL1, CXCR2, TNF-α and apoptosis proteins were detected by Real-time PCR and Western blot.ResultsThe cancer pain threshold in bone pain model were higher than that of control group (P<0.05,P<0.01), while cancer pain threshold in diphosphated group was improved(P<0.01).Compared with control group, the expression of chemotactic factor CXCL1 and its receptor of CXCR2 in model group were up-regulated(P<0.01), while the expression of those parameters were improved(P<0.01).The expression of TNF-α, Bax as well as Caspase-3 were up-regulated and Bcl2 was down-regulated in model group(P<0.01), while diphosphate normalized those parameters with a statistical difference(P<0.01). ConclusionDiphosphate alleviates the bone cancer pain by inhibiting the enhanced CXCL1 and its receptor CXCR2 as well as promoting apoptosis.
diphosphate; bone cancer pain; chemotactic factor; apoptosis; receptor
黄淮学院青年骨干教师资助计划,河南省教育厅科技攻关项目(14B180006)
李宾,男,硕士,讲师,研究方向:分子生物学、生物化学,E-mail:binlyyy@163.com。
R927.1
A
1005-1678(2015)02-0031-04

