多聚赖氨酸在大鼠海马神经元原代培养中工作浓度的研究
韩璐,肖凤,张岫美
(1.天津生物工程职业技术学院 生物技术系,天津 300461;2.河北省围场县医院 消化内分泌科,河北 围场 068450;3.山东大学医学院 药理学系,山东 济南 250012)
多聚赖氨酸在大鼠海马神经元原代培养中工作浓度的研究
韩璐1,肖凤2,张岫美3Δ
(1.天津生物工程职业技术学院 生物技术系,天津 300461;2.河北省围场县医院 消化内分泌科,河北 围场 068450;3.山东大学医学院 药理学系,山东 济南 250012)
目的 优选多聚赖氨酸(poly-D-lysine,PDL)在大鼠海马神经元原代培养中的最佳工作浓度。方法 颈椎脱臼处死孕18 d的Wistar大鼠3只,取出胚胎并分离脑组织。迅速分离海马组织,胰酶消化,吹打并以合适浓度(30万/3.5 cm皿)接种于0.01、0.05、0.1、0.25、0.5、0.75、1、2 mg/mL的PDL工作浓度包被的培养皿中,采用相差显微镜观察神经元形态,同时采用CCK-8试剂盒进行神经元活性检测。结果 神经元接种4 h后贴壁,1 d后突起发生,4 d后与周围神经元形成联系,7 d后成熟并形成网状联系。PDL最佳工作浓度范围位于0.25~0.75 mg/mL,神经元在此浓度范围内生长状态及活性最佳。结论 通过实验确定了PDL最佳工作浓度,对于神经元培养有重要意义。
海马神经元;原代培养;PDL工作浓度
海马属于大脑皮层边缘系统,参与众多高级精神活动,例如学习、记忆、情绪等。因此,海马神经元在高级神经功能中发挥着重要的作用[1-3]。在1977年,Banker等[4]率先成功在体外分离并培养了海马神经元,为细胞层次的神经科学研究奠定了基础。此后,神经元培养技术得到了进一步完善及发展[5-6]。在海马神经元分离培养过程中,步骤复杂,可变性大,关键步骤条件的优化对于成功培养海马神经元至关重要。本实验通过比对不同条件下神经元生长存活状态,优化分离培养条件,从而为后续相关研究提供依据和参考。
1 材料与方法
1.1 实验动物 孕18 d的雌性Wistar大鼠3只,购自北京维通利华实验动物中心,动物合格证号:SCXK京2014-2015,许可证号:SCXK京20110011-001。本实验遵循《实验动物保护条例》。
1.2 主要试剂 杜氏改良培养液(Dulbecco’s modified eagle medium, DMEM-F12)、神经元基础培养基(neurobasal medium)、0.05%胰酶+EDTA、B-27无血清添加剂、胎牛血清(fetal bovine serum,FBS)购自Gibco公司;多聚赖氨酸(poly-D-lysine, PDL)、青霉素/链霉素(penicillin and streptomycin, P/S)、L型谷氨酰胺购自sigma公司;Hank’s 平衡盐溶液(Hank’s Balanced salt solution, HBSS) 自制:8 g/L NaCl,0.4 g/L KCl,1 g/L葡萄糖,60 mg/L KH2PO4,47.5 mg/L Na2HPO4,0.35 g/L NaHCO3,调pH至7.2。
1.3 主要仪器 解剖显微镜(Nikon SMZ445,尼康公司);超净工作台(SCB-1360 北京东联哈尔有限公司);倒置相差显微镜(Nikon TS100,尼康公司);CCK-8试剂盒(A311-01,Vazyme公司);酶标仪(MK3,Thermo公司)。
1.4 方法
1.4.1 准备工作:PDL包被培养皿或者爬片:研究设计了0.01、0.05、0.1、0.25、0.5、0.75、1、2 mg/mL的PDL包被组,观察最佳包被浓度。将培养皿加入PDL工作液,置于细胞培养箱中孵育40 min,回收PDL工作液,将培养皿置于超净工作台中晾干。晾干后用无菌的去离子水洗3次,去除为包被于皿底的PDL,然后将培养皿晾干备用。
1.4.2 神经元分离培养过程:①取材:颈椎脱臼处死孕18 d Wistar大鼠,将大鼠全身浸泡于75%消毒酒精中10~20 s。然后移至超净工作台,使用无菌器械剪开皮肤,更换无菌器械剪开腹肌及腹膜,暴露腹腔。连同子宫一起取出所有胎鼠至无菌的冷的HBSS中浸泡。用眼科剪取头,用显微解剖镊分别剥离头皮、颅骨、硬脑膜,暴露脑组织。用眼科镊小心完整地取出大脑、小脑及中脑,置于无菌的冷的HBSS中。在解剖显微镜下放置盛有少量无菌HBSS的皿,将剥离好的脑组织置于镜下,用显微解剖镊小心剥离脑组织表面的血管等结缔组织,其中海马处的结缔组织可由左右向中间剥离,动作轻柔,一般可完整剥下所有结缔组织。然后用维纳斯剪将海马部分小心剪下,置于冷的HBSS中。
② 消化:用维纳斯剪将上一步的海马组织剪碎,用无菌移液器移至无菌离心管中,静置,待海马组织下沉至管底后,小心地移除上清,加入5 mL预热至37 ℃的0.05%的胰酶消化液。置于37 ℃水浴消化10 min,期间每隔2~3 min轻柔晃动管子,使组织悬浮起来,利于消化。10 min后,加入含有10% FBS的DMEM/F12培养基终止消化,静置,待组织沉淀后移除上清,加入5 mL DMEM/F12(含10% BS)培养基,轻柔吹起组织,以洗去残留的胰酶,重复洗3~4次。最后加入3~5 mL(根据组织量而定)DMEM/F12(含10% FBS),用力吹打10~20下使消化完的组织分散为单细胞。使用200目筛网过滤后取细胞悬浮液进行稀释。
③ 细胞计数:稀释后的细胞进行计数,取干净的细胞计数板,加入细胞悬浮液,静置2 min后开始计数:将细胞计数板洗净擦干,将细胞悬浮液滴入细胞计数板上,置于显微镜下静置2 min后计数。公式如下:细胞数/L=4大格细胞数/4×稀释倍数×107。
④ 细胞接种:预热好神经元培养液(1%glutamate+2%B27+97%neurobasal medium)加入培养皿中,6孔板每孔接种30万神经元。置于细胞培养箱中培养,4 h后神经元贴壁,可予以更换全部培养液,以后每3 d换1/3~1/2的培养液。
1.4.3 神经元形态观察及检测: ①形态观察:用相差显微镜观察不同处理组神经元生长状态并拍照。②神经元活性检测:用CCK-8试剂盒检测不同时间不同处理组神经元活性,以反映神经元存活情况。
1.4.4 验证试验:用酶标仪检测不同处理组神经元第8天的培养液在450 nm处的吸光度值,进行3次独立重复试验。
2 结果
2.1 神经元形态学观察 倒置相差显微镜下观察,接种4 h后大部分细胞已经贴壁(90%以上),此时神经元没有突起生长,呈圆形或略椭圆形。1 d后神经元开始长突起,约3~4 d后突起明显增长,相邻神经元突起相互交织,胞体增大,呈圆形或纺锤形,6~8 d逐渐成熟,胞体圆润饱满,光晕显著。实验选取第7天的神经元观察对比不同组之间的差异,发现PDL浓度为0.1~0.5 mg/mL时神经元形态最佳,见图1。反应神经元状态较好,而过高浓度和过低浓度时神经元突起均僵硬、变直且飘起、未贴壁,胞体出现类似凋亡小泡的空泡结构。继续观察至10 d后此组神经元大部分死亡。

图1 第7天不同处理组神经元形态(×200)Fig.1 Morphology of neurons in different groups in day 7(×200)
2.2 神经元存活活力检测 用CCK-8试剂盒检测神经元活力状态,活力与吸光度成正比,可以反映存活情况。见图2,结果表明:0.01~2 mg/mL各组450 nm的吸光度OD值平均值分别为0.15896、0.2568、0.32158、0.4122、0.41369、0.3658、0.20235、0.10235,PDL在(0.01~0.5 mg/mL)工作浓度范围内,海马神经元存活随PDL浓度升高而增强,且高于一定范围即产生明显的毒性作用。
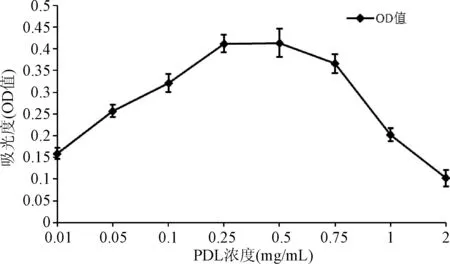
图2 不同处理组吸光度值(n=3)Fig.2 Absorbance value of different treatment groups(n=3)
2.3 验证试验结果 图1和图2均经过3次独立重复试验。由于神经元为高度分化的细胞,不会增殖,因此CCK-8吸光度反映存活神经元数。由图2可以看出在0.25~0.75 mg/mL的PDL浓度时,神经元形态最佳且活力最高,提示神经元在0.25~0.75 mg/mL的PDL工作浓度时有最佳的存活状态。
3 讨论
神经元培养技术对于神经生物学的科学研究非常重要,特别是在细胞水平上进行相关疾病的发生、发展、转化等研究中,能够提供稳定的、易于重复的,同时又便于实验控制及干预的模型[5],例如研究马达蛋白在神经元中的作用过程中,需要体外培养神经元[6], 在某些疾病模型中,体外神经元培养也是重要的研究方法,例如脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)先天性基因突变导致其不能调节型分泌[7]。因此,神经元体外培养对于神经科学工作人员来说是必备的基本的技能。
神经元的体外培养技术的基本过程在国内外已经基本成熟[8-10]。由于取材过程中不可能完全分离胶质细胞与神经元,同时由于操作误差也容易污染成纤维细胞。胶质细胞及成纤维细胞在血清的刺激下均有显著的增殖,时间久了以后在培养过程中会明显妨碍神经元的观察及实验。因此采用血清替代物B27来提供神经元生长必需的营养物质,同时对于胶质细胞和成纤维细胞的生长有显著的抑制作用。总的来说,神经元在无血清培养基中生长情况良好,目前与在含有血清的培养环境中相比,生长状态无异。
神经元是高度分化的细胞,没有分裂增殖,只能原代贴壁培养,因此其接种后的贴壁对于其存活来说至关重要。由于脑组织特殊的结构,神经元“天生”不具有较好的贴壁能力,因此需要事先于培养皿表面包被一层PDL以改变皿上的电荷,使细胞更易于结合贴附[11]。但是PDL对于细胞具有一定的毒性作用,因此其皿中剩余的PDL量对于神经元的存活就尤为重要。在实验过程中发现PDL的包被效果对于神经元的存活有重大影响,37 ℃包被40 min时,在0.25~0.75 mg/mL的工作浓度下神经元存活最好,过高或者过低均对神经元形态及活性有显著抑制作用。因此实验建议PDL包被条件为:0.25~0.75 mg/mL于37 ℃孵育40 min后,吸出PDL,晾干培养皿后用去离子水洗3遍后晾干备用。
神经元取材过程中其他的关键步骤:①剥离结缔组织膜的时候一定要剥离彻底,否则极易污染成纤维细胞;②尽量不要使用阿糖胞苷等分裂抑制剂,避免其对神经元产生损伤作用,阿糖胞苷会极大影响神经元的状态;③胰酶消化的时间需要把握好,一般在10 min左右较好。时间过短会消化不充分,导致后续的吹打过程剧烈从而损伤细胞,消化时间过长会导致细胞损伤,同样减少神经元得量;④神经元换半液对于神经元状态有重要作用,神经元自身会分泌神经营养因子类物质,如:BDNF、神经生长因子(nerve growth factor,NGF)等。从而促进神经元的存活、生长等进程[12],换半液有助于保留神经营养因子等营养物质;⑤吹打细胞时要轻柔,尽量减少物理损伤;⑥离心对细胞也是一种损伤,所以应尽量减少离心时间及离心次数。
综上所述,PDL工作浓度及工作时间对于神经元的存活至关重要。神经元体外培养过程中各个细节均需要注意。本实验中筛选的PDL工作浓度下神经元生长良好,存活多。其他列举的注意事项对于优化神经元体外培养技术均有很大帮助。
[1] Fasick V,Spengler RN,Samankan S,et al.The hippocampus and TNF: Common links between chronic pain and depression[J].Neurosci Biobehav Rev,2015,53:139-159.
[2] Cirneci D,Silaghi-Dumitrescu R.Learning tasks as a possible treatment for DNA lesions induced by oxidative stress in hippocampal neurons[J].Neural Regen Res,2013,8(32):3063-3070.
[3] Christian KM,Song H,Ming GL.Functions and dysfunctions of adult hippocampal neurogenesis[J].Annu Rev Neurosci,2014,37:243-262.
[4] Banker GA,Cowan WM.Rat hippocampal neurons in dispersed cell culture[J].Brain Res,1977,126(3):397-425.
[5] Viesselmann C,Ballweg J,Lumbard D,et al.Nucleofection and primary culture of embryonic mouse hippocampal and cortical neurons[J].J Vis Exp,2011,24 (47):e2373.
[6] Correia SS,Bassani S,Brown TC,et al Motor protein-dependent transport of AMPA receptors into spines during long-term potentiation[J].Nat Neurosci,2008,11(4):457-66.
[7] Chen ZY,Jing D,Bath KG.et al.Genetic variant BDNF(Val66Met) polymorphism alters anxiety-related behavior[J].Science,2006,314(5796):140-143.
[8] Kaech S,Banker G.Culturing hippocampal neurons[J].Nat Protoc,2006,1(5):2406-2415.
[9] Barbati AC,Fang C,Banker GA,et al.Culture of primary rat hippocampal neurons: design,analysis,and optimization of a microfluidic device for cell seeding,coherent growth,and solute delivery[J].Biomed Microdevices,2013,15(1):97-108.
[10 ] 张学平,王高华,王惠,等.海马神经元原代培养与纯度鉴定方法的优化[J].武汉大学学报,2013,34(5):703-710.
[11] Kim YH,Baek NS,Han YH,et al.Enhancement of neuronal cell adhesion by covalent binding of poly-D-lysine[J].J Neurosci Methods,2011,30,202(1):38-44.
[12] Chao MV.Neurotrophins and their receptors: a convergence point for many signalling pathways[J].Nat Rev Neurosci,2003,4(4):299-309.
(编校:王冬梅)
Study on working concentration of PDL in primary culture of rat hippocampal neuron
HAN Lu1, XIAO Feng2, ZHANG Xiu-mei3Δ
(1.Department of Biotechnology, Tianjin Vocational College of Bioengineering, Tianjin 300461, China; 2.Department of Gastroenterology and Endocrinology, Hebei Weichang County Hospital, Weichang 068450, China; 3.Department of Pharmacology, School of Medicine, Shandong University, Ji’nan 250012, China)
ObjectiveTo explore working of concentration of PDL used in primary culture of rat hippocampal neurons.Methods3 pregnant wistar rats were executed by cervical dislocation, the embryos were taken out and the hippocampal tissue was dissected quickly.Then the tissue was digested by trypsin and planted into dishes with proper concentration(300000/3.5cm vessle)which were coated by different PDL solution in different concentration (0.01,0.05,0.1,0.25,0.5,0.75,1,2 mg/mL).The state of the cultured neurons was observed to determine the most suitable concentration of PDL solution in coating dishes.Neurons activity was observed by CCK-8 Kit.ResultsMost neurons had adhered in 4 h.Protrusion of neurons began to grow in 1 d.The connection between neurons appeared in 4 d.Neurons matured and the network-connection was set up in 7 d.The best working concentration of PDL is between 0.25 and 0.75 mg/mL, neurons grew well and activity was optimum during this concentration.ConclusionThe working concentration of PDL is important for the hippocampal neuron culture and this work is worth being applied.
hippocampal neurons; primary culture;working concentration of PDL
韩璐,女,硕士,讲师,研究方向:细胞生物学,E-mail:luhan2010@126.com;张岫美,通讯作者,男,博士,教授,研究方向:中枢神经损伤与修复的药物干预及细胞分子机制,E-mail:zhangxm@sdu.edu.cn 。
R331
A
1005-1678(2015)05-0037-03

