酶标仪快速测定大鼠、小鼠精子密度的方法研究
江伟雯, 许艺飞,陈娅琦,蔡泳锋,吴清和,黄萍, 操红缨
(广州中医药大学 中药学院,广东 广州 510006)
酶标仪快速测定大鼠、小鼠精子密度的方法研究
江伟雯, 许艺飞,陈娅琦,蔡泳锋,吴清和,黄萍, 操红缨Δ
(广州中医药大学 中药学院,广东 广州 510006)
目的 利用酶标仪建立一种快速、准确的测定大、小鼠精子密度的方法。方法 ①最适波长确立与回归方程建立:雄性KM小鼠和SD大鼠各6只,脱颈椎处死后分离左侧附睾,于PBS内充分剪碎,水浴充分游离精子,用酶标仪分别在300、380、450、530、600 nm下测定吸光度,拟合吸光度曲线,取相关系数最接近于1及标准差最小的为最佳波长;取KM小鼠、SD大鼠各10只,乙醚过量麻醉致死后用PBS稀释得到4、8、16、36倍的精子悬液,用酶标仪检测吸光度并使用细胞计数板对样品进行计数,以精子密度为横坐标及吸光度为纵坐标建立回归方程。 ② 精子吸光度稳定性检测:KM小鼠和SD大鼠各6只,乙醚过量麻醉致死后制备左侧附睾悬液,样品置于室温(25 ℃)或继续37 ℃水浴,并于水浴后的0、20、30、40、50、60 min,取样品测定吸光度,记录样品的吸光度变化。③ 回归方程验证:使用20%乙醇灌胃30 d造KM小鼠少精症模型,采用吸光度-精子密度曲线方程及细胞计数板计数2种方法测定造模KM小鼠精子密度,验证新方法。结果 确立KM小鼠、SD大鼠吸光度-精子密度曲线在380 nm处可以建立最适回归方程,KM小鼠精子密度x1与吸光度y1的关系为线性函数,线性回归方程为y1=2×10-9x1+0.0648,R2=0.9743;SD大鼠精子密度x2与吸光度y2的关系为线性函数,线性回归方程为y2=5×10-9x2+0.0621,R2=0.9940;SD大鼠精子悬液在水浴60 min后,A值与0 min时相比显著减低(P<0.05),但在常温下40 min后显著升高(P<0.05);KM小鼠精子悬液在水浴和常温条件下50 min后,与0 min时相比,A值显著升高(P<0.05);与正常对照组相比,用酶标仪检测和标准曲线计算的乙醇少精组的精子密度均显著下降(P<0.05);与标准曲线计算相比,通过细胞计数板方法检测乙醇少精组的精子密度没有显著变化。吸光度-精子密度曲线方程法可有效检测出少精症动物模型精子密度的减少。结论 利用酶标仪建立吸光度-精子密度曲线方程法可以快速、准确的测定KM小鼠和SD大鼠的精子密度。
精子密度;吸光度;SD大鼠;KM小鼠;少精模型
在大鼠、小鼠实验指标和养殖过程中,测定其精子密度极为普遍。目前常用的测定方法有血球计数法[1]、流式细胞仪法[2]和分光光度法[3]。其中血球计数法在处理大量样品时显得繁琐和低效,流式细胞仪法处理繁琐,费用高;而分光光度法具有操作简单,费用便宜等优点;酶标仪所运用的技术就是分光光度法,能更加方便快速得到吸光度,适用于不同物质的分光光度法的测定。精子悬液在紫外光下呈现一定的吸光度,利用建立的精子密度与吸光度标准曲线能够快速、精确地测定精子密度[4-8]。大鼠、小鼠的精子数量在生殖系统实验上作为一个评判标准,其快速检测技术尤为重要,因此本实验拟运用酶标仪测定大鼠、小鼠精子悬液的吸光度(absorbance,A)建立A值-精子密度标准曲线以快速测定精子密度,构建2个变量的方程关系,并通过建立小鼠乙醇少精模型验证运用吸光度标准曲线计算出精子密度方法的可行性。
1 材料与方法
1.1 材料
1.1.1 实验动物:KM小鼠,38只,SPF级,雄性,体质量30~35 g;SD大鼠,22只,SPF级,雄性,体质量300~350 g,均由广州中医药大学实验动物中心提供,大鼠许可证为44005900001714,小鼠许可证为44007200015976。实验动物严格遵守《实验动物保护条例》。
1.1.2 实验仪器与试剂:Multiskan Go 1510全波长酶标仪(美国Thermo scientific公司);Eclipse TE2000-s倒置显微镜(日本Nikon公司);96孔板(上海百研生物技术有限公司)、细胞计数板(上海求精生化试剂仪器有限公司,编号:02270113)。
PBS溶液(武汉博士德生物技术有限公司,);无水乙醇(天津市大茂化学试剂厂,批号20130928,分析纯,纯度>99.7%)。
1.2 实验方法
1.2.1 最适波长确定:各取6只雄性SD大鼠、KM小鼠,脱颈椎处死后仰卧放置,轻轻挤压腹部使得睾丸向下移动,剪开睾丸处皮肤层,拉出左侧睾丸,紧贴睾丸处找到附睾头,顺势找出整个附睾,分离附睾与睾丸。将雄性大鼠、小鼠左侧的完整附睾放进装有1 mL,37 ℃预温PBS的EP管中,用剪刀充分剪碎附睾,置于37 ℃恒温水浴箱里25 min制成精子悬液。用移液枪吸取EP管中部精子混悬液150 μL,用PBS梯度稀释成4、8、16、36倍,制备成精子悬液,另外准备空白PBS作为空白对照。96孔板中每孔加入100 μL以上倍数的精子悬液,每个倍数重复4个孔,用全波长酶标仪分别在300、380、450、530、600 nm(波长下测定吸光度,拟合吸光度曲线,取相关系数最接近于1及标准差最小的为最佳波长。
1.2.2 标准曲线的建立:各取10只雄性SD大鼠、KM小鼠,同1.2.1方法制备4、8、16、36倍精子悬液,另外准备空白PBS作为空白对照。96孔板中每孔加入100 μL不同倍数精子悬液,用全波长酶标仪在经过1.2.1项下所得到的最适波长下测定吸光度,并利用细胞计数板在倒置显微镜下,计数上述溶液中的精子密度(精子密度计算按精子数/mL=四大方格中精子总数×2×104),以精子密度为横坐标,吸光度为纵坐标建立标准曲线。
1.2.3 样品稳定性:各取6只大鼠、小鼠按上述步骤制备成精子悬液,在37 ℃水浴和室温(25 ℃)条件下继续放置0、20、30、40、50、60 min,在最适波长条件下测定其吸光度。对吸光度进行配对t检验,探讨精子混悬液在室温(25 ℃)或37 ℃水浴条件下,1h内的样品吸光度的稳定性。
1.2.4 乙醇少精模型:随机将16只KM小鼠分为正常对照组和模型组,每组8只。模型组动物每天按10 mL/kg灌胃20%乙醇溶液[9],正常对照组动物灌胃等体积蒸馏水,造模30d。按上述步骤制备成精子悬液,96孔板中每孔加入100 μL待测液体,用全波长酶标仪分别在最适波长下测定吸光度,利用1.2.2所求的KM小鼠标准曲线计算其精子密度;利用细胞计数板在倒置显微镜下,计数上述溶液中的精子密度。对比2者有无差别,以验证新方法的可行。
2 结果
2.1 SD大鼠、KM小鼠精子不同波长下吸光度拟合曲线相关系数 SD大鼠、KM小鼠精子不同波长下吸光度拟合曲线相关系数见表1。大、小鼠精子吸光度拟合曲线R2均在380 mm处最接近1,且标准差为最小。因此,380 mm为最佳检测精子吸光度波长。
表1 SD大鼠精子悬液在不同波长下吸光度拟合曲线的相关系数±s,n=6)Tab.1 The R2 of SD rat and KM mice sperm suspension absorbance fitting curve under different wavelength ±s,n=6)
2.2 标准曲线的建立 对精子密度与吸光度关系的回归分析发现,精子密度与吸光度呈良好的线性关系。SD大鼠精子密度x1与吸光度y1的关系为线性函数,线性回归方程为y1=5×10-9x1+0.0621(R2=0.9940),见图1-A;KM小鼠精子密度x2与吸光度y2的关系为线性函数,线性回归方程为y2=2×10-9x2+0.0648(R2=0.9743),见图1-B。
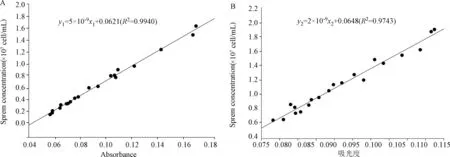
图1 精子密度与吸光度的标准曲线方程A:大鼠的标准曲线;B:小鼠的标准曲线Fig.1 The standard calibration curves of sperm concentration (cells/mL) and absorbanceA:The standard calibration curves of rats;B:The standard calibration curves of mice
2.3 稳定性实验 SD大鼠精子悬液在水浴60 min后,A值与0 min时相比显著减低(P<0.05),但在常温下40 min后显著升高(P<0.05);KM小鼠精子悬液在水浴和常温条件下50 min后,与0 min相比,A值显著升高(P<0.05)。见表2。

表2 SD大鼠、KM小鼠精子悬液稳定性Tab.
*P<0.05,与0 min相比,compared with 0 min
2.4 乙醇少精模型 与正常对照组相比,用酶标仪检测和标准曲线计算的乙醇少精组的精子密度均显著下降(P<0.05);与标准曲线计算相比,通过细胞计数板方法检测乙醇少精组的精子密度没有显著变化。见表3。
表3 2种方法检测KM小鼠精子密度±s)Tab.3 The density of KM mice sperm detected by the two ±s)
*P<0.05,与对照组相比,compared with control group
3 讨论
大鼠、小鼠精液分析是一项重要的用于评价生殖性实验的检查指标,如壮阳实验[10],生殖系统评价实验[11]等,测定精子密度最常见的方法有目测法、血球计数法和库尔特颗粒计数法[12]。目测法虽然简单,但十分不精确;计数法虽然精确,但费时、费力,在处理大量样品时很难做到快速及时,也会造成一些人为误差,来自精子计数操作过程中的技术误差,如计数池的差异、样本混匀、加样、技术人员的熟练程度等。而现有文献报道利用吸光度原理测定精子密度,具有操作方法简便、快速及结果准确等特点,在很多领域上都有应用,尤其是在家畜精子密度研究中应用较多[13-15],有关测定实验动物精子密度的研究较少。本实验首次建立通过酶标仪检测实验动物SD大鼠,KM小鼠精子悬液的吸光度来确定快速检测精子密度的方法。
据文献报道[16],不同种类的酶标仪、物种及稀释度对结果均会造成一定的影响。因此本实验建议在使用吸光度曲线测定精子密度时,最好使用同一酶标仪、同一块板在同一稀释度条件下进行实验,以减少实验所产生的误差。此外,不同种属的动物可能有不同的吸光度差异,本文仅采用了SD大鼠及KM小鼠进行实验,不能代表所有种属的大鼠、小鼠。
研究发现[4-6],测定动物精子密度所用到的波长在300 nm到780 nm之间,故本实验选用300、380、450、530、600 nm波长下检测大小鼠精子悬液的吸光度。实验结果中SD大鼠、KM小鼠精子吸光度曲线在300 nm~450 nm均可以建立相关系数较高的标准曲线,但在380 nm处,曲线相关系数变化的标准差最小,稳定性最高,因此本实验最佳检测精子吸光度波长为380 nm。稳定性实验证明,在常温条件(25 ℃)下,大鼠精子悬液在40 min,小鼠在30 min就会与初始值有显著性差异。但从图2曲线变化条件上看,无论大小鼠在常温条件下超过20 min,曲线即出现混乱。主要原因是精子在非适宜生存条件下,会出现大量的死亡沉底,从而导致吸光度的异常变化。水浴条件下(37 ℃),精子吸光度能在较长一段时间保持稳定。文献报道,精子游离处理有使用20 min及30 min 2种时间[17-18],本实验也证明2个时间均稳定且差异不大。
通过模拟酗酒造成的精子密度减少症状[19]。在KM 小鼠乙醇少精模型实验中,本实验成功使用标准曲线法验证了这一模型KM小鼠的精子密度的降低,精子计数法及标准曲线法均得到了相似的结果。大鼠酒精少精症模型[17],本研究亦有开展相关实验,但2种方法均未显示造模大鼠精子密度与正常大鼠精子密度有差异(数据未展示)。
建立精子密度-吸光度曲线的方法与计数板计数法各有优缺点,吸光度曲线法可以更加快速准确地得到实验结果,但在吸光度测量过程中需保持精子活力,同时,该方法也要求实验人员必须要有熟练的操作技能,分离附睾是否完整,脂肪剥离是否干净,吸取精子悬液是否均匀无杂质等均对实验结果有较大的影响。计数板计数法[20]人工误差大,操作繁琐,但不需要对精子活力有要求,即使精子死亡亦可得到实验结果。
因此,通过本研究建立的酶标仪检测法可以快速准确地测定大鼠、小鼠的精子密度,可以加快大小鼠精子计数的速度,有利于研究大鼠、小鼠生殖能力及提高生殖能力相关实验速率。
[1] 徐文.鸡新城疫疫苗的最新研究进展[J].家禽科学,2008(6):43-45.
[2] 王贺民,秦素琴,魏涛.鸡新城疫疫苗研究进展[J].中国家禽,2006,28(18):48-51.
[3] 张进隆.黄芪多糖对鸡新城疫抗体效价的影响[J].国外畜牧学-猪与禽,2010 (1):72-73.
[4] 张亮,郭宗义,潘红梅,等.分光光度法快速测算公猪精子密度的研究[J].广东农业科学,2012(5):103-108.
[5] 陈春娜,黄颖颖,陈先均,等.分光光度法测定达氏鲟精子密度标准的研究[J].江苏农业科学,2014,42(1):184-186.
[6] 管卫兵,杨牧川,王成辉.分光光度法测定两种蟹类精子密度的研究[J].水产学杂志,2012,25(1):35-37.
[7] 刘志平,白玉研,张娟茹.狐精液精子密度简易检测法的初步研究[J].经济动物学报,2005,9(1):4-7.
[8] 王坤,蒋隽,朱立军,等.鸡精子密度检测方法研究[J].中国家禽,2014,36(12):11-14.
[9] 陈逸青,刘丛云,陈勤.淫羊藿总黄酮对酗酒模型小鼠精子质量和DNA损伤的影响[J].中国医院药学杂志,2012,32(18):1426-1429.
[10] 马明月,张玉敏,李海山,等.乙醇对雄性小鼠精子生成的影响[J].工业卫生与职业病,2000,26(4):209-211.
[11] 王晶莹.采用40%尿素溶液做稀释液进行精子密度检查的效果观察[J].中国畜牧杂志,1985(5):23-24.
[12] 张涛,章龙珍,庄平,等.分光光度法测定俄罗斯鲟精子密度标准的研究[J].海洋渔业,2009,31(1):87-91.
[13] 李孝娟,郭光成,岳鹏飞,等.721 型分光光度计测定猪精子密度操作指南[J].黑龙江动物繁殖,2008,16(3):24.
[14] 吴宓.应用7230 型分光光度计测定公牛精子密度[J].黄牛杂志,1994,67(2):39-41.
[15] 肉孜汗,热合曼,热孜亚.应用 721 型分光光度计测定公羊精液密度的试验[J].新疆畜牧业,2002(4):20-21.
[16] Rondeau M, Rouleau M.Effects of dilution rates, animal species and instruments on the spectrophotometric determination of sperm counts[J].Rev Can Biol,1981, 40(2):173-180.
[17] 谭成森.铅与乙醇对雄性大鼠生殖系统联合作用的实验研究[D].沈阳:中国医科大学,2004.
[18] 刘清珍,邵永,商学军,等.吗啡耐受对雄性大鼠生精功能影响的初步探讨[J].中华男科学杂志,2014,20(12):1073-1076.
[19] 时艺珊,王晓蕾,张玉敏,等.乙醇对男性生殖系统功能的影响[J].中国公共卫生,2004,20(2):197-198.
[20] 陆金春,吕年青,黄宇烽,等.3种精子计数池的质量评估[J].中华男科学杂志,2004,10(10):755-760.
(编校:王冬梅)
Rapidly detecting the sperm concentration in mice and rats based on enzyme-labeled instrument
JIANG Wei-wen, XU Yi-fei, CHEN Ya-qi, CAI Yong-fei, WU Qing-he, HUANG Ping, CAO Hong-yingΔ
(School of Chinese Materia Medica, Guangzhou University of Chinese Medicine, Guangzhou 510006, China)
ObjectiveTo establish a rapid and accurate method,and to determine the density of mice and rats sperm with enzyme-labeled instrument.Methods①The optimal wavelengths and the regression equation set up: After six Kunming mice and six Sprague-Dawley rats were sacrificed, the left epididymis was separated and fully cut up in phosphate buffer saline.With water bath,the sperm were fully dissociated.Using the enzyme-labeled instrument to detect the wavelength absorbance respectively under different wavelength and fitting absorbance curve.The best wavelength will be the most close to 1 of the correlation coefficient (R2) and the standard deviation of minimum.After ten Kunming mice and ten Sprague-Dawley rats were sacrificed,the sperm suspension of different concentration gradient were got.The regression equation of the sperm density and absorbance was established by using enzyme-labeled instrument and haemocytometer.②The test of sperm absorbance stability: Mice and rats,six respectively,were used to make the sperm suspension.Samples were put in room temperature (25 ℃) or 37 ℃ water bath continued,and after water bath about 0,20,30,40,50,60 min,the change of absorbance was recorded.③The regression equation verification: The mice were administrated orally with 20% ethanol solution for 30 days to make oligospermia.In order to verify the new method,two different method were used to get the sample sperm.ResultsThe optimal absorbancy-sperm density curve could be established at 380 nm.The means of KM mice sperm count (x1) and absorbance (y1) are showed to be the linear function,and the linear regression equation isy1=2×10-9x1+0.0648,R2=0.9743.The means of SD rat sperm count (x2) and absorbance (y2) are showed to be the linear function,and the linear regression equation isy2=5×10-9x2+0.0621,R2=0.9940.SD rat sperm suspension liquid after 60 min in water bath, absorbance value at 0 min significantly decreased(P<0.05), but at room temperature after 40 min significantly increased(P<0.05); KM mice sperm suspension in the water bath and under the condition of normal temperature after 50 min, compared with the 0 min, absorbance value increased significantly(P<0.05).Compared with control group, sperm density of ethanol oligozoospermia group by enzyme standard detector and standard curve calculation were significantly decreased (P<0.05);compared with absorbancy-sperm density equation, determination of ethanol oligozoospermia group of sperm density by cell counting plate method had not significant difference.The results suggested absorbancy-sperm density equation could effectively detect the reduction of the mice sperm in oligospermia.ConclusionUsing enzyme-labeled instrument to set up the curve of absorbancy- sperm density equation can estimate the sperm density of mice and rats rapidly and exactly.
sperm density; absorbance; SD rat; KM mice; oligospermia model
江伟雯, 女,硕士在读,研究方向:中药新药与保健品研发,E-mail:304128246@qq.com;操红缨,通讯作者,女,博士,副教授,研究方向:中药泌尿与生殖药理研究,E-mail:1171629708@qq.com。
R965
A
1005-1678(2015)09-0026-04

