乙型肝炎肝靶向新药
——帕拉德福韦
闫荟羽,曲晓宇,王红玉,张四喜
(吉林大学第一医院 药品管理部,吉林 长春 130021)
乙型肝炎肝靶向新药
——帕拉德福韦
闫荟羽,曲晓宇,王红玉,张四喜Δ
(吉林大学第一医院 药品管理部,吉林 长春 130021)
目的 对乙型肝炎肝靶向新药帕拉德福韦的药理作用机制、药动学、临床研究进展及前景等进行综述。方法 通过检索国内外文献数据库Web of Science 、Elsevier ScienceDirect、Springer Link、Wiley Online Library、Pubmed、中国知网、万方数据知识服务平台、维普中文期刊全文数据库等系统,对帕拉德福韦的研究进行总结。结果 帕拉德福韦(pradefovir,PDV)是一种肝靶向性阿德福韦(PEMA)的前体药物。口服吸收迅速,在肝药酶CYP 3A4作用下可迅速转化为阿德福韦。与阿德福韦酯相比,具有较小的肾毒性以及较大的肝靶向作用。结论 帕拉德福韦具有良好的安全性及有效性,尚未发现其耐药性。在美国PDV已获得FDA的III期临床批件,目前在国内已进入Ⅰ期临床试验研究,未来将具有很好的临床应用前景。
帕拉德福韦;乙型肝炎;靶向
乙型肝炎病毒(hepatitis B Virus,HBV) 感染呈全球性分布,估计影响全球近4 亿人。高达40% 的慢性乙型肝炎(chronic hepatitis B,CHB) 患者可能因之出现肝硬化、肝细胞癌等并发症[1];每年约有100 万人死于HBV 感染所致的肝衰竭、肝硬化和肝细胞性肝癌(hepatocellular carcinama,HCC)[2-3]。我国慢性乙型肝炎患者约为2000万人,是我国肝硬化和HCC的主要病因,对人民健康危害极大[4]。
目前用于治疗CHB 的抗病毒药物有干扰素( 包括普通干扰素和聚乙二醇干扰素) 和口服核苷( 酸) 类似物( NAs) 两类[5]。前者因存在显著的副作用和需要通过注射方式给药等弊端,不易为患者所接受[6-7]。
核苷(酸) 类似物(nucleos(t)ide analogues,NAs)迄今已成为治疗CHB的主要药物,然而从第一个NAs问世至今的十余年来人们一直对其干扰人类细胞核和线粒体DNA 聚合酶( 线粒体DNA) 的担心没有停止过[6-9]。
目前治疗CHB的一线药物阿德福韦酯是PMEA酯酶激活的前体药物,然而由于其肾脏毒性,每日剂量为10 mg,低于其最佳有效剂量。帕拉德福韦(pradefovir,PDV)的出现,可避免阿德福韦酯的一些临床应用缺陷。
1 作用机制
帕拉德福韦是由Gilead Sciences公司上市的与抗阿德福韦酯产生的具同样活性的代谢物PMEA的一种前药,在美国完成的一项Ⅱ期临床研究显示,其具强效抗乙肝活性。大鼠分别口服给予30 mg/kg帕拉德福韦和阿德福韦酯(14C标记),结果显示,肝脏放射性帕拉德福韦是阿德福韦酯的十五倍,肾脏放射性是阿德福韦酯的1/3[10]。
PDV的化学名称:(+)-顺-9-{2-[4-[(S)-(3-氯苯基)-2-氧-1,3,2-二氧磷杂六环-2-亚甲基]-1-乙基}腺嘌呤,结构式见图1。
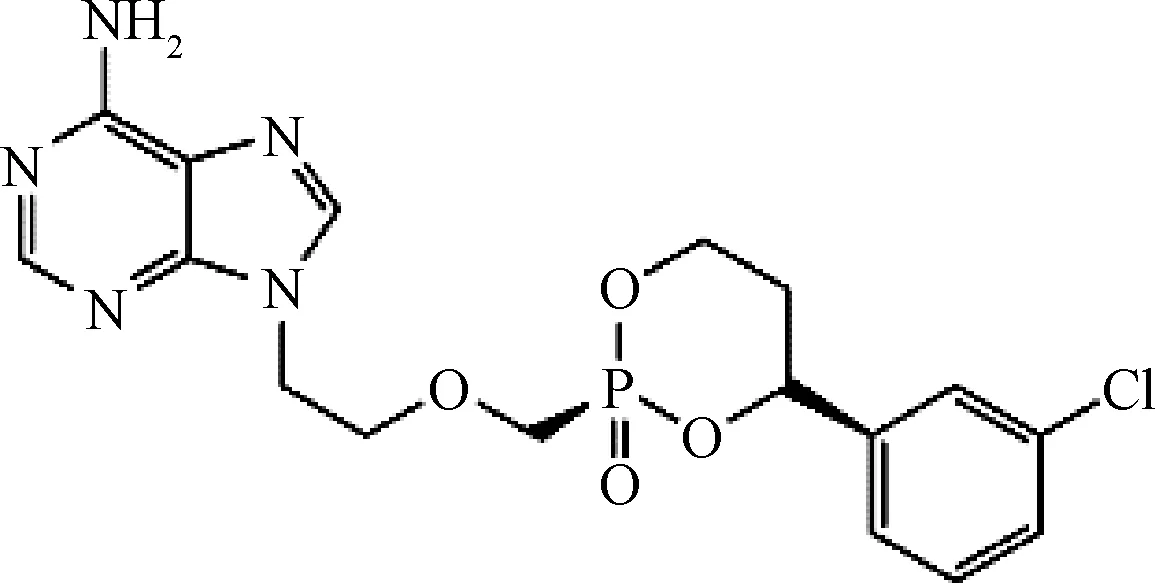
图1 帕拉德福韦化学结构式Fig.1 The chemical structural formula of PDV
PDV是阿德福韦的前体药物,在肝脏经过肝药酶CYP3A4作用下转化为PEMA;该药通过增加肝组织药物剂量、减少肾脏阿德福韦酯的剂量,可避免阿德福韦酯所致的肾损害,从而起到降低肾毒性的作用[11]。
一项包含有1A、1A2、2A6、2B6、2C8、2C9、2C19、2D6、2E1、3A4、3A5等亚型的CYPs催化PDV转化为PMEA的试验,结果表明,只有CYP3A4有显著的活性可将PDV转化为PMEA。添加酮康唑(CYP3A4抑制剂)后可极大地抑制了PDV转化为PMEA,分别加入酮康唑0.05、0.1、0.2、0.5和2 μM后,抑制程度分别为80%、90%、96%、98%和99%,从而证明CYP3A4是PDV转化为PMEA的主要酶系。另一项试验,门静脉插管大鼠和猴单剂量经口给予PDV(30 mg/kg),服药后早期门静脉血浆中并未测得ADV,提示肠道中CYP3A4并不参与介导PDV转化为PEMA。PDV在门静脉和全身循环系统中的含量比均较高,进一步证明了该药优良的肝脏靶向性。
因此,PDV主要在肝脏CYP3A4酶作用下转化为PEMA,大鼠肠道中的CYP3A4酶对PDV转化为PEMA几乎不起作用,然而大鼠肠道CYP3A4不起显著作用并不能代表人肠道CYP3A4的作用[12],尚无人体的相关数据。
作为CYP3A4 激活的PMEA前体药物,体内PDV经可快速吸收并转化为PMEA,并具有极好的肝靶向性和安全性。与阿德福韦酯相比,具有更强的药理活性、耐受性和较小的肾脏毒性。
2 药物代谢动力学
一项入组23名男性健康受试者的试验中,分别口服给予帕拉德福韦 10、30、60 mg和安慰剂。不同剂量的耐受性均比较好。给药后,帕拉德福韦的Cmax约为1.0~1.2 h,提示药物吸收迅速;PMEA的Cmax约为1.2~1.5 h,提示药物能够迅速转化;此后血浆药物浓度随着时间的延长而下降,帕拉德福韦T1/2约为10 h;帕拉德福韦 Tmax分别为(1.2±0.4)、(1.0±0.0)和(1.0±0.0)h。随着剂量从10、30增加到60 mg,血浆Cmax,AUC0-96和AUC0-∞也增加,Cmax分别为(8.32±1.90)、(36.4±11.3)和(82.9±31.1)ng/mL;AUC0-96分别为(34.3±3.4)、(94.7±28.3)、和(170±48)ng·h/mL;AUC0-∞分别为(23.8±1.2)、(100±30)和(161±23.0)ng·h/mL。食物对帕拉德福韦的吸收无显著影响,摄食组和空腹组的相关参数分别为,Cmax(40.8±15.4)和(36.4±11.3)ng/mL,Tmax为(1.3±0.5)和(1.0±0.0) h,AUC0-96为(105±26)和(94.7±28.3)ng·h/mL ,AUC0-∞为(113±32)和(100±30)ng·h/mL,T1/2分别为(15.5±3.0)和(10.1±2.9) h;然而药物与食物同服可显著降低PMEA的转化率[10]。
帕拉德福韦在人肝微粒体内转化为PMEA的速度取决于底物的浓度,低浓度时(0~50 μM)帕拉德福韦转化为PMEA的速率与浓度成正比,接近一级速率方程。当浓度超过160 μM时,转化速率达到饱和,遵循Michaelis-Menten方程,米氏常数Km为60 μM,最大代谢速率为每毫克蛋白228 pmol/min,固有清除率约为359 mL/min,在人体内约不到60%的PDV可转化为PEMA[12]。
口服给药后,生物利用度约42%,帕拉德福韦吸收迅速,Tmax约为1h,肝脏内在细胞色素P450 3A4酶的作用下,迅速转化为活性代谢物PMEA,即阿德福韦。帕拉德福韦是CYP3A4一个很好的底物,它既不诱导、又不抑制CYP3A4酶,表明PDV与其他药物联用,不影响其他药物的在体内的代谢。因在肝内被转化为活性形式,所以局部的药物浓度高,全身暴露量较少,因阿德福韦引起的剂量限制性的肾毒性因而减小。
3 临床研究
一项由244例HBV感染患者参与的多中心、随机对照试验。试验组包括5个治疗组:帕拉德福韦 5、10、20和30 mg组以及adefovir dipivoxil 10 mg/day组。治疗持续48周。结果显示,和adefovir dipivoxil相比,帕拉德福韦组患者HBV DNA水平降低更为显著,分别给予10、20和30 mg的PDV抗HBV活性均比10 mg ADV强[13]。
另一项由242例亚洲代偿性HBV感染患者组成的临床试验研究,所有患者HBV DNA病毒载量≥5×105copy/mL。47~55例患者随机分配到PDV各剂量组(5、10、20、30 mg每天)和ADV(10 mg),持续给药24周。结果显示,PDV可迅速吸收并转化为PMEA。在12周和24周,PDV和PMEA的Cmax和AUC随着剂量的增加而增加。30 mg的PDV转化为PMEA的AUC约为10 mg ADV的75%。24周时,10 mg ADV,血清HBV DNA水平降低中值为3.66 log10copy/mL,5、10、20、30 mg PDV,血清HBV DNA水平降低中值分别为3.32、4.31、4.32、5.07 log10copy/mL,PK/PD分析提示30 mg PDV可达到98%的Emax[14]。
我国西安新通药物研究有限公司研制的肝靶向化学1.1类新药甲磺酸帕拉德福韦于2013年获得国家食品药品监督管理总局批准,正式在我国进入临床研究,在美国PDV已获得FDA的Ⅲ期临床批件[15-16]。
4 安全性和耐药性
大鼠和猴分别经口给予PDV 30和60 mg/kg,28 d内均未发生明显的安全性不良事件,30 mg/kg的剂量是安全的,可接受的安全剂量最高达60 mg/kg,但在100 mg/kg或更高剂量下观察到肾毒性[12,17]。分别给大鼠口服30 mg/kg PDV和ADV,3 h后分别摘取肝和肾测量14C放射性,结果药物浓度在肝脏中PDV是ADV的3陪,肾脏中PDV是ADV的1/3[18];另一项研究结果显示肝脏中PDV是ADV的15陪,肾脏中PDV是ADV的1/3;毒性研究提示[17]。与ADV比较,PDV具有更高的安全性和耐受性[19]。。
在40例美国和加拿大的慢性HBV感染患者中进行的一项安慰剂对照、剂量递增研究考察了PDV(5、10、30、60 mg/d,口服,持续28 d)的安全性、耐受性和药动学,结果显示,该药最高剂量组常见不良反应是腹泻、消化不良、鼻咽炎、上呼吸道感染以及头痛,大多数不良反应较轻微,且其发生率与安慰剂组相似,常见不良反应是头痛[14,20]。
5 展望
帕拉德福韦主要在肝脏经CYP3A4转化为PEMA,该药品肝靶向性强,肾脏毒性和耐药均明显低于同类治疗药品;初步研究表明,对乙肝的疗效好、副作用低、治疗成本低。该靶向药品核心制备技术已在美国、德国、欧盟、英国、法国、中国等13个国家获得专利授权[15-16]。目前在美国已完成Ⅰ、Ⅱ期临床试验,在我国已取得临床批件,正在进行Ⅰ期临床试验,并在多个国家取得专利授权,相信不久的将来,该药能为HBV感染的患者带来福音。
[1] Samal J,Kandpal M,Vivekanandan P.Molecular mechanisms underlying occult hepatitis B virus infection[J].Clin Microbiol Rev,2012,25(1):142-163.
[2] Ganem D,Prince AM.Hepatitis B virus infection-natural history and clinical consequences[J].N Engl J Med,2004,350(11):1118-1129.
[3] World Health Organizaion.Hepatitis B ( Revised August 2008) [EB/OL].[2010-12-9].http:/ /www.who.int /mediacentre /factsheets /fs204 /en /.
[4] 斯崇文.慢性乙型病毒性肝炎抗病毒治疗的进展[J].中国医院用药评价与分析,2013,13(2):100-102.
[5] Giles M,Visvanathan K,Sasadeusz J.Antiviral therapy for hepatitis B infection during pregnancy and breastfeeding[J].Antivir Ther,2011,16:621-628.
[6] Sonneveld MJ,Janssen HL.Chronic hepatitis B:peginterferon or nucleos(t) ide analogues?[J].Liver Int,2011,31 Suppl 1:78-84.
[7] 张磊,程书权.核苷(酸)类似物治疗慢性乙型肝炎研究进展[J].中华临床医师杂志(电子版),2013,7(2):766-768.
[8] Apostolova N, Blas-García A, Esplugues JV. Mitochondrial toxicity in HAART:an overview of in vitro evidence[J].Curr Pharm Des,2011,17(20):2130-2144.
[9] Kim BK,Oh J,Kwon SY,et al.Clevudine myopathy in patients with chronic hepatitis B[J].J Hepatol,2009,51(4): 829-834.
[10] Lin CC, Xu C, Teng A, et al.Pharmacokinetics of pradefovir and PMEA in Healthy Volunteers After Oral Dosing of pradefovir [J].J Clin Pharmacol,2005,45(11):1250-1258.
[11] Hynicka LM, Yunker N, Patel PH. A Review of Oral Antiretroviral Therapy for the Treatment of Chronic Hepatitis B[J]. Ann Pharmacother,2010,44(7-8):1271-1286.
[12] Lin CC, Fang C, Benetton S, et al. Metabolic Activating of pradefovir by CYP3A4 and Its Potential as an Inhibitor or Inducer[J]. Antimicrob Agents Chemother,2006,50(9):2926-2931.
[13] Lee KS, Lim SG, Chuang WL,et al.Safety,tolerability and antiviral activity of pradefovir mesylate in patients with chronic hepatitis B virus infedtion:48-week analysis of a phase 2 study[J]. J Hepatol, 2006, 44(6):S274.
[14] 王姗.乙型肝炎治疗药——帕拉德福韦[J].药学进展,2008,32(5):232-234.
[15] 西安科技信息网,http://www.snstd.gov.cn:8083/init Sn Three Page Hot Article Detail.do?method=init Sn Three Page Hot Article Detail & uType=&articleId=114679.
[16] 陕西省人民政府网,http://www.shaanxi.gov.cn/0/xxgk/1/2/4/430/1374/1398/1421/33899.htm.
[17] Lin CC,Yeh LT,Vitarella D,et al.Remofovir mesylate:a prodrug of PMEA with improved liver-targeting and safety in rats and monkeys[J]. Antivir Chem Chemother,2004,15(6):307-317.
[18] Lin CC, Zhu N, Lourenco D,et al.Comparative disposition and metabolic profiles of [14C]remofovir and [14C]adefovir dipivoxil in rat liver and kidney[J]. J Hepatol,42(Suppl 2):149.
[19] Lin C, Xu C, Yeh L,et al.Pharmacokinetics and pharmacodynamics of pradefovir,a liver-targeting prodrug of PMEA in HBV patients[J].J Hepatol,2006,44:S16.
[20] Lau D, Nguyen T, Tong M,et al.Sfety,tolerability,pharmacokinetics and pharmacodynamics of remofovirir chronic HBV patients in USA and Canada following daily dosing for 28 days[J]. J Hepatol,2005,42(2):32.
(编校:王俨俨)
Pradefovir: a new drug that targets to the liver for treatment of hepatitis B
YAN Hui-yu, QU Xiao-yu, WANG Hong-yu, ZHANG Si-xiΔ
(Department of Pharmacy, The First Hospital of Jilin University, Changchun 130021, China)
ObjectiveTo review pharmacological mechanism, pharmacokinetics, clinical research progress and prospects of pradefovir, a liver targeted medicine for hepatitis B.MethodsThe studies of pradefovir were summarized by searching literature databases of Web of Science,Elsevier ScienceDirect,Springer Link,Wiley Online Library, Pubmed, CNKI, Wanfang and VIP datebase.ResultsPradefovir is a prodrug that targets to the liver, which absorbs rapidly by oral administration. Pradefovir could be quickly converted to adefovir with hepatic drug metabolizing enzyme CYP3A4. Compared with adefovir dipivoxil, it has shown smaller nephrotoxicity and larger liver targeting.ConclusionPradefovir has shown favorable safety and effectiveness in the clinical study and has no durg resistance to be found. The approval Ⅲ clinical trial has been acquired of pradefovir in USA and has enteredⅠ clinical trial currently in our country, which has good prospects for clinical application in future.
pradefovir; hepatitis B; target
闫荟羽,女,硕士,主管药师,研究方向:药事管理和临床合理用药研究,E-mail:419351036@qq.com;张四喜,通信作者,男,硕士,主管药师,研究方向:药物缓控释制剂和临床合理用药研究,E-mail:zhsixi@163.com。
R575.1
A
1005-1678(2015)12-0186-03

