亚氨基二乙酸芳香衍生物的多核铜配合物氧化切割DNA研究
吴琳琳,李萌,黄婷
(武警四川省总队医院 药剂科,四川 乐山 614000)
亚氨基二乙酸芳香衍生物的多核铜配合物氧化切割DNA研究
吴琳琳,李萌,黄婷
(武警四川省总队医院 药剂科,四川 乐山 614000)
目的 研究亚氨基二乙酸芳香衍生物的多核铜配合物对DNA氧化切割的影响。方法 合成配合物后,利用电位滴定方法测定配体的质子化常数和配合物的稳定常数,利用琼脂糖凝胶电泳的方法研究 DNA 的切割作用。结果 在生理条件下配合物H4L1、H4L2、H6L3与Cu2+之间的配位能力较强; 3个多羧酸多铜配合物在等 Cu2+浓度下切割效率均高于相应的单核铜配合物, Cu2+中心之间存在协同作用;配合物H6L3在3者中的 DNA切割效率最高,配合物H4L1次之,配合物H4L2切割效率最低。结论 改变配合物螯合配位基团对于配合物性质有很大的影响,为合理的设计合成铜类核酸酶提供一个理论基础。
多核铜配合物;DNA氧化切割;人工金属核酸酶
核酸的断裂与基因的重组技术是分子生物学与基因工程的核心技术,因而研究人工合成的定点切割核酸的切割剂,即核酸的“分子剪刀”在理论与应用上都具有十分重要的意义。目前在人工核酸切割剂的研究中,金属配合物占了很大的比重,由于自然界中许多与核酸有关的天然酶的活性部位,含有两个或多个相互协同作用的金属离子[1]。近年来,多核金属配合物作为人工核酸切割剂的研究倍受世人关注,而且具有广阔的应用前景。金属配合物具有丰富的结构和生物功能,已被应用于金属人工核酸酶、金属抗癌药物及潜在的基因载体研究等领域。在人工核酸酶研究中,选择性比切割效率更为重要,而目前金属核酸酶的设计还未真正达到定位切割的效果。把具有切割性能铜配体与DNA靶向性结合性能的基团连接起来,是实现DNA特异性切割的良好设计策略。亚氨基二乙酸是一种有效的螯合基团,可以与金属离子形成带负电的配合物[2],本研究中以亚氨基二乙酸为基本配位单元,分别用间二甲苯、对二甲苯和均三甲苯这3个桥连基团进行桥连,得到3个配体,3个配体与CuCl2反应得到3个配合物,通过2组配合物的对比,可以阐述金属中心的螯合基团在DNA氧化切割中的作用。
1 材料与方法
1.1 药品与试剂 pUC19质粒DNA购自大连宝生物有限公司,小牛胸腺 DNA(CT-DNA)、三羟甲基氨基甲烷(Tris)、溴化 3,8-二氨基-5-乙基-6-苯基菲啶鎓(EB)购自sigma公司。所用溶剂:CuCl2·H2O、亚氨基二乙酸酯均为国产分析纯和化学纯,使用前未经纯化。
1.2 仪器 Titrando809电位滴定仪购自瑞士万通;PAR273A电化学工作站购自美国EG&G(普林斯顿);Bruker Advance/AV 500 MHz核磁共振仪购自瑞士布鲁克公司。DYCP-31BN凝胶电泳仪购自美国Thermo 公司。
1.3 方法
1.3.1 配体的合成:3个配体根据文献方法合成[3]。
1.3.2 电位滴定测试:配体的质子化常数和配合物的稳定常数可以通过自动电位滴定进行测定。复合pH玻璃电极采用三点校正。滴定液中配体的浓度均为1.000×10-3mol/L, 配合物滴定过程中,L1、L2、L3与Cu2+的摩尔比分别为1︰2,1︰2和1︰3支持电解质为0.10 mol/L KCl。总体积为15.00 mL。整个滴定过程中通入被水饱和的高纯氮气。每次的滴定体积为15 mL。滴定的pH范围为2~11.5。 共收集60~120数据点。稳定常数的计算采用南开大学孙宏伟教授的SCMAR程序。配体储备液配制时加入一定量的氢氧化钠使其溶解。
1.3.3 DNA切割测试:利用琼脂糖凝胶电泳的方法研究DNA的切割作用。将超螺旋pUC19质粒DNA与一定量的铜配合物混合,加入1 mmol/L的抗坏血酸(Vc),再用50 mmol/L Tris-HCl/50 mmol/L NaCl缓冲溶液定容。37 ℃孵化1 h后,加入1 μL终止缓冲剂(EDTA,30 mmol/L;甘油,36%;二甲苯腈蓝FF,0.05%;溴酚蓝,0.05%)终止反应。利用EB染色的 0.7%凝胶电泳分析切割结果,电泳测定在TAE(40 mmol/L Tris acetate/1 mmol/L EDTA)缓冲液,50 mV电压下进行2 h,并用UV凝胶成像系统对电泳图进行拍照成像。根据琼脂糖凝胶中EB的密度分析来定量每一种形式的DNA。由于EB与超螺旋DNA的嵌入作用低于开环(Form II)及线性(Form III),因而在定量DNA时,应该在得到的超螺旋DNA含量上乘以一个校正因子1.47。在机理研究中,10%DMSO(羟基自由基清除剂)或10 mmol/L NaN3(单线态氧清除剂)或10 qmmol/L KI(过氧化氢清除剂)首先加入到超螺旋DNA和铜配合物的混合溶液中,在37 ℃温育 15 min, 然后加入Vc引发反应。
2 结果
2.1 配合物的结构与表征 H4L1:1H NMR(D2O,加入K2CO3):δ=3.62 ppm(s,8H),δ=4.30 ppm(s,4H),δ=7.53 ppm(s,4H);H4L2:1H NMR(D2O,加入K2CO3):δ=3.37 ppm(s,8H),δ=4.00 ppm(s,4H),δ=7.42 ppm(s,4H);H6L3:1H NMR(D2O):δ=4.03 ppm(s,12H),δ=4.57 ppm(s,6H),δ=7.77 ppm(s,3H)。
2.2 电位滴定 配合物1,2,3在不同PH值下存在形式和比例见表1。 配合物1,2,3在不同的pH下存在形式不同,见图1。

表1 配合物1,2,3在不同pH值下存在形式及比例Tab.1 Existing form and proportion of complexes 1, 2, 3 in different pH value
注:“—”代表表中是缺失值

图1 配合物1、2、3的各存在形式分布曲线Fig.1 Distribution curves of existing forms of the complexes 1,2 and 3
2.3 配合物核酸酶活性
2.3.1 配合物1,2和3对pUC19质粒DNA的切断:配合物1随着浓度升高可以逐渐将FormⅠ DNA转变成Form Ⅱ DNA(FormⅠ:共价闭环形;FormⅡ:开环缺刻形;Form Ⅲ:线形)。当浓度达到18 μmol/L时,开始有Form Ⅲ DNA产生;浓度达到21 μmol/L时,Form Ⅱ DNA和Form Ⅲ DNA同时存在,而Form Ⅰ DNA基本消失。与配合物Ⅰ类似,当配合物2浓度达到21 μmol/L时,Form Ⅰ DNA彻底降解为Form Ⅰ DNA及Form Ⅲ DNA。而配合物3可以在10 μmol/L时将大部分的Form Ⅰ DNA转变为Form Ⅱ DNA。12 μmol/L时,Form Ⅰ DNA完全转变为Form Ⅱ DNA及Form Ⅲ DNA。在图示的4个配合物中,亚氨基二乙酸铜的切割效率最低,即使浓度达到48 mmol/L也只能够将Form Ⅰ DNA降解至Form Ⅱ DNA,见图2。

图2 配合物1-3及其单核配合物(亚氨基二乙酸铜)切割pUC19质粒DNA的琼脂糖凝胶电泳图Fig.2 Agarose gelelectrophoresis of complexes 1,2, 3 and mononuclear complexes(Imino two copper acetate) cutting pUC19 plasmid DNA
2.3.2 活化氧物种捕捉剂存在下的pUC19质粒DNA切割:当加入DMSO时,配合物1-3的切割活性明显降低,抑制率分别为91%,84% 和 48%;过氧化氢清除剂KI的加入同样能够显著的降低配合物的切割活性,抑制率分别为78%,62%和 60%,而 NaN3的加入对于切割反应影响较小,说明单线态氧并非这类配合物的DNA切割过程中产生的活性氧中间。见图3。
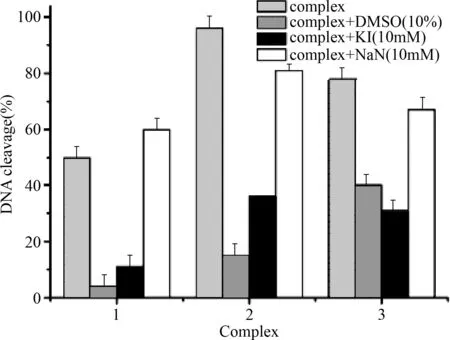
图3 配合物在不同清除剂存在下的DNA切割Fig.3 Complexes in the presence of different scavenger cutting DNA
本实验中的3个配合物Cu2+/Cu+氧化还原电位高低遵循的顺序为:3>1>2,这与配合物的DNA切割效率一致。
3 讨论
金属配合物具有诱导DNA凝聚的潜力,带正电的多核金属配离子有可能诱导DNA发生可逆凝聚,成为一种新型基因载体,对基因治疗具有重要的意义。金属配合物和DNA相互作用的方式和机理的研究,对探索配合物在抗肿瘤药物、分子生物学、生物工程技术及其他相关领域的应用具有非常重要的意义。在研究配合物与DNA相互作用的基础上,通过适当的方法使DNA发生断裂,这是获取DNA的序列信息和阻止癌变基因复制的重要工作。本研究利用铜配合物进行合成新的配体1’-3’,在不同的ph值下配合物配体存在形式也不同。
配合物1-3在相同的Cu2+浓度下,切割效率明显要高于亚氨基二乙酸铜,Form Ⅰ DNA消失时,相应的配合物1-3 Cu2+浓度分别为42,40和36 mmol/L;而配合物1在15 μmol/L的浓度下,50%的Form Ⅰ DNA可以转变为Form Ⅱ DNA,配合物2可以将40%的Form Ⅰ DNA转变为Form Ⅱ DNA,配合物3在10 μmol/L时就能将90%的Form Ⅰ DNA转变成Form Ⅱ DNA;在配合物1,2,3的Cu2+浓度均为30 μmol/L时,剩余的超螺旋pUC19质粒DNA含量分别为44%、60%、9%,说明配位铜中心之间存在着协同作用,切割效率遵循以下顺序:3>1>2。这个顺序与配合物跟 DNA结合能力的顺序相一致,说明配合物与 DNA结合能力的大小可能是影响DNA切割的主要因素[4-8]。但在配合物1’-3’中,情况与配合物1,2,3并不相同。配合物1’,2’,3’中,Form I DNA消失时,相应的配合物1’-3’ Cu2+浓度分别为2,1和9 mmol/L,这很显然的说明了配合物1’-3’切割效率高于配合物1-3,可能由于结合能力的强弱所致。然而配合物2’对于 DNA 的切割并不能产生线性DNA(Form III DNA),这不同于配合物2,说明它们对于DNA氧化切割机理不同[9-10]。需要引起注意的是配合物3’,它与DNA结合能力最强,但是切割效率却是3者中最低的,螯合单元换为亚氨基二乙酸时,配合物3与DNA结合能力最强,切割效率在3者中最高。
本文合成了3个有机配体:N,N,N’,N’-间苯二甲胺基四乙酸(H4L1)、N,N,N’,N’-对苯二甲胺基四乙酸(H4L2)、N,N,N,N’,N’,N’-1,3,5-苯三甲胺基六乙酸(H6L3),并利用这3个配体合成了3个多羧酸多铜配合物(1-3)并首次研究了多羧酸多铜配合物氧化切割DNA的能力,同时与其多吡啶多铜类似物(1’-3’)的切割活性比较探索了DNA氧化切割中多铜协同作用中的配位基团效应。配合物 1-3 与配合物 1’-3’的差别在于螯合配位基团由二-(2-吡啶基甲基)胺变为亚氨基二乙酸,基本螯合单元的改变让配合物性质发生了变化。研究发现,3个多羧酸多铜配合物在等 Cu2+浓度下切割效率均高于相应的单核铜配合物,说明Cu2+中心之间存在协同作用,这与配合物 1-3相同[11]。配合物 3 在3者中的 DNA切割效率最高,配合物1次之,配合物2切割效率最低,这与它们的DNA结合能力相一致[12]。配合1-3与DNA结合能力远低于配合物1’-3’,切割效率也远低于1’-3’,但是配合物2可以诱导产生线性DNA,这种一点是配合物2’所不具备的。配合物3’与DNA结合能力最强,但是切割效率在1’-3’中确最低。因而对于DNA氧化切割,多羧酸多铜配合物与多吡啶多铜配合物所采用的机理并不相同[13]。通过加入不同的活性氧清除剂可以发现,配合物1-3采用Fenton机理氧化切割DNA,而配合物1’-3’采用的是非任意切割的DNA 结合的ROS机理。改变配合物螯合配位基团对于配合物性质有很大的影响,这些工作可以为合理的设计合成铜类核酸酶提供一个很好的指导。表明·OH在切割过程中起着重要作用,·OH的随机扩散使Form I DNA转变成Form II DNA,Form III DNA的出现说明配合物1-3与DNA采用一种特定的结合方式,在相同的配合物上产生两个·OH自由基破坏邻近的两个脱氧核糖以产生线性DNA,这与上述的DNA强结合能力导致高切割效率相一致。通过对比DMSO和KI对配合物1和2的抑制率,可以看出配合物对于DNA的氧化切割主要采用以·OH为主要活性氧物种的Fenton机理。
[1] Fu XB,Zhang JJ,Liu DD,et al.Cu(II)-dipeptide complexes of 2-(4’-thiazolyl)benzimidazole: Synthesis,DNA oxidative damage,antioxidant and in vitro antitumor activity[J].J Inorg Biochem,2015,143:77-87.
[2] Farrow SC,Facchini PJ.Functional diversity of 2-oxoglutarate/Fe(II)-dependent dioxygenases in plant metabolism[J].Front Plant Sci,2014,9(5):524-529.
[3] Gup R,Gökce C,Aktürk S.Copper(II) complexes with 4-hydroxyacetophenone-derived acylhydrazones: synthesis,characterization,DNAbinding and cleavage properties[J].Spectrochim Acta A Mol Biomol Spectrosc,2015,134(5):484-492.
[4] Reddy PR,Shilpa A,Raju N,et al.Synthesis,structure,DNA binding and cleavage properties of ternary amino acid Schiff base-phen/bipy Cu(II) complexes[J].J Inorg Biochem,2011,105(12):1603-1612.
[5] Rabindra Reddy P,Shilpa A.Synthesis,characterization,and DNA-binding and -cleavage properties of dinuclear Cu(II)—salophen/salen complexes[J].Chem Biodivers, 2011,8(7):1245-1265.
[6] Shakir M,Azam M,Ullah MF,et al.Synthesis,spectroscopic and electrochemical studies of N,N-bis[(E)-2-thienylmethylidene]-1,8-naphthalenediamine and its Cu(II) complex: DNA cleavage and generation of superoxide anion[J].J Photochem Photobiol B,2011,104(3):449-456.
[7] Neelakantan MA,Sundaram M,Nair MS.Synthesis,spectral and thermal studies of some transition metal mixed ligand complexes: modeling of equilibrium composition and biological activity[J].Spectrochim Acta A Mol Biomol Spectrosc,2011,79(5):1693-1703.
[8] Li DD,Tian JL,Gu W,et al.DNA binding,oxidative DNA cleavage,cytotoxicity,and apoptosis-inducing activity of copper(II) complexes with 1,4-tpbd (N,N,N’,N’-tetrakis(2-yridylmethyl)benzene-1,4-diamine) ligand[J].J Inorg Biochem,2011,105(6):894-901.
[9] Yang Z,Wang Y,Yang G.Copper (II) complex of 1,10-phenanthroline and L-tyrosine with DNA oxidative cleavage activity in the gallic acid[J].Biometals, 2011,24(4):737-745.
[10] Yue H,Zhu Y,Wang Y,et al.Investigation and improvement of DNA cleavage models of polyamide + Cu(II) nuclease + OOH- ligands bound to DNA[J].BMC Struct Biol,2010,10(35):1172-1480.
[11] Li DD,Huang FP,Chen GJ,et al.Four new copper(II) complexes with 1,3-tpbd ligand: Synthesis,crystal structures,magnetism,oxidative and hydrolytic cleavage of pBR322 DNA[J].J Inorg Biochem,2010,104(4):431-441.
[12] Banerjee S,Mondal S,Sen S,et al.Four new dinuclear Cu(ii) hydrazone complexes using various organic spacers: syntheses,crystal structures,DNA binding and cleavage studies and selective cell inhibitory effect towards leukemic and normal lymphocytes[J].Dalton Trans,2009,14(34):6849-6860.
[13] Tan J,Wang B,Zhu L.DNA binding and oxidative DNA damage induced by a quercetin copper(II) complex: potential mechanism of its antitumor properties[J].J Biol Inorg Chem,2009,14(5):727-739.
(编校:王冬梅)
Study on oxidative cutting DNA with pentanuclear copper complexes of imino acetic acid two aromatic derivatives
WU Lin-lin,LI Meng, HUANG Ting
(Department of Pharmacy, Armed Police Corps Hospital of Sichuan Province, Leshan 614000, China)
ObjectiveTo study effect of pentanuclear copper complexes of imino acetic acid two aromatic derivatives on oxidative cutting DNA.MethodsSynthesized complexes later, protonation constants and the stability constants of the complexes were determined by potentiometric titration method, the cutting DNA was studied by agarose gelelectrophoresis.ResultsUnder physiological conditions, complexes H4L1, H4L2, between H6L3 and Cu2+coordination capability was stronger; three carboxylic multi copper complexes in Cu2+concentration cutting efficiency were higher than the corresponding mononuclear copper complexes, synergistic effect exists between Cu2+Center; H6L3 complexes of the three DNA cut the highest efficiency, complex H4L1 was followed, complex H4L2 cutting efficiency was the lowest.ConclusionChange the complex chelating ligands has great influence on the properties of complex, which provides a theoretical basis for the design and synthesis of copper nucleases reasonable.
pentanuclear copper complexes; DNA oxidative cutting;artificial metallonucleases
吴琳琳,女,硕士,副主任药师,研究方向:药物化学,E-mail:wll13981398866@163.com。
O641.4
A
1005-1678(2015)03-0072-04

