化学反应热计算难点突破
雷范军 乐善堂

化学反应热的计算是高中化学的基本技能之一,也是每年高考必考的内容之一。该部分主要涉及热化学方程式的加减乘除、盖斯定律的应用、反应热的计算表达式或结果等知识,下面根据课标、教科书和高考考纲的要求,对该部分的重难点问题进行剖析。
一、根据热化学方程式的加减乘除计算反应热
例1 已知:①
②
③
(l)反应①属于_____(填“吸热”或“放热”)反应。
(2)反应①消耗8gCH4(g)时,
(3)反应②生成2 mol H2(g)时,
(4)反应③的
解析:(I),说明反应①属于吸热反应。
(2)由可知,;由可知,
(3)由可知
(4)观察可知,反应①+②=③,则反应③的△H3=反应①的△H1+②的 △H2=
答案:(l)吸热 (2)+103.2 (3) -82.0(4)+165.4
技巧点拨:(1)反应热与各物质的物质的量成正比,各物质的系数減半,则焓变随之减半,系数加倍时,焓变随之加倍。
(2)两个热化学方程式相加减时,焓变也随之相加减。
二、根据盖斯定律推断反应热的计算表达式
例2 在298K、lOlkPa时,已知:
②
③
则△H3与△H1和△H2间的关系正确的是
解析:为了约去2H2(g),观察可知,反应①;由盖斯定律可知,反应①的故选A。
答案:A
技巧点拨:2~4个热化学方程式之间加减乘除时,可以约去某些反应物或产物,得到指定反应物和产物的热化学方程式,它们的焓变也可以进行相应的加减乘除,这样就可以推断焓变的计算表达式。
三、根据已知焓变的热化学方程式计算反应热的结果
例3 用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①
②
③
在H2SO4溶液中,Cu与H2O2反应生成和的反应热△H等于()。
解析:为了约去,观察可知,由热化学方程式①+1/2×②+③可知,的故选A。
答案:A
技巧点拨:利用盖斯定律计算反应热或书写热化学方程式的思路如下:
四、根据共价键的断裂与形成计算反应热
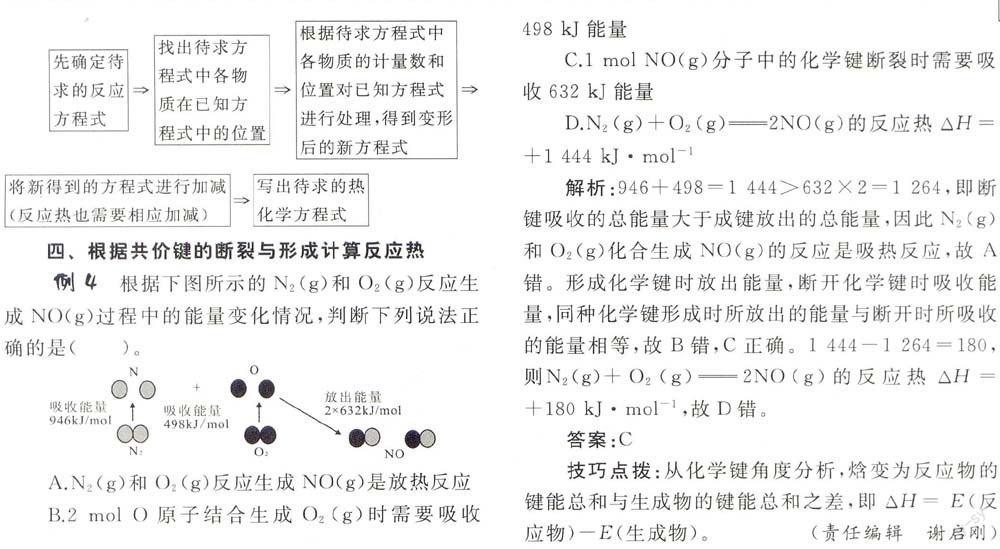
例4 根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是()。
A.N2(g)和O2(g)反应生成NO(g)是放热反应
B.2 molO原子结合生成02(g)时需要吸收498kJ能量
C.1 mol NO(g)分子中的化学键断裂时需要吸收632kJ能量
D.N2(g)+02(g)——2NO(g)的反应热
解析:946+498=1444>632×2=1264,即断键吸收的总能量大于成键放出的总能量,因此N2(g)和O2(g)化合生成NO(g)的反应是吸热反应,故/\错。形成化学键时放出能量,断开化学键时吸收能量,同种化学键形成时所放出的能量与断开时所吸收的能量相等,故B错,C正确。1444-1264=180,则N2(g)+02(g)=2NO(g)的反应热△H=,故D错。
答案:C
技巧点拨:从化学键角度分析,焓变为反应物的键能总和与生成物的键能总和之差,即△H=E(反应物)-E(生成物)。

