穿刺植入细管注射阿霉素脂质体治疗大鼠脑胶质瘤的初步研究
徐兵吴林岚黄素钦杨晓梅吴开木
作者单位:350025福州1福建医科大学孟超肝胆医院肝病研究所;350001福州2福建省第二人民医院检验科;3福州市菁华崇辉医院内科
临床研究
穿刺植入细管注射阿霉素脂质体治疗大鼠脑胶质瘤的初步研究
徐兵1吴林岚2黄素钦1杨晓梅3吴开木2
作者单位:350025福州1福建医科大学孟超肝胆医院肝病研究所;350001福州2福建省第二人民医院检验科;3福州市菁华崇辉医院内科
目的建立一种经皮向脑间质内注射药物以抑制脑胶质瘤生长的方法。方法通过埋于皮下的直通接头和带有冰套的细管经皮向SD大鼠脑内注射生理盐水(带管正常对照组);向脑胶质瘤模型大鼠脑内分别注射阿霉素(ADR)脂质体(ADR脂质体组)、ADR水剂(ADR水剂组)、生理盐水(盐水对照组);各组大鼠在注射药物后5 d、10 d分别以同法再注射一次。在末次注射药物后4 d,从后3组大鼠中各取8只大鼠测定脑肿瘤体积和血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐(Cr)的水平。其余大鼠常规继续饲养,观察大鼠生存时间。结果治疗14 d后,ADR脂质体组大鼠肿瘤体积为(27.5±6.4)mm3,明显低于盐水对照组的肿瘤体积(57.5±6.3)mm3(P<0.05);ADR脂质体组大鼠肿瘤抑制率为(52.2±14.6)%,明显高于ADR水剂组的肿瘤抑制率(27.7±9.5)%(P<0.05);ADR脂质体组大鼠平均生存期为(42.3±8.2)d,明显长于ADR水剂组的平均生存期(29.9±4.8)d(P<0.05);ADR脂质体组和ADR水剂组大鼠的血清ALT、AST、Cr值与盐水对照组比较差异均不明显(P均>0.05)。带管正常对照组大鼠全部存活50 d以上。结论带冰套和金属芯的细管易于穿刺植入脑内,通过皮下的直通接头和脑内的细管可经皮向脑内注入药物,并明显抑制脑肿瘤生长,延长荷瘤大鼠存活时间。
脑肿瘤;阿霉素;脂质体;接头;经皮注射;治疗
临床上诸多药物难以通过血脑屏障,这一直是脑肿瘤化疗的难点。脑胶质瘤约占脑肿瘤的45%,该肿瘤常常侵入周围正常脑组织,手术切除难以切净,复发率较高,但90%的恶性脑胶质瘤复发在原病灶周围2 cm以内[1]。通过病灶局部给药可绕过血脑屏障,杀灭病灶周围肿瘤细胞,减少药物全身毒副反应。现有的局部给药法一般需多次穿刺注射,或术中一次性给药,药物在组织间内弥散距离较小[2~7],故疗效不理想,不良反应也较多。本实验设计一种带有冰套的细管直接穿刺植入脑间质,可经皮穿刺通过埋于皮下的直通接头和脑内的细管,将药物注入脑间质内。我们用该法将阿霉素脂质体注入大鼠脑内治疗脑胶质瘤,初步证明了该法的可行性和安全性。现介绍如下。
1 材料和方法
1.1 主要材料和试剂
SD大鼠(雄性,体重280~320 g,SPF级,动物合格证号:SCXK沪2007-0005)和C6大鼠脑胶质瘤细胞(上海斯莱克实验动物公司)。聚乙烯(PE)细管外径为0.5 mm,内径为0.25 mm(上海红叶塑料制品公司)。金属管芯长5 cm,外径为0.1 mm,钝头不锈钢输注针,注射针头(PE注射器针头)。硅胶液及硫化剂(成都中蓝晨光化工研究设计院)。阿霉素(ADR)注射液(2mg/ml,浙江海正药业)。阿霉素脂质体(LI月OD,含ADR 2 mg/ml,上海复旦张江生物医药公司,国药准字H20084432)。
1.2 冰套细管的制备
取一内径为1 mm的玻璃管,管内壁涂硅油,200℃烤30 min硅化。20%明胶溶液用微波炉加热8 s×3次以灭菌。将灭菌明胶溶液加热溶解后灌入硅化玻管中。将插有管芯的PE细管插入玻管及明胶溶液中,并置-20℃冻成冰套细管。将冰套细管连管芯一并从玻管中拔出,置-20℃备用。
1.3 直通接头的制备
将PE注射针头的大口端和针管截短。以硫化剂加入硅胶液启动固化,取半固化硅胶封盖于注射接头的大口,热压灭菌并使硅胶完全固化封口,制成直通接头。
1.4 大鼠脑胶质瘤模型的制备和接头细管植入
SD大鼠用10%水合氯醛(300 mg/kg)腹腔注射麻醉,将大鼠头部固定于大鼠脑立体定位仪上,手术暴露颅骨,定位前囟,在前囟后5 mm、矢状线右旁切开5mm的骨表面,用牙科高速钻机在颅骨上钻开一小孔,暴露硬脑膜并用针刺一小孔,经此孔将插有管芯的冰套细管穿刺入脑内8 mm。拔出管芯,保留细管在脑内(细管外壁冰套将逐渐溶解)。将细管外口连接于直通接头的针管。用注射针穿过直通接头的硅胶封口,顺着接头的三角漏斗状大口严密地插入接头内的针管口中,通过针管和细管向大鼠脑内注入0.9%NaCl溶液15μl(带管正常对照)或C6脑胶质瘤细胞(2×106/L)/15μl制作大鼠脑胶质瘤模型。再将直通接头埋在头皮下,用骨蜡封闭骨窗,缝合头皮。术后大鼠常规饲养,术后5 d内每天给每只大鼠腹腔注射青霉素10万U以预防感染。
1.5 大鼠脑内局部抑瘤实验
大鼠注射接种后6 d,用经皮注射法(通过埋于头皮下的接头和脑内的细管)向带管正常对照的大鼠脑内注射生理盐水17μl;向C6脑胶质瘤模型大鼠脑内注射ADR脂质体、ADR水剂(均含ADR 0.1 mg/kg[8])、生理盐水各17μl;将大鼠分别作为带管正常对照组(n=6)、ADR脂质体组(n=16)、ADR水剂组(n=16)和盐水对照组(n=16)处理。在注射盐水或药物后5 d、10 d,分别在各组大鼠以同法注射一次。在末次注射治疗后4 d,从后3组大鼠中各取出8只大鼠,麻醉后经左心室主动脉采血样并快速注入4%多聚甲醛溶液,然后开颅取出大鼠全脑,置10%福尔马林溶液固定后,沿植入的细管方向冠状切开脑瘤并完整取出,按脑瘤垂直和水平方向测量肿瘤直径,并计算肿瘤体积,肿瘤体积=a×b2/2(a:肿瘤最大直径,b:肿瘤最小直径)[1]。测定大鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐(Cr)的浓度。其余大鼠继续常规饲养、观察。
1.6 观测指标
观察各组大鼠生存期及一般状况。测算、比较各组荷瘤大鼠的肿瘤体积、肿瘤生长抑制率(对照组肿瘤体积-治疗组肿瘤体积)/对照组肿瘤体积×100%[9]、血清ALT、AST、Cr的浓度和平均生存期。
1.7 统计学分析
用SPSS 19.0统计学软件处理、分析实验数据。计量资料以均数±标准差(±s)表示,两组比较用t检验。计数资料中两组比较用χ2检验,生存曲线用Kaplan-Meier分析。P<0.05为差异有统计学意义。
2 结果
2.1 荷瘤大鼠生活状况及存活期
盐水对照组大鼠接种肿瘤细胞后活动量逐渐减少,饮水、饮食量均减少,皮毛失去光泽,出现腹泻,对刺激反应迟钝,逐渐消瘦。接种16 d开始发生死亡,至23 d全部死亡,平均生存期为(20.3±4.6)d。ADR水剂组大鼠生活状况有所改善,接种后20 d开始发生死亡,至36 d全部死亡,平均生存期为(29.9±4.8)d。ADR脂质体组大鼠生活状况明显改善,症状出现较晚,接种后28 d开始发生死亡,至50 d全部死亡,平均生存期为(42.3±8.2)d。3组大鼠的生存曲线见图1。ADR脂质体组大鼠生存期较其他两组大鼠生存期明显延长(P<0.05)。见表1。
2.2 荷瘤大鼠脑肿瘤生长情况
治疗后ADR脂质体组大鼠的肿瘤体积小于ADR水剂组肿瘤体积,差异有统计学意义(P<0.05);ADR脂质体组的肿瘤生长抑制率为(52.2±14.6)%,明显高于ADR水剂组的相应值(27.7±9.5)%,差异有统计学意义(P<0.05)。见表1。提示阿霉素脂质体对脑肿瘤的生长抑制作用更明显。
2.3 荷瘤大鼠血清肝肾功能指标
治疗后ADR脂质体组和ADR水剂组大鼠血清ALT、AST、Cr值与盐水对照组比较,差异均无统计学意义(P均>0.05)。见表2。提示本法治疗对大鼠未见明显肝肾毒性。
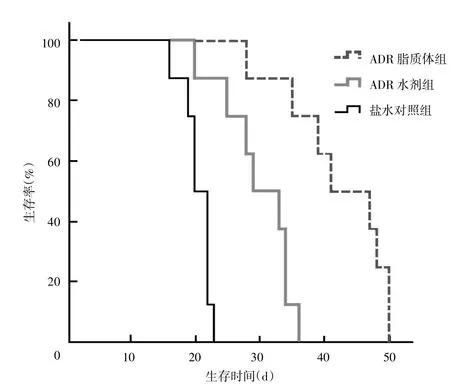
图1 通过植入的接头和细管经皮向脑内注射不同药物治疗大鼠脑胶质瘤的生存曲线
表1 通过植入的接头和细管经皮向脑内注射不同药物治疗大鼠脑胶质瘤的情况(±s)

表1 通过植入的接头和细管经皮向脑内注射不同药物治疗大鼠脑胶质瘤的情况(±s)
▲分别与盐水对照组、ADR水剂组比较,P<0.05;△与ADR水剂组比较,P<0.05。
组别n肿瘤体积(mm3)盐水对照组8 57.5±6.3 ADR水剂组8 41.6±5.3 ADR脂质体组8 27.5±6.4▲肿瘤生长抑制率(%)平均生存期(d)-20.3±4.6 27.7±9.5 29.9±4.8 52.2±14.6△42.3±8.2▲
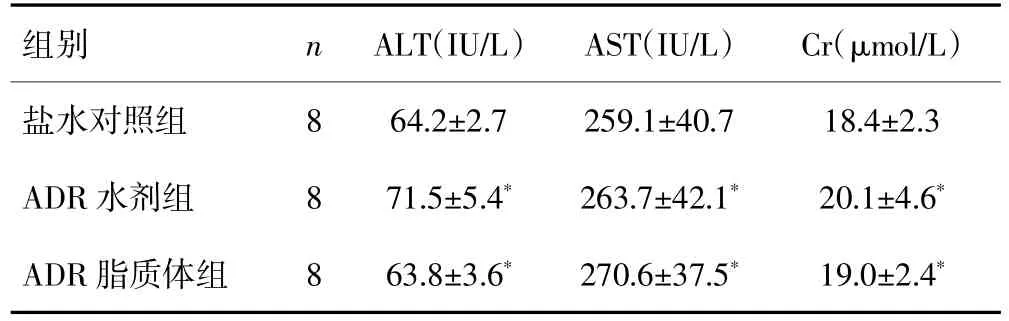
表2 通过植入的接头和细管经皮向脑内注射不同药物治疗大鼠脑胶质瘤的血清肝肾功能指标
3 讨论
临床上如何更好地对肿瘤局部进行化疗,一直是肿瘤防治研究的重点之一。有报道用各种注射器将药液、凝胶剂[2]、药粒[3]、脂质体[4]等注射到肿瘤病灶,亦有用植入的Ommaya囊[5]向瘤灶注射药液或直视下将药物放在瘤灶[6,7]等局部给药法。但多次注射、局部感染、肿瘤细胞播散或其他潜在危害常常使治疗难以延续,加之由于局部药物浓度过高,对正常组织损害较大。有学者用局部增强对流输送(convectionenhanced delivery,CED)给药法治疗脑胶质瘤,将带有管芯的聚乙烯(PE)细管直接插入脑间质病灶,细管外口连接微量注射泵用持续正压将药液注入脑内,使药液在脑间质能扩散更远、更均匀[1,10]。该报道所用的PE细管内径仅为50μm至0.76 mm;由于细管内径小,临床应用时不易手持定位插入脑内病灶,且需将细管外口引出体外与微量泵对接,插管和长期输注都不太方便。为此,本研究作了如下改进:①先在PE细管外壁加冰套,冰套含明胶较为坚韧,使细管变粗、变硬,便于手持准确穿刺植入脑内(如细管较短也可不要冰套,仅需管芯细管置-20℃冻硬后使用)。⑵植入脑内后的冰套在体温下(>30℃)会逐渐融化并被机体吸收,使细管重新变细、变软。⑶注射针可直接严密地插入皮下的直通接头针管口,将药液注入与针管相连的细管,不易漏液。⑷微创穿刺。植入的PE细管为生物惰性,柔韧光滑,体积小,对组织刺激性小,可植入2根或更多细管[1,10]。⑸用直通接头代替可植入泵,可减少污染,适于持续正压注射。⑹用脂质体剂代替普通注射液(水剂)。脂质体主要通过膜融合和内吞进入细胞,可穿过黏膜甚至皮肤[11],且多位于脂质体核心的ADR受到外层膜保护,可在组织中弥散更远、更均匀;并可通过所谓增强渗透和滞留作用,更多地浓集在肿瘤组织释放药物,有一定的肿瘤靶向性[12]。本实验在荷瘤大鼠治疗中注入ADR脂质体(无须持续正压注射)比注入ADR水剂获得更好的疗效。文献报道用ADR-聚(二聚酸-SA)共聚酸酐缓释片(ADR为2.5 mg/kg)瘤旁植入治疗大鼠脑胶质瘤的平均生存期为46 d[13],而本实验用ADR脂质体(ADR为0.1 mg/kg×3)瘤旁注射治疗大鼠脑胶质瘤的平均生存期为42.3 d。两法的大鼠生存期相近,但本法的用药量仅为前法的1/8,毒副反应较低。有报道用微量泵持续正压将卡铂输注到脑胶质瘤局部,可使荷瘤大鼠生存期≥120 d或出现肿瘤消失[1]。因此如果本法结合持续正压注药,扩大药物在脑内弥散范围,可能会延长荷瘤大鼠生存期。另外还可在细管侧壁增加切口或孔,使药物弥散更快、更广,用以预防性给药。为了防止细管口堵塞,可定期注入少量惰性气体(如CO2)冲洗管口的坏死组织。另外还可试用细管插入蛛网膜下腔,直接将药物注射到脑表面,使药物在脑表面浓集(常用的腰椎部行鞘内注药化疗,须注入较多药物才能使药物扩散到脑表面达到治疗浓度,但毒副反应较大)。本研究植入的直通接头和细管均可长期留在体内,因PE材料制造的人工血管、心瓣膜、关节等均已广泛用于临床,罕有安全性问题的报道。此外,可用明胶、交联明胶或其它可生物降解材料制作细管或套管。用套管包住不锈钢注射针管,将针管连同套管刺入体内,捅破针管口外套管注药,将套管留在体内,通过套管注药。细管和套管可在体内降解吸收。
综上,本研究结果表明,带冰套(或冻硬的)PE细管易于穿刺植入脑间质。通过植入的细管和皮下的直通接头可经皮将ADR脂质体注入脑内,并明显抑制脑肿瘤生长。但植入物的长期影响及其远期疗效有待进一步研究。
(承蒙我院研究中心陈耕为本文制图,特致感谢)
[1]孙建军,王振宇.局部对流传送药物治疗脑胶质瘤[J].中国临床神经外科杂志,2005,10(3):234-236.
[2]张鹏,王文,行利,等.三氧化二砷-泊洛沙姆407缓释剂瘤内注射治疗裸鼠人肝癌移植瘤的实验研究[J].临床肿瘤学杂志,2009,14(4):293-296.
[3]张友逊,马秀萍,兰传鑫.开腹配合彩超引导125I粒子植入术治疗晚期胰腺癌16例临床分析[J].中国癌症防治杂志,2009,1(4):330-332.
[4]彭洪云,李凯,方路.低位直肠癌经肛尾介入直肠系膜内注射5-氟尿嘧啶缓释剂的新辅助化疗实验研究[J].中华临床医师杂志(电子版),2013,7(7):2941-2944.
[5]张绍林,王占祥,陈玉英.经Ommaya囊局部治疗脑胶质瘤的研究进展[J].临床神经外科杂志,2011,8(3):164-166.
[6]张志明,赵荫农,刘剑勇,等.5-氟尿嘧啶缓释剂在肝细胞性肝癌根治性切除术中植入预防复发的研究[J].中国癌症防治杂志,2010,2(3):176-178.
[7]汤阳阳,林新居,彭民浩,等.肝癌切除术中局部植入5-氟尿嘧啶缓释剂的安全性研究[J].中国癌症防治杂志,2011,3(4):309-312.
[8]刘暌,雷霆,牛洪泉,等.阿霉素控释剂对大鼠C6脑胶质瘤治疗的研究[J].中华实验外科杂志,2001,18(1):67-68.
[9]郭伟剑,李杰,白永瑞,等.甘氨双唑钠提高肝动脉阻断结合外放射治疗大鼠肝移植瘤的疗效[J].肿瘤防治杂志,2005,12(9):655-658.
[10]梅国顺,杜建新.脑恶性胶质瘤的局部治疗现状[J].中华神经外科疾病研究杂志,2007,6(4):379-381.
[11]彭向前,张鉴.脂质体作为经皮局部给药载体的研究进展[J].中国药事,2005,19(6):358-360.
[12]周蔚,周彩存,孟淑燕,等.靶向肺癌的紫杉醇长循环脂质体抑瘤作用研究[J].肿瘤,2011,31(3):203-209.
[13]牛洪泉,张涛,舒航,等.局部化疗缓释剂对大鼠C6脑胶质瘤的疗效观察[J].中国临床神经外科杂志,2002,7(1):14-16.
[2015-01-27收稿][2015-02-25修回][编辑阮萃才]
Prelim inary study of in jecting adriam ycin liposom es through a thin tube im p lanted in the brain for treating brain glioma in rats
XU月ing1,WU Linlan2,HUANG Suqin1,YANG Xiaomei3,WU Kaimu2(1Institute of Liver Diseases,Mengchao Hepatobiliary Hospital of Fujian Medical University,Fuzhou 350025,P.R.China;2The Second People′s Hospital of Fujian Province;3Fuzhou Jing-hua Chonghui Hospital,Fuzhou 350001,P.R.China)
XU月ing.E-mail:xubing1228@163.com
ObjectiveTo develop a percutaneousmethod of administering drugs into the brain in order to suppress glioma growth.M ethodSprague-Dawley rats were injected in the brain with 0.9%NaCl solution through a direct adapter implanted under the skin and a thin tube jacketed with an ice sleeve,while rats with brain gliomas
0.9%NaCl solution,aqueous adriamycin or ADR liposomes through a thin tube wrapped in an ice sleeve attached to a device implanted under the skin.The injectionswere repeated 5 and 10 d later.Starting at 4 d after the last injection,tumor volume and serum concen-trations of alanine aminotransferase(ALT),aspartate aminotransferase(AST),and creatinine(Cr)weremeasured in 8 animals from the saline control group,aqueous ADR group and ADR liposome group.The remaining animals in each group were implanted with tubes but not administered drug or saline in order to assess survival following surgery.Results月y 14 d after the last injection,tumor volumewas significantly smaller in the ADR liposome group(27.5±6.4)mm3than in the saline control group(57.5±6.3)mm3(P<0.05).Tumor growth inhibition wassignificantly greater in the ADR liposome group(52.2±14.6)%than in the aqueous ADR group(27.7±9.5)%(P<0.05),and mean survivalwas significantly longer in the ADR liposome group(42.3±8.2)d vs(29.9±4.8)d(P<0.05).Serum concentrations of ALT,AST,Cr were similar between both ADR groups and the saline control group(P>0.05).All rats in the control group survived more than 50 d.ConclusionIt is possible to safely and effectively implant a percutaneous drug delivery system through a puncture in the brain.This system,comprising a thin polyester tube with an ice sleeve and metal core,was able to administer ADR to significantly suppress tumor grouth in ratswithout obvious side effects on liver or kidney function.
月rain neoplasm;Adriamycin;Liposome;Adapter;Percutaneous injection;Therapy
R739.41
A
1674-5671(2015)02-05
10.3969/j.issn.1674-5671.2015.02.05
徐兵。E-mail:xubing1228@163.com

