真空无溶剂体系中酯化和酯交换生物合成甾醇酯
胡立志,陈昊,孙立斌,张萍,齐良俊,孙树坤,解桂东,于殿宇
(1.国家大豆工程技术研究中心,哈尔滨150050;2.东北农业大学食品学院,哈尔滨150030)
真空无溶剂体系中酯化和酯交换生物合成甾醇酯
胡立志1,陈昊1,孙立斌2,张萍1,齐良俊2,孙树坤1,解桂东2,于殿宇2
(1.国家大豆工程技术研究中心,哈尔滨150050;2.东北农业大学食品学院,哈尔滨150030)
使用固定化脂肪酶Lipozyme IM和Novozym 435作为催化剂,以转换率为指标,在真空度30 mbar、80℃、无溶剂和无添加水的反应条件下,探讨反应时间、酶添加量、甾醇添加量对酯交换生物合成甾醇酯的影响,通过响应面分析对固定化脂肪酶Lipozyme IM作为催化剂条件进行优化。最佳反应条件为:反应温度80℃、真空度30 mbar、反应时间48 h、酶添加量1.0%、甾醇添加量6.3%,转换率为97.65%。使用固定化脂肪酶Lipozyme IM作为催化剂条件下,甾醇与油酸甲酯进行酯交换,即使重复使用10次后仍保持90%以上转换率,脂肪酶Novozym 435仍保持40%以上转换率。
脂肪酶;酯化和酯交换;植物甾醇;植物甾醇酯;脂肪酸
植物甾醇是一种甾体化合物,具有重要生理功能,在降低胆固醇、抗癌、抗病毒、免疫调节等方面功效明显。甾醇是甾族化合物中一类,由于其常态为固态,所以又称作固醇,主要以游离、高级脂肪酸酯、苷三种形式存在于动物、植物和微生物体内,至今已发现100多种植物甾醇,含量较丰富的主要有β-谷甾醇、豆甾醇、菜油甾醇和菜籽甾醇[1-2]。植物甾醇可有效降低血液中胆固醇含量,降低心脑血管疾病发生。植物甾醇具有抗癌、抗动脉粥样硬化、抗氧化和抗炎等功效,被广泛应用于制药、保健品、化妆品、动植物生长激素及化工、纺织等各领域[3-4]。虽然植物甾醇具有降低血清胆甾醇水平功效,但游离植物甾醇在水和油脂中的低溶解性限制其在食品中实际应用[5-6]。植物甾醇酯在植物油脂中含量非常少,但具有更优脂亲和性和更佳的降胆固醇效果,这不仅方便甾醇在含脂食品中传递,生物利用率高,溶解度好,还可改善产品外观及口感[7-8]。临床试验表明,成人每天摄入1.3 g以上植物甾醇酯即可达到显著降低胆固醇目的[9-10]。
甾醇酯通过相应甾醇与脂肪酸酯化、脂肪酸甲酯或三酰甘油酯交换、脂肪酸卤化物或脂肪酸酐反应制取[10-12]。Katsunori等、裘爱泳等分别采用脂肪酶催化甾醇与不饱和脂肪酸在含水溶剂体系中反应生产甾醇酯[13-14],关于植物油脂与植物甾醇在真空和无溶剂体系中反应合成植物甾醇酯的研究较少。
本试验在真空、无溶剂、无添加水反应条件下,使用固定化脂肪酶Lipozyme IM和Novozym 435作为催化剂,生物合成植物甾醇酯,对油酸、油酸甲酯和三油酸甘油酯与植物甾醇发生酯化和酯交换反应合成植物甾醇酯的方法进行研究,在真空和不同脂肪酶条件下,比较反应温度、反应时间、脂肪酶添加量、甾醇添加量、脂肪酶使用次数等试验条件下对酯化和酯交换反应的影响,为实际生产奠定基础。
1 材料与方法
1.1 材料和试剂
甾醇、油酸、油酸甲酯和三油酸甘油酯及固定化脂肪酶Lipozyme IM均购自Sigma公司;固定化脂肪酶Novozym 435购自诺维信公司,其他试剂药品均为分析纯。
1.2 方法
精确称量一定量的植物甾醇、油酸或油酸甲酯或三油酸甘油酯及脂肪酶Novozym 435或Lipozyme IM,通过磁力搅拌在有螺旋盖真空管中进行40、60和80℃及不同反应条件试验,真空度30 mbar,反应完成后,3 000~4 000 r·min-1条件下离心20 min,取上层反应物。
1.3 转换率测定
反应过程中每隔2 h收集样品,注入气相色谱并使用下列公式计算转换率(%)。

谷甾醇和谷甾醇酯使用标准试剂确定,峰面积与浓度成比例。
2 结果与分析
2.1 反应温度对转换率的影响
结果见图1,2。
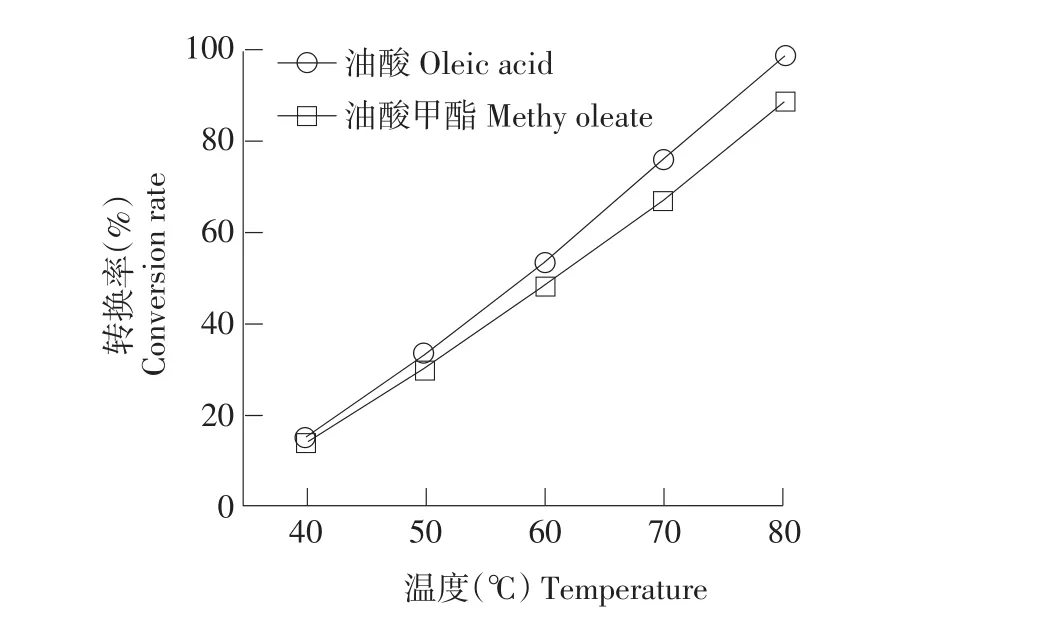
图1 温度对油酸和油酸甲酯与甾醇酯化和酯交换转换率的影响(使用酶Novozym 435)Fig.1Effect of temperature on the conversion rate of phytosterol with oleic acid and transesterification with methyl oleate using Novozym 435
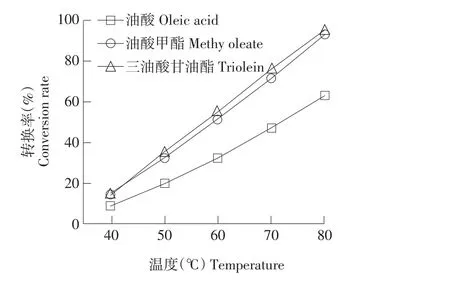
图2 温度对油酸、油酸甲酯及三油酸甘油酯与甾醇酯化和酯交换转换率的影响(使用酶Lipozyme IM)Fig.2Effect of temperature on the conversion rate of phytosterol with oleic acid and transesterification with methyl oleate or triolein using Lipozyme IM
反应温度是影响转换率的主要因素。在真空和不同温度条件下,采用固定化脂肪酶Novozym 435和Lipozyme IM催化,研究甾醇与不同酰基供体在酯化反应和酯交换反应中的转换率。由图1可知,使用酶Novozym 435催化条件下,反应温度对油酸和油酸甲酯与甾醇酯化和酯交换转换率影响结果显示,反应温度对转换率影响显著,40和60℃条件下转换率明显升高,80℃反应条件下,油酸与甾醇酯化转换率达到88.7%,油酸甲酯与甾醇酯交换转换率达到99.2%,转换率增加随温度升高而增加,使用酶Lipozym IM催化条件下,反应温度对油酸、油酸甲酯和三油酸甘油酯的酯化和酯交换转换率影响结果一致(见图2)。
2.2 反应时间对转换率的影响
结果见图3。

图3 时间对油酸、油酸甲酯及三油酸甘油酯与甾醇酯化和酯交换的转换率影响(使用酶Lipozyme IM)Fig.3Effect of time on the conversion rate of phytosterol with oleic acid and transesterification with methyl oleate or triolein using Lipozyme IM
反应时间是影响转换率的主要因素。反应时间过短,酯化和酯交换反应不完全;反应时间过长,影响品质,造成资源浪费。由图3可知,在使用酶Lipozym IM催化条件下,反应时间对油酸和油酸甲酯及三油酸甘油酯与甾醇酯化和酯交换转换率影响显著,随时间增加,转换率快速上升,反应时间24 h,达到较高转换率,其中油酸与谷甾醇酯化率达到63.5%,油酸甲酯与甾醇酯酯交换率达到97.3%,三油酸甘油酯与甾醇酯酯交换率达到90.1%。反应时间48 h后,转换率分别缓慢增加到各自最高值。
2.3 酶添加量对转换率的影响
结果见图4。
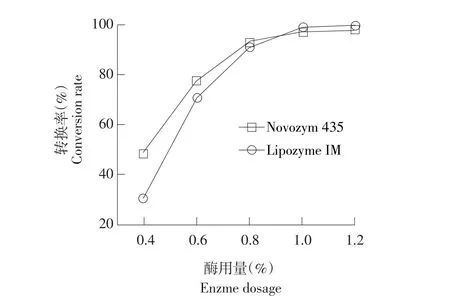
图4 酶催化剂量对转换率的影响Fig.4Effect of enzyme dosage on conversion rate
由图4可知,在真空度30 mbar和温度80℃,使用固定化脂肪酶Novozym 435和Lipozyme IM为催化剂,采用油酸甲酯作为酰基供体的条件下,不同酶添加量(0.4%、0.6%、0.8%、1.0%和1.2%)对油酸甲酯与甾醇酯交换转换率影响结果显示,在酶添加量1.0%条件下,两种酶催化效果相近,最高酯交换率均达到约98%,试验结果显示,酶用量0.4%~1.0%时,转换率随脂肪酶添加量增加而增加。
2.4 甾醇添加量对转换率的影响
结果见图5。

图5 甾醇添加量对转换率的影响Fig.5Effect of phytosterol dosage on conversion rate using Lipozyme IM
由图5可知,在真空度30 mbar和温度80℃,使用固定化脂肪酶Lipozyme IM作为催化剂条件下,甾醇添加量对酯交换转换率影响结果表明,甾醇添加量2.0%~7.0%时,对酯交换转换率有显著影响,即酯交换转换率随甾醇添加量增加而显著增加,6.0%添加量达到较高转换率。
2.5 二次回归方程建立与分析
在单因素试验基础上采用中心组合设计(Box-Benhnken),以反应时间(A)、加酶量(B)和甾醇添加量(C)为自变量,以转换率(R1)为响应值设计3因素3水平响应面试验。自变量水平编码见表1,试验设计方案及结果见表2。
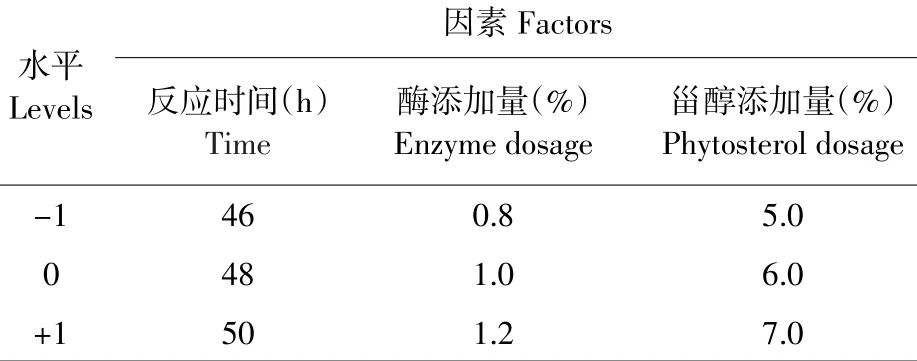
表1 因素水平编码Table 1Code of factors and levels

表2 响应面设计方案及试验结果Table 2Design proposal and experiment result of response surface
利用Design Expert 7.0.0软件对试验结果进行方差分析,结果见表3。
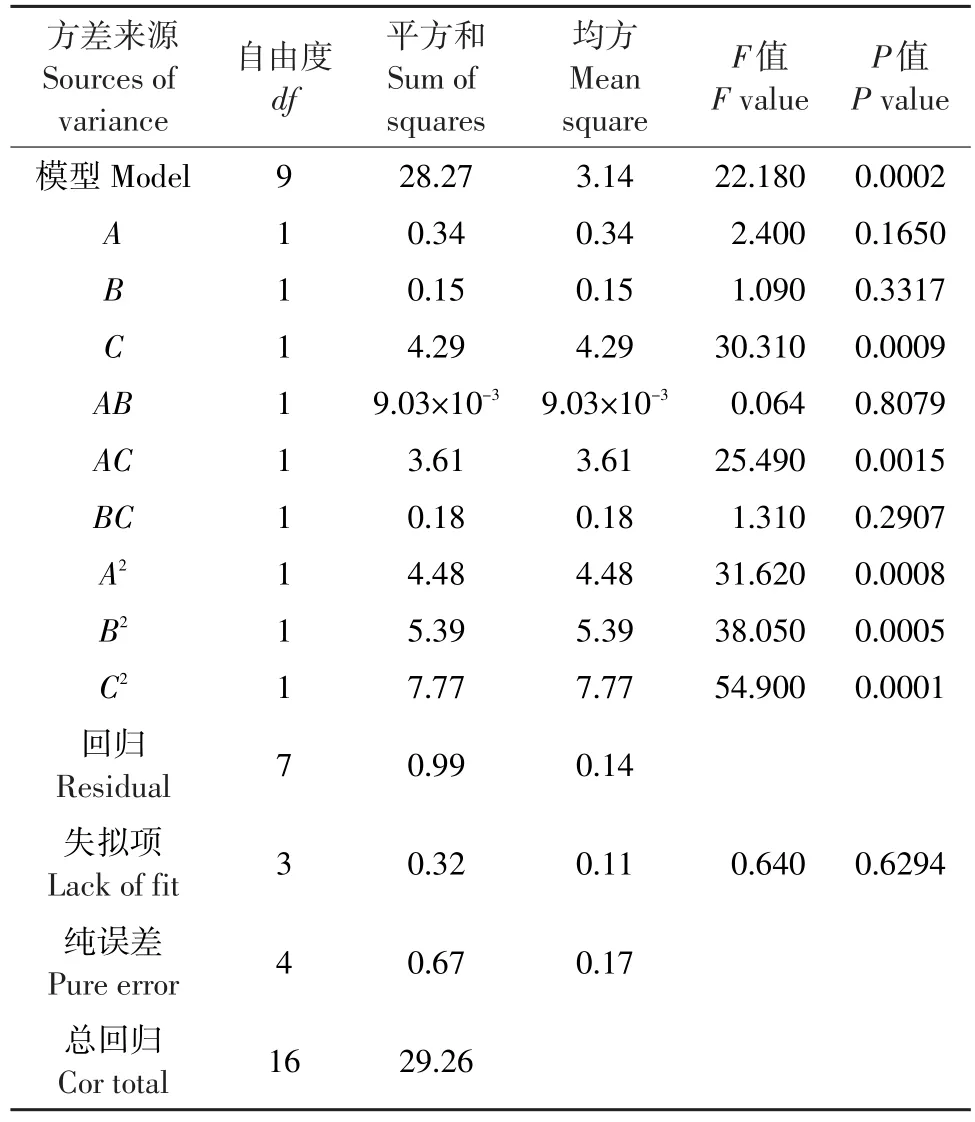
表3 方差分析结果Table 3Test results of variance analysis
通过对试验数据进行多元回归拟合,得到转换率(R1)对自变量反应时间(A)、酶添加量(B)和甾醇添加量(C)的回归方程为:
R1=97.67-0.21A-0.14B+0.73C-0.048AB+0.95 AC-0.22BC-1.03A2-1.13B2-1.36C2
由表3可知,方程因变量与自变量之间线性关系明显,该模型回归显著(P<0.0001)失拟项不显著(P>0.05),该模型R2=96.61%,R2Adj=92.26%,说明该模型与试验拟合良好。图6~8分别是反应时间(h)、酶添加量(%)和甾醇添加量(%)交互作用对转换率的响应曲面图。
由图6可知,随反应时间及酶添加量增加,转换率均呈现先升高后缓慢下降。由此可见,转换率极值出现在试验范围内,在反应时间约为48 h,酶添加量1.0%~1.2%时,转换率在97%以上。
由图7可知,随反应时间与甾醇添加量增加,转换率均呈现先升高后缓慢下降趋势。由此可见,转换率极值出现在试验范围内,在反应时间约为48 h,酶添加量0.55%~0.65%时,转换率在97%以上。
由图8所示,随酶添加量与甾醇添加量增加,转换率均呈现先升高后缓慢下降趋势。由此可见,转换率极值出现在试验范围内,在酶添加量1.0%,甾醇添加量0.55%~0.65%时,转换率在97%以上。
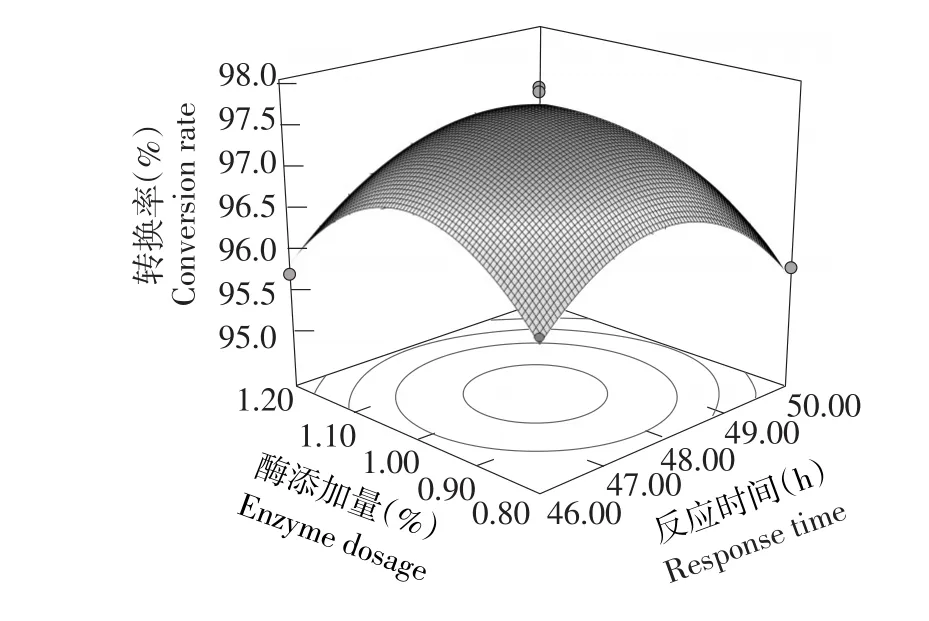
图6 反应时间与酶添加量影响转换率的响应面Fig.6Response surface and contour of effect of A and B on conversion rate
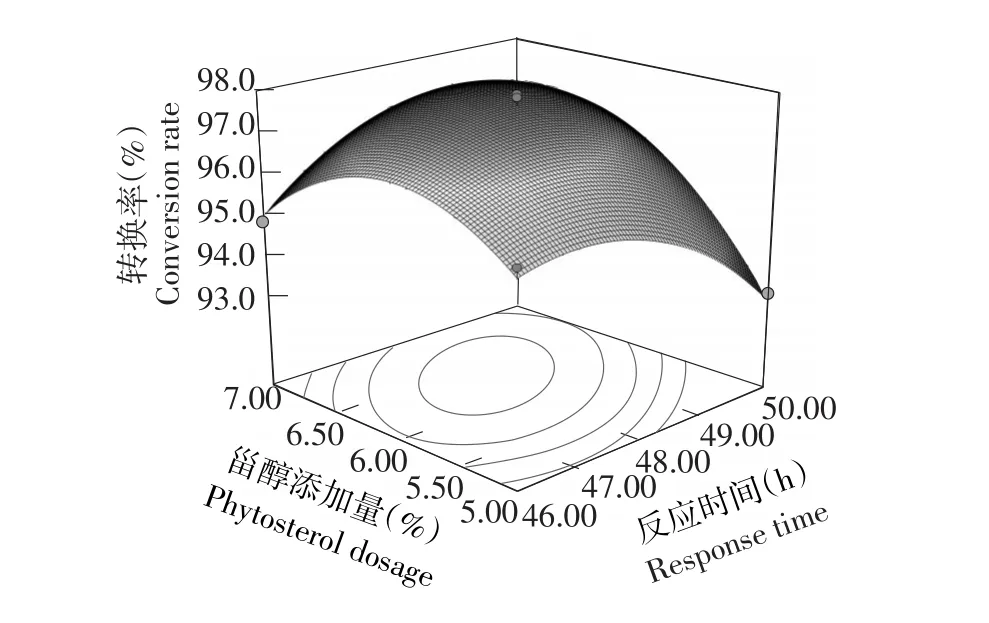
图7 反应时间与甾醇添加量交互影响转换率的响应面Fig.7Response surface and contour of effect of A and C on conversion rate
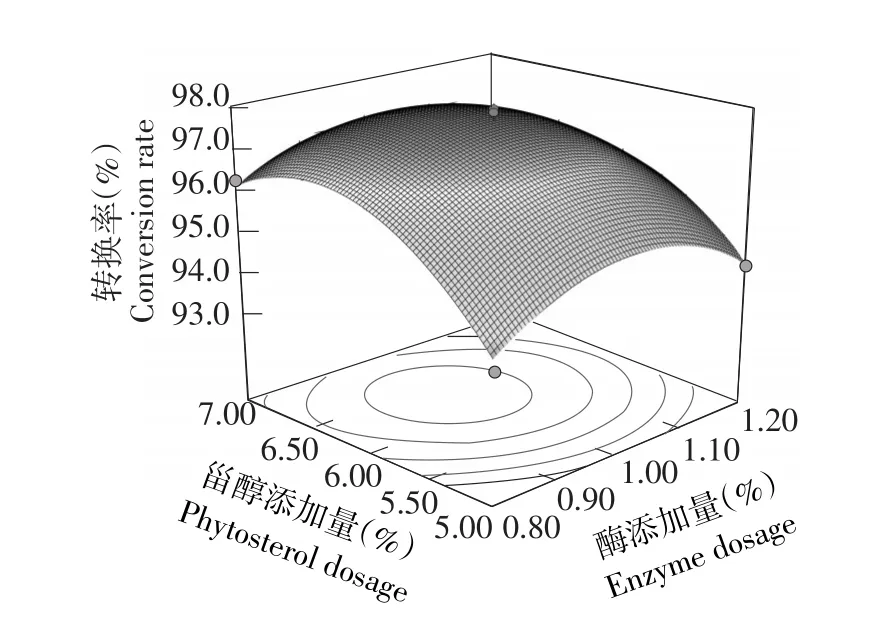
图8 酶添加量与甾醇添加量交互影响转换率的响应面Fig.8Response surface and contour of effect of B and C on conversion rate
应用响应面优化分析方法对回归模型进行分析,寻找最优响应结果见表4。
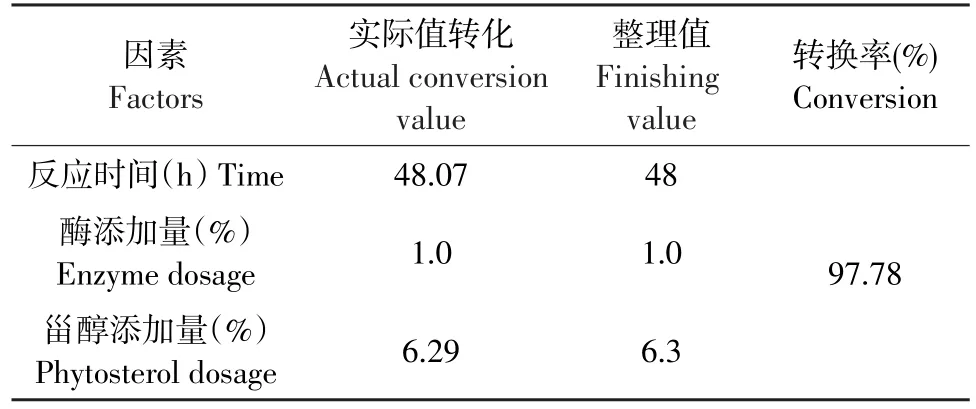
表4 响应面寻优结果Table 4Results of response surface optimization
为检验响应面方法所得结果可靠性,按照上述整理值进行试验,转换率为97.65%。预测值与试验值之间拟合良好,证实模型有效。
2.6 酶重复使用次数对转换率的影响
结果见图9。

图9 脂肪酶Novozym 435和Lipozyme IM重复使用的稳定性Fig.9Stability of repeated using time of lipase Novozym435 and Lipozyme IM
由图9可知,在真空度30 mbar和80℃,使用固定化脂肪酶Novozym 435和Lipozyme IM为催化剂条件下,研究脂肪酶重复使用对酯交换反应程度的影响。在重复使用过程中Novozyme 435重复使用10次仍保留40%活性。Lipozyme IM酶经过10次酯交换反应,仍保留大部分活性。
3 讨论
目前国内学者关于植物甾醇酯合成方法和工艺研究主要集中在有机介质或者以水为溶剂时植物甾醇酯合成工艺方法和条件。张敏等选择脂肪酶Lipozyme 435为催化剂,叔丁醇(分子筛脱水)为溶剂,以酯化率为目标,确定合成二酯最佳反应条件为:脂肪酶Lipozyme 435用量100 g·L-1,单酯浓度50 mmol·L-1,单酯与赤藓糖醇物质的量比1.0∶3.5,反应温度55℃,反应时间120 h,该条件下酯化率可达81.6%[12]。也有以超临界流体萃取作为酶催化反应介质,为能够得到食品级植物甾醇酯产品,通常采取无溶剂酯交换法合成。因此,植物油脂与植物甾醇在真空和无溶剂体系中反应合成植物甾醇酯的研究具有重要意义。
化学法制备植物甾醇酯具有易实现工业化生产和工艺条件简单的优势,但反应温度相对较高,易产生产品褐变、副反应等,导致植物甾醇品质下降等。采用酶法合成方法具有催化反应过程温和环境友好,可节省能耗,还可避免副反应发生以及无毒安全特点[15]。马媛等利用甾烷醇与亚油酸,无溶剂条件下采用直接酯化法合成亚油酸甾烷醇酯,优化得出最佳合成工艺:反应时间5 h,反应温度150℃,亚油酸与甾烷醇物质的量比3∶1,催化剂用量3%,此条件下,亚油酸甾烷醇酯酯化率可达到81.23%[16]。酶法合成植物甾醇酯,催化反应过程温和,环境友好,但植物甾醇酯酶法合成成本较高,难于实现工业化,如何降低生产成本并保持高效生产尚待于深入研究。
4 结论
本研究在真空、无溶剂、无添加水反应条件下,使用固定化脂肪酶Lipozyme IM和Novozym 435作为催化剂,生物合成植物甾醇酯,对油酸、油酸甲酯和三油酸甘油酯与植物甾醇发生酯化和酯交换反应合成植物甾醇酯的方法进行探索。本研究结果表明,一定范围内,酯化和酯交换反应程度强烈随参数增加而增加。在最佳反应条件下,即反应温度80℃、真空度30 mbar、反应时间48 h、酶添加量1.0%、甾醇添加量6.3%,转换率为97.65%。植物甾醇与油酸酯化或与油酸甲酯或三油酸甘油酯酯交换反应几乎全部转换为相应长链酰基酯,脂肪酶经过10次酯交换反应重复使用,仍保留较高活性。
[1]Fernades P,Cabral J M.Phytosterols:Applications and recovery methods[J].Bioresource Technology,2007,98:2335-2350.
[2]贾蔓箐,唐辉,李翠华,等.棉油皂脚中植物甾醇的提取工艺研究[J].食品研究与开发,2015,36(6):45-48.
[3]Okoli C O,Akah P A.Mechanisms of the anti-inflammatory activity of the leaf extracts of Culcasia scandens P.Beauv(Araceae)[J]. Pharmacol Biochem Behavior,2004,79(3):473-481.
[4]Choi Y H,Kong R,Kim Y A,et al.Induction of Bax and activation of caspases during beta-sitosterol-mediated apoptosis in human colon cancer cells[J].Int J Oncol,2003,23:1657-1662.
[5]吕双双,李书国.植物甾醇性质、功能、安全性及其食品的研究进展[J].粮食加工,2014,39(4):40-47.
[6]Belisl F.Functional food science[J].The Internal Life Sci Institute,2002,23(3):113-116.
[7]许青青,金文彬,苏宝根,等.植物甾醇酯的化学合成及其分离研究进展[J].中国粮油学报,2014,29(3):120-128.
[8]潘丽军,廖珺,姜绍通,等.微波辅助植物甾醇油酸酯的酶促催化合成[J].中国粮油学报,2014,29(8):120-128.
[9]Lees A M,Mok Y,Lees R S,et al.Plant sterols as cholesterollowering agents[J].Atherosclerosis,1977,28(2):325-328.
[10]Rtey C K,Higgins J D,John D,et al.Stable salad dressings:US, 6123978[P].2000-09-06.
[11]Shimada Y,Hirota Y,Baba T,et al.Enzymatic synthesis of steryl esters of polyunsaturated fatty acids[J].J Am Oil Chem Soc,1999, 76:713-716.
[12]张敏,贾承胜,张晓鸣,等.脂肪酶催化合成亲水性植物甾醇酯[J].中国油脂,2015,40(2):77-80.
[13]Katsunori M,Youichi M,Shiro O.Process for preparing fatty acid ester:Europe,0195311A[P].1994-04-13.
[14]裘爱泳,刘军海.酶催化合成植物甾醇酯和植物甾烷醇酯[J].中国油脂,2003,28(6):25-27.
[15]王腾宇,王铭义,宋玉卿,等.响应面法优化生物酶法合成植物甾醇酯[J].食品科学,2011,32(4):59-63.
[16]马媛,贾承胜,张晓鸣,等.无溶剂直接酯化法合成亚油酸植物甾烷醇酯的研究[J].食品工业科技,2012(6):285-289.
Synthesis of phytosteryl esters by esterification and transesterification in vacuo and without solvent using lipases/
HU Lizhi1,CHEN Hao1,SUN Libin2, ZHANG Ping1,QI Liangjun2,SUN Shukun1,XIE Guidong2,YU Dianyu2
(1.The National Research Centre of Soybean Engineering and Technology,Harbin 150050,China;2.School of Food Science, NortheastAgricultural University,Harbin 150030,China))
Phytosteryls has been converted in high extent to the corresponding long-chain acyl esters via esterification with oleic acid or transesterification with methyl oleate or trioleoylglycerol using immobilized lipases Lipozyme IM and Novozym 435 as biocatalysts in vacuo 30 mbar and without adding water or solvent,at 80℃.This paper had investigated the effect of temperature,time and phytosterol dosage on conversion.By the response surface analysis,the optimum operating parameters of synthesis of phytosteryl esters by esterification and transesterification were as follows:reaction temperature of 80℃,vacuum of 30 mbar,reaction time of 48 h,enzyme dosage of 1.0%,phytosteryl dosage of 6.3%,the conversion rate was 97.65%.Transesterification of phytosteryls and fatty acid methyl ester using immobilized lipases Lipozyme IM as biocatalysts,lipases Lipozyme IM remained the conversion rate of more than 90%even after 10 times of repeated use.Lipase Novozym 435 remained the conversion rate of more than 40%.
lipases;esterification and transesterification;phytosteryls;phytosteryl esters;fatty acids
TQ645.9+8
A
1005-9369(2015)09-0038-06
时间2015-9-23 9:38:06[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150923.0938.002.html
胡立志,陈昊,孙立斌,等.真空无溶剂体系中酯化和酯交换生物合成甾醇酯[J].东北农业大学学报,2015,46(9):38-43.
Hu Lizhi,Chen Hao,Sun Libin,et al.Synthesis of phytosteryl esters by esterification and transesterification in vacuo and without solvent using lipases[J].Journal of Northeast Agricultural University,2015,46(9):38-43.(in Chinese with English abstract)
2015-04-08
黑龙江省级基本科研业务费课题项目(DADOU2014-2)
胡立志(1956-),男,教授,博士,研究方向为油脂加工和利用。E-mail:hlz035d832n@yeah.net

