香蕉肉桂醇脱氢酶基因的克隆及表达分析
王 卓,徐碧玉,贾彩红,李健平,刘菊华,张建斌,苗红霞,金志强,2*
(1 中国热带农业科学院热带生物技术研究所/农业部热带生物技术重点开放实验室,海口571101;2 中国热带农业科学院海口实验站/海南省香蕉遗传改良重点实验室,海口570102)
木质素是由苯丙烷类单体聚合而成的酚类多聚体,赋予植物机械强度和疏水性,在植物对环境适应中起着重要作用。研究发现在苔类地钱和红藻等非维管植物中也存在木质素[1]。在植物中木质素以三维立体聚合物嵌入植物细胞壁,其木质素单体主要分为3类:愈创木基木质素(guaiacyl lignin,G-木质素)、对-羟基苯基木质素(hydroxy-phenyl lignin,H-木质素)和紫丁香基木质素(syringyl Lignin,S-木质素)。这些单体在不同科的植物中其数量和比例不同[2-3]。肉桂 醇 脱 氢 酶(cinnamyl alcohol dehydrogenase,CAD)属于依赖于NADPH 的酶类,在木质素合成中有着重要作用,是木质素单体合成途径中的还原酶之一。CAD 主要在木质素单体合成过程中最后一步起作用,其催化对-香豆酸、松柏醛及芥子酸还原成相应的醇。CAD 在木质素种类和功能多样性中起重要作用[1]。迄今,已从多种植物如烟草[4-5]、桉 树[6-7]、草 莓[8]、拟 南 芥[9]、苜 蓿[10]、小麦[11]、小 立碗藓[12]、蒿[13]和 茶[14]等中克 隆了CAD基因。在已完成全基因组测序的香蕉A 基因组中预测出7个CAD 基因[15]。但尚未见香蕉CAD 基因克隆及表达分析的相关报道。
香蕉是热带、亚热带发展中国家重要的农作物之一。其果实由于富含蛋白质和碳水化合物,是一些热带地区人民的主要粮食和国民收入的主要来源[16]。然而香蕉枯萎病严重威胁香蕉的正常生产[17]。木质素在植物抗病中起着重要作用,木质素快速沉积或木质素类物质的生成能限制病原菌的生长和侵染,进而起到抗病作用[18-20]。同样作为木质素合成的末端酶,CAD 基因的表达往往也伴随着病原菌的侵染而增加[21-22],CAD 基因的表达与植物抗病性密切相关。因此,了解香蕉CAD 将有助于阐明木质素合成的调控机理,为全面揭示香蕉木质素代谢与香蕉枯萎病的密切关系奠定理论基础。本研究首次从香蕉中分离并克隆一个MaCAD 基因,利用生物信息学网站分析该基因的结构特性,采用荧光定量技术分析该基因的表达模式,探讨MaCAD在枯萎病菌胁迫下香蕉根系中的表达调控,有助于进一步了解香蕉抗枯萎病的调控机理。
1 材料和方法
1.1 材料及处理
供试香蕉品种为‘巴西蕉’(cv.Cavendish)和‘农科1号’(cv.Nongke No.1)购自中国热带农业科学院组培中心,苗龄为移栽大棚后约60d的健康杯苗,其中‘巴西蕉’为枯萎病菌感病品种,‘农科1号’为耐病品种。香蕉枯萎病菌4号生理小种[Fusarium oxysporumf specialis(f.Sp)cubense Tropical Race 4,Foc TR4],为中国热带农业科学院环境与植物保护研究所张欣博士馈赠。
1.2 方 法
1.2.1 病原菌的培养收集及接种香蕉 将香蕉枯萎病生理4号小种孢子悬浮液接种于马铃薯葡萄糖琼脂培养基(PDA)上,28 ℃培养7d,用无菌水将孢子洗下来,用2层Mirocloth膜过滤,滤液4 000r/min离心15min,弃上清,沉淀用50mL无菌水重悬,再4 000r/min离心15min,重复2次,收集Foc TR4孢子。
将‘巴西蕉’(cv.Cavendish AAA)和‘农科1号’(cv.Nongke No.1)分为2组,每组60棵幼苗。以蘸根接菌法接种Foc TR4,接种浓度为每毫升1×106个孢子。接种后2、4和6d取样,以未接种的为对照(0d)。液氮中速冻后,置于-80 ℃冰箱备用,重复3次。
1.2.2 文库的筛选 取2μL含文库质粒的大肠杆菌DH10B 菌液涂于氯霉素平板上,随机挑取克隆进 行菌 落PCR 鉴 定,挑 取 大 于800bp 的 克 隆[23]。使用96孔板进行碱裂解法提取质粒DNA,测序委托北京华大基因技术公司完成。测出的DNA 序列经过切除载体和接头序列后在NCBI核酸数据库BLASTn和蛋白数据库BLASTx中进行同源核苷酸和蛋白序列检索。应用DNAMAN、ProtParam和MEGA4等生物软件分析获得cDNA 序列及其编码蛋白质的结构特点,并与NCBI数据库(http://www.ncbi.nlm.nih.gov/blast)和香蕉A 基因 组 数 据 库(http://banana-genome.cirad.fr/tools.html)中已知核酸和蛋白序列进行比较分析。
1.2.3 MaCAD1在香蕉不同器官的表达分析 选取生长8个月的香蕉根、球茎、假茎、叶、花和果实按照Wan等[24]的方法提取RNA。每个样品取4μg总RNA,用Invitrogen SuperScriptTMⅢReverse Transcriptase合成cDNA 第一链。以香蕉根、球茎、假茎、叶、花和果实的cDNA 为模板,以MaActin片段为内参,采用RT-PCR 方法对其进行组织特异性表达分析。将MaCAD1在香蕉A 基因组数据库(http://banana-genome.cirad.fr/tools.html)中进行比对,在序列5′端非保守区域设计MaCAD1基 因 表 达 引 物P1(5′-GAGAAGGGAGAACGGAGTC-3′)和P2(5′-TCCCACCTTGAAGTTGCT-3′)。MaActin1 引 物 为NP1(5′-CGAGGCTCAATCAAA-GA-3′)和NP2(5′-ACCAGCAAGGTCCAAAC-3′)。
1.2.4 香蕉接种Foc TR4后MaCAD1的表达 以接种后不同时间点的香蕉根系cDNA 第一链为模板,引物同1.2.3,以MaActin 片段为内标,采用实时荧光定量PCR 检测MaCAD1 的表达。PCR 反应程序为:95 ℃预变性3min;95 ℃变性7s,60 ℃退火15s,72 ℃延伸20s,循环40 次。实时定量PCR 采用TaRaKa 公司的试剂盒,染料为SYBR Green,在吉泰生物科技公司Mx 3005P 荧光定量PCR 仪上进行。
1.3 数据统计分析
每个实验组均做3次生物重复,利用SAS软件(SAS 9.0for Windows)进行显著性分析。结果用KyPlot软件进行绘图。
2 结果与分析
2.1 MaCAD1克隆与序列分析
通过对香蕉根系cDNA 文库克隆的随机测序,获得一个可能是香蕉肉桂醇脱氢酶基因的cDNA片段,将克隆测通后获得完整的ORF(图1)。测序后经BLAST 比对发现,该序列与其他植物CAD 基因序列具有较高一致性,表明该序列是香蕉CAD基因编码框全长cDNA,命名为MaCAD1,GenBank登录号为KF582533。MaCAD1序列全长为1 427 bp,其中5′非翻译区168bp,3′非翻译区182bp,含有一个1 077bp 的ORF,编码358 个氨基酸残基(图2)。MaCAD1推导的氨基酸可编码预期分子量为39.24kD,等电点为6.55。在GenBank 中对MaCAD1蛋白质进行保守结构域搜索和同源性分析,结果表明MaCAD1蛋白属于CAD1家族成员。MaCAD1蛋白在N 端具有醇脱氧酶的典型保守结构域:包括2个Zn2+结合位点和1个NAD(P)辅酶结合位点(图3)。为了研究MaCAD1 与其它各物种 间 的 进 化 关 系,利 用 软 件 MEGA 4.0 将MaCAD1基因的氨基酸序列和拟南芥、水稻的CAD 氨基酸序列利用软件MEGA 4.0中的N-J的方法构建系统进化树。由图4结果可知,所有CAD基因大致可以分为3 个类型。MaCAD1 分属于ClassⅢ类,它与OsCAD6同源关系最近(图4)。
2.2 香蕉MaCAD1组织特异性表达分析
采用半定量RT-PCR方法,以MaActin作为内参,分别检测香蕉不同部位MaCAD1mRNA 转录水平的变化。结果表明,MaCAD1在假茎中表达量最高,是根中的6.2倍。在叶和果实中表达量较高,其表达量分别是根系中相对表达量的3.2和2.6倍(图5)。

图1 MaCAD1的全长cDNA PCR 产物凝胶电泳检测结果A.文库质粒克隆检测;B.MaCAD1ORF扩增;M.DL2000Fig.1 Identification of the PCR products of full-length cDNA sequence of MaCAD1 A.Plasmid cloning PCR product;B.MaCAD1 ORF PCR product;M.DL2000

图2 MaCAD1编码的核酸和氨基酸序列带下划线的碱基序列表示起始密码子;*表示终止密码子Fig.2 Nucleotide and deduce amino acid sequence of MaCAD1 The nucleotide sequence with underlined means initiator codon;* means terminator codon
2.3 不同抗性香蕉品种接种FocTR4后MaCAD1的表达
香蕉枯萎病是一种典型的土传病害,病菌从香蕉根系入侵,形成整株危害,在香蕉整个生长周期均可发病。接种3周后,感病品种‘巴西蕉’叶片明显发黄、下垂,叶片周围干枯,植株生长明显减缓;耐病品种‘农科1号’则没有明显的发病症状(图6)。
在感病品种‘巴西蕉’中,MaCAD1的相对表达量在接种FocTR4后逐渐下降,且差异达到极显著(P<0.01);在接种6d时MaCAD1的相对表达量达到最低,相对表达量值为0.29,仅为对照的三分之一(图7)。在耐病品种‘农科1 号’中MaCAD1的相对表达量在接种FocTR4 后显著增加(P<0.01),在接种6d时MaCAD1的相对表达量达到最大,是对照的4.1倍(图7)。因此,从相对表达量的变化上看MaCAD1在感病品种‘巴西蕉’中的表达被抑制,而在耐病品种‘农科1号’中的表达被激活,表明该基因可能与香蕉的抗病反应密切相关。
3 讨 论

图3 MaCAD1和其他植物CAD 的序列比对分析图中从上至下依次代表的是枣椰、油棕、中国莲、木本棉、梅、甜菜、茶、烟草、苹果中相应的CAD氨基酸序列;划实线部分为Zn2+结合位点,虚线部分为NADPH 结合位点Fig.3 Alignment of amino acid sequences of MaCAD1and other plant CADs The amino acid sequences in the maps which from the top to the bottom represent are:Phoenix dactylifera,Elaeis guineensis,Nelumbo nucifera,Gossypium arboreum,Prunus mume,Beta vulgaris subsp.vulgaris,Camellia sinensis,Nicotiana tomentosiformis,Malus domestica.Zn2+binding motifs are underlined,and NADPH binding motif is dash underlined

图4 MaCAD1蛋白与拟南芥和水稻CAD 蛋白的进化树图中分支点的数字表示Bootstrap验证中基于1 000次重复该节点可信度的百分比;括号内为氨基酸登录号Fig.4 Phylogenetic relationship between the banana of CAD1and CAD proteins fromArabidopsis thaliana and Oryza sativa The number on the branches indicate the reliability percent of Bootstrap values based on 1 000replications;The accession No.was given in brackets
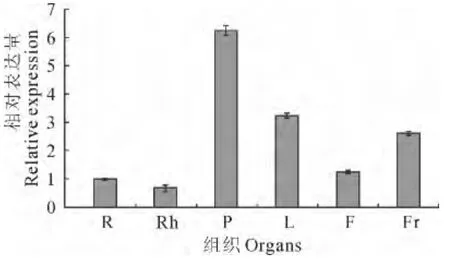
图5 QRT-PCR检测MaCAD1在香蕉不同部位中的表达情况R.根;Rh.球茎;P.假茎;L.叶;F.花;Fr.果实Fig.5 Quantitative RT-PCR analysis of the expression MaCAD1in banana tissues R.Root;Rh.Rhizome;P.Psedostem;L.Leaf;F.Flower;Fr.Fruit

图6 耐病品种‘农科1号’(A)与感病品种‘巴西蕉’(B)接种Foc TR4后的症状Fig.6 Symptoms of resistant(A)and susceptible(B)varieties after inoculation Foc TR4
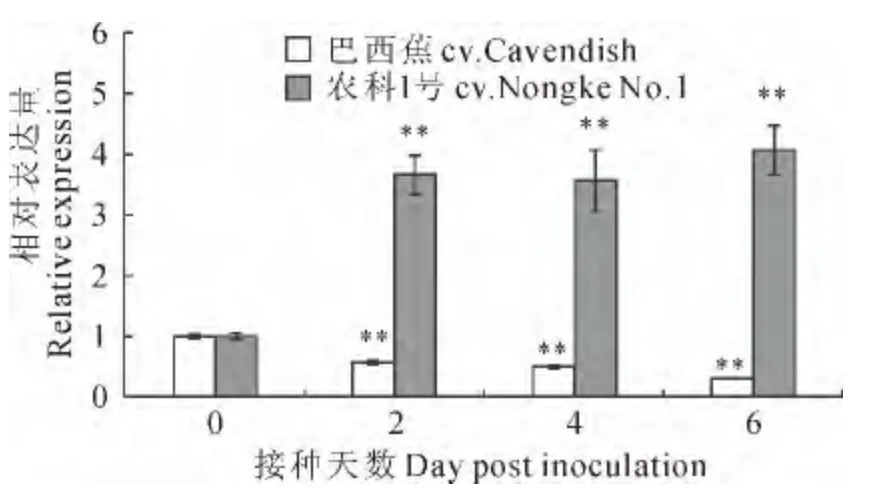
图7 不同抗性香蕉品种接种FocTR4后MaCAD1的表达**代表接种前后差异达到0.01水平Fig.7 The expression of MaCAD1in banana varieties with different resistance after inoculation with FocTR4**refers to significant difference after inoculation at 0.01level
木质素经苯丙烷生物合成途径合成,是植物中主要的代谢产物之一,其含量仅次于纤维素的大分子有机物质,在为植物提供机械力、运输水分和抵抗外界逆境等方面起着重要作用[25-26]。CAD为催化木质素单体生物合成的最后一个酶,在木质素种类和功能多样性中起着重要作用[1]。本研究获得1个全长香蕉CAD1基因。在序列分析方面,该基因与其它植物的CAD 基因具有较高一致性。MaCAD1编码氨基酸的分子量为39.24kD,等电点为6.55,这与已报道的其它植物CAD 蛋白特征相似[3,21]。MaCAD1推导氨基酸序列中包含完整的醇脱氧酶的典型保守结构域,包括2 个Zn2+结合位点和1 个NAD(P)辅酶结合位点,因此MaCAD1为含Zn2+醇脱氢 酶[8-9];同 时,NAD(P)辅 酶 结 合 位 点 也 表 明MaCAD1属于 典 型 的 植 物CAD 酶 类[4,7-8]。聚 类 分析结果表明MaCAD1与水稻OsCAD6亲缘关系较近,同属于ClassⅢ。在其它植物中,Ⅲ类CAD 编码的酶不仅能与松柏醛、香豆醛、芥子醛等催化底物特异结合,同样还能与脂肪醛、肉桂酰等物质结合生成不同类型的木质素[6]。这些结果均表明MaCAD1基因编码的确实为香蕉Ⅲ类CAD 蛋白,可能在香蕉木质素合成中起作用。
在其他植物中,CAD 基因在根、茎、叶和花等组织中均有表达[27]。本研究在根、球茎、假茎、叶、花和果实中均检测到MaCAD1 表达,表明MaCAD1 在香蕉组织中属于组成型表达,根据这一结果推出该基因可能在香蕉的生长和发育过程中起着重要作用。在植物与病原菌互作时,木质素的含量、类型和积累速度在不同植物与病原菌互作时存在差异[28]。栓皮 栎(Quercus variabilis Bl.)的QsCAD1 在 抗Phytophthora cinnamomi的过程中能失活该菌产生的毒素[22]。在香蕉与枯萎病菌互作时,抗病品种比感病品种能积累更多的木质素,CAD 活性和木质素的生物合及香蕉抗枯萎病能力成密切相关[29]。MaCAD1在感病品种‘巴西蕉’(cv.Cavendish)中的基因表达被抑制,而在耐病品种‘农科1 号’(cv.Nongke No.1)中被激活,MaCAD1基因表达与香蕉抗病性正相关,说明该基因可能参与香蕉响应Foc TR4侵染的过程。目前,香蕉抗病种质的创制是解决香蕉枯萎病的有效方法之一,然而缺乏有效的抗病种质的鉴定及筛选方法。利用标记基因在苗期筛选抗病苗能节约育种时间及效率。MaCAD1 在耐病品种中表达趋势与感病品种相反且相对表达量的倍数高于感病品种,因此该基因可以当作一个新的抗枯萎病菌侵染的标记基因。
本试验克隆了MaCAD1基因,并对其序列进行生物信息学分析,对其组织和接种Foc TR4的响应研究说明该基因参与了香蕉的生长发育及抗病反应。今后将继续对该基因在香蕉抗枯萎中的作用机制进行进一步的研究,以期能揭示CAD 在香蕉抗枯萎病中的生理作用。
[1] ESPINEIRA J M,NOVOUZAL E,GOMEZ ROS L V,et al.Distribution of lignin monomers and the evolution of lignification among lower plants[J].Plant Biology,2011,13(1):59-68.
[2] VANHOLME R,MORREEL K,RALPH J,et al.Lignin engineering[J].Current Opinion in Plant Biology,2008,11(3):278-285.
[3] GUO D M,RAN J H,WANG X Q.Evolution of the cinnamyl/sinapyl alcohol dehydrogenase(CAD/SAD)gene family:the emergence of real lignin is associated with the origin of bona fide CAD[J].Journal of Molecular Evolution,2010,71(3):202-218.
[4] KNIGHT M E,HALPIN C,SCHUCH W.Identification and characterisation of cDNA clones encoding cinnamyl alcohol dehydrogenase from tobacco[J].Plant Molecular Biology,1992,19(5):793-801.
[5] DAMIANI I,MORREEL K,DANOUN S,et al.Metabolite profiling reveals a role for atypical cinnamyl alcohol dehydrogenase CAD1in the synthesis of coniferyl alcohol in tobacco xylem[J].Plant Molecular Biology,2005,59(5):753-769.
[6] GOFFNER D,VAN DOORSSELAERE J,YAHIAOUI N,et al.A novel aromatic alcohol dehydrogenase in higher plants:molecular cloning and expression[J].Plant Molecular Biology,1998,36(5):755-765.
[7] GRIMAPJ,FEUILET C,GOFFNER D,et al.Molecular cloning and expression of a Eucalyptus gunnii cDNA clone encoding cinnamyl alcohol dehydrogenase[J].Plant Molecular Biology,1993,21(6):1 085-1 095.
[8] BLANCOPR,MEDINAEN,LOPEZRJ,et al.Cloning,expression and immunolocalization pattern of a cinnamyl alcohol dehydrogenase gene from strawberry(Fragaria×ananassacv.Chandler)[J].Journal of Experimental Botany,2002,53(375):1 723-1 734.
[9] KIM S J,KIM M R,BEDGAR D L,et al.Functional reclassification of the putative cinnamyl alcohol dehydrogenase multigene family in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(6):1 455-1 460.
[10] BRILL E M,ABRAHAMS S,HAYES C M,et al.Molecular characterisation and expression of a wound-inducible cDNA encoding a novel cinnamyl-alcohol dehydrogenase enzyme in lucerne(Medicago sativa L.)[J].Plant Molecular Biology,1999,41(2):279-291.
[11] MA Q H.Functional analysis of a cinnamyl alcohol dehydrogenase involved in lignin biosynthesis in wheat[J].Journal of Experimental Botany,2010,61(10):2 735-2 744.
[12] RENSING S A,LANG D,ZIMMER A D,et al.The Physcomitrella genome reveals evolutionary insights into the conquest of land by plants[J].Science,2008,319(5 859):64-69.
[13] LI X,MA D,CHEN J,et al.Biochemical characterization and identification of a cinnamyl alcohol dehydrogenase from Artemisia annua[J].Plant Science,2012,193:85-95.
[14] DENG W W,ZHANG M,WU J Q,et al.Molecular cloning,functional analysis of three cinnamyl alcohol dehydrogenase(CAD)genes in the leaves of tea plant,Camellia sinensis[J].Journal of Plant Physiology,2013,170(3):272-282.
[15] DHONT A,DENOEUD F,et al.The banana(Musa acuminata)genome and the evolution of monocotyledonous plants[J].Nature,2012,448:213-217.
[16] AURORE G,PARFAIT B,et al.Bananas,raw materials for making processed food products[J].Trends Food Sci.Technol.,2009,20:78-91.
[17] HWANG S C,KO W H.Cavendish banana cultivars resistant to Fusarium wilt acquired through somaclonal variation in Taiwan[J].Plant Dis.,2004,88:580-588.
[18] HUDGINS J W,CHRISTIANSEN E,FRANCESCHI V R.Induction of anatomically based defense responses in stems of diverse conifers by methyl jasmonate:aphylogenetic perspective[J].Tree Physiology,2004,24(3):251-264.
[19] MITCHELL H J,HALL J L,BARBER M S.Elicitor-induced cinnamyl alcohol dehydrogenase activity in lignifying wheat(Triticum aestivum L.)leaves[J].Plant Physiology,1994,104(2):551-556.
[20] SIEGRIST J,JEBLICK W,KAUSS H.Defense responses in infected and elicited cucumber(Cucumis sativus L.)hypocotyl segments exhibiting acquired resistance[J].Plant Physiology,1994,105(4):1 365-1 374.
[21] LOGEMANN E,REINOLD S,SOMSSICH I E,et al.A novel type of pathogen defense-related cinnamyl alcohol dehydrogenase[J].Biological Chemistry,1997,378(8):909-914.
[22] COELHO A C,HORTA M,NEVES D,et al.Involvement of a cinnamyl alcohol dehydrogenase of Quercus suber in the defence response to infection by Phytophthora cinnamomi[J].Physiological and Molecular Plant Pathology,2006,69(1):62-72.
[23] WANG ZH(王 卓),YIN X M(殷晓敏),WANG J B(王家保),et al.Construction and characterization of normalized full-length cDNA library of banana roots[J].Acta Horticulturae Sinica(园艺学报),2011,38(9):1 667-1 674(in Chinese).
[24] WAN C Y,WILKINSTA.A modified hot borate method significantly enhances the yield of high-quality RNA from cotton(Gossypium hirsutum L.)[J].Analytical Biochemistry,1994,223(1):7-12.
[25] CHEN H Q(陈慧勤),ZHAO SH Q(赵淑清).Recent advance in plant disease resistance and acquired resistance system[J].J.Shanxi Agric.Univ.(山西农业大学学报·自然科学版),2003,23(3):286-291(in Chinese).
[26] LI W(李 伟),XIONG J(熊 谨),CHEN X Y(陈晓阳).Advances in the research of physiological significance and genetic regulation of lignin metabolism[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2003,23(4):675-681(in Chinese).
[27] GE Q(葛 茜),KUANG J(邝 静),WU Y C(武玉 翠),et al.Cloning and expression analysis of cinnamyl alcohol dehydrogenase(SmCAD)gene in Salvia miltiorrhiza Bunge[J].Plant Science Journal(植物科学学报),2013,31(3):261-268(in Chinese).
[28] HAMMERSCHMIDT R.Induced disease resistance:how do induced plants stop pathogens?[J].Physiological and Molecular Plant Pathology,1999,55(2):77-84.
[29] VANDEN BERG N,BERGER D K.HEIN I,et al.Tolerance in banana to fusarium wilt is associated with early up-regulation of cell wallstrengthening genes in the roots[J].Molecular Plant Pathology,2007,8(3):333-341.

