不同抗性甜瓜接种蔓枯病菌后若干生理指标的变化
王红英 钱春桃 张永兵 伊鸿平 郭勤卫 刘佳 吴明珠 陈劲枫
摘要:对不同抗性甜瓜接种蔓枯病菌后测定叶片中叶绿素、可溶性糖、可溶性蛋白含量和3种防御酶(PPO、PO、PAL)的活性。结果表明:叶绿素含量在接种后呈现先增加后减小趋势,抗病甜瓜增幅大。叶绿素含量高于感病甜瓜;可溶性糖含量在接种后先降低后升高、再降低再升高,抗病甜瓜可溶性糖含量高于感病甜瓜:可溶性蛋白含量在接种后逐渐升高,感病甜瓜峰值出现早于抗病甜瓜;3种酶活性在接种后都有不同程度提高。其中抗病甜瓜酶活性增幅高于感病甜瓜。几种酶活性变化可以用于甜瓜蔓枯病抗性鉴定。
关键词:甜瓜;蔓枯病菌;叶绿素;可溶性糖;可溶性蛋白;PPO;PO;PAL
甜瓜(Cucumis melo L.)蔓枯病是由Didymellabroniae(Auersw.)Rehm引起的一种真菌性病害,其发生常会导致毁灭性的后果。植物在受到病原菌侵入后,叶片组织会因病原菌侵入发生一系列变化。据报道。叶绿素、可溶性糖、可溶性蛋白含量和防御酶多酚氧化酶(PPO)、过氧化物酶(PO)及苯丙氨酸解氨酶(PAL)与黄瓜霜霉病、黄瓜白粉病、西瓜枯萎病等多种病害的抗性有关。然而在不同抗病体系中,植物的抗病机制表现不尽相同,有关不同抗性甜瓜接种蔓枯病菌后的影响还未见报道。因此,笔者选取抗病和感病甜瓜材料。对其接种蔓枯病菌后测定分析叶片中一些生理指标和几种保护酶活性的变化,以进一步探讨这些指标与甜瓜蔓枯病抗性之间的关系。
1材料与方法
1.1材料
供试材料伊丽莎白为感病甜瓜(S),由新疆农业科学院哈密瓜研究中心提供;PI 420145为抗病甜瓜(R),由美国康乃尔大学Molly John教授提供。抗、感病材料均经过课题组多代自交和蔓枯病抗性鉴定。供试蔓枯病菌为本实验室分离纯化并保存的A型菌株,该菌株的分生孢子在仅含磷酸二氢氨的马铃薯平板培养基上,经7 d暗培养和4 d间歇紫外灯(12 h紫外灯/12 h黑暗)处理的光照条件下产生。
1.2抗性鉴定
抗性鉴定试验于2010年秋季在南京农业大学园艺站塑料大棚内进行,抗、感材料各60株,30株接种鉴定,30株用清水喷施作为对照,3次重复。接种鉴定参照Zhang等的方法进行,在甜瓜植株长到3-4片真叶时,选取长势一致的植株对叶部和茎部同时喷施接种,蔓枯病菌孢子悬浮液体积浓度为1×105个·mL-1。接种后覆盖棚膜保湿3 d,温度控制在25℃左右,于接种后第7天统计发病情况,病情严重程度分级标准为:
茎部:1级,无伤害;2级,单个病斑长1-10mm,或者多个病斑总长1-20 mm但未环茎1周;3级,病斑21-80mm,或是环茎1周;4级,茎蔓萎蔫;5级,植株死亡。1-2级为抗病,3-5级为感病。
叶部:1级,侵染面积为0;2级,侵染面积≤25%;3级,25%<侵染面积≤50%;4级,50%<侵染面积≤75%;5级,侵染面积>75%。1-2级为抗病,3-5级为感病。
1.3取样方法
接种处理前取样1次,接种后每天取样1次,取8 d,共取9次(每次均取相同部位功能叶),用于各生理指标测定,测定结果取3次重复平均值。
1.4生理指标测定
参照沈伟其的方法测定叶绿素含量(略有改动):植物叶片约4g,于液氮中研磨,然后加入在65℃水浴中预热提取缓冲液约900μL,并振荡摇匀,再加入巯基乙醇约20μL,65℃水浴30min;加入5mol·L-1KAC 300μL,冰浴30-60 min,12000转·min-1,离心10min:清液加入1/5体积的5%CTABBuffer上下颠倒充分摇匀,65℃水浴20min;待冷却至室温后,加入等体积的氯仿/异戊醇(24:1)抽提2次,室温11000转·min-1,离心5min;如界面浑浊,再抽提1-2次;取上清液,加入2/3体积的异丙醇,上下颠倒充分摇匀,室温放置10min,12000转,min-1,离心10min;弃上清液,用70%乙醇洗涤沉淀2次,抽干沉淀,加TE溶解。加1/10体积的Rnase(约40μL,10mg·mL-1)处理DNA样品,37℃,30min;加入等体积的氯仿,异戊醇(24:1)抽提2次,吸上清液加110体积的3mol·L-1NaAc(pH值5.2),2倍体积的无水乙醇摇匀,-20℃放置10 min;4℃,6000转·min-1离心5min,用70%乙醇洗涤沉淀2次,抽干沉淀,加适量TE Buffer溶解,取2μL与0.8%琼脂糖凝胶中。100 V电泳30 min。其余-20℃保存。用蒽酮法测定可溶性糖含量。用考马斯亮蓝G-250法测定可溶性蛋白含量。PPO和PO液提取参照谭兴杰等的方法。PAL液提取参照秦鑫等所采用的方法。
2结果与分析
2.1甜瓜接菌后叶绿素含量变化
图1显示,接种前抗病甜瓜叶绿素含量高于感病甜瓜。接种后抗、感病甜瓜叶绿素含量开始均呈增加趋势,抗病甜瓜增幅大于感病甜瓜:抗病甜瓜和感病甜瓜第1个峰值均出现在接种后第2天,达到峰值后均呈现不同程度的下降,并分别在接种后第6天和第5天出现第2个峰值。之后抗病甜瓜和感病甜瓜叶绿素含量继续下降,至第8天时叶绿素含量均低于对照,但抗病甜瓜叶绿素含量一直高于感病甜瓜。抗、感病甜瓜对照叶绿素含量均有小幅度下降。

2.2甜瓜接菌后可溶性糖含量变化
图2显示,接种前抗病甜瓜可溶性糖含量高于感病甜瓜。接种后,抗、感病甜瓜可溶性糖含量变化趋于一致,即下降、升高、再下降、再升高,均在第8天升到最高点。抗病甜瓜接种后可溶性糖含量出现大幅度下降,第3天降到最低点,接种后第5天开始再次出现大幅度下降:感病甜瓜接种后可溶性糖含量第1天下降,随后上升,第3天开始出现较大幅度的下降,第5天降至最低点,随后开始上升,第7天快速上升。不同抗性甜瓜在不同时期可溶性糖含量变化不同:接种初期,抗病甜瓜可溶性糖含量下降幅度较大,后期上升幅度也较大:感病甜瓜变化幅度不大,且可溶性糖含量均低于抗病甜瓜。抗、感病对照甜瓜可溶性糖含量基本处于稳定不变的状态。

2.3甜瓜接茵后可溶性蛋白含量变化
图3显示,接种前,抗病甜瓜可溶性蛋白含量高于感病甜瓜。接种后,抗、感病甜瓜可溶性蛋白含量均增加,且变化趋势大体相同,先缓慢升高、再快速升高、再下降。但不同抗性甜瓜可溶性蛋白含量具体变化又不同:抗病甜瓜可溶性蛋白含量缓慢上升,峰值出现在接种后第3天。而后降幅相对平缓,第6天降幅增大后再平缓;感病甜瓜上升很快,峰值出现在接种后第2天,而后快速下降至第4天趋于平缓,最后抗、感病甜瓜均逐渐降低至正常水平。除第2

天感病甜瓜可溶性蛋白含量略高于抗病甜瓜外,其余均明显低于抗病甜瓜。抗、感病甜瓜接种后第8天可溶性蛋白含量接近对照。抗、感病对照可溶性蛋白含量基本没有变化。
2.4甜瓜接菌后3种防御酶活性变化
2.4.1 PPO活性变化图4显示,接种前,抗病甜瓜PPO活性显著高于感病甜瓜。接种后,抗、感病甜瓜PPO活性都有不同程度提高。均在第6天达到峰值,抗病甜瓜的增幅及峰值显著大于感病甜瓜,之后均有不同程度的下降,但都明显高于对照。抗病甜瓜PPO活性一直高于感病甜瓜。抗、感病对照甜瓜PPO活性基本没有变化。

2.4.2 PO 活性变化 图5显示,接种前,抗、感病甜的PO活性略高于感病甜瓜。接种后,抗、感病甜瓜第1、2天PO活性增幅不明显,第3、4天出现大幅度的增加,随后上升幅度基本趋于平稳:感病甜瓜PO活性变化趋势与抗病甜瓜基本相同,但上升幅度
 略低于抗病甜瓜。接种前后抗病甜瓜PO活性均高于感病甜瓜。从接种后第4天开始,抗、感病甜瓜PO活性显著高于对照,抗、感病对照的PO活性基本无变化。
略低于抗病甜瓜。接种前后抗病甜瓜PO活性均高于感病甜瓜。从接种后第4天开始,抗、感病甜瓜PO活性显著高于对照,抗、感病对照的PO活性基本无变化。
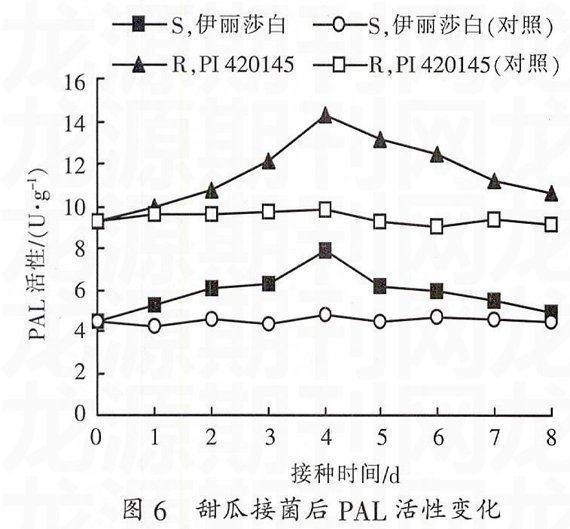
2.4.3 PAL 活性变化 图6显示,接种前。抗病甜瓜PAL活性高于感病甜瓜。接种后,抗、感病甜瓜PAL活性均呈上升趋势,均在第4天达到峰值,随后逐渐下降趋于正常:接种后第8天抗病甜瓜PAL活性略高于对照,感病甜瓜与对照趋于一致。感病甜瓜PAL活性相对稳定,抗病甜瓜接种前后PAL活性均高于感病甜瓜。抗、感病对照PAL活性变化不大。
3讨论
在本研究中抗病甜瓜叶绿素含量一直高于感病甜瓜,暗示叶绿素含量与蔓枯病抗性存在一定程度的正相关。接种后,抗病甜瓜可以进一步合成叶绿素促进光合作用和营养物质的合成,增强了植物的抗病性。接种前抗病甜瓜可溶性糖含量高于感病甜瓜。接种后抗、感病甜瓜可溶性糖含量变化基本一致,糖含量的变化与抗性没有明显的关系。然而刘庆元等对黄瓜霜霉病的研究认为黄瓜叶内可溶性糖含量越高,其抗病性越强,否则就越弱。刘素萍等认为糖是病原菌生长繁殖必须的营养物质,糖含量越高是促进植物感病的一个重要因素,本试验结果与其报道不相符。糖含量的高低在不同品种间与抗性的关系是不完全相同的。接种前抗病甜瓜可溶性蛋白含量高于感病甜瓜,接种后感病甜瓜峰值出现早于抗病甜瓜,说明感病甜瓜比抗病甜瓜对病原菌的侵入更为敏感,抗病性与植物对病原菌侵染的反应呈负相关。
本研究结果表明。接种后甜瓜PPO、PO和PAL活性显著提高,抗病品种酶活性升高的相对幅度大于感病品种,说明抗病品种的抗性与酚类代谢物质代谢活性相关,酚类物质的分泌能够增加植物的抗性,次生代谢酶活性增强是甜瓜抗病性的重要生化机制。PPO、PO和PAL对蔓枯病病原菌的侵染具有积极作用,根据其是否接种蔓枯病菌的变化规律,可以为甜瓜蔓枯病的接种鉴定提供参考。
4结论
本研究结果表明,甜瓜植株在受蔓枯病菌侵染后,抗、感病材料叶片中的叶绿素、可溶性糖、可溶性蛋白含量较对照均发生了明显的变化,抗病材料的PPO、PO及PAL活性均高于感病材料。这些酶活性的变化与甜瓜蔓枯病抗性有密切关系。

