新疆阿勒泰地区8种生态型罗布麻光合生理及生长特性研究
高 鹏,南志标,吴永娜,刘起棠,孟繁杰,肖正春,段廷玉*
(1兰州大学 草地农业生态系统国家重点实验室,草地农业科技学院,兰州730020;2甘肃省生物治疗与再生医学重点实验室,兰州大学 第一医院东岗院区生物技术实验中心,兰州730000;3 戈宝绿业有限公司,广东深圳518001;4 南京野生植物综合利用研究院,南京210042)
罗布麻是罗布麻属(Apocynum)和白麻属(Poacynum)一类植物的总称,广泛分布于西欧、中亚、北美及中国北方地区,在中国有2 属3 种罗布麻,为罗布麻属的罗布红麻(Apocynumvenetum)和白麻属的白麻(Poacynumpictum)、大叶白麻(Poacynumhendersonii)[1]。罗布麻兼具纺织及药用等功能,在国民经济建设和国民保健中的作用不断加强[2-3],其商品化开发日益受到重视。但近年来,随着生态环境恶化和不合理开发,罗布麻野生资源受到严重破坏[4]。目前,仅在中国新疆有集中连片分布,而新疆的阿勒泰地区是中国已知罗布麻种类分布最多且野生资源保存较好的地区。
随着罗布麻野生资源的减少,人工种植已成为满足市场需求的主要方式。但目前罗布麻种植主要采用野生种子进行繁殖,品种选育工作还未开展,导致其产量和质量较低,尤其是抗病性极差,严重阻碍罗布麻产业的发展,因此,亟待选育具有优良经济性状和抗病能力的罗布麻品种。作为同一物种在不同生境下发生在遗传、形态以及生理代谢等方面形成的植物生态型,拥有较为丰富和稳定的基因型[5],因此,系统研究罗布麻生态型的生物学性状、生理特征和生长特性,对其多样性保护、野生驯化及品种选育等方面[6]具有重要意义。
国内外有关罗布麻的报道主要集中在分类研究[7-10]、生物学和生理学特征[11-13]、资源开发利用[14-15]、药效化学成分分析[16-18]等方面,而有关不同生态型罗布麻光合生理及生长特性研究未见报道。本研究以生长在阿勒泰地区的8种主要生态型罗布麻为研究对象,通过分析评价其在外部形态、光合生理及生长等方面的特征,以期为罗布麻种质资源保护、品种选育及合理布局提供科学依据。
1 材料和方法
1.1 研究地概况
研究地位于新疆阿勒泰市阿拉哈克乡的戈宝绿业有限公司罗布麻种质资源圃(N47°44.882′~47°44.910′,E87°29.580′~87°29.596′,海 拔高度548~564m),据阿勒泰气象站50年资料,研究地年最高温37.6 ℃,年最低温-43.5 ℃,年均温4.5 ℃;年均降雨量126.7mm。
种质资源圃于2009年建立,建立前为种植食葵的农田。土壤类型为灰漠盐碱土,pH 8.5。种质资源圃共有白麻(紫斑、青秆、红秆、粉秆、白花、宽叶)、大叶白麻和罗布红麻8种罗布麻生态型,其中大叶白麻和白麻移栽自土山区的盐碱地和荒漠沙地,罗布红麻移栽自红沟和盐湖区的沼泽湿地。各生态型通过挖根后直接移栽而成,株距1m,行距3m。灌溉采用滴灌,滴灌带为内镶式滴灌管(天业,新疆,中国),滴孔位于麻丛中心,间距1 m,公称流量4.0 L/h。种质资源圃统一间隔10~15d 灌溉1 次。2010~2012年无病害防治措施,2013年7月上旬间隔7d喷施三唑酮,共喷施3次,防治锈病。每月人工除草1次。
种质资源圃由19块种植相同生态型罗布麻的独立小区构成,每小区面积均大于667m2。除大叶白麻为2个独立小区,白麻宽叶为1个独立小区外,其余生态型均为3个独立小区。为满足试验要求,将白麻宽叶和大叶白麻小区划分为3个重复小区。
1.2 测定指标和方法
1.2.1 光合生理特征值 试验于2013年罗布麻成株期(6月15日)和花果期(8月1日)的上午、中午和下午3个时间段进行,由于阿勒泰市与北京时间存在2~3h时差,因此将上午、中午和下午时间分别设定为9:30~10:30、14:30~15:30和18:30~19:30。试验期间为晴朗、无风天气。每个重复小区随机(避开边缘植株)选取长势一致的植株3株,每株选取中部1枝条,用红绳定枝,每次测定选取定枝枝条中部1 片完全展开的成熟叶片。采用美国产Li-6400便携式光合仪,在自然光下测定光合生理参数值。将叶片平展夹入光合仪标准叶室(6cm2),完毕后打开叶室,叶片用碳素笔沿叶室上、下边缘划线,然后取出叶片,装入自封袋并编号,带回室内置于4 ℃冰箱保存,用于计算叶面积。
将保存于4℃冰箱内叶片取出,沿上、下划线部位整齐剪下,将剪下的叶片平铺在白色打印纸上,用0.5mm 碳素笔沿叶片边缘整齐描线,并用剪刀沿描线部位整齐剪下,最后编号并采用美国产Epson Perfection 4870Photo叶面积仪测量叶面积,利用公式计算实际光合生理值和水分利用效率(WUE):
实际光合生理值=(测得光合生理值/6)×叶面积WUE=净光合速率/蒸腾速率。
1.2.2 生长特性 测定光合生理值的同时,每重复小区选择3株未标记植株,齐地面剪下,将叶片迅速摘下装入自封袋,105 ℃杀青,80 ℃烘干至恒重测定干重。用直尺测定株高,用游标卡尺测定地径,计数每株一级分枝数,利用公式计算茎节长:
茎节长=株高/分枝数。
1.2.3 气象因子及土壤含水量 采用安装在种植资源圃内的美国产EM50自动气象站,收集光照强度、大气温度和空气相对湿度值。采用烘干法测定0~60cm 土层土壤重量含水量,每小区3个重复。
1.3 数据处理
所有数据采用SPSS 19.0软件进行统计分析,利用单因素方差分析(One-way ANOVA)分析不同类型罗布麻的光合生理及生长特性。应用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 不同生态型罗布麻分类地位和形态学特征
种质资源圃8种生态型罗布麻中,1 种为大叶白麻,1种为罗布红麻,其余6种均为白麻。除白麻宽叶外,各生态型移栽3年后,在株型、叶型、叶色和花色等性状上均能保持稳定;白麻宽叶随移栽年限增加,其株型和各部位叶型趋于变小,性状不稳定。从表1、图1可以看出,各生态型罗布麻可通过形态学特征进行区分。
2.2 试验区气象及土壤水分状况
试验区罗布麻成株期的光照强度较花果期高,而其气温和相对湿度则较花果期低。2个生育时期不同时段光照强度在中午时最高,下午最低,而气温则为下午>中午>上午,空气相对湿度则相反(表2)。试验期间各小区土壤含水量为20.5% ~21.95%,且不同生态型之间差异不显著,即各生态型罗布麻生育期内的立地环境条件相似。

表1 阿勒泰地区不同生态型罗布麻的分类地位及形态学特征Table1 The taxonomic status and morphological characteristics of the different ecotype Luobuma

图1 阿勒泰地区8种主要生态型罗布麻Fig.1 The 8ecotypes of Luobuma in Altay

表2 试验期间种质资源圃气象条件和土壤含水量状况Table2 The weather and soil moisture during the experiment of germplasm resources garden
2.3 不同生态型罗布麻光合生理特征
2.3.1 净光合速率(Pn) 从日变化上看,2个时期各生态型罗布麻Pn均在上午时最高,分别为20.2~30.1和17.8~24.7μmol·m-2·s-1;中午时次之,较上午分别降低6%~45%和11%~42%,其中,白麻紫斑、白麻宽叶和大叶白麻降幅较大,分别为26%~45%和29%~42%,白麻白花降幅最小,仅为6%和12%;下午时最低,较上午分别降低22%~62%和34%~62%(图2)。
就同一时间段而言,2个生育时期各生态型的Pn存在差异。上午时,白麻青秆、白麻紫斑和大叶白麻的Pn相对较高,成株期和花果期分别为27~30和22~25μmol·m-2·s-1;白麻红秆和白麻粉秆的Pn在成株期时显著低于白麻青秆;白麻白花、白麻宽叶和罗布红麻的Pn在2个生育时期均显著低于白麻青秆、白麻紫斑和大叶白麻,分别为20~24和18~20μmol·m-2·s-1。中午时,白麻青秆、白麻红秆、白麻粉秆、白麻白花和大叶白麻的Pn无显著差异,但显著高于其他生态型;在成株期,白麻紫斑和罗布红麻的Pn最低,且显著低于白麻青秆,仅为白麻青秆的60%;而在花果期,白麻紫斑和白麻宽叶的Pn最低,为白麻青秆的54%~77%。下午时,白麻青秆、白麻红秆和大叶白麻的Pn仍为8种生态型中最高,而其余生态型的Pn较低(图2)。
可见,白麻青秆、白麻红秆和大叶白麻的Pn在2个时期均处于8种生态型中较高水平,白麻宽叶和罗布红麻则相对较低。处于中间的生态型中,白麻粉秆在上午和中午时较高,下午时显著降低;白麻紫斑在上午时较高,中午和下午时显著降低;白麻白花表现则与白麻紫斑相反。
2.3.2 蒸腾速率(Tr) 2个时期各生态型罗布麻的Tr在上午时分别为6.9~11.2 和4.2~8.0 mmol·m-2·s-1;中午时,除白麻紫斑较上午有所降低外,其余生态型均较上午明显升高,升幅分别为1%~29%和2%~42%,其中白麻白花和白麻粉秆的升幅较高,分别为28%~29%和37%~42%,白麻红秆、白麻宽叶和大叶白麻的升幅较低,分别为1%~12%和2%~5%;下午时,各生态型的Tr为最低,较上午分别降低24%~44%和6%~50%。
同期各生态型罗布麻的Tr存在差异。2 个生育时期的上午,白麻青秆、白麻红秆、白麻紫斑的Tr均高于其他生态型,分别为10.5~11.2 和6.7~8.0mmol·m-2·s-1;而此时白麻白花和罗布红麻的相对较低,分别为6.9~8.2和5.3~5.8mmol·m-2·s-1;白麻粉秆、大叶白麻的Tr在花果期显著高于白麻白花和罗布红麻。中午时,2 个生育时期白麻青秆、白麻红秆、白麻粉秆、白麻白花和大叶白麻的Tr相对较高,分别为8.0~11.2和5.8~8.0 mmol·m-2·s-1;白麻紫斑和罗布红麻的Tr在花果期与上述5种生态型相近,但在成株期显著低于上述5种生态型;白麻宽叶的Tr在成株期较高,而花果期较低。下午时,白麻青秆、白麻红秆和白麻白花的Tr均显著高于其余生态型,分别为6.4~8.8和4.6~5.2mmol·m-2·s-1,其他5种生态型的Tr分别为4.3~5.7 和3.4~4.1mmol·m-2·s-1(图3)。
以上结果说明,白麻青秆和白麻红秆在2个时期均保持较高的Tr,白麻粉秆、白麻宽叶、大叶白麻和罗布红麻的Tr则相对较低。白麻紫斑在上午时较高,中午和下午时显著降低;白麻白花表现则与白麻紫斑相反。
2.3.3Ci/Ca从日变化上看,除白麻粉秆的Ci/Ca值在成株期的中午较上午显著升高外,其余生态型均为上午时最高,中午和下午时最低。就同一时间段而言,各生态型罗布麻的Ci/Ca值在下午时无显著差异,上午和中午时呈现不同特征。上午时,白麻红秆、白麻宽叶和大叶白麻的Ci/Ca值为8种生态型中较高者(0.64~0.75),而罗布红麻为最低(0.58~0.61),其余生态型居中。中午时,成株期的白麻宽叶、白麻白花、白麻红秆和白麻粉秆的Ci/Ca值较高(0.62~0.66),白麻青秆和大叶白麻的次之(0.57~0.58),白麻紫斑和罗布红麻的较低(0.51~0.55);花果期白麻青秆的Ci/Ca值最高(>0.6),白麻宽叶的最小(0.51,图4)。可见,白麻粉秆Ci/Ca值与其他生态型不同,在中午净光合光合速率显著下降时,其Ci/Ca值反而呈上升趋势。8 种生态型中,白麻红秆和白麻宽叶始终保持较高的Ci/Ca,而罗布红麻的Ci/Ca值为最低。

图2 各生态型罗布麻成株期(A)和花果期(B)的净光合速率Fig.2 Net photosynthetic rate of Luobuma in adult stage(A)and flowering fruit bearing stage(B)
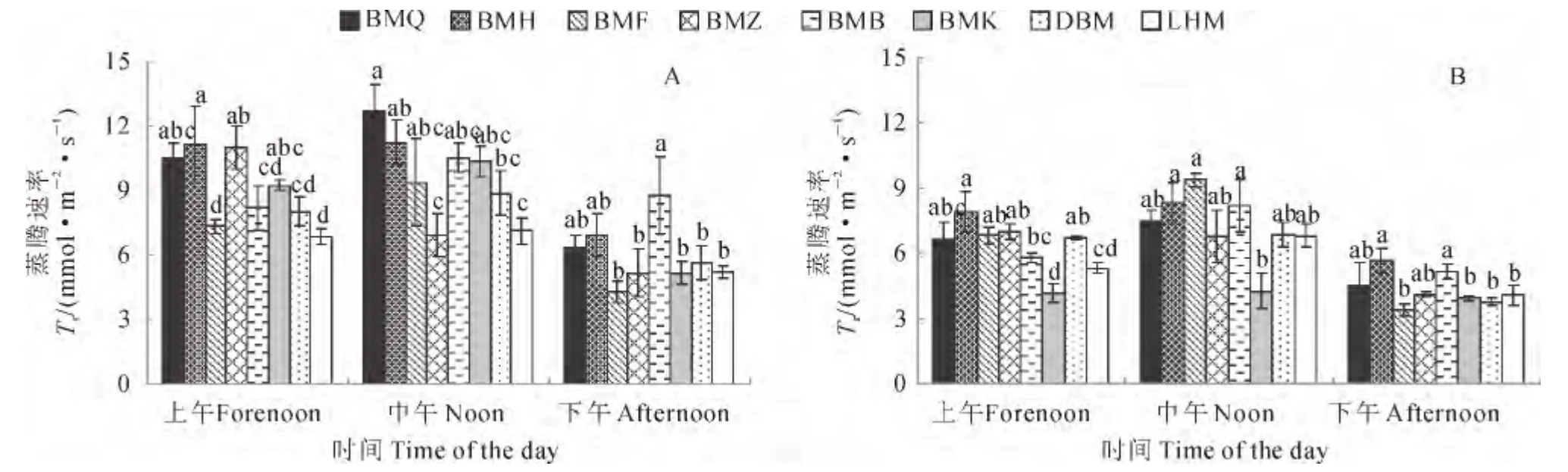
图3 各生态型罗布麻成株期(A)和花果期(B)的蒸腾速率Fig.3 Transpiration rate of Luobuma in adult stage(A)and flowering fruit bearing stage(B)
2.3.4 气孔导度(Gs) 2个时期各生态型罗布麻的Gs均为上午时最高,分别为7.1~12.7和4.3~9.4mol·m-2·s-1;下午时最低,分别为4.3~8.8和3.4~5.6 mol·m-2·s-1。同期各生态型罗布麻的Gs存在差异。白麻青秆、白麻红秆和大叶白麻在3个时间段均在8种生态型中较高;罗布红麻在上午和中午时显著低于这3种生态型(P<0.05),下午时差异不显著;白麻紫斑在上午时较这3种生态型低,但较白麻白花、白麻宽叶和罗布红麻的高。白麻白花和白麻宽叶在上午相对较低,但在中午和下午较高(图5)。这说明不同生态型罗布麻Gs的变化特征与Pn、Tr和Ci/Ca均有较好的一致性,尤其在中午,各生态型Gs的降低可能是导致后者显著下降的主要原因。而在下午,各生态型的Gs受环境影响较小,且差异不显著。
2.3.5 水分利用效率(WUE) 2个时期各生态型罗布麻的WUE均为上午时较高,分别为2.3~3.5和3.2~4.5,中午和下午时较低,其WUE均在1.7~2.7之间。就同一时间段而言,成株期的上午和中午,白麻青秆、白麻粉秆、大叶白麻和罗布红麻的WUE较其他生态型要高,并以大叶白麻的最高,分别为3.5和2.6;而白麻红秆、白麻白花和白麻宽叶相对较低,分别为2.3~2.6和1.7~1.9;各生态型的WUE在下午无显著差异。花果期的上午,除白麻宽叶具有较高WUE外,其他生态型的WUE均低于白麻宽叶,且生态型之间差异不显著;各生态型的WUE在中午和下午均无显著差异(图6)。可见,大叶白麻、罗布红麻相对其他生态型具有较高的WUE,而白麻生态型中只有白麻青秆和白麻粉秆在成株期和白麻宽叶在花果期的WUE相对较高。
2.4 不同生态型罗布生长特性
花果期各生态型罗布麻的株高、地径和叶干重较成株期显著增加,其中白麻紫斑的增幅最大,白麻粉秆的增幅最小。各生态型主杆茎节的长度在2个时期变化不大,而白麻青秆、白麻紫斑和罗布红麻的一级分枝数随时间增加明显,其余生态型变化不大。
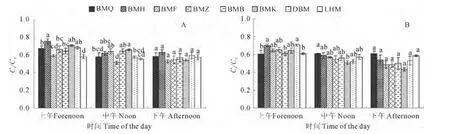
图4 各生态型罗布麻成株期(A)和花果期(B)的Ci/Ca 值Fig.4 The Ci/Cavalue of Luobuma in adult stage(A)and flowering fruit bearing stage(B)
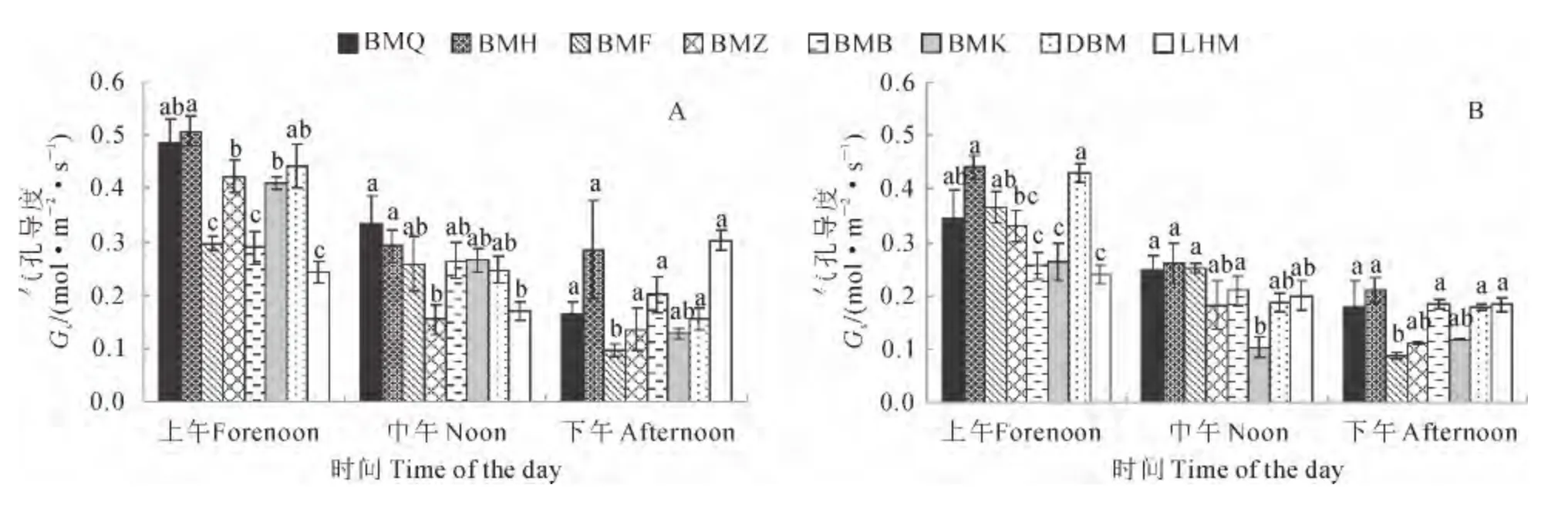
图5 各生态型罗布麻成株期(A)和花果期(B)的气孔导度Fig.5 Stomatal conductance of Luobuma in adult stage(A)and flowering fruit bearing stage(B)
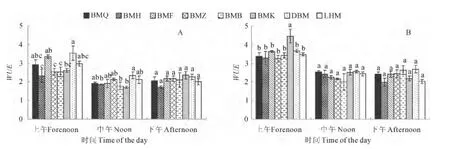
图6 各生态型罗布麻成株期(A)和花果期(B)的水分利用效率Fig.6 The WUE value of Luobuma in adult stage(A)and flowering fruit bearing stage(B)

表3 不同生态型罗布麻生长特性Table3 The growth characteristics of the different ecotypes of Luobuma(mean±SD)
2个生育时期各生态型罗布麻的株高均以白麻粉秆和白麻白花较高(>110cm)并显著高于其他生态型,大叶白麻最小(65~70cm),其余生态型居中。2个生育时期罗布麻茎节均以大叶白麻生态型最长(>6.5cm),白麻红秆、白麻粉秆、罗布红麻、白麻青秆和白麻紫斑较短(3.9~4.5cm),白麻白花最短(<3.9cm)。各生态型罗布麻的地径表现为白麻粉秆、白麻白花(>8.2mm)>白麻青杆、白麻红秆、罗布红麻>白麻紫斑、大叶白麻(<6.6mm)。罗布麻叶干重在2个时期均以白麻青秆、白麻粉秆、白麻白花较高,并显著高于其他生态型,分别为8.9~15.9 g和22.6~24.9g;白麻红秆、白麻紫斑和大叶白麻次之,分别为5.0~7.8g和16.4~18.0g;罗布红麻最低分别,分别仅为4.9和11.2g(表3)。
总体来看,白麻各生态型叶干重和株高较罗布红麻和大叶白麻要高,并以白麻白花和白麻粉秆的最高,白麻紫斑最低。在成株期至花果期之间,白麻青秆、白麻紫斑和白麻宽叶的叶产量和株高较其他白麻生态型增加明显,相对为晚熟类型,而白麻粉秆为早熟类型,其余生态型则介于二者之间。大叶白麻的干重虽较罗布红麻要高,但其株高较罗布红麻小;此外,大叶白麻的干重虽小于白麻,但其茎节为所有生态型中最长。
3 讨 论
本研究通过系统评价阿勒泰地区主要生态型罗布麻移栽3年后,在外部形态和光合生理及生长(株高、分枝数、地径和叶干重等)方面的特征,初步明确了其生物学性状的稳定性、生理特征和经济性状的差异性,并基于此划分出适合于阿勒泰地区培育的罗布麻类型。
将某个植物种以生态群体为基础,根据形态学特征和生理指标进行生态型划分,是植物驯化、引种、育种的重要理论依据[19]。尤其是光合作用和蒸腾作用等光合生理指标作为植物极为重要的生理代谢过程,在反映植物生长、产量及对环境适应性方面具有重要意义[20]。而根据植物种类和生态因子的不同,光合速率和蒸腾速率呈现出不同的日变化规律[21]。张永霞等[13]在对罗布红麻和白麻Pn和Tr研究后认为,二者Pn的日变化在上午时最高,中午时出现明显的光合“午休”现象,下午时最低;而其Tr的日变化在中午时最高。本研究结果表明,各生态型罗布麻的Pn和Tr随时间呈现不同变化特征,其中Pn在上午时最高,中午时出现不同程度降低,这与光合“午休”现象一致。植物光合“午休”是对强光照和高温的自我保护机制,与光照强度、气孔开张程度和CO2浓度等有关[11]。本研究中,罗布麻的光合“午休”出现在中午光照强度最高时,尤其是成株期表现最明显,且此时气孔导度和Ci/Ca值均较小,说明气孔因素是导致Pn下降的主要原因[22]。但罗布麻的这种光合“午休”程度在不同生态型之间存在差异,其中白麻紫斑和大叶白麻表现最明显,白麻白花表现最微弱,即白麻白花较其他生态型具有更好的耐受高光强和高温的能力。此外,白麻粉秆在成株期的中午,Gs降低,但Ci/Ca与其他生态型不同,呈上升趋势,表明此时非气孔因素是其光合能力降低的主要因素。各生态型罗布麻的Pn下午时最低,这主要是由于光照强度减弱所致,但不同生态型之间对弱光利用程度有差异,其中白麻白花利用弱光的能力最强,白麻粉秆和白麻紫斑则最差。各生态型罗布麻的Tr除白麻紫斑在中午时最低外,其余生态型均在中午时最高,下午时最低,这与张永霞等的研究结果一致。
除光合和蒸腾作用,WUE的变化也是评价植物对环境适应能力的重要指标[23]。本研究中各生态型罗布麻在相同时间段的Pn、Tr和WUE呈现各自特征。其中,大叶白麻的Pn最高,Tr较低,WUE最高,相对其他生态型为低蒸腾高光合高水分利用效率型;罗布红麻的Pn显著低于大叶白麻,但Tr较大叶白麻更低,因此WUE也较高,属低蒸腾低光合高水分利用效率型。大叶白麻和罗布红麻较低的Tr可能与其叶片具有典型的旱生结构有关。根据苏红文等[9]的研究,罗布麻红麻和大叶白麻的叶片具有较厚的角质层、乳头状瘤,以及气孔较少且仅分布于叶下表皮等特点,可以防止叶内水分过度蒸腾。此外,大叶白麻的光合能力较罗布红麻要强,这是由于其具有更高比例的栅栏组织、叶肉组织和海绵组织,从而防止强光对叶肉的灼伤,同时也能增强光合效率。与大叶白麻和罗布红麻不同,白麻各生态型的Pn、Tr和WUE表现出复杂特点。其中,白麻青秆、白麻红秆、白麻粉秆与大叶白麻均属低蒸腾高光合高水分利用效率型。白麻白花在中午和下午时表现为高蒸腾高光合低水分利用效率型,上午时则为低蒸腾低光合低水分利用效率型。而白麻紫斑与白麻白花相反。孙丽君等[11]通过研究新疆艾比湖白麻的光合生理特征后发现,白麻为高光合高蒸腾型植物,午前的光合能力大于午后,且Pn峰值在10~14μmol·m-2·s-1之间。这与本研究结果不完全一致,尤其是白麻生态型上午的Pn均大于20μmol·m-2·s-1,这种差异可能与研究地的气候、生态环境有关。
目前,罗布麻商品化开发主要为生产保健茶和纺织面料,因此叶片和茎秆纤维的质量和产量决定生态型的优劣。张卫明等[24]研究认为,罗布麻纤维的优质优用要按照麻秆主茎长短、粗细以及分枝数进行挑选,主茎长且粗,分枝数少的植株纤维品质最优。本研究中,白麻白花主茎最长,但一级分枝较多,可能导致麻皮短纤维较多,不适合生产纤维,但其叶产量较高,因此,可作为产叶型培育。白麻红秆和白麻粉秆的叶产量、茎节长度和粗度均较优,且抗旱性强,可作为产叶型和产纤维型进行培育。阿勒泰地区的大叶白麻仅在土山荒漠有零星分布,且叶产量低,主茎最短,这可能与气候及生境条件有关。任玉平等[25]的研究表明,新疆大叶白麻集中分布于高温少雨,土壤干燥的塔里木盆地南缘,而阿勒泰地区较南疆要湿润,温度要低,因此,大叶白麻不适合在阿勒泰地区种植。罗布红麻的叶产量较低且对土壤水分的要求高,但由于其具有较高水分利用效率,且药效成分种类和含量均明显高于白麻和大叶白麻[18],尤其是成品茶的口感和香味也较白麻好[26],因此适合作为产叶型进行培育。除上述生态型外,其余3种生态型经济性状较差,其中白麻宽叶性状不稳定,不适合进行培育。
阿勒泰地区不同生态型罗布麻在长期进化中形成适应其生长环境的稳定性状,在外部形态和光合生理特征上呈现出各自特征,并决定其生长特性。本研究对性状稳定的罗布麻生态型依据其叶产量和茎秆质量初步划分为产叶型或产纤维型,但在种植过程中发现,病虫害问题也日趋严重,因此,对不同生态型罗布麻的抗病性评价还有待进一步研究。
[1] 蒋英,李秉涛.中国植物志[M].北京:科学出版社,1977,63:163.
[2] XIE W Y,ZHANG X Y,WANG T,etal.Botany,traditional uses,phytochemistry and pharmacology ofApocynumvenetumL.(Luobuma),A review[J].JournalofEthnopharmacology,2012,141(1):1-8.
[3] JIE Y C(揭雨成),LENG J(冷 娟),XU Y(徐 英).The progress of studies on ecological characteristics and industrialization of kendyr[J].PlantFiberandProducts(中国麻业),2001,23(3):34-37(in Chinese).
[4] LIU Q T(刘起棠),ZHANG W M(张卫明),XIAO ZH C(肖正春),etal.Conservation status ofApocynumvenetumL.resources in central and eastern China[J].ChineseWildPlantResources(中国野生植物资源),2009,28(3):9-11(in Chinese).
[5] TURESSON G.The species and the variety as ecological units[J].Hereditas,1922,3:100-113.
[6] LIU Z Y(刘志彦),CHEN B G(陈北光),XIE ZH SH(谢正生),etal.Advances in plant ecotype classification[J].EcologicScience(生态科学),2004,23(4):365-369(in Chinese).
[7] ZHANG WM(张卫明),PENG XM(彭雪梅),LU CM(陆长梅),etal.A Taxonomic study of‘Luobuma’based on sequence data of 3noncoding DNA regions[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2007,27(5):859-863(in Chinese).
[8] ZHANG W M(张卫明),XIAO ZH CH(肖正春),GU G P(顾龚平),etal.On the resources utilization ofApocynumand it classification[J].ChineseWildPlantResources(中国野生植物资源),2006,25(2):15-19(in Chinese).
[9] SU H W(苏红文),MA M(马 淼),LI X Y(李学禹),Acomparative anatomy of different populations onApocynumvenetumandPoacynumhendersonii[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),1997,17(3):348-354(in Chinese).
[10] ZHANG P Y(张鹏云).The reseaurch of wild Luobum[J].JournalofLanzhouUniversity(兰州大学学报),1958,1:57-80(in Chinese).
[11] SUN L J(孙丽君),LCH H(吕长辉),TIAN Y H(田幼华),etal.Comparison on photosynthetic physiological characteristics ofPoacynumPictum(Schrenk.)Bail.of desert species under different soil water contents[J].XinjiangAgriculturalSciences(新疆农业科学),2011,48(4):755-760(in Chinese).
[12] WANG D Q(王东清),LI G Q(李国旗),WANG L(王 磊),Daily dynamics of photosynthesis and water physiological characteristics ofApocynumvenetumandA.cannabinumunder drought stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2012,32(6):1 198-1 205(in Chinese).
[13] ZHANG Y X(张永霞),LI G Q(李国旗),YAN W X(闫伟兄),etal.A study on photosynthetic characteristics ofApocynumvenetumL.andPoacynumpictumBaill[J].AgriculturalResearchintheAridAreas(干旱地区农业研究),2008,26(2):102-105(in Chinese).
[14] 董正钧,刘寿山.罗布麻的综合利用[M].北京:科学出版社,1978.
[15] WANG L L,HAN G T,ZHANG Y M.Comparative study of composition,structure and properties ofApocynumvenetumfibers under different pretreatments[J].CarbohydratePolymers,2007,69:391-397.
[16] KIM D W,TAKAKO Y,MASAO H,etal.Effects of aqueous extracts ofApocynumvenetumleaves on spontaneously hypertensive,renal hypertensive and NaCl-fed-hypertensive rats[J].JournalofEthnopharmacology,2000,72:53-59.
[17] OLIVER G,JUN IN,KAZUAKI K.Kaempferol from the leaves ofApocynumvenetumpossesses anxiolytic activities in the elevated plus maze test in mice[J].Phytomedicine,2009,16:295-302.
[18] ZHANG Y C,LIU C M,ZHANG Z K,etal.Fast differentiation ofApocynumvenetumwith related species by UPLC/MS and UPLC/SPE/NMR[J].MedicinalChemistryResearch,2012,21(7):1 077-1 083.
[19] 周纪伦,郑师章,杨持.植物种群生态学[M].北京:高等教育出版社,1992,45-51.
[20] ZHOU Y L(周艳丽),WANG Y(王 艳),LI J Y(李金英),etal.Allelopathy of garlic root exudates[J].ChineseJournalofAppliedEcology(应用生态学报),2011,22(5):1 368-1 372(in Chinese).
[21] REN J(任 军),FAN L Y(范丽颖),etal.Study on photosynthesis of youngSorbuspohuashanensisand the effect of ecological factors[J].JournalofNortheastNormalUniversity(Natural Science Edition)(东北师大学报,自然科学版),2006,38(2):96-100(in Chinese).
[22] ZHANG Y X(张永霞),LI G Q(李国旗),YAN W X(闫伟兄),etal.Prmiary Research on Diurnal Changes of the ChlorophyⅡFluorescence Parameters ofApocynumvenetumL.andApocynumhenderseniiHook.f[J].ChineseWildPlantResources(中国野生植物资源),2007,26(5):50-53(in Chinese).
[23] UEDA Y,NISHIHARA S,TOMITA H,etal.Photosynthetic response of Japanese rose speciesRosabracteataandRosarugosato temperature and light[J].ScientiaHorticulturae,2000,84(3):365-371.
[24] ZHANG W M(张卫明),XIAO ZH CH(肖正春),ZHANG G L(张广伦),etal.Study on ecotype ofApocynumin Xinjiang and its fiber quality[J].ChineseWildPlantResources(中国野生植物资源),2006,25(4):33-37(in Chinese).
[25] REN Y P(任玉平),ZHANG J L(张江玲),YANG G(扬 刚),etal.Survey of wild hemp resource in the two rivers valley of Tarim Basin on Xinjiang[J].PrataculturaScience(草业科学),2008,25(4):37-41(in Chinese).
[26] LIU Q T(刘起棠),XIAO ZH CH(肖正春),ZANG W M(张卫明),etal.Quality evaluation of Gaubau Kender tea[J].ChineseWild PlantResources(中国野生植物资源),2010,1:18-20(in Chinese).

