海虾虾青素的提取工艺及含量测定
陈西广,康中一,冷江昊,黎体民
(1.中国海洋大学海洋生命学院,山东 青岛 266003;2.山东省青岛第二中学,山东 青岛 266061)
海虾虾青素的提取工艺及含量测定
陈西广1,康中一2,冷江昊2,黎体民2
(1.中国海洋大学海洋生命学院,山东 青岛 266003;2.山东省青岛第二中学,山东 青岛 266061)
以新鲜海虾为材料,采用单因素实验研究了提取溶剂、料液比、提取温度、提取时间、提取次数对虾青素提取效果的影响,用紫外可见分光光度法测定了不同部位虾青素的含量,比较了煮熟虾壳与新鲜虾壳中虾青素的含量变化。结果表明,乙酸乙酯是提取虾青素的最适溶剂,最佳提取条件是:料液比1∶2(g∶mL)、提取温度60℃、提取时间3h、提取2次。虾壳中虾青素含量最高,煮熟后虾壳中虾青素含量明显降低。
海虾;虾青素;提取工艺;含量测定;紫外可见分光光度法
在螃蟹和虾等水生甲壳生物的真皮层中分布着大量的、多数呈青黑色的色素,因此新鲜虾蟹一般呈青色。其中的虾青素(又称虾红素、虾黄素等)本身为鲜红色,平时与其它色素及蛋白质结合在一起,不能显示红色。加热煮熟后,螃蟹和虾等水生甲壳生物真皮层中的大多数色素被破坏,其结合蛋白质也会变性分离,而虾青素性质相对稳定,仅有少量分解,于是呈现出红色[1-4]。
虾青素是一种酮式类胡萝卜素,化学名称为3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素,化学结构为:
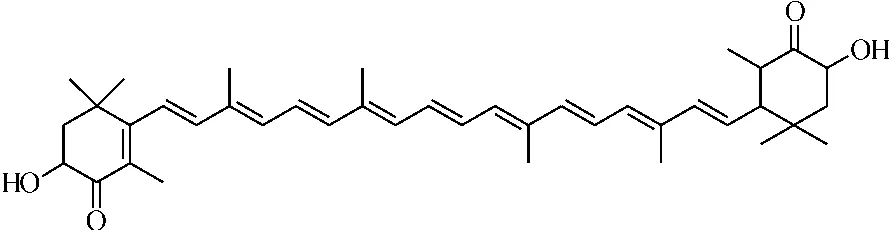
从20世纪80年代开始,人们对虾青素的生物学功能进行了研究,发现其具有许多重要的生理功能,安全性好,因此越来越受到人们的关注。例如,虾青素具有极强的色素沉积能力,陈晓明等[5]研究了富含虾青素酵母对金鱼体色的影响。余俊欣等[6]对室内养殖所致白虾体色素不足进行了研究,发现在幼虾饲料中添加虾青素可达到增色效果。
虾青素是萜烯类共轭长链抗氧化剂[7],具有强抗氧化功能。di Mascio等[8]研究发现虾青素具有强猝灭分子氧的能力,Miki等[9]证明了虾青素抗氧化能力超过维生素E。体外细胞培养实验证明,虾青素具有高免疫调节活性,能明显增强机体局部和全身免疫力[10]。活体实验显示,虾青素能使小鼠增强白介素-1和肿瘤坏死因子α的释放,具有抗机体炎症和抗肿瘤作用[11]。Tanaka等[12]发现服用虾青素可明显降低小鼠膀胱癌的发生率以及大鼠口腔癌。此外,虾青素还可能具有保护心血管及中枢神经系统的作用。
作者以新鲜海虾为原料,探讨了虾青素提取工艺,并比较了不同部位虾青素的含量。
1 实验
1.1 材料与仪器
鲜海虾,市售;虾青素标样。
紫外可见分光光度计,上海精密科学仪器厂。
1.2 虾壳中虾青素的提取
将市售鲜海虾进行剥壳分离,整个虾体分为虾壳、虾头和虾腹3部分。虾壳中虾青素的提取工艺流程见图1。

图1 从虾壳中提取虾青素的工艺流程Fig.1 Extraction process of astaxanthin from shrimp shells
虾壳软化:新鲜海虾剥壳去肉洗净,用热风吹干(控制温度低于80℃),称量;将干虾壳用2mol·L-1醋酸浸泡10h。过滤,用清水洗至中性,干燥。
除去蛋白质:将软化干燥的虾壳用粉碎机粉碎,过150目筛,在pH值2.5、温度50℃条件下用胃蛋白酶水解2h,除去蛋白质,抽滤,水洗滤渣至中性,于50℃下真空干燥。
浸泡提取:称取一定量的去蛋白虾壳粉,转入蒸馏烧瓶中,加入适量体积的溶剂,搅拌,控制一定温度浸提一定时间,过滤,去渣,冷却,得虾青素提取液。
1.3 虾头部、虾腹部中虾青素的提取
虾头部、虾腹部中虾青素的提取方法同1.2,只是去掉第一步虾壳的软化,直接进行第二步。
1.4 虾青素标准曲线的绘制
标准溶液的配制:精密称取20mg虾青素标样,用少量乙酸乙酯溶解,并转移至容量瓶中,定容至100 mL,得浓度为200mg·L-1的标准溶液。使用时用乙酸乙酯稀释成20mg·L-1、16mg·L-1、12mg· L-1、10mg·L-1、8mg·L-1、6mg·L-1、4mg· L-1、2mg·L-1等一系列浓度的虾青素标准溶液,分别在虾青素乙酸乙酯溶液的最大吸收波长474nm处测定吸光度。以虾青素浓度为横坐标、吸光度为纵坐标作图,绘制虾青素标准曲线。
1.5 单因素实验
1.5.1 提取溶剂的选择
称取2.0g经过处理的虾壳粉6份,分别加入10 mL乙醇、丙酮、石油醚、乙酸乙酯、异丙醇、二氯甲烷,常温下浸泡提取2h,旋蒸浓缩后干燥,溶解于10mL石油醚中,在虾青素石油醚溶液的最大吸收波长468 nm处测定吸光度。
1.5.2 提取溶剂用量的选择
称取1.5g经过处理的虾壳粉5份,分别加入乙酸乙酯1.5mL、3.0mL、4.5mL、6.0mL和7.5mL[即料液比(g∶mL,下同)为1∶1、1∶2、1∶3、1∶4、1∶5],常温下浸泡提取2h,旋蒸浓缩后干燥,将溶液浓缩至相同体积,在474nm处测定吸光度。
1.5.3 浸泡提取温度的确定
称取1.5g经过处理的虾壳粉8份,加入3.0mL乙酸乙酯,分别置于20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃的水浴中,浸泡提取3h,快速冷却至室温过滤,测定吸光度。
1.5.4 浸泡提取时间的确定
称取1.5g经过处理的虾壳粉5份,加入3.0mL乙酸乙酯,分别在60℃水浴中浸泡提取1h、2h、3h、4h、5h,快速冷却至室温过滤,测定吸光度。
1.5.5 最适提取次数的选择
称取1.5g经过处理的虾壳粉3份,加入3.0mL乙酸乙酯,60℃浸泡提取3h,快速冷却至室温过滤;滤渣重新加入3.0mL乙酸乙酯,重复提取4次,分别在474nm处测定吸光度。
1.6 不同部位虾青素含量的测定
分别称取干燥后的虾壳粉1.5g、虾头部5.0g、虾腹部25.0g,按照单因素实验得到的最优条件浸泡提取虾青素,合并提取液,减压浓缩至2mL,测定吸光度,由标准曲线计算虾青素含量。
1.7 煮熟虾壳中虾青素含量的测定
煮熟后虾壳中虾青素提取方法是:首先将新鲜海虾整体煮熟,再进行剥壳分离,只取其中的虾壳,其余步骤同1.2,提取条件采用1.5单因素实验得到的最优条件,由标准曲线计算虾青素含量。
2 结果与讨论
2.1 单因素实验结果
2.1.1 溶剂对提取效果的影响(图2)

图2 溶剂对提取效果的影响Fig.2 Effect of solvents on extraction efficiency
由图2可以看出,不同溶剂的提取效果相差较大,其顺序为:乙酸乙酯>丙酮>异丙醇>二氯甲烷>乙醇>石油醚。其中,乙酸乙酯的提取效果最好,故选择适宜的溶剂为乙酸乙酯。
2.1.2 料液比对提取效果的影响(图3)
由图3可以看出,当料液比从1∶1变化为1∶2时,即随着溶剂乙酸乙酯用量的增加,提取的虾青素含量有较大提高;而继续增加溶剂用量时,虾青素含量提高不大。故选择适宜的料液比为1∶2。
2.1.3 提取温度对提取效果的影响(图4)
由图4可以看出,当提取温度较低时,随着提取温度的升高,吸光度逐渐增大,60℃时吸光度最大;之后随着提取温度的升高,吸光度逐渐减小,提取温度越高下降越快。在50~70℃之间吸光度变化较缓慢。故选择适宜的提取温度为60℃。

图3 料液比对提取效果的影响Fig.3 Effect of solid-liquid ratio on extraction efficiency

图4 提取温度对提取效果的影响Fig.4 Effect of extraction temperature on extraction efficiency
2.1.4 提取时间对提取效果的影响(图5)
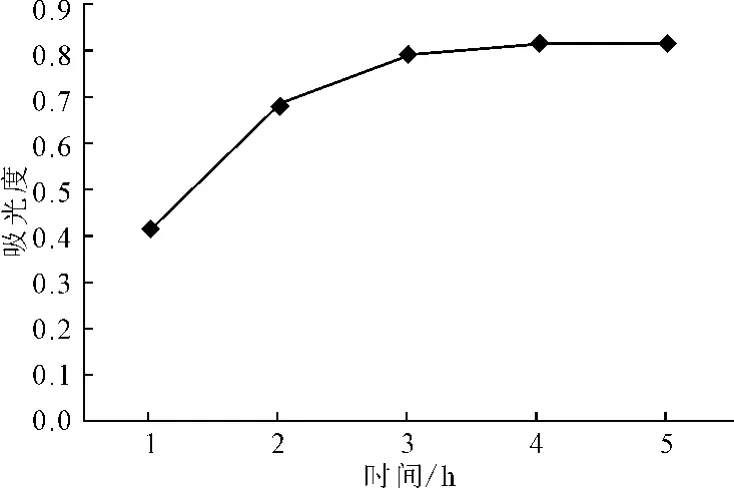
图5 提取时间对提取效果的影响Fig.5 Effect of extraction time on extraction efficiency
由图5可以看出,随着提取时间的延长,提取液的吸光度显著增加,3h后增加缓慢。故选择适宜的提取时间为3h。
2.1.5 提取次数对提取效果的影响
取3份虾壳样品A、B、C,以乙酸乙酯重复提取4次,测定吸光度,结果如表1所示。
由表1可知,虾壳经过第1、2次乙酸乙酯提取后,95%以上的虾青素已经被提取出,第3、4次提取得到的虾青素很少,综合考虑,提取2次较适宜。

表1 提取次数对提取效果的影响Tab.1 Effect of extraction times on extraction efficiency
综上,确定从虾壳中提取虾青素的适宜条件为:以乙酸乙酯为溶剂,料液比为1∶2(g∶mL),在60℃下提取3h,重复提取2次。在此工艺条件下,可得到较好的提取效果,获得较好的经济效益。
2.2 各部位虾青素含量的测定结果(表2)

表2 虾不同部位的虾青素含量Tab.2 Astaxanthin content in different parts of shrimp
从表2可知,虾青素在虾壳中含量最高,头部也含有一定量的虾青素,而腹部几乎不含,这也解释了为什么煮熟的虾的腹部一般不显红色的原因。
2.3 煮熟后虾壳中虾青素含量的测定结果
煮熟后虾壳的乙酸乙酯提取液在474nm测定吸光度并计算虾青素含量,结果如表3所示。

表3 新鲜虾壳与煮熟虾壳中虾青素含量比较Tab.3 Comparison of astaxanthin contents in fresh and cooked shrimp shell
由表3可知,新鲜海虾虾壳的虾青素含量高于煮熟的海虾,原因是高温会破坏部分虾青素,导致虾青素含量下降。
3 结论
对海虾虾青素的提取条件、虾各部位虾青素的含量、煮熟后虾壳中虾青素的含量变化等进行了探讨。结果表明,乙酸乙酯是适宜的提取溶剂,最佳提取条件为:料液比1∶2(g∶mL)、提取温度60℃、提取时间3h、提取2次。在虾头、虾壳和虾腹各部位中,虾壳的虾青素含量最高,腹部几乎不含虾青素。煮熟后的海虾虾壳中虾青素含量明显降低,说明高温会破坏虾青素,这对于虾青素的高效提取分离收集具有指导性意义。
[1] 董玉华,赵元凤.虾青素的生物学来源和功能的研究进展[J].水产科学,2005,24(10):50-52.
[2] 张影霞,武利刚,罗志辉,等.虾青素的提取及其稳定性的研究[J].现代食品科技,2008,24(12):1288-1291.
[3] 许培雅,章银军.虾壳虾青素提取工艺的研究[J].粮食与饲料工业,2003,(2):27-28,34.
[4] SACHINDRA N M,BHASKAR N,MAHENDRAKAR N S.Recovery of carotenoids from shrimp waste in organic solvents[J].Waste Manage,2005,26(10):1092-1098.
[5] 陈晓明,徐学明,金征宇.富含虾青素的法夫酵母对金鱼体色影响[J].中国水产科学,2004,11(1):70-73.
[6] 余俊欣,黄美莹,刘文御.饲料中的还原虾红素对白虾体色素的影响[J].水产研究(台湾),2003,11(112):57-65.
[7] LIM B P,NAGAO A,TERAO J,et al.Antioxidant activity of xanthophylls on peroxyl radical-mediated phospholipid peroxidation[J].Biochim Biophys Acta,1992,1126(2):178-184.
[8] di MASCIO P,DEVASAGAYAM T P,KAISER S,et a1.Carotenoids,tocopherols and thiols as biological singlet molecular oxygen quenchers[J].Biochem Soc Trans,1990,18(6):1054-1056.
[9] MIKI W,HOSODA K,KONOD K,et al.Astaxanthin-containing drink:JP,10155459[P].1998-06-16.
[10] ARAKANE K.Superior skin protectionviaastaxanthin[J].Camtenoid Science,2002,5:21-24.
[11] JYONOUCHI H,SUN S,MIZOKAMI M,et al.Effects of various carotenoids on cloned,effector-stage T-helper cell activity[J].Nutr Cancer,1996,26(3):313-324.
[12] TANAKA T,MORISHITA Y,SUM M,et al.Chemoprevention of mouse urinary bladder by the naturally occurring carotenoid astaxanthin[J].Carcinogenesis,1994,15(1):15-19.
Extraction Technology and Content Determination of Astaxanthin in Shrimp
CHEN Xi-guang1,KANG Zhong-yi2,LENG Jiang-hao2,LI Ti-min2
(1.College of Marine Life,Ocean University of China,Qingdao 266003,China;
2.Qingdao No.2 Middle School of Shandong Province,Qingdao 266061,China)
The astaxanthin was extracted from fresh shrimp.The effects of extraction solvent,solid-liquid ratio,extraction time,extraction temperature and extraction times on astaxanthin extraction efficiency were investigated by single factor experiment.And the astaxanthin contents of different parts of shrimp were measured by UV-Vis spectrophotometry,the astaxanthin contents in fresh and cooked shrimp shell were compared.The results showed that,ethyl acetate was the most suitable solvent,the optimal extraction conditions were as follows:extracting for 3heach time at 60℃with solid-liquid ratio of 1∶2(g∶mL),extracting twice.The highest astaxanthin content was in shrimp shell.The astaxanthin content decreased obviously in cooked shrimp shell.
shrimp;astaxanthin;extraction technology;content determination;UV-Vis spectrophotometry
TQ 914.2
A
1672-5425(2015)01-0046-04
中国海洋大学—青岛二中“起航计划”资助项目
2014-09-27
陈西广(1963-),男,山东曹县人,博士,教授,博士生导师,研究方向:生物化学、海洋生物,E-mail:xgchen@ouc.edu.cn。
10.3969/j.issn.1672-5425.2015.01.011

