从光学显微镜到光学“显纳镜”
李 焱 龚旗煌
(北京大学物理学院,北京 100871)
光学显微镜(optical microscope)在生物学和医学等众多科学技术以及生产领域发挥着重要作用.16世纪至18世纪细胞等生物学和医学的重大发现几乎都与显微镜的重要改进分不开.进入20世纪,光学显微镜又有重要突破,分辨能力进入纳米尺度[1-7].2014年获得诺贝尔化学奖的超分辨荧光显微镜,已是名副其实的“显纳镜”(nanoscope).
1 光学显微镜的原理
显微镜的发明,大大提升了人类的观察能力,打开了人类认识微观世界的大门.人类感官接收的外部信息中,约90%以上通过眼睛传递给大脑.眼睛看见物体形成视觉的过程可以简化成以下几步(见图1):来自物体的光穿过角膜和瞳孔到达晶状体后折射,折射光线穿过玻璃体在视网膜上形成像,再经视神经传导至大脑视觉中枢形成视觉.其中黄斑附近视神经最发达,所以眼睛观察物体时,通常将成的像调节到黄斑附近.由于瞳孔和晶状体大小有限,而且感光细胞也有一定大小,当两个物点距离太近时,形成的像斑重叠或落在同一感光细胞上时,眼睛便不能分辨.一般人眼的正常角分辨率为1′,对于眼睛敏感的绿光,两个物点在1m处间隔大于0.3mm才能分辨清楚,亦即在明视距离(25cm)处两个物点的间距要大于0.08mm才能分辨清楚.因此,人眼要看清整个长度仅为0.21mm的柄翅卵蜂等微小物体是极其困难的,但借助显微镜却能做到.
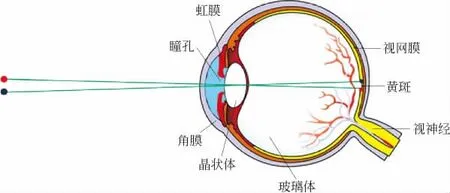
图1 眼睛成像示意图
显微镜的使用已有400多年的历史.16世纪,欧洲的眼镜业已经很发达,放大镜广泛使用,磨镜技术大大提高,为显微镜的出现奠定了基础.1590年,荷兰和意大利的眼镜制造者已经制造出类似显微镜的放大仪器.1610年前后,意大利的伽利略和德国的开普勒在研究望远镜的同时,改变物镜和目镜之间的距离,得出合理的显微镜光路结构,当时的光学工匠纷纷从事显微镜的制造、推广和改进.
光学显微镜的成像系统主要由靠近物体的物镜和靠近眼睛的目镜组成,如图2所示.被观察物体位于物镜的前焦点外侧附近,经物镜成一倒立的实像于目镜前焦点内侧附近,这个中间像经目镜成一放大虚像于明视距离处.常规显微镜最大有效放大倍率接近500倍,分辨能力提升到亚微米.人们借助显微镜可以“看见”微米量级的微小物体.
2 光学显微镜的组成

图2 光学显微镜成像原理图
17世纪中叶,英国的罗伯特·胡克(Robert Hooke)和荷兰的列文虎克(Anton van Leeuwenhoek)对显微镜的发展作出了卓越的贡献.1665年前后,胡克在显微镜中加入粗动和微动调焦机构、照明系统和承载标本片的工作台.这些部件经过不断改进,成为现代显微镜的基本组成部分.常见的光学显微镜一般由载物台、聚光照明系统、物镜和目镜组成的成像系统和调焦机构组成.早期的光学显微镜只是光学元件和精密机械元件的组合,它以人眼作为接收器来观察放大的像.后来在显微镜中加入了摄影装置,以感光胶片作为可以记录和存储的接收器.现代又普遍采用光电元件、电视摄像管和电荷耦合器等作为显微镜的接收器,配以微型电子计算机后构成完整的图像信息采集和处理系统,如图3所示.
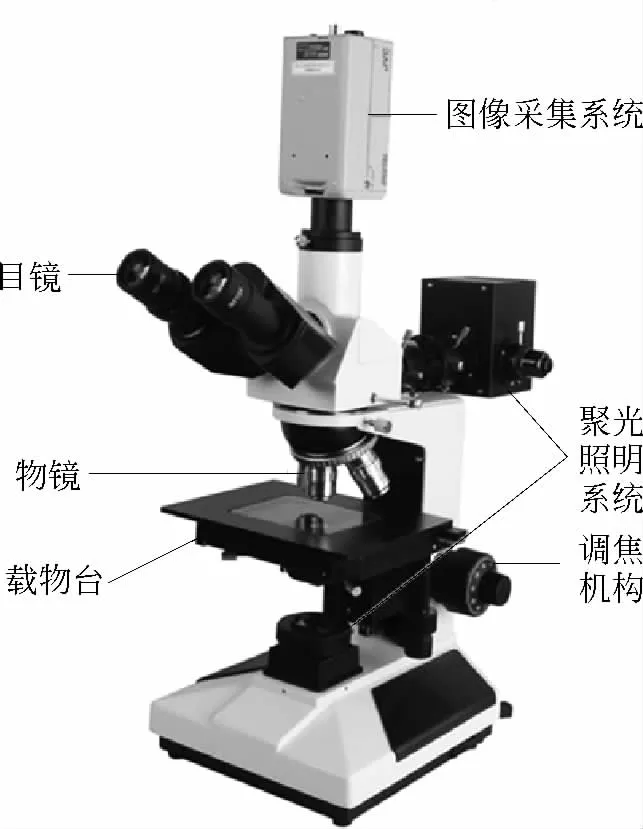
图3 光学显微镜的组成
3 光学显微镜对生物学发展的推动作用
显微镜的发明极大地促进了生物学和医学等学科的发展.1665年,胡克利用显微镜观察软木的木栓组织上的微小气孔,并命名为“细胞”.图4为胡克显微镜.
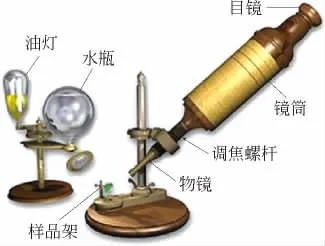
图4 胡克显微镜
1674年,列文虎克发现了原生动物,并随后发现了“细菌”,创建微生物学,他还发明了高倍物镜的研磨和抛光方法,被称为“显微镜之父”.1833年,布朗 (Brown)通过显微镜观察紫罗兰,随后发表了对“细胞核”的详细论述.1857年,寇利克(Kolliker)发现了细胞中的“线粒体”.1879年,佛莱明 (Flemming)发现了动物细胞进行有丝分裂时,其清晰可见的染色体活动过程.人们借助显微镜逐渐描绘出细胞的结构,植物叶肉细胞的立体结构模型如图5所示.
1888年,以卡嘉尔(Cajal)为首的组织学家发展出显微镜染色观察法,为显微解剖学奠定了基础.1932年,泽尼克(Zernike)发明出相衬显微镜,可以直接观察活细胞和未染色标本,他为此在1953年获得了诺贝尔物理学奖.1952年,诺马斯基(Nomarski)发明了微分干涉相衬光学显微镜,能显示细胞等立体影像.1988年,共焦扫描显微镜投入使用,不仅可以用于观察细胞形态,也可以用于进行细胞内生化成分的定量分析和实现长时间活细胞动态观察.1990年,发展了非线性光学多光子显微成像技术,可以获得生物细胞、活组织的长时间动态三维成像.
4 阿贝衍射极限
虽然光学显微镜发展迅速,但是人们继续提高常规光学显微镜分辨能力却遇到了不可逾越的障碍,常规光学显微镜不能分辨病毒或比其更小的东西,这是受到阿贝衍射极限的限制,如图6所示.由于衍射的存在,物镜、眼睛等无法把光线汇聚成无限小的点,而只会在像平面上形成有限大小的艾里斑(中心是很亮的斑,外围是明暗相间的环).光学仪器成像过程中,是把物平面上的无数微小的点转换成艾里斑,然后再把它们叠加起来呈现在像平面上.
艾里斑的大小与光学系统有关,而能分辨的最小细节由瑞利判据决定.假如物平面上有两个点,通过一个光学成像系统后产生两个艾里斑.当这两个点离得较远时,像平面上的艾里斑也会离得较远——此时我们可以很容易地分辨出物平面上有两个点.如果把两个点逐渐移近,艾里斑也会随之接近.当这两个艾里斑接近到一个圆斑中心与另一个圆斑边缘重合的时候,我们达到能够分辨出有两个点的极限(这就叫瑞利判据).如果这两点再接近,像平面上的两个艾里斑互相重叠在一起,实际看起来成为一个圆斑,那物平面上的两个点就不能分辨了,如图7所示.早在1872至1873年,阿贝(Ernst Abbe)通过分析指出,在常规光学显微镜中,恰能分辨时两点的距离约为半波长.可见光中波长最短的蓝光波长约400nm,这意味着光学显微镜能分辨出的物体最小距离约0.2μm(200nm).因此0.2μm 成为光学显微镜能够达到的最高分辨率,也就是我们通常所说的阿贝衍射极限.细胞的许多内部结构以及大部分病毒的尺寸,都在200nm左右或者更小,常规光学显微镜就无能为力了.

图7 阿贝衍射极限示意图
5 光学“显纳镜”—超分辨荧光显微镜
为了绕开阿贝衍射极限的限制,很多人选择了其他显微技术,利用光学近场扫描技术或非线性光学方法,或使用波长极短的电子显微镜(分辨率能达到0.2nm),但是这些方法不利于活体生物样品大视角远场实时观察.2014年获得诺贝尔化学奖的埃里克·贝齐格、斯特凡·黑尔和威廉·莫纳(图8)独辟蹊径,突破阿贝衍射极限,将分辨能力提升到纳米量级,实现了超分辨荧光显微技术,又大大推动了生物学和医学的发展.

图8 获得2014年诺贝尔化学奖的3位科学家
超分辨率荧光显微镜利用了荧光分子的发光特性.荧光分子能够吸收一种波长的光,放射出另外一种波长的光.荧光分子有一定的寿命,其持续发光一段时间后,将不能继续发光.荧光分子可以是荧光蛋白质分子,也可以是有机分子.
在莫纳之前,人们观测荧光分子时都是同时观测到几百万甚至几千万个分子,得到的结果是其平均统计结果.而莫纳是第一个能够探测单个荧光分子的人,在1989年,那是一项伟大的成就.能够探测并观察单个荧光分子对于超分辨率显微镜极其重要,并启发大量化学家将他们的注意力转向单分子研究,其中一位便是埃里克·贝齐格.虽然单个荧光分子成像后也是一个0.2μm的爱里斑,但是在没有其他分子存在的情况下,它的中心位置可以通过大量统计而精确地定位,定位精度能可以达到1nm.
莫纳的另一个贡献是发现了像控制电灯泡一样方便地控制荧光蛋白发光的方法即光激活(photoactivation).1997年,莫纳来到加州大学圣迭戈分校,后来被授予诺贝尔奖.绿色荧光蛋白技术的发明人钱永健也在这里任职.钱永健从水母体内分离出发绿色荧光的蛋白,其重要意义在于它能够让活体生物体内细胞的其他蛋白质同样变得可见.运用基因技术,科学家们将这些微小的绿色荧光蛋白与其他类型的蛋白进行结合.这样,利用绿色荧光作为标记,科学家们便能知道那些被标记的蛋白质在生物体内所处的位置.莫纳注意到一种绿色荧光蛋白分子,其荧光可以被随意地开启或关闭.当用波长488nm的光激发这一蛋白质时,它开始发出荧光,但过一会之后它就熄灭了.此后不管再使用多少光去照射它,这个蛋白质的荧光都已经死了.然而如果使用波长为405nm的光去照射它,这个蛋白质又能再次复活并发出荧光.当该蛋白质被再次激活,它会再次发出波长为488nm的荧光.莫纳将这些可以被光激活的蛋白质均匀分散到一种凝胶中,这样其单个分子之间的距离就能大于阿贝衍射极限所限定的0.2μm的长度.由于这些分子被分散开来,一台常规的光学显微镜便可以区分来自单个分子发出的荧光——它们就像是带着开关的微小灯泡.这一发现显示了通过光学手段操控单个分子荧光的可能性,解决了两年多一直困扰着埃里克·贝齐格的问题.
贝齐格发明的超分辨率显微镜叫光激活定位显微镜(PALM:PhotoActivated Localization Microscopy),利用了莫纳发现的光激活方法.贝齐格利用微弱的405nm激光照射样品,使得其中极小部分荧光分子能够发出荧光.由于这些发光的荧光分子很稀疏从而相距较远,它们的位置能够精确地确定下来.等这些分子失去活性后,再次照射405nm激光而激活另一小部分荧光分子.重复这个过程即可将样品中的所有分子定位出来,从而得到整个样品的图像,其原理如图9所示.
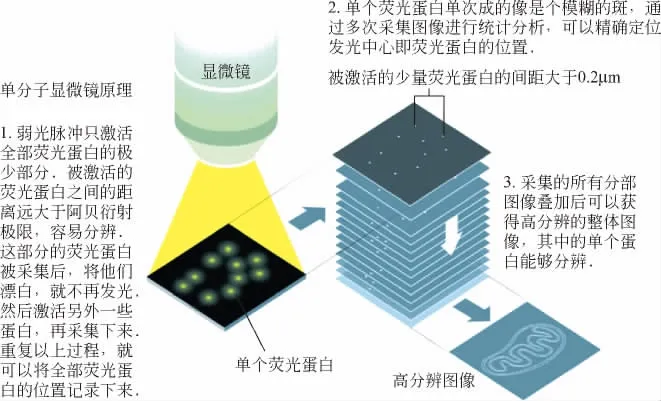
图9 单分子荧光显微原理
溶酶体膜的光激活定位显微镜成像与传统光学显微镜成像的比较如图10所示,可以看出超分辨光激活定位显微镜确实是“显纳镜”.
几乎与贝齐格2006年发明PALM同时,哈佛大学化学系与物理系的华人教授庄小威也独立发明了另一种超分辨率显微镜-随机光学重构显微镜 (STORM:STochastic Optical Reconstruction Microscopy).PALM和STORM这两种显微技术不仅同年,而且原理也基本一致.不同之处在于贝齐格利用的是光激活蛋白,而庄小威使用的是有机荧光分子对.图11是常规显微镜和STORM显微镜拍摄的线粒体图像.

图10 溶酶体膜的显微成像
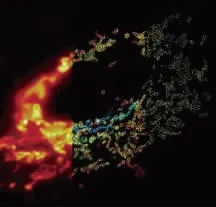
图11 一个细胞中的线粒体
黑尔发明的受激发射损耗(STED:STimulated Emission Depletion)显微技术,直接实现对点扩展函数的调制,能够实现更快的成像速度,对荧光染料依赖程度低,因此备受关注.科学家们利用受激发射原理可以冷却荧光分子,即将一束特定激光束对准一个荧光分子,后者立即失去能量并变得黯淡.1994年,黑尔提出了受激发射损耗显微技术的设想,计划采用一束激光来激发所有的荧光分子,随后利用另外一束激光让所有分子荧光熄灭——那些位于中心位置上纳米尺度空间内的荧光分子除外.当进行记录时则只记录下这一纳米部分.让这一光束扫过整个样品表面,并连续记录光强信息,就有可能得到一张整体图像.每次允许发出荧光的空间区域越小,最后得到的图像分辨率便越高.于是,从原理上说,对于光学显微成像的极限再也不复存在了,如图12所示.
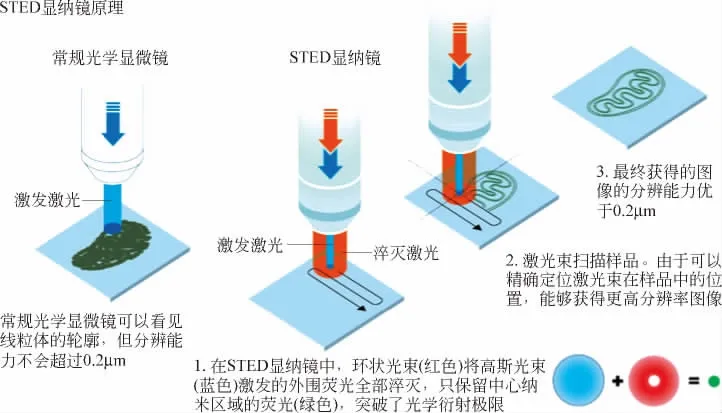
图12 受激发射损耗显微原理
多年以后这项理论才得以在实践中被证实.在那段时间里,黑尔一边继续科研工作,一边四处奔走筹集科研经费.2000年,他证明了自己的技术方法在实际工作中是可行的.当时他对大肠杆菌进行了拍摄,其分辨率是此前任何光学显微镜都未能达到过的(图13).
图14是常规显微镜和受激发射损耗显微镜拍摄的一个人类脑瘤样本的对比图像,不难看出超分辨受激发射损耗显微技术的巨大优势.
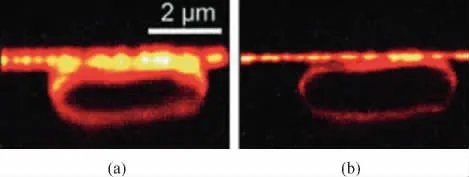
图13 第一张由黑尔使用受激发射损耗显微技术拍摄的大肠杆菌图像
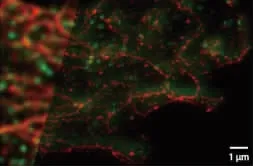
图14 一个人类脑瘤样本
6 结语
超分辨荧光显微技术是物理思想、化学方法、光学技术和分子探针相结合的产物,大大提高了人们认识微观世界的能力,光学显微镜进入了“显纳镜”时代,并在众多领域得到了广泛应用.光学显微镜不断带动许多学科的发展,现在的功能越来越强,也必将继续促进科学技术和社会进步.
[1]谷祝平.光学显微镜[M].兰州:甘肃人民出版社,1985.
[2]光学显微镜网站:http://micro.magnet.fsu.edu/primer/index.html
[3]毛峥乐,王琛,程亚.超分辨远场生物荧光成像 -突破光学衍射极限[J].中国激光,2008,35(9):1283-1307.
[4]李明.超分辨显微,至极至美:2014年诺贝尔化学奖述评[J].物理,2014,43(12):813-816.
[5]2014年诺贝尔化学奖网站和相关文献:http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2014/
[6]顾牡,王青.有光的日子—— 写在2015国际光年 [J].物理与工程,2015,25(1):封2.
[7]钟锡华 .光,你这个精灵 [J].物理与工程,2015,25(1):14-19.

