香菇菌糠对绿色木霉防治黄瓜枯萎病的增效作用
谷祖敏, 周 飞, 毕 卉, 李宝聚, 张 兵, 田小颖
(1.沈阳农业大学植物保护学院,沈阳 110161;2.中国农业科学院蔬菜花卉研究所,北京 100081)
香菇菌糠对绿色木霉防治黄瓜枯萎病的增效作用
谷祖敏1, 周 飞1, 毕 卉1, 李宝聚2*, 张 兵1, 田小颖1
(1.沈阳农业大学植物保护学院,沈阳 110161;2.中国农业科学院蔬菜花卉研究所,北京 100081)
试验以栽培香菇剩余的菌糠为原料,采用室内抑菌试验和盆栽试验相结合的方法探讨了香菇菌糠对绿色木霉防治黄瓜枯萎病的增效作用。菌糠提取液对绿色木霉菌丝生长和孢子萌发表现促进作用,促进率分别为18.20%和9.82%;对黄瓜枯萎病菌菌丝生长和孢子萌发表现抑制作用,抑制率分别为11.85%和87.78%。香菇菌糠与木霉混合使用对黄瓜枯萎病的防效达70.26%,黄瓜的地上部分鲜重和根重分别增加了65.06%和58.10%。与单用木霉相比,加入香菇菌糠后绿色木霉在土体土、根际土和根系中定殖数量分别提高了251.39%、208.21%和104.76%,黄瓜枯萎病菌数量分别减少了56.98%、77.72%和76.83%。
菌糠; 绿色木霉; 黄瓜枯萎病; 生物防治
黄瓜枯萎病是由半知菌亚门尖孢镰刀菌黄瓜专化型(Fusarium oxysporum f.sp.cucumerinum)侵染引起的维管束病害。在露地和保护地栽培黄瓜上均可发生,发病率一般为10%~30%,重茬地严重时可达80%~90%[1]。木霉生长繁殖速度快,能迅速占领空间,竞争养分,可分泌抗生物质抑制病原菌的生长,对植物病原菌具有重寄生作用,被认为是极有价值的植病生防因子[2]。但木霉单独使用时因受环境的影响其生存能力和定殖能力较弱,从而影响其生物活性的发挥,使其生防效果的稳定性和持久性均较差[3-4]。近年来一些研究将木霉与优质有机肥结合起来使用,使其在植物的土传病害防治和植株生长方面有一定的积极促进作用[5-6]。菌糠是利用农业秸秆、木屑等原料进行食用菌栽培,出菇后的培养基剩余物。菌糠富含蛋白质、多糖和矿物质,将其与生防菌混合使用,将会改善田间土壤环境,促进拮抗菌的生存和定殖,提高拮抗菌防治病害的效果。
本文通过室内抑菌测定和盆栽试验,探索香菇菌糠与绿色木霉混合使用对黄瓜枯萎病的发生以及对黄瓜植株生长的影响,为进一步研发拮抗菌强化的微生物有机肥、预防和控制蔬菜土传病害提供理论依据。
1 材料与方法
1.1 试验材料
供试菌株:生防菌株为绿色木霉(Trichoderma viride)TR-8;致病菌株为尖孢镰刀菌黄瓜专化型(Fusarium oxysporum f.sp.cucumerinum),均由沈阳农业大学农药学试验室提供。
供试菌糠:香菇菌糠由辽宁省农业科学院食用菌研究所提供。
供试黄瓜种子:‘荷兰M6’。
供试培养基:马铃薯培养基(PDA)(马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 m L)用于培养绿色木霉和黄瓜枯萎病菌;玉米粉沙土培养基(玉米粉∶沙土∶水=1∶1∶0.8)用于盆栽试验中扩繁黄瓜枯萎病菌接种物;麦麸稻壳玉米粉培养基(麦麸∶稻壳∶玉米粉=6∶1.5∶2.5,水适量)用于盆栽试验中扩繁绿色木霉接种物;镰刀菌选择性培养基:KH2PO41.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,Fe-Na-EDTA 0.01 g,L-天门冬酰胺2.0 g,D-半乳糖20.0 g,蒸馏水1 000 m L,Na2B4O7·10H2O 1.0 g,硫酸链霉素0.3 g,用于镰刀菌的选择性培养;孟加拉红培养基用于木霉的培养。
供试土壤:草炭土和蛭石1∶1混合作为育苗土;消毒菜园土、草炭土、蛭石按4∶1∶1作为移栽土壤。
1.2 香菇菌糠提取液的制备
将香菇菌糠粉碎,称取50 g样品放入三角瓶中,加无菌水500 mL,常温振荡浸泡24 h,8层纱布过滤,滤液用细菌过滤器(d=0.22μm)过滤,加无菌水定容至500 mL,获得100 mg/mL菌糠提取液,然后用无菌水依次稀释至50.25、12.5和6.25 mg/m L。
1.3 香菇菌糠提取液对绿色木霉和黄瓜枯萎病菌菌丝生长的影响
采用菌丝生长速率法进行测定。分别取1 mL不同浓度菌糠提取液加到培养皿中,然后加入融化后冷却至40℃左右的PDA培养基,充分混合均匀。凝固后,在平板中央分别接种黄瓜枯萎病菌和绿色木霉菌饼(d=0.5 cm),以加无菌水为对照,每个处理3次重复。处理后置于25℃恒温箱中培养,3 d后测量绿色木霉菌落直径,7 d后测量枯萎病菌菌落直径,计算菌丝生长抑制率。菌丝生长抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
1.4 香菇菌糠提取液对绿色木霉和黄瓜枯萎病菌孢子萌发的影响
分别取20μL绿色木霉和黄瓜枯萎病菌分生孢子悬浮液滴于凹玻片上,然后分别加入20μL不同浓度的菌糠提取液,混匀后25℃保湿培养24 h,显微镜下测定孢子萌发率,以加等量无菌水的处理作为空白对照,计算孢子萌发抑制率,每个处理3次重复。孢子萌发抑制率(%)=(对照孢子萌发率-处理孢子萌发率)/对照孢子萌发率×100。
1.5 盆栽试验测定香菇菌糠对绿色木霉防治黄瓜枯萎病和促进植株生长的影响
黄瓜枯萎病菌接种物的制备 黄瓜枯萎病菌接种至PDA平板中,25℃培养7 d,从菌落边缘打取菌饼(d=0.5 cm),然后将菌饼接种至装有玉米粉沙土培养基的三角瓶中,每瓶接种4个菌饼,25℃恒温培养14 d,待培养基表面长满菌丝后,将含菌丝的培养基取出,作为病原菌接种物备用。
绿色木霉接种物的制备 绿色木霉接种至PDA平板中,25℃培养5 d,从菌落边缘打取菌饼(d=0.5 cm),然后将菌饼接种至装有麦麸稻壳玉米粉培养基的三角瓶中,每瓶接种4个菌饼,25℃恒温培养10 d,将培养物过筛,获得绿色木霉分生孢子。
防病盆栽试验 先将绿色木霉分生孢子加入到育苗土中,充分混匀,土壤中木霉孢子浓度为106个/g土,然后将菌糠分别按照3%、6%、9%、12%(质量分数)的比例与育苗土混合,装入育苗盘中,播种事先催芽的黄瓜种子。试验设置2个对照,CKⅠ为单独木霉处理, CKⅡ为空白对照(育苗土中无木霉和菌糠),每个处理5次重复。7 d之后移栽到营养钵(18 cm×12 cm)中,营养钵中装有含4%(质量分数)的黄瓜枯萎病菌接种物的土壤,每钵移栽3株黄瓜幼苗,处理后将营养钵置于温度25℃、相对湿度60%~70%的气候培养箱中,14 d后调查黄瓜发病情况。
防病结果调查 黄瓜枯萎病的分级标准参考柏敏战等的方法[7]。1级,无症状;2级,1片或2片子叶明显变黄,以致脱落;3级,1片或2片真叶变黄或全株发黄,子叶稍萎蔫下垂;4级,全株明显萎蔫或真叶严重变黄,生长受抑制、矮化;5级,全株严重萎蔫以致枯死。按下式计算病情指数和防病效果。病情指数=∑(各级病株数×相应级数)/(调查总株数×最高病级数),防病效果(%)=(对照组病情指数-处理组病情指数)/对照组病情指数×100。同时调查植株生物量,将植株拔出用剪刀沿茎基部剪开,根系洗净、晾干,称重各处理地上部分鲜重(茎和叶)和地下部分鲜重(根系),计算植株生长促进率。促进率(%)=(处理根或茎鲜重-对照根或茎鲜重)/对照根或茎鲜重×100。
1.6 香菇菌糠对绿色木霉和枯萎病菌数量影响的测定
防病盆栽试验结果调查后,每个处理随机抽取3个盆钵,每钵采集3个部位的样品进行木霉和镰刀菌计数。(1)土体土壤采集:将黄瓜根系周围的土体土壤充分混匀后,取100 g混合样品。(2)根际土壤采集:抖落粘在黄瓜根系表面的土壤后,称重根系,按每克根加9 mL无菌水的比例放入装有玻璃珠的试管中,置于涡旋仪上涡旋5 min,洗脱在无菌水中的土壤即为根际土壤。(3)根系采集:取黄瓜根1 g,75%乙醇消毒3 min,无菌水冲洗3次,无菌滤纸吸干后,于灭菌的研钵中研磨成匀浆,加入9 mL无菌水,振荡混匀。
枯萎病菌和木霉计数采用稀释平板法。将土样或根系研磨液稀释至适当浓度,各吸取0.1 m L分别放入镰刀菌选择性培养基和木霉培养基平板中,涂布均匀,于28℃培养3 d,进行菌落计数。
1.7 数据统计分析方法
试验所得数据结果采用DPS 7.05软件进行方差分析,Duncan’s新复极差法(P<0.05)进行显著性检验。
2 结果与分析
2.1 香菇菌糠提取液对绿色木霉和枯萎病菌菌丝生长的影响
由表1可知,香菇菌糠提取液浓度低于12.5 mg/mL时对两种菌生长影响不大,和对照差异不显著。随着菌糠提取液浓度的增加,对绿色木霉和黄瓜枯萎病菌菌丝生长表现出不同的作用,促进了绿色木霉的生长而抑制了黄瓜枯萎病菌的生长,不同浓度之间差异显著。浓度为100 mg/m L菌糠提取液对绿色木霉菌丝生长的促进率为18.20%,对黄瓜枯萎病菌菌丝生长的抑制率为11.85%。
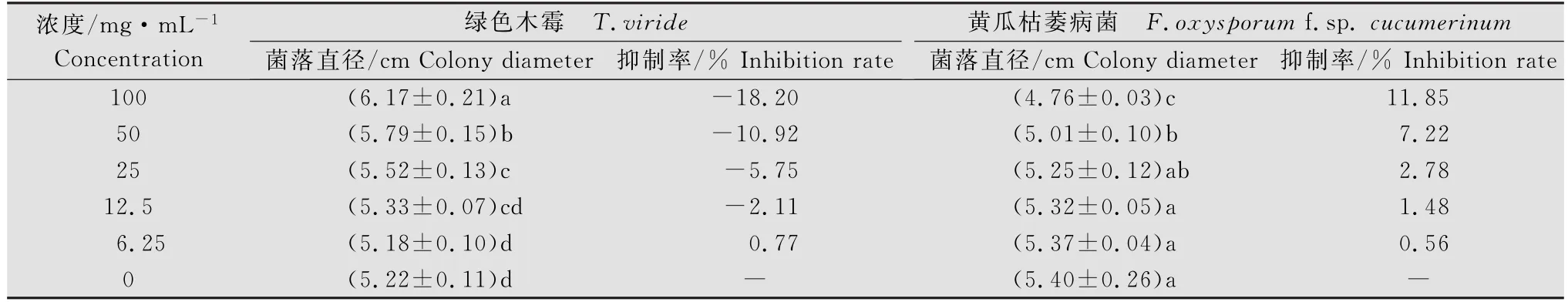
表1 不同浓度香菇菌糠提取液对绿色木霉和黄瓜枯萎病菌菌丝生长的影响1)Table 1 Effect of different concentration extract from mushroom residuum on mycelium growth of Fusarium oxysporum f.sp.cucumerinum and Trichoderma viride
2.2 香菇菌糠提取液对木霉和枯萎病菌孢子萌发的影响
香菇菌糠提取液对绿色木霉和黄瓜枯萎病菌的孢子萌发也表现不同的作用(表2)。低浓度的提取液对绿色木霉孢子萌发基本无影响,提取液浓度的增加不同程度促进了孢子的萌发,浓度为100 mg/mL时对木霉孢子萌发的促进率达9.82%。不同浓度的香菇菌糠提取液对黄瓜枯萎病菌的孢子萌发均有抑制作用,浓度越高抑制作用越强,不同浓度之间抑制作用差异显著。在最高浓度100 mg/mL时对孢子萌发的抑制率高达87.78%。

表2 不同浓度香菇菌糠提取液对绿色木霉和黄瓜枯萎病菌孢子萌发的影响Table 2 Effect of different concentration extract from mushroom residuum on spore germination of Fusarium oxysporum f.sp.cucumerinum and Trichoderma viride
2.3 香菇菌糠对木霉防治黄瓜枯萎病和黄瓜生物量的影响
温室盆栽试验结果显示,育苗时高浓度菌糠的添加对绿色木霉防治黄瓜枯萎病表现显著的增效作用。木霉单独使用时防效仅为45.12%,加入3%菌糠对木霉的防病作用影响较小,与单用木霉相比较,防效差异不显著。随着菌糠浓度加大,木霉的防病作用显著增加,在菌糠浓度为12%时防效达到70.26%,比单用木霉提高了55.72%。
从表3看出,木霉可以明显促进黄瓜根系和植株的生长发育,加入菌糠后这种促进作用显著增加。不同浓度的菌糠和木霉混合对黄瓜幼苗生长的促进作用差异显著。在含有木霉的育苗基质中加入12%的菌糠,地上部分鲜重和地下部分鲜重分别增加了65.06%和58.10%,与单用木霉相比,分别提高了181.04%和204.99%。
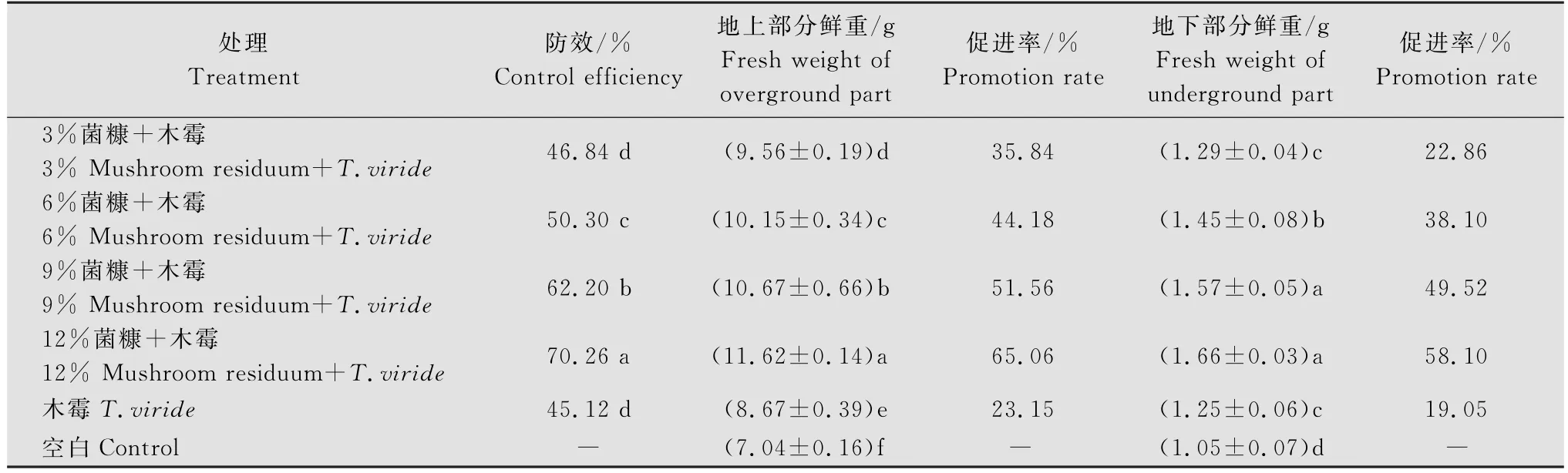
表3 香菇菌糠对绿色木霉防治黄瓜枯萎病和黄瓜生物量的影响Table 3 Effect of mushroom residuum on control efficiency against cucumber wilt and cucumber biomass
2.4 香菇菌糠对木霉和黄瓜枯萎病菌数量的影响
施入菌糠对土壤中生防菌和致病菌在植物根系和土壤中的定殖有明显的影响(表4)。菌糠的添加显著增加了绿色木霉在土壤、根际和根系中定殖的数量,施用12%菌糠的处理检测到的木霉数量最多,在土体土、根际土和根系中木霉数量分别为71.86× 104、167.42×104和0.43×104cfu/g,与单用木霉相比数量分别提高了251.39%、208.21%和104.76%。育苗土中加入绿色木霉显著降低了土壤和根系中枯萎病菌的数量,木霉单独使用的处理枯萎病菌在土体土、根际土和根系中的数量显著低于空白对照,加入香菇菌糠后各部位枯萎病菌数量更是显著减少。菌糠浓度为12%时在土体土、根际土和根系中枯萎病菌数量分别为18.94×104、15.57×104和2.28× 104cfu/g,与单用木霉相比数量分别减少了56.98%、77.72%和76.83%。总体来看,绿色木霉和枯萎病菌在根际土中定殖数量最多,其次是土体土,而在根系中数量最少。土体土和根际土中两种菌的数量在不同浓度菌糠的处理间差异显著,而在根系中低浓度间差异不显著。
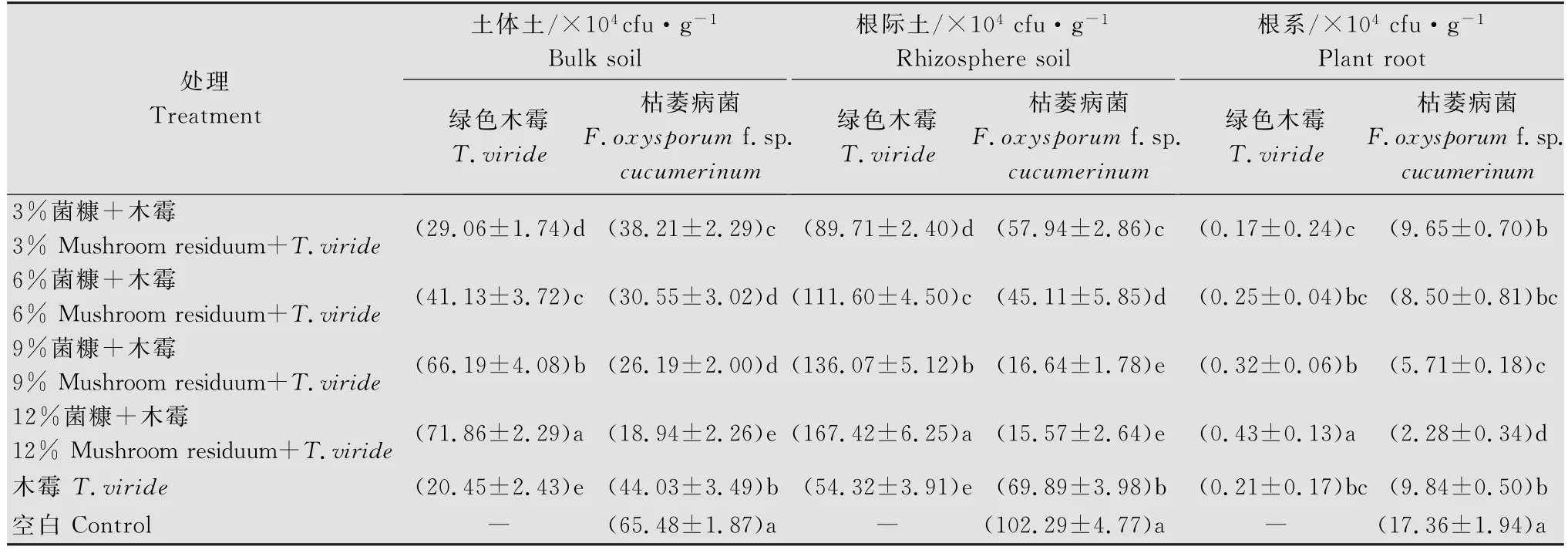
表4 香菇菌糠对绿色木霉和黄瓜枯萎病菌数量的影响Table 4 Effect of mushroom residuum on the quantity of Fusarium oxysporum f.sp.cucumerinum and Trichoderma viride
3 结论与讨论
国内外利用菌糠和木霉结合防治土传病害主要集中在将菌糠二次利用,作为木霉的培养基质使用,如高苇等[8]、周巍等[9]、李进一等[10]将绿色木霉先接种到菌糠上进行发酵培养,然后将菌糠发酵物再拌土处理来防治黄瓜立枯病和枯萎病。Kleifeld等同样以菌糠为基质发酵培养木霉后栽培辣椒,研究哈茨木霉在辣椒根际的定殖和防病作用[11]。本研究在前期确认香菇菌糠对生防菌和致病菌菌丝生长和孢子萌发影响的基础上,将菌糠作为木霉防病的增效剂添加到育苗土中,结果证实香菇菌糠显著提高了木霉对黄瓜枯萎病的防治效果,并且提高了木霉在土壤和根系中定殖的数量。
香菇菌糠对绿色木霉防病起增效作用主要与香菇菌糠对致病菌和生防菌表现不同的作用有关。黄瓜枯萎病作为一种土传病害,其是否发病以及发病严重程度除了受环境因素如温度、湿度等影响之外,主要取决于土壤中病原菌的数量。从致病菌的角度来看,香菇菌糠中含有某种特殊物质,强烈抑制黄瓜枯萎病菌孢子萌发,轻微抑制菌丝生长,这种抑制作用一定程度上减少了枯萎病菌的数量和病菌的致病作用。从生防菌的角度来看,香菇菌糠对绿色木霉菌丝生长和孢子萌发表现促进作用。香菇菌糠对绿色木霉来说是一种“养分”,促使木霉快速生长和繁殖,提供更多的木霉发挥生防作用,也提高了木霉在土壤中的竞争营养和侵染位点的能力,从而有效抑制病原菌的侵染。
[1] 蒲子婧,张艳菊,刘东,等.黄瓜枯萎病生物防治策略研究进展[J].中国蔬菜,2011(6):9-14.
[2] 郭润芳,史宝胜,高宝嘉,等.木霉菌在植病生物防治中的应用[J].河北林果研究,2001,16(3):294-298.
[3] Jackson A M,Whipps J M,Lynch J M.Nutritional studies of four fungi with disease biocontrol potential[J].Enzyme Microbiology Technology,1991,13:456-461.
[4] Kredics L,Antal Z,Manczinger L,et al.Influence of environmental parameters on Trichoderma strains with biocontrol potential[J].Food Technology Biotechnology,2003,41(1):37-42.
[5] Chen Lihua,Yang Xingming,Raza Waseem,et al.Solid-state fermentation of agro-industrial wastes to produce bioorganic fertilizer for the biocontrol of Fusarium wilt of cucumber in continuously cropped soil[J].Bioresource Technology,2011,102(4):3900-3910.
[6] Yang Xingming,Chen Lihua,Yong Xiaoyu,et al.Formulations can affect rhizosphere colonization and biocontrol efficiency of Trichoderma harzianum SQR-T037 against Fusarium wilt of cucumbers[J].Biology and Fertility of Soils,2011,47(3):239-248.
[7] 柏敏战,郑贵彬.番茄枯萎抗病性室内鉴定方法研究[J].植物病理学报,1997,27(1):59-63.
[8] 高苇,李宝聚,王万立,等.菌糠木霉发酵物对黄瓜枯萎病的防效研究[J].北方园艺,2013(16):140-143.
[9] 周巍,彭霞薇,李宝聚,等.绿色木霉菌糠发酵物对常见黄瓜土传病害的防治[J].广东农业科学,2012(14):78-81.
[10]李进一,井印,雷琛琛.食用菌废料(菌糠)木霉发酵物对黄瓜土传病害防治及促生作用的初步研究[J].食用菌,2010,32(4):67-68.
[11]Kleifeld O,Chet I.Trichoderma harzianum-interaction with plants and effect on growth response[J].Plant and Soil,1992, 144(2):264-272.
(责任编辑:王 音)
Synergism action of mushroom residuum on Trichoderma viride against cucumber Fusarium wilt
Gu Zumin1, Zhou Fei1, Bi Hui1, Li Baoju2, Zhang Bing1, Tian Xiaoying1
(1.College of Plant Protection,Shenyang Agricultural University,Shenyang 110161,China;2.Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
The synergism action of mushroom residuum on Trichoderma viride against cucumber Fusarium wilt was investigated through inhibitory activity in laboratory and greenhouse pot experiment.Extract of mushroom residuum promoted the mycelium growth and spore germination of T.viride with the rate of 18.20%and 9.82%,respectively.Further more,the extract could inhibit the mycelium growth and spore germination of Fusarium oxysporum by 11.85%and 87.78%,respectively.The mixture of mushroom residuum and T.viride caused 70.26%control efficiency to Fusarium wilt,65.06%and 58.10%fresh weight increase in overground part and underground part,respectively.Compared with the treatment of T.viride used solely,the mixture could increase the quantity of T.viride in bulk soil,rhizosphere soil and cucumber roots by 251.39%,208.21%and 104.76%, respectively,and decrease that of F.oxysporum by 56.98%,77.72%and 76.83%,respectively.
mushroom residuum; Trichoderma viride; Fusarium wilt of cucumber; biological control
S 476.19
B
10.3969/j.issn.0529-1542.2015.06.039
2014-09-26
2014-12-23
沈阳农业大学大学生创新创业训练计划项目(2014159)
*通信作者 E-mail:libj@mail.caas.net.cn

