利用贴牌水培法快速鉴定稗草对二氯喹啉酸的抗药性水平
李巳夫, 唐 涛, 刘雪源, 刘都才, 柏连阳, 马国兰, 彭亚军
(1.湖南农业大学农药研究所,长沙 410128;2.湖南省植物保护研究所,长沙 410125; 3.湖南省农业科学院,长沙 410125)
利用贴牌水培法快速鉴定稗草对二氯喹啉酸的抗药性水平
李巳夫1,2, 唐 涛2, 刘雪源2, 刘都才2, 柏连阳3*, 马国兰2, 彭亚军2
(1.湖南农业大学农药研究所,长沙 410128;2.湖南省植物保护研究所,长沙 410125; 3.湖南省农业科学院,长沙 410125)
本文通过室内贴牌水培法及整株法,快速鉴定并验证了2013年采自湖南省不同地区稻田的50个稗草生物型对二氯喹啉酸的抗药性,试验结果表明:贴牌水培法所用的二氯喹啉酸甄别剂量为80 mg/L;稗草死亡率越低,其抗性倍数(resistance factor,RF)越高,其中死亡率为0时,整株法测定的RF值高达896.07~1 209.38;贴牌水培法测定的稗草样本对二氯喹啉酸的ED50远低于整株法,但两种方法得到的不同稗草生物型对二氯喹啉酸的抗性水平趋势高度吻合。笔者认为以贴牌水培法测定的死亡率小于40%的稗草样本对二氯喹啉酸的抗性风险较高,值得深入研究。
稗草; 贴牌水培法; 二氯喹啉酸; 甄别剂量; 抗性倍数
稗草[Echinochloa crusgalli(L.)Beauv.]是一种分布广、危害重的恶性杂草,前期防除不当,易对水稻生产造成极大影响[1]。目前,我国水稻田稗草防除仍以化学防治为主,常用除稗剂为二氯喹啉酸(quinclorac)、五氟磺草胺(penoxsulam)、噁唑酰草胺(metamifop)、嘧啶肟草醚(pyribenzoxim)和氟吡磺隆(flucetosulfuron)[2-4]。其中,二氯喹啉酸作为经济、安全和有效的除稗剂品种之一[5-6],自1998年开始在湖南省推广应用,但随着连续、单一及随意增加剂量等不科学使用,湖南地区的许多稗草生物型对二氯喹啉酸的抗药性水平由敏感逐渐演变为高抗[7-9]。
现今,传统的稗草抗药性检测手段主要有整株水平测定法(简称整株法、盆栽法)、器官或组织水平测定法、细胞或细胞器水平测定法和分子水平检测方法等[10-14]。上述方法各有利弊,如整株法具有使用范围广及结果准确等优点,但亦存在费力、占用空间大、周期长的缺点,而其他方法使用范围窄且易受仪器条件限制。为此,建立一种简便、快速鉴定稗草对除草剂的抗药性水平方法,对于指导水稻田稗草防除乃至水稻的安全、高效生产至关重要。
植物水培是无土栽培模式下的一种重要方法,因其具有轻简、便捷及快速等优点,已被广泛用于室内科学研究和农业生产实践[15]。为便于获得健壮且整齐一致的稗草植株,以及快速鉴定其对二氯喹啉酸的抗药性水平,笔者结合实际情况设计了一套新颖的贴牌水培法,现将试验结果报道如下。
1 材料与方法
1.1 试验材料
供试杂草:将2013年采集于湖南省不同地区稻田的232份稗草(E.crusgalli),按照地理位置划分为湘东(长沙县、宁乡县、望城区)、湘北(常德市、沅江市)及湘中(湘潭县、湘乡县)稻区,并从上述样本中随机抽取50份(表1),快速鉴定其对二氯喹啉酸的抗药性水平。
供试药剂:50%二氯喹啉酸可湿性粉剂(江苏快达农化股份有限公司)。
仪器设备:生测喷雾塔(3WPSH-500E型),农业部南京农业机械化研究所;电子天平(FA1004B型、精确度10-4g、量程0~100 g),上海精密科学仪器有限公司。
1.2 试验方法
1.2.1 贴牌水培法
种子萌发:将采回的成熟的稗草种子置于-25℃冰箱中储存一个月,然后用0.25%硝酸钾溶液于30℃浸泡1 d,捞出后以清水冲洗种子表面残留的硝酸钾溶液,最后将种子放在塑料杯中套袋、催芽(图1a)。约3 d后种子萌发[16]。
营养液配制:取微量元素水溶肥料[肥万稼通用型,Mn+Zn+Mo≥100 g/L,以色列昕爵国际集团(中国)生物有限公司]200μL,加水稀释后配制成浓度为1.11μL/m L的营养液;试验期间,每隔15 d换一次营养液。

表1 湖南省不同地区水稻田稗草样本采集信息Table 1 Sampling information of Echinochloa crusgalli from rice fields at different areas in Hunan Province

续表1 Table 1(Continued)
幼苗定植:选取疏水的塑料标签牌(长15 cm、宽5 cm、厚度0.05 cm),先在距离每块标签牌底部6 cm的位置贴一层双面胶,然后贴上5根已萌发且生长一致的稗草幼苗(株高约6 cm且尚未至一叶一心期),并用透明胶带固定幼苗(图1b);最后将其放入1.11μL/mL营养液中培养,保持幼苗根部浸入营养液中(图1c)。
培养条件:温度为(28±2)℃、光周期L∥D=14 h∥10 h、相对湿度(RH)为40%~60%,以下同。
1.2.2 贴牌水培法确定甄别剂量
甄别剂量是使敏感生物型的死亡率达95%以上的最低剂量。采用实验室保存的稗草敏感生物型(感病对照),根据二氯喹啉酸的田间推荐剂量(500 mg/L),以10倍梯度设置系列剂量进行预试验,然后逐渐缩小剂量范围,多次重复试验加以验证,最后获得该药剂对稗草的甄别剂量。
1.2.3 贴牌水培法测定甄别剂量下稗草的死亡率
药剂处理:待稗草幼苗长至两叶期时,采用1.2.2得到的甄别剂量(80 mg/L二氯喹啉酸)处理,并以清水为对照。每个处理重复4次,每重复选用10株幼苗。将粘有幼苗的标签牌置于含3.0 L二氯喹啉酸药液的盒(长25 cm、宽15 cm、高15 cm)内,确保幼苗全部浸入药液中(图1d),30 min后取出,置于室内晾干。
药效调查:将晾干后的幼苗重新置于营养液中,置于温室内培养(图1e),15 d后调查稗草死亡率。植株整体枯黄或者心叶枯死即视为死亡,而其他情况则视为存活。死亡率(%)=(幼苗死亡数/供试幼苗数)×100。
1.2.4 整株法验证不同死亡率区间稗草样本对二氯喹啉酸的抗性
根据1.2.3的结果,选择死亡率≤40%的全部稗草样本,以及死亡率为41%~100%的部分稗草样本,采用整株法验证其对二氯喹啉酸的抗药性水平。方法参照NY/T1155.4-2006[17]。
播种、定植:在塑料盆(d=9 cm)内装入风干、过筛(20目)、混匀后的沙土,每盆固定播种30粒已露白的稗草种子;待出苗后,定苗20株/盆。
药剂配制:基于贴牌水培法的稗草死亡率,死亡率大于40%的稗草样本组,配制5 g/L二氯喹啉酸,然后以5倍梯度依次稀释成6个系列梯度浓度。死亡率小于等于40%的稗草样本组,配制50 g/L二氯喹啉酸,再以5倍梯度依次稀释成6个系列梯度浓度。
药剂处理:待稗草苗长至3~4叶期,采用生测喷雾塔(工作压=0.275 MPa)茎叶喷雾处理,喷液量450 L/hm2。每处理重复4次。
药效调查:施药后,详细记录稗草的受害症状,如生长抑制、叶片畸形和黄化等。处理后15 d,采用电子天平称量稗草地上部分鲜重,计算鲜重抑制率、ED50及抗性倍数(resistance factor,RF)。
抗性倍数(RF)=整株法测定的ED50/同一试验中整株法测定的ED50中最小的值
1.2.5 贴牌水培法测定二氯喹啉酸对不同死亡率区间稗草样本的ED50
根据1.2.3的结果,分别从死亡率区间为81%~100%、61%~80%、41%~60%、21%~40%、1%~20%、0中各选取1个稗草样本,采用贴牌水培法培养并测定其对二氯喹啉酸的ED50。
药剂处理:试验设6个浓度处理(基于贴牌水培法中稗草死亡率再确定具体浓度),每个处理重复4次,每个重复选取10株长势一致的2叶期稗草幼苗。药剂处理方法同1.2.3。
处理15 d后,用滤纸吸干取下的稗草样本上的水分,称量茎叶重量,计算并比较两种方法测定的二氯喹啉酸对稗草的ED50,分析其相关性。
1.3 数据处理
利用Microsoft Excel 2007与DPS V7.05的数量型数据分析法对试验数据进行统计,分别求出二氯喹啉酸对稗草样本的回归方程、相关系数、ED50及95%置信区间。
2 结果与分析
2.1 贴牌水培法甄别剂量确定及抗性水平筛选
贴牌水培法测定结果表明,当二氯喹啉酸剂量为60、70 mg/L时,稗草(敏感对照)死亡率分别为80%和90%,均低于95%;其剂量为80 mg/L时,稗草(敏感对照)死亡率接近100%;因此,将80 mg/L视为该药剂对稗草的甄别剂量。以该剂量处理50份稗草样本后15 d的死亡率结果如图2所示。由图2可知,死亡率≤40%的稗草样本仅有9个,即编号01、04、10、23、32、37、44、45、50。

图1 贴牌水培法主要操作步骤示意图Fig.1 Schematic diagram of major steps for water culture method with label cards(WCMLC)
如以死亡率为标准,可以将其划分为6个区间,即81%~100%、61%~80%、41%~60%、21%~40%、1%~20%和0,其对应的样本数分别占总样本数的48%、22%、12%、6%、6%和6%。
2.2 整株法验证不同死亡率区间稗草样本对二氯喹啉酸的抗性
选取贴牌水培法测得的9个疑似高抗的稗草样本(死亡率≤40%)及其他不同抗药性水平的6个样本[编号06(死亡率100%,下同)、36(90%)、28(80%)、24(70%)、02(60%)、14(55.6%)],通过整株法进一步验证其对二氯喹啉酸的抗药性水平,结果表明:相对于06号敏感型稗草(ED50= 0.012 g/L),有46.67%(7/15)的稗草样本对二氯喹啉酸已产生了极高水平的抗药性,其RF值为210.09~1 209.38;20.00%(3/15)的稗草样本对该药剂存在较高水平的抗药性,其RF值为95.83~119.86;6.67%(1/15)的稗草样本表现为中等水平的抗药性,其RF值为18.51;其余2个样本对二氯喹啉酸仍保持较敏感水平,RF值为1.83~2.36(表2)。以上说明,贴牌水培法测定的稗草死亡率和整株法测出的稗草对二氯喹啉酸的RF值呈负相关。

图2 二氯喹啉酸甄别剂量处理15 d后稗草死亡率Fig.2 The mortality of Echinochloa crusgalli at 15 day after treatment with quinclorac at the screening dose

表2 不同稗草样本对二氯喹啉酸的生物测定结果(整株法)Table 2 The bioassay results of different biotypes of Echinochloa crusgalli to quinclorac using whole plants method(WPM)
此外,由表2可知:稗草对二氯喹啉酸的RF值在死亡率为0~20%区间(贴牌水培法)内随死亡率降低大幅上升,RF值由340.12升至1 209.38;其次是30%~40%区间,随死亡率降低RF值由119.86升至210.09。
2.3 贴牌水培法与整株法所测抗性水平对比
由表3可知,贴牌水培法测定的稗草对二氯喹啉酸的RF值随着死亡率降低而逐渐递增,其中所选的7个代表性样本中50号样本RF值最高为26.80,而其经整株法测出的RF值高达1079.23,后者为前者的40.27倍。此外,其他5个抗性样本(36、24、14、32、45号)由整株法测定的RF值分别为贴牌水培法的1.51~49.18倍(表2、表3)。以上结果说明,贴牌水培法和整株法测定的同一稗草样本对二氯喹啉酸的抗性水平趋势较吻合,但抗性倍数存在一定差异,可能归因于二者所用的培养介质(水和土壤)、施药方式(浸药法和喷雾法)及药剂吸收途径(茎叶/根部吸收和茎叶吸收)不同。
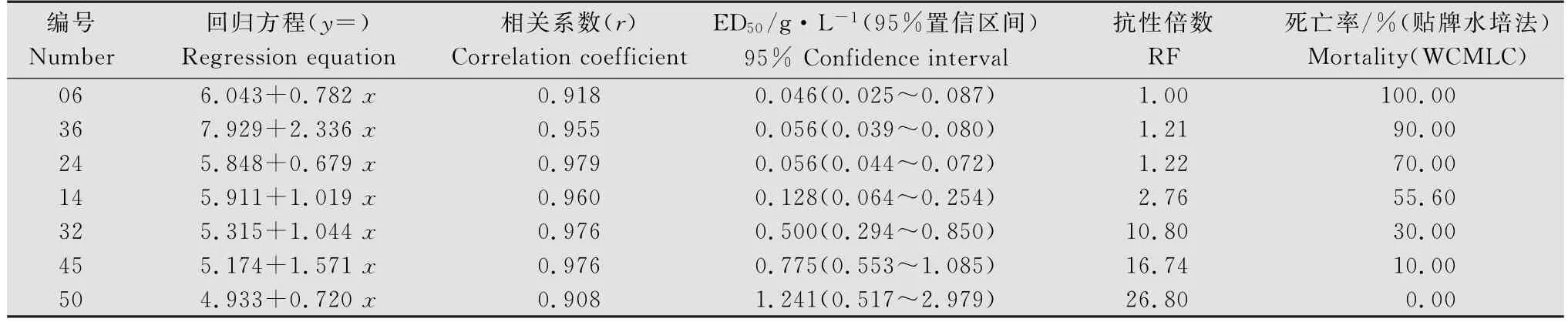
表3 不同稗草样本对二氯喹啉酸的生物测定结果(贴牌水培法)Table 3 The bioassay results of different biotypes of Echinochloa crusgalli to quinclorac using WCMLC
[2] 胡进生,汤洪涛,缪松才,等.稻田稗草的发生危害及防除对策[J].杂草科学,1991(3):32-34.
[3] 苏文伟,刘学东.几种酰胺类除草剂毒力、药效及安全性评价[J].杂草科学,2004(3):45-47.
[4] 马国兰,刘都才,刘雪源,等.不同除草剂对直播稻田杂草的防效及安全性评价[J].杂草科学,2014,32(1):91-95.
[5] Martinez L,de Prado N R,de Prado R.Fate of quinclorac in resistant Echinochloa crusgalli[C]//Proceedings of the Second International Weed Control Congress.Copenhagen,Denmark,1996:535-540.
[6] Yasuor H,Milan M,Eckert J W,et al.Quinclorac resistance:a concerted hormonal and enzymatic effort in Echinochloa phyllopogon[J].Pest Management Science,2012,68(1):108-115.
[7] 李拥兵,王小玲,夏阳,等.湖南稻区稗草对二氯喹啉酸的抗药性研究[J].植物保护,2004,30(3):48-52.
[8] 吴声敢,赵学平,吴长兴,等.我国长江中下游稻区稗草对二氯喹啉酸的抗药性研究[J].杂草科学,2007(3):25-26.
[9] 马国兰,柏连阳,刘都才,等.我国长江中下游稻区稗草对二氯喹啉酸的抗药性研究[J].中国水稻科学,2013,27(2):184-190.
[10]Letouze A,Gasquez J.A pollen test to detect ACCase targetsite resistance within Alopecurus myosuroides populations[J]. Weed Research,2000,40(2):151-162.
[11]Ryan G F.Resistance of common groundsel to simazine and atrazine[J].Weed Science,1970,18(5):614-616.
[12]Tal A,Kotoula-Syka E,Rubin B.Seed-bioassay to detect grass weeds resistant to acetyl coenzyme A carboxylase inhibiting herbicides[J].Crop Protection,2000,19(7):467-472.
[13]付仲文,张朝贤,钱益新,等.几种抗药性杂草的检测方法[J].植物保护,1999,25(4):40-42.
[14]董立尧,吕波,徐江艳,等.农田杂草抗药性检测方法研究进展[J].杂草科学,2011,29(2):1-4.
[15]段彦丹,樊力强,吴志刚,等.蔬菜无土栽培现状及发展前景[J].北方园艺,2008(8):63-65.
[16]吴声敢,王强,赵学平,等.稗草休眠特性及其解除[J].浙江农业学报,2007,19(3):225-228.
[17]中华人民共和国农业部.NY/T115.4-2006,农药室内生物测定试验准则—除草剂 第4部分:活性测定试验茎叶喷雾法[S].北京:中国农业出版社,2006.
[18]汪晓云.植物水培的风险原因探讨[J].北方园艺,2010(15):201-203.
3 结论与讨论
研发杂草抗药性的快速鉴定技术是其抗药性治理的前提。目前,杂草抗药性的室内检测方法多种多样,可以基于不同的需求选择不同的检测方法[14]。其中,整株法为杂草抗药性初筛方法中准确可靠和重复性好的常用方法,但因费时费力,难以满足短时间内实现大量样本对药剂的抗药性快速筛选的要求。本研究发现,以营养液为培养介质并结合浸药方式的贴牌水培法,不仅省时省力,而且步骤简化、易于操作。该方法的难点在于合适的甄别剂量的确定,一方面需了解杂草对某种药剂的敏感生物型;另一方面需反复试验、逐步缩小剂量范围,最终选择使得至少95%以上的敏感生物型样本死亡且尽可能小的剂量,作为甄别剂量。此外,由于水培条件下的稗草根系完全浸泡于营养液中,易受有害物质积累和病原菌侵染的影响,从而导致个别根系发生“病变”甚至整株死亡[18]。
从贴牌水培法和整株法测定结果得知,本研究随机抽取的50份稗草样本中对二氯喹啉酸存在抗药性的样本仅占少数,而高抗的样本更少。然而,对于稗草抗药性研究,往往越是高抗的样本,越有研究价值。因此,针对成千上万份的大样本时,建立一种抗药性快速筛选方法,不仅可以简化前期的摸索工作,且对于后期的抗药性机理研究至关重要。本研究系统地比较了贴牌水培法的死亡率与整株法的抗性倍数之间的关系,结果发现:稗草死亡率在40%以下时,随死亡率降低稗草对二氯喹啉酸的抗性倍数迅猛升高,可能归因于这些样本对该药剂产生了比较高水平的抗药性。此外,基于ED50的抗性倍数分析结果表明,贴牌水培法测定的稗草样本对二氯喹啉酸的抗药性水平和整株法保持一致,说明该方法结果可靠,适用于稗草抗药性初筛。
[1] 李扬汉.中国杂草志[M].北京:中国农业出版社,1998.
(责任编辑:杨明丽)
Rapid identification of resistance level of barnyardgrass (Echinochloa crusgalli)to quinclorac using water culture method with label cards(WCMLC)
Li Sifu1,2, Tang Tao2, Liu Xueyuan2, Liu Ducai2, Bai Lianyang3, Ma Guolan2, Peng Yajun2
(1.Institute of Pesticide Science,Hunan Agricultural University,Changsha 410128,China;2.Hunan Institute of Plant Protection,Changsha 410125,China;3.Hunan Academy of Agricultural Sciences,Changsha 410125,China)
In the present study,50 biotypes of barnyardgrass,Echinochloa crusgalli(L.)Beauv.,were collected from different rice fields of Hunan Province in 2013,and their resistance levels to quinclorac were conducted using water culture method with label cards(WCMLC)and whole plant method(WPM).The bioassay results showed that the screening dose of quinclorac was 80 mg/L via WCMLC.The lower mortalities of the tested E.crusgalli, the higher values of resistance factor(RF).RF values were 896.07-1 209.38 as for 0 of mortality.Comparing ED50value between WCMLC and WPM,similar resistance level trends of E.crusgalli to quinclorac were observed.The ED50value determined by WCMLC was remarkably lower than that of WPM.There was a higher resistant risk to 80 mg/L of quinclorac when the mortalities of E.crusgalli biotypes was lower than 40%using WCMLC.Therefore,further study was worthy for carrying out in these biotypes.
Echinochloa crusgalli; water culture method with label cards(WCMLC); quinclorac; screening dose; resistance factor
S 451.21
A
10.3969/j.issn.0529-1542.2015.06.027
2014-10-24
2015-01-29
公益性行业(农业)科研专项(201303031);国家自然科学基金项目(31201530)
*通信作者 E-mail:bailianyang2005@aliyun.com.cn

