南方红豆杉根腐病病原及其拮抗芽胞杆菌的鉴定
谯天敏, 罗 蓉, 朱天辉
(四川农业大学林学院,成都 611130)
南方红豆杉根腐病病原及其拮抗芽胞杆菌的鉴定
谯天敏, 罗 蓉, 朱天辉*
(四川农业大学林学院,成都 611130)
经形态学特征观察、致病性测定及rDNA-ITS序列分析,首次确定红豆杉根腐病病原为尖孢镰刀菌(Fusarium oxysporum)。采用平板对峙培养法从健康植株根际土壤中筛选得到3株对尖孢镰刀菌具有明显拮抗作用的芽胞杆菌YB6、YB15、YB37。经形态学、生理生化及16S rDNA同源性分析,并通过构建16S rDNA系统发育树,将YB6、YB15和YB37分别鉴定为蜡样芽胞杆菌(Bacillus cereus)、解淀粉芽胞杆菌(B.amyloliquefaciens)和多黏类芽胞杆菌(Paenibacillu polymy xa),其中多黏类芽胞杆菌拮抗效果最好,具有进一步研究开发的潜力。本研究通过对南方红豆杉根腐病病原鉴定及其拮抗芽胞杆菌的筛选,对该病的防治提供了理论依据。
南方红豆杉; 根腐病; 尖孢镰刀菌; 拮抗芽胞杆菌
红豆杉在资源植物中具有较突出的地位[1],它是集药用、观赏、绿化、特种优质用材为一体的珍贵树种,其根、茎、叶中可提取一种近年来全球紧俏的高新技术抗癌新药成分紫杉醇[2]。天然红豆杉资源非常有限,远远不能满足医药市场的需求[3],所以人工种植的红豆杉成为提取紫杉醇的主要来源。南方红豆杉因其出苗率较高而被选为人工栽种的优良种。但南方红豆杉实生苗繁殖慢,扦插繁殖技术要求高,尤其苗期病虫害发生较多[4]。近年来,随着南方红豆杉人工种植面积的扩大,病害逐年加重,对紫杉醇的生产供应产生了极大的影响。
目前,国内有关红豆杉病害的研究较少。范晓龙等[2]根据Sutton[5]的炭疽病分类鉴定方法对南方红豆杉炭疽病病原进行了分离鉴定。有关红豆杉根腐病病原分离、鉴定及其拮抗菌的筛选等研究尚未见报道。根腐病是一种较难防治的土传病害[6],生产上常采用化学防治方法,但化学农药的大量不合理使用给生态环境及人类带来了不良影响[7],也无法达到根治的效果。生物防治方法因具有安全、经济、长效和不污染环境等特点而逐渐成为防治病虫害的有效手段。微生物农药的开发利用是生物防治未来的主要趋势,拮抗菌株的筛选和鉴定则是微生物农药开发的基础[8]。
本试验从发病的南方红豆杉根部分离出一株致病菌株,从形态学、致病性和分子生物学等方面进行了鉴定,并针对该病原菌筛选出3株拮抗作用较好的芽胞杆菌,以期为南方红豆杉根腐病的有效防治奠定基础。
1 材料与方法
1.1 病原菌分离
从雅安市天赐苗木有限公司洪雅县生产基地采集具有南方红豆杉根腐病典型症状的新鲜病株进行室内鉴定。采用常规组织分离法[9]进行分离:先用无菌水将新鲜的病株根部冲洗干净,观察根部症状。从病健交界处切取4 mm×4 mm的病组织,在70%乙醇中浸泡1~2 min,再移至0.1%的升汞中灭菌3~4 min,接着用无菌水洗3~4次。在无菌条件下将病组织接种至PDA平板培养基上培养,长出菌丝后,取菌落边缘菌丝转至新鲜PDA上培养,经单孢纯化后获得菌种,保存于PDA斜面上,并于4℃冰箱中备用。
1.2 病原鉴定
1.2.1 致病性测定
用柯赫氏法则(Koch’s postulate)验证病原菌的致病性。将分离并纯化的真菌移至PDA培养基上培养7 d后,加20 m L无菌水洗下孢子,制成浓度为106~107个的真菌孢子悬浮液,然后采用伤口接种法[9](在健康无病、生长良好的植株基部距离土面3~5 cm处用灭菌刀轻轻弄伤根系表皮,使之形成伤口),在伤口处滴孢子悬浮液2 m L/株,3次重复,每次重复接种10株,以无菌水处理作对照。每天定时观察植株发病情况并做记录。从接种发病的病株根部取腐根木质部和韧皮部病健交界处组织,用组织分离法分离病原菌,并进行鉴定。
1.2.2 病原菌的形态观察
将分离获得的优势菌株在PDA上培养,于25℃恒温培养箱中培养5 d,在此期间观察记录病原菌菌株的培养特征,包括菌落颜色、形态和菌落生长速度;制作切片,在光学显微镜下观察有无大、小型分生孢子和厚垣孢子及其大小、形状和着生方式;隔膜有无及其数目、产孢结构等。参考Booth镰刀菌分类标准[10]和真菌鉴定手册[11]进行鉴定。
1.2.3 病原菌r DNA-ITS序列分析
1.2.3.1 DNA的提取
采用摇床振荡培养方法液体培养病原菌,具体操作:接种病原菌菌株于PDA培养基上,室温下连续培养3 d后,取菌落边缘菌丝少许,转接于装有100 m L PD液体培养基的300 m L锥形瓶中,25℃, 125 r/min条件下振荡培养5 d。收集菌丝体,先用无菌水冲洗干净,再用无菌滤纸吸干多余水分。收集的菌丝置于-20℃条件下保存备用。基因组DNA的提取参照天根植物基因组DNA提取试剂盒的操作步骤。
1.2.3.2 PCR扩增
扩增r DNA片段的引物为真菌通用引物ITS1和ITS4,上海生工技术公司合成。其序列分别为ITS1:5'-TCCGTAGGTGAACCTGCGG-3';ITS4:5'-TCCTCCGCTTATTGATATGC-3'。反应扩增体系(20μL)包括:基因组DNA 1μL,10×PCR buffer 2μL,0.25 mmol/L d NTP 1μL,5 U/μL r Taq 0.2μL,1μmol/L ITS1 0.5μL,1μmol/L ITS4 0.5μL,dd H2O 14.8μL。反应程序为:96℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min,4℃保存。PCR产物的检测在1.5%琼脂糖凝胶电泳上进行。
1.2.3.3 产物的回收克隆
参照林剑伟等[12]的方法,利用回收试剂盒(天根植物基因组DNA提取试剂盒)对目标基因片段进行切胶、回收、纯化。将回收的PCR产物连接至p MD18-T载体上,转化大肠杆菌JM109感受态,利用菌落PCR筛选阳性克隆[13],送上海生工技术公司进行测序。
1.2.3.4 ITS序列分析及系统发育树的构建
将测序所得的片段序列,登录NCBI进行BLAST比对,从GenBank中下载与所得片段同源性较高的菌株的rDNA-ITS序列,利用MEGA 5.0建立病原菌株的系统发育树,进行基于rDNA-ITS的序列分析。
1.3 拮抗芽胞杆菌的筛选与鉴定
1.3.1 筛选
1.3.1.1 分离纯化
从雅安市天赐苗木有限公司洪雅县南方红豆杉栽培基地采集健康植株根际土样,风干备用。称取土样10 g,放入盛有90 m L无菌水和玻璃珠的三角瓶中,摇床上剧烈振荡30 min后于80℃的水浴中保持20 min。用无菌水进行梯度稀释并涂布NA平板,于37℃培养箱中培养24 h左右,挑取菌落形态差异明显的单菌落进入初筛。
1.3.1.2 初筛
以病原菌为指示菌,采用PDA平板对峙生长法。平板中央先移入直径为3 mm的病原菌的琼脂块,再将分离得到的菌株点接在距平板中央3 cm处的4个角点上,每个菌株3次重复,置于25℃培养箱中培养3~5 d,选出对病原菌生长有抑制作用的菌株进入复筛。
1.3.1.3 复筛
将初筛得到的菌株采用平板对峙法进行反复筛选,每个菌株3次重复,置于25℃培养箱中培养3~5 d,选出对病原菌生长抑制效果明显的菌株,并测量抑菌带大小(细菌菌落中心至病原菌菌丝边缘的距离)和计算抑菌率,直到筛出抑菌圈半径较大,被抑病原菌菌丝边缘平齐且拮抗作用持久的菌株。
抑菌率(%)=(对照病原菌菌落直径—处理病原菌菌落直径)/对照病原菌菌落直径×100。
1.3.2 鉴定
1.3.2.1 形态特征
参照沈萍等[14]的方法,观察拮抗芽胞杆菌在NA培养基上的生长特征和显微形态特征。
1.3.2.2 生理生化特征
参照《伯杰细菌鉴定手册》[15]、《常见细菌系统鉴定手册》[16]、Gordon等的《芽胞杆菌属》[17]和王大耜的《细菌分类基础》[18],对拮抗作用较好的菌株进行相关生理生化指标的测定。
1.3.2.3 16S r DNA同源性分析
采用摇床振荡培养方法液体培养拮抗菌株18~24 h,收集菌体,以DP305离心柱型细菌基因组DNA提取试剂盒(由北京天根生化科技有限公司提供)提取的基因组DNA为模板,采用细菌16S r DNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACT T-3')进行PCR扩增。25μL反应液:2×PCR Master mix 12.5 mL,引物27F和1492R浓度0.2μmol/ L,各0.75 mL,目的DNA 1μL,dd H2O 10μL。PCR反应程序参照杜毓博等[19]:94℃5 min;94℃30 s、55℃45 s、72℃60 s,30个循环;72℃7 min。反应结束后,用1%琼脂糖凝胶电泳检测PCR扩增结果,用Promega公司的Wizard PCR产物纯化试剂盒对PCR产物进行纯化,回收目的片段,送生工生物工程(上海)股份有限公司测序。
根据上海生工技术公司发回的片段序列,登录NCBI进行BLAST比对,从GenBank中下载同源性较高菌株的16S r DNA序列,利用MEGA 5.0建立拮抗菌株的系统发育树,进行基于16S r DNA的序列同源性分析。
2 结果分析
2.1 病原鉴定
2.1.1 病害症状
南方红豆杉根腐病危害面积大,病症严重,且潜伏周期较长,一旦发现病害便是大面积植株已受到伤害,发病率达到80%,这给防治工作带来很大困难。采样地点发病植株多是10 cm左右的栽培苗,受害面积大,给当地的生产者带来很大的经济损失。病株发病时根部受病菌侵染初呈褐斑,后皮层腐烂(干腐)变黑,发霉,木质部变色,尤其是主根皮层腐烂水渍状,后呈红褐色,病株叶片变褐由下往上,由内向外,严重时枝叶萎蔫失水,最后导致全株死亡。
2.1.2 病原菌的分离和致病性测定
采用常规组织分离法[9],从发病的植株根部分离得到7株病原菌菌株,纯化后培养比较,发现各菌株形态特征一致,为同一种真菌。分离菌株经伤口接种法接种于健康南方红豆杉植株根部后,20 d后发病。试验结果显示发病症状与初始感染南方红豆杉根腐病症状一致,发病率达到100%,对照组没有症状出现,将接种发病的南方红豆杉腐根进行再次分离,分离物与第1次得到的分离物菌落形态一致,产生的孢子也与第1次分离的孢子形态一致。
2.1.3 病原菌形态特征
病原菌在PDA平板上,于25℃培养箱中培养,菌落平均生长速率为1.21 cm/d,其中在培养第3天到第4天增长速率最大。5 d后,菌落直径约为6.0 cm,菌落圆形,气生菌丝茂盛,致密,为白色绒毛状;菌落边缘菌丝呈放射状,菌落背面中央淡紫色,边缘乳白色(图1)。镜检发现病原菌菌丝透明,产孢细胞为瓶状,共产生大小两种分生孢子,营养条件不佳时产生厚垣孢子。小型分生孢子(图2)居多,卵形、肾形,无色无隔,假头状聚生,大小为(4.1~14.4)μm×(2.4~3.9)μm;大型分生孢子(图2)镰刀形,两端渐均匀变细,略弯曲,足孢显著,1~3个隔,大小为(14.2~21.53)μm×(2.0~3.9)μm,平均17.16μm ×2.6μm;厚垣孢子球形或卵形,间生或顶生。根据以上形态特征以及田间症状,依据Booth镰刀菌分类标准[12],并参考《真菌鉴定手册》[13],初步鉴定该病原菌为尖孢镰刀菌(F.oxysporum)。
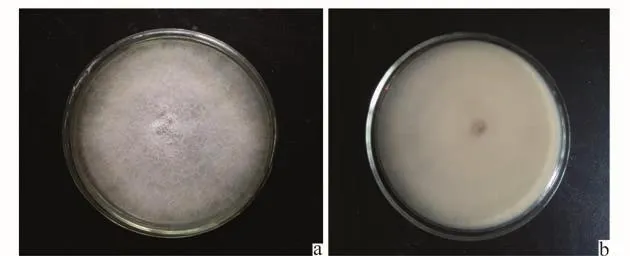
图1 病原菌菌落正面(a)与反面(b)图Fig.1 The front(a)and back(b)of the pathogenic bacterial colonies
2.1.4 病原菌r DNA-ITS序列分析
采用真菌ITS1/ITS4通用引物对其进行PCR扩增,得到一条大小约500 bp明亮清晰的片段。测序结果显示,该序列长度为520 bp,将该序列与Gen-Bank中的核酸序列进行同源性比对,发现该病原菌菌株的ITS序列与尖孢镰刀菌(F.oxysporum)(登录号:EF611088)的ITS序列同源性达到了100%。选取NCBI登录的尖孢镰刀菌及相近属rDNA-ITS序列,进一步用软件DNAMAN和MEGA5.0进行多重比对,并采用NJ法构建系统发育树,结果见图3。
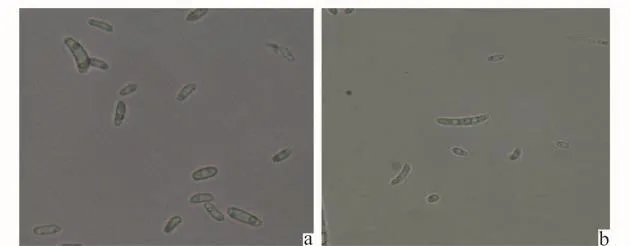
图2 病原菌的小型(a)和大型(b)分生孢子Fig.2 The small(a)and big(b)conidia of the pathogen
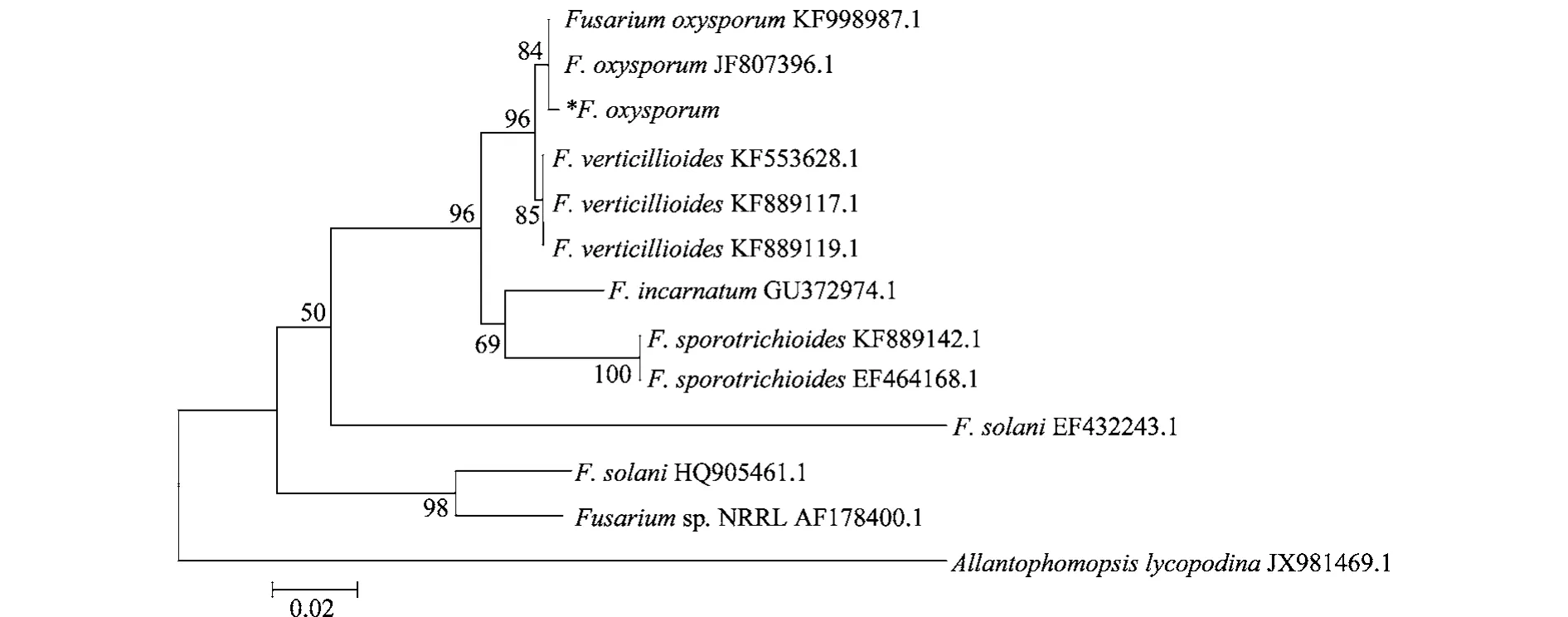
图3 基于ITS序列分析构建的南方红豆杉根腐病病原菌系统发育树Fig.3 The phylogenetic tree of the pathogen causing root rot of Taxus chinensis var.mairer based on ITSsequence analysis
2.2 拮抗芽胞杆菌的分离筛选和鉴定
2.2.1 分离筛选结果
经涂布培养,共分离出37株能在NA培养基上生长良好且外表性状不同的菌株,命名为YB1~YB37。经初筛,共筛选出9株对病原有拮抗效果的菌株,分别为YB6、YB9、YB15、YB18、YB20、YB27、YB30、YB36、YB37。采用PDA平板对峙生长法对初筛得到的9株菌株进行反复筛选,最终筛选出3株对南方红豆杉病原菌拮抗效果良好的菌株,分别为YB6、YB15和YB37,3株拮抗菌株的抑菌率都在30%以上,其中YB37拮抗效果最好,拮抗抑菌带达到10 mm。3株拮抗菌株对南方红豆杉根腐病病原菌的拮抗效果见表1和图4。

表1 3株拮抗菌对南方红豆杉根腐病菌的拮抗效果(对峙培养5 d)1)Table 1 Inhibitory effects of the three bacterial strains(culture for 5 d)

图4 3株拮抗菌与病原菌对峙培养5 d的拮抗效果图Fig.4 Antagonistic effects of the inhibitory strains against the pathogen cultured for 5 days
2.2.2 拮抗菌株的鉴定
2.2.2.1 形态特征和生理生化特征
拮抗菌株接种于NA培养基培养24 h后,挑取菌体革兰氏染色,电子显微镜下观察形态,48 h后观察菌落特征,结果见表2。根据表中描述,YB6、YB15、YB37分别与蜡样芽胞杆菌(B.cereus)、解淀粉芽胞杆菌(B.amyloliquefaciens)、多黏类芽胞杆菌(P.polymyxa)形态基本一致。

表2 3株拮抗菌株的菌落形态及特征Table 2 The colony morphology and characteristics of three antagonistic strains
生理生化试验结果见表3。结果表明,YB6、YB15和YB37分别与蜡样芽胞杆菌、解淀粉芽胞杆菌和多黏类芽胞杆菌生理生化特征基本一致。
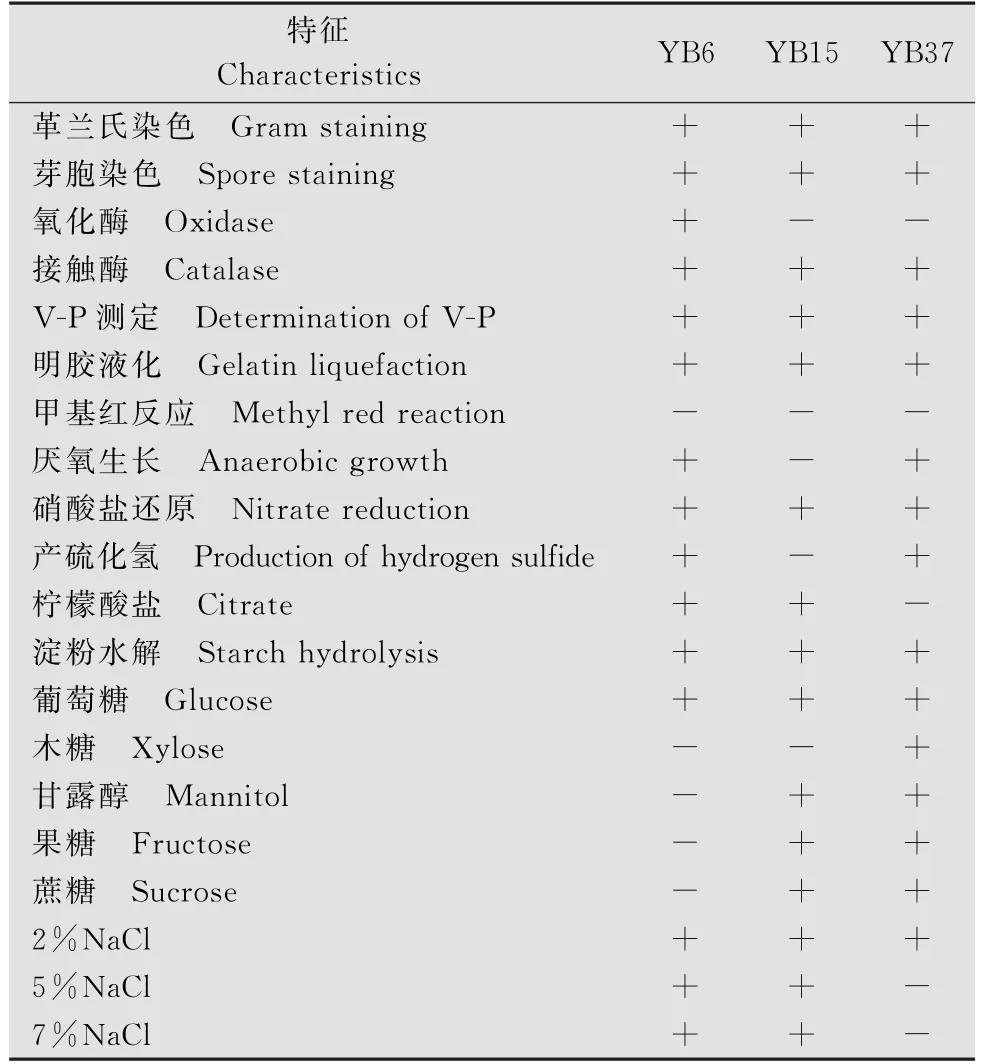
表3 3株拮抗菌株的生理生化特性1)Table 3 The physiological and biochemical characteristics of three antagonistic strains
2.2.2.2 16S r DNA同源性分析结果
采用细菌通用引物27F/1492R对拮抗菌YB6、YB15、YB37的16S r DNA进行基因PCR扩增,分别得到大小约1 500 bp片段,产物的测序结果表明YB6、YB15、YB37扩增片段大小分别为1 221、1 222、1 243 bp(图5)。
图5 3株拮抗菌的电泳图像Fig.5 Electrophoresis of the three antagonistic strains
将测序结果在NCBI数据库中与已知序列进行BLAST比对,结果显示,YB6、YB15、YB37序列长度分别为1 221、1 222、1 243 bp。YB6与蜡样芽胞杆菌(登录号:GQ344805.1)的16S rDNA同源性达到了100%,YB15与解淀粉芽胞杆菌(登录号:JN700147.1)的16S rDNA同源性达到了99%,YB37与多黏类芽胞杆菌(登录号:JQ283974.1)的16SrDNA同源性达到了99%。选取NCBI登录的芽胞杆菌或类芽胞杆菌及相近属16S rDNA序列,进一步用DNAMAN和MEGA5.0并采用NJ法构建系统发育树。构建系统发育树结果如下(图6):
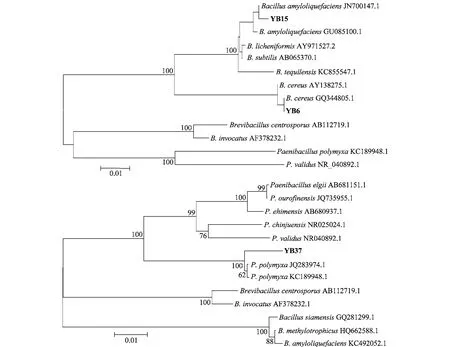
图6 3株拮抗菌株的系统发育树Fig.6 The phylogenetic tree of the three antagonistic strains
由图可知,YB6和YB15属芽胞杆菌属,YB37属类芽胞杆菌属,结合形态特征和生理生化特征,最终鉴定YB6、YB15、YB37分别为蜡样芽胞杆菌(B. cereus)、解淀粉芽胞杆菌(B.amyloliquefaciens)和多黏类芽胞杆菌(P.polymy xa)。
3 讨论
作者从雅安市天赐苗木有限公司洪雅县生产基地采集的具有南方红豆杉根腐病典型症状的新鲜病株上分离得到一株病原菌菌株。根据形态学、致病性测定结果和分子生物学序列分析结合田间发病症状,最终鉴定该病原菌为尖孢镰刀菌(F.oxysporum)。尖孢镰刀菌是一种土壤习居菌,为一类常见的土传真菌。此前有关尖孢镰刀菌引起植物根腐病害已有不少报道,如周洪友等发现一株尖孢镰刀菌黄芪专化型(F.oxysporum f.sp.astragali)侵染沙打旺导致其根腐[20];黄芳等在西葫芦根腐病的病原鉴定中确定尖孢镰刀菌为病原菌[21]。尖孢镰刀菌引起南方红豆杉根腐现象国内暂未见详细报道。
南方红豆杉根腐病潜伏期长、破坏性大且范围广,这给该病的防治带来了一定困难。传统的化学防治对病害有一定的防治效果,但一些常用的土壤消毒剂对人、畜和大气臭氧层的危害很大,目前已基本禁用[22]。当前,生产中推行的治理方法是用微生物菌剂(肥)来防治土传病害[23-25]。芽胞杆菌是一类抗逆能力强,繁殖速度快,营养要求简单,易定殖在植物表面的生防细菌,近年来正逐渐成为世界生防菌的研究重点。本研究不仅鉴定了该病病原,且针对尖孢镰刀菌引起的南方红豆杉根腐病筛选出3株拮抗效果良好的拮抗芽胞杆菌。经鉴定,3株芽胞杆菌分别为蜡样芽胞杆菌(B.cereus)、解淀粉芽胞杆菌(B.amyloliquefaciens)和多黏类芽胞杆菌(P. polymyxa),其中多黏类芽胞杆菌拮抗效果最好,拮抗带达到10 mm,具有进一步开发利用的潜力,这为该病的防治工作进一步奠定了坚实的基础。
本研究对南方红豆杉根腐病首次进行病原鉴定,且筛选出3株对病原菌拮抗作用明显的芽胞杆菌,为今后防治红豆杉根腐病提供了一定的理论依据。但本文只是针对洪雅县某生产基地的南方红豆杉根腐病进行了病原分离鉴定和拮抗菌的筛选,其他地区的发生情况和病原菌的株系还有待进一步研究;镰刀菌的寄主范围十分广泛,各种寄主分离菌系的致病性和生理性状不尽相同,我国主要作物上的其他镰刀菌能否侵染红豆杉及其致病性的强弱还需进一步探讨,这对于人工种植红豆杉和采取农业措施防治红豆杉根腐病将具有指导意义。
[1] 吕志鹏.甘肃南部红豆杉栽培技术与病虫害防治[J].北京农业,2011(5):152-153.
[2] 范晓龙,朱建华,周旭,等.南方红豆杉炭疽病病原鉴定及其生物学特性[J].福建林学院学报,2006,26(2):117-122.
[3] 李湘萍.红豆杉属植物的地理分布与应用前景[J].植物杂志, 1994(4):20-21.
[4] 李金平.南方红豆杉生态特性及栽培技术[J].中南林业调查规划,2002,21(2):61-62.
[5] Sutton B C.The Coelomycetes:fungi imperfecti with pycnidia, acervuli and stromata[M].Kew:Commonwealth Mycological Institute,1980:525-526.
[6] 张艳秋,刘伟,胡长效.草莓根腐病的发生规律与综合防治[J].植保技术与推广,2003(1):14-16.
[7] 彭好文,黎起秦,林纬.生物防治研究及其应用概况[J].广西农业生物科学,2004,23(2):170-174.
[8] 王振军,刘玉霞,刘新涛,等.用16S r DNA序列分析方法鉴定4个拮抗细菌[J].河南农业科学,2006(5):59-61.
[9] 方中达.植病研究方法[M].北京:中国农业出版社,1998:112-134.
[10]高同春,叶钟音,王梅,等.水稻早育秧苗立枯病致病镰刀菌分离、鉴定及致病性测定[J].中国水稻科学,2001,15(4):320-322.
[11]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[12]林剑伟,阙友雄,陈天生,等.一株甘蔗黑穗病菌的分离与系统发育分析[J].中国农学通报,2007(5):293-297.
[13]胡长志,孙晓棠,谢克强,等.白莲腐败病病原菌的分离鉴定[J].长江蔬菜,2013(18):92-94.
[14]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999.
[15]布坎南R E,吉本斯N E.伯杰细菌鉴定手册:中文版(8版) [M].中国科学院微生物所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984.
[16]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[17]Gordon R E,Haynes W S,Pang C H N.芽孢杆菌属[M].蔡妙英,刘聿太,译.北京:中国农业出版社,1983.
[18]王大耜.细菌分类基础[M].北京:科学出版社,1977:102-152.
[19]杜敏博.梨黑星病拮抗菌FJ1的筛选及拮抗机理研究[D].西安:西北大学,2012.
[20]周洪友,杨合同,唐文华.沙打旺根腐病发生及病原菌鉴定[J].草地学报,2004,12(4):285-288,297.
[21]黄芳,王建明,徐玉梅.等.西葫芦根腐病的病原鉴定[J].山西农业科学,2007,35(12):28-30.
[22]王树雪,魏艳敏,尚巧霞,等.三株拮抗细菌的鉴定及抑菌作用研究[J].中国生物防治学报,2013,29(4):647-654.
[23]胡洪涛,王开梅,李芒.几种枯草芽孢杆菌发酵液防治草莓病害的药效试验[J].湖北农业科学,2002(2):52.
[24]徐淑华,蒋继志,姚克文.两株拮抗细菌对草莓根腐病菌的抑制作用[J].河北农业大学学报,2005,28(3):81-83,97.
[25]赵秀娟,徐文桥,张凤巧.土壤拮抗微生物对几种草莓病原菌的拮抗作用测试[J].中国农业科技导报,2007,9(2):77-81.
Identification of the pathogen isolated from root rot of Taxus chinensis var.mairer and screening of its antagonistic Bacillus
Qiao Tianmin, Luo Rong, Zhu Tianhui
(College of Forestry,Sichuan Agricultural University,Chengdu 611130,China)
In this study,the pathogen isolated from root rot of Taxus chinensis var.mairer was first indentified. Based on morphological characteristics,pathogenicity and r DNA ITS sequence analysis,the results showed that the pathogen of root-rot disease of T.chinensis var.mairer was Fusarium oxysporum.The tablet confrontation training method was adopted to screen the antagonistic Bacillus species from the healthy plant rhizosphere,and three strains with obvious antagonistic effect were obtained,namely YB6,YB15 and YB37.Through morphological,physiological,biochemical and 16S r DNA homology analysis as well as the construction of 16S r DNA phylogenetic tree,we found that YB6,YB15 and YB37 were Bacillus cereus,B.amyloliquefaciens and Paenibacillus polymyxa,respectively.The antagonistic effect of P.polymyxa was the best with further research and development potential. This study provides some valuable information for effective prevention and treatment of this disease.
Taxus chinensis var.mairei; root rot; Fusarium oxysporum; antagonistic Bacillus
S763.1S476
A
10.3969/j.issn.0529-1542.2015.06.010
2014-11-17
2014-12-22
四川省教育厅重点项目(12ZA115)
*通信作者 E-mail:zhuth1227@126.com

