土壤强还原过程产生的有机酸对土传病原菌的抑制作用
黄新琦, 温 腾, 孟 磊, 张金波, 蔡祖聪*
(1.南京师范大学地理科学学院,南京 210023;2.江苏省物质循环与污染控制重点实验室,南京 210023;3.海南大学农学院,海口 570228)
土壤强还原过程产生的有机酸对土传病原菌的抑制作用
黄新琦1,2, 温 腾1, 孟 磊3, 张金波1,2, 蔡祖聪1,2*
(1.南京师范大学地理科学学院,南京 210023;2.江苏省物质循环与污染控制重点实验室,南京 210023;3.海南大学农学院,海口 570228)
土壤强还原(reductive soil disinfestation,RSD)能有效杀灭土传病原菌,并已在日本、荷兰和美国取得一系列的推广应用,但对于RSD的杀菌机理不甚明了。本试验采用高效液相色谱和荧光定量PCR等技术研究了以玉米秸秆为有机碳源的RSD处理过程中土壤产生的有机酸种类,以及不同浓度的有机酸对土壤病原菌的抑制效果。结果表明:以玉米秸秆为有机碳源的RSD过程中主要产生了乙酸和丁酸;经50 mmol/L丁酸溶液处理的土壤中立枯丝核菌、辣椒疫霉、尖孢镰刀菌及茄劳尔氏菌的数量分别为对照的3.5%、38.9%、11.5%和7.9%;10 mmol/L的丁酸可以完全抑制尖孢镰刀菌菌丝的生长;5 mmol/L的丁酸即可完全抑制尖孢镰刀菌的孢子萌发。本研究结合前人报道表明有机酸,尤其是乙酸和丁酸,对于RSD的杀菌机理起着重要的作用。
土传病害; 乙酸; 丁酸; 尖孢镰刀菌
土传病害是指由存在于土壤中的病原微生物在条件适宜时萌发并侵染植物而导致的病害[1]。大量的研究表明,在环境条件相对不变的条件下,随着土壤病原菌数量的增加,作物土传病害的发生呈上升趋势[2-3]。因此,能否有效地降低土壤中病原菌的数量是防控土传病害取得成功的关键因素。目前生产上主要通过使用化学杀菌剂[4]以及一些物理的土壤消毒方法,如暴晒、深翻、淹水等[5],来降低病土中植物病原菌的数量。但由于人们日益增加的食品安全顾虑,许多化学杀菌剂已不再被允许使用;传统土壤消毒方法也由于成本较高、防治效果差或者环保上的原因不能进行推广[6]。因此,迫切需要寻找替代的土壤消毒方法来降低连作土壤中植物病原菌的数量。
在2000年,日本和荷兰相继独立发明了土壤强还原法(reductive soil disinfestation,RSD)来降低土壤中病原菌数量及防控作物土传病害[78]。RSD由向土壤中添加易分解的有机物料并保持土壤厌氧状态组成。尽管此方法在日本、荷兰和美国进行了一系列的推广应用[9],但人们对于RSD的杀菌机理仍不甚明了[10]。许多研究表明RSD过程中产生的有机酸,尤其是乙酸和丁酸,可能起到杀菌的效果[10],本试验在此基础上研究了RSD过程中是否能产生除乙酸和丁酸之外的抑菌有机酸,以及这些有机酸的不同浓度对于多种土壤病原微生物的抑制效果。
1 材料与方法
1.1 材料
供试土壤:试验土壤采自江苏省宜兴市多年种植水稻地块,采回后经暴晒、风干和过筛后备用。供试有机物料:收集采摘后的玉米秸秆地上部,充分晾干,打碎,C/N为45.7。
供试菌株:尖孢镰刀菌古巴专化型(Fusarium ox ysporum f.sp.cubense)N21菌株由本实验室分离纯化;立枯丝核菌(Rhizoctonia solani)Q1、茄劳尔氏菌(Ralstonia solanacearum)2010、辣椒疫霉(Phytophthora capsici)MXL1由南京农业大学资源与环境学院提供。
选择性培养基:尖孢镰刀菌选择性培养基(K2培养基)[11]:K2HPO41 g、KCl 0.5 g、MgSO4· 7H2O 0.5 g、Fe-Na-EDTA 0.01 g、L-天门冬酰胺2 g、半乳糖10 g、琼脂16 g,去离子水定容至900 m L,高压灭菌后冷却至60℃,加入100 m L盐溶液(75%五氯硝基苯0.9 g、牛胆盐0.45 g、Na2B4O7· 10 H2O 0.5 g、硫酸链霉素0.3 g,用10%磷酸调p H至3.8±0.2)。M-SMSA培养基[12]:水解酪蛋白1 g,蛋白胨10 g,甘油5 m L,琼脂20 g,蒸馏水1 L。p H 6.5,121℃高压灭菌15 min,冷却至50℃每升加入以下成分:结晶紫5 mg、多黏菌素B硫酸盐100 mg、杆菌肽25 mg、氯霉素5 mg、青霉素5 mg、2,3,5-三苯基四氮50 mg、放线菌酮100 mg。燕麦培养基[13]:燕麦片30 g,煮沸30 min后过滤去除杂质,琼脂20 g,蒸馏水补足至1 000 m L,121℃高压灭菌20 min,冷却后加入利福平20 mg、氨苄青霉素200 mg、70%五氯硝基苯100 mg。
1.2 病原菌的制备
按文献报道[14],将真菌性病原菌(尖孢镰刀菌、立枯丝核菌和辣椒疫霉)活化后转接到装有100 m L马铃薯蔗糖培养基的500 m L三角瓶中,静置培养7 d,取出洗净后放入均质仪中打碎。将细菌性病原菌(茄劳尔氏菌)活化后转接至牛肉膏蛋白胨培养基中,30℃170 r/min振荡培养2 d,将菌悬液7 000 g离心10 min,弃去上清,将菌体重悬于0.5%的生理盐水中。最终将真菌性病原菌以1 kg土1.5 g菌丝鲜重的浓度、细菌性病原菌以1 g土106cfu的浓度均匀拌入上述准备好的水稻土中。
1.3 抑菌有机酸的筛选
根据文献报道[15],选择乙酸、丁酸、顺丁烯二酸、异戊酸、乳酸、柠檬酸、丙酸和蚁酸这8种有机酸进行筛选试验。将50 m L浓度为50 mmol/L的有机酸溶液倒入装有50 g病土的250 m L三角瓶中,封口后将三角瓶放置在25℃的培养箱中培养5 d,分别以加5 m L和50 m L去离子水的装有相等土量的三角瓶为好氧(CK1)和厌氧(CK2)对照,每个处理3个重复。培养结束后采用K2培养基对土壤中的尖孢镰刀菌进行平板涂布计数。
1.4 RSD过程中产有机酸种类的鉴定
将150 g拌有玉米秸秆(1%,W/W)的病土装入圆柱形的容器(内径5 cm,高15 cm)中,然后加入75 mL去离子水,末端密封,将土柱置于25℃的培养箱中培养10 d。以未混有玉米秸秆的病土为对照,每个处理3个重复。培养结束后,用土壤溶液采样器采集土壤溶液,过0.45μm滤膜后4℃保存备用。
使用高效液相色谱(HPLC)测定土壤溶液中的有机酸。HPLC采用XDB-C18柱(4.6×250 mm, Agilent,USA),并以2.5 mmol/L H2SO4(A)和甲醇(B)为流动相。梯度洗脱步骤为:0 min,95%A +5%B;5 min,95%A+5%B;8 min,85%A+ 15%;40 min,85%A+15%B。流速为1 m L/min,紫外检测波长为210 nm。
1.5 不同浓度有机酸对病原菌数量的抑制试验
将50 mL不同浓度的有机酸溶液加入装有50 g病土的250 m L三角瓶中,置于25℃的培养箱中培养5 d,以去离子水作为对照,每个处理3个重复。培养结束后通过平板稀释涂布计数法检测土壤中茄劳尔氏菌(M-SMSA培养基)和辣椒疫霉(燕麦培养基)的数量。采用荧光定量PCR检测立枯丝核菌和尖孢镰刀菌的数量,土壤DNA的提取采用Power-Soil®DNA提取试剂盒(MO-BIO,美国),荧光定量PCR反应体系和反应条件参照文献[14,16],立枯丝核菌和尖孢镰刀菌的特异性引物分别为ST-RS1(F) 5'-AGTGTTATGCTTGGTTCCACT-3',ITS4(R)5'-TCCTCCGCTTATTGATATGC-3'和ITS1-F(F)5'-CTTGGTCATTTAGAGGAAGTAA-3',AFP308(R) 5'-CGAATTAACGCGAGTCCCAAC-3'。
1.6 有机酸对尖孢镰刀菌孢子萌发和菌丝生长的影响
将活化后的尖孢镰刀菌菌丝块(直径5 mm)转接至含稀释4倍的马铃薯蔗糖培养基(potato dextrose agar,PDA)的平板中间,25℃培养1 d,然后在距菌丝中心3 cm的位置放置牛津杯,在牛津杯里加入100 mmol/L有机酸,25℃再培养2 d后观察菌落形态。1/4 PDA培养基熔化冷却后加入过滤除菌的有机酸,混合均匀倒平板,制备含不同浓度不同种类有机酸的1/4 PDA平板,将活化后的尖孢镰刀菌菌丝块转接至上述1/4 PDA平板中间,25℃培养3 d后测定菌落直径。参照文献[17]制备尖孢镰刀菌孢子悬浮液,使其浓度为每毫升小于1 000个孢子。在含有不同浓度有机酸的2%水琼脂平板上涂布0.1 m L上述孢子悬浮液,平板置于培养箱中25℃培养3 d,统计平板上萌发的孢子数。
1.7 数据处理
试验数据处理使用Excel 2003和SPSS 13.0 (SPSS Inc.,Chicago,USA)统计分析软件。
2 结果与分析
2.1 抑制尖孢镰刀菌有机酸的筛选
本研究参照文献报道选择了RSD过程中可能产生的8种有机酸,检测其对土壤中尖孢镰刀菌数量的影响。结果表明(图1):乙酸、丙酸、丁酸和异戊酸能显著降低土壤中尖孢镰刀菌的数量,其中异戊酸对病原菌的抑制作用最强,加入50 mmol/L异戊酸溶液的土壤中尖孢镰刀菌数量仅为对照(CK2)的7.4%;乙酸和丁酸次之,加入50 mmol/L乙酸和丁酸溶液的土壤中尖孢镰刀菌数量分别为对照(CK2)的16.2%和11.5%;丙酸的抑制作用最弱。相较而言,另4种有机酸对于尖孢镰刀菌并无抑制作用,与CK2相比,加入顺丁烯二酸、乳酸、柠檬酸和蚁酸溶液的土壤中尖孢镰刀菌数量反而显著增加。
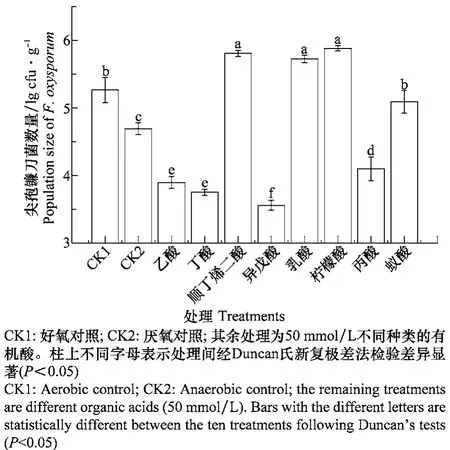
图1 土壤中添加50 mmol/L不同种类有机酸处理5 d后的尖孢镰刀菌数量Fig.1 The population of Fusarium oxysporum in the soil after treated with 50 mmol/L different organic acids solutions for 5 days
2.2 RSD过程中产生有机酸种类的鉴定
土壤溶液HPLC测定结果(图2)表明,添加1%玉米秸秆并持续淹水10 d的土壤中产生了大量的乙酸和丁酸,此外还有少量的丙酸,而并未检测到异戊酸。在只淹水未添加有机物料的土壤溶液中没有检测到有机酸。

图2 HPLC测定RSD处理的土壤溶液中的有机酸种类图谱Fig.2 Identification of organic acids in the soil treated by RSD using HPLC
2.3 有机酸对于土壤中病原菌数量的影响
不同浓度的4种抑菌有机酸对病原菌数量影响试验结果(图3)表明:4种有机酸都能显著降低土壤中立枯丝核菌、辣椒疫霉、尖孢镰刀菌及茄劳尔氏菌的数量(P<0.05),其中,立枯丝核菌、尖孢镰刀菌及茄劳尔氏菌数量降幅较大。在这4种有机酸中,异戊酸对于病原菌的抑制作用最强,乙酸和丁酸次之,丙酸最弱;并且随着有机酸浓度的增加,对病原菌的抑制作用呈上升趋势。加入50 mmol/L异戊酸溶液的土壤中立枯丝核菌、辣椒疫霉、尖孢镰刀菌及茄劳尔氏菌的数量分别为对照(添加去离子水的病土)的3.1%、25.7%、5.2%和4.4%;加入50 mmol/L丁酸溶液的土壤中立枯丝核菌、辣椒疫霉、尖孢镰刀菌及茄劳尔氏菌的数量分别为对照的3.5%、38.9%、11.5%和7.9%。
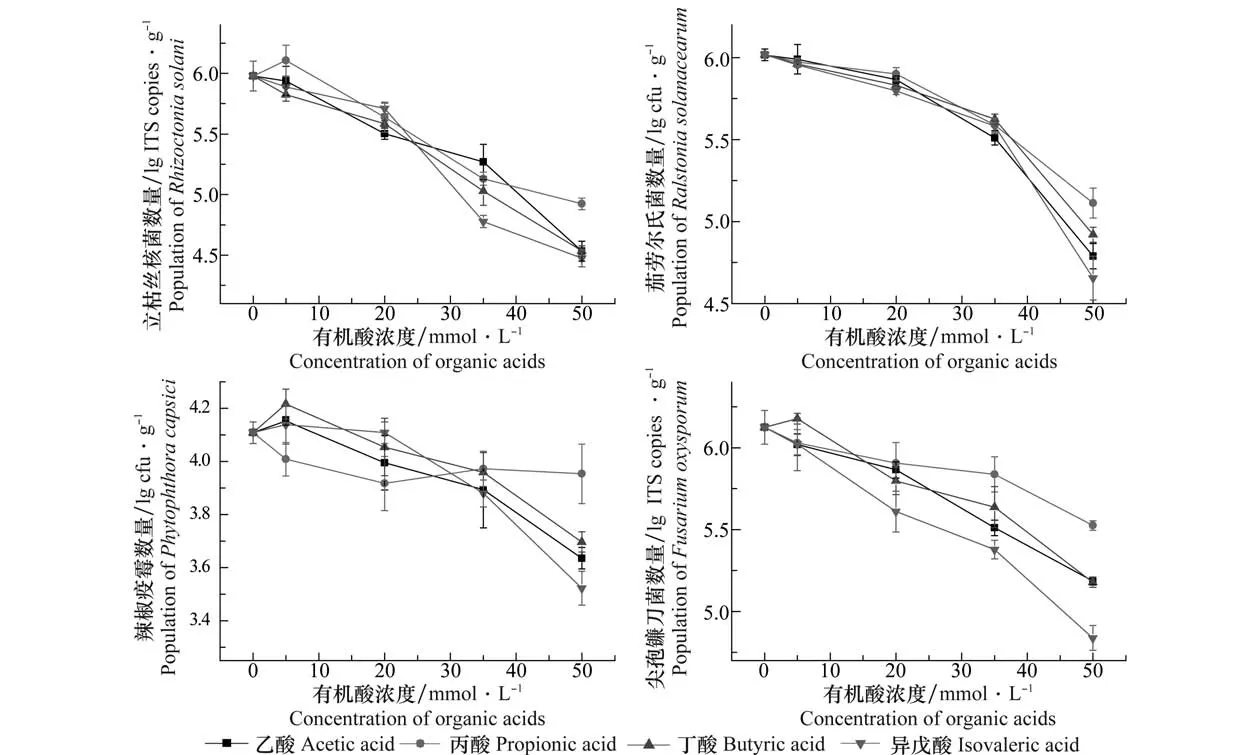
图3 经不同浓度4种有机酸溶液处理后土壤中不同植物病原菌数量的变化Fig.3 Change of the populations of different plant pathogens in the soils treated with four kinds of toxic organic acid solutions with different concentrations
2.4 有机酸对尖孢镰刀菌孢子萌发和菌丝生长的影响
如图4所示,4种有机酸均能显著抑制尖孢镰刀菌的菌丝生长和孢子萌发,并且抑制作用随着有机酸浓度的增加而增强。其中丁酸和异戊酸对尖孢镰刀菌的抑制作用较强;10 mmol/L的丁酸和异戊酸可以完全抑制尖孢镰刀菌的菌丝生长;5 mmol/L丁酸和异戊酸即可完全抑制尖孢镰刀菌的孢子萌发。

图4 含有不同浓度4种有机酸的1/4 PDA培养基对尖孢镰刀菌菌丝生长和孢子萌发的影响Fig.4 Influences of 1/4 PDA medium with different concentrations of the four toxic organic acids on the mycelium growth and the spore germination of Fusarium oxysporum
此外,在牛津杯试验中(图5)可以明显观察到4种有机酸抑制尖孢镰刀菌菌丝生长而使其形成椭圆形的菌落。

图5 牛津杯试验测定不同种类有机酸(100 mmol/L)对尖孢镰刀菌菌丝生长的抑制作用Fig.5 Determination of the inhibitory effect of different organic acids(100 mmol/L)on the growth of Fusarium oxysporum mycelia using Oxford cups
3 讨论
RSD已被许多研究证实是一种可以降低土壤病原真菌及线虫数量的有效技术[910,18]。随后许多研究结果,如RSD处理过程中土壤p H下降及有机酸产生菌,如梭菌属(Clostridium spp.)的出现等,表明RSD过程中产生的有机酸可能是RSD具有杀菌效果的重要原因[19]。这些有机酸可能有乙酸、丁酸、顺丁烯二酸、异戊酸、乳酸、柠檬酸、丙酸和蚁酸[15]。本试验结果表明,乙酸、丙酸、丁酸和异戊酸可以显著降低土壤病原菌数量。随后对RSD过程中土壤溶液的HPLC测定结果表明,以玉米秸秆为有机碳源的RSD处理过程中产生了大量的乙酸和丁酸,此外还有少量的丙酸。Momma等在以乙醇为有机碳源的RSD中检测到了大量的乙酸[20],还有报道指出以麦麸或葡萄糖为碳源的RSD处理的土壤中产生了乙酸和丁酸[19,21]。这些研究表明了不论是何种有机物料,乙酸和丁酸是RSD处理过程中产生的主要抑菌有机酸。此外,顺丁烯二酸、乳酸、柠檬酸和蚁酸显著增加了土壤中病原菌数量,原因可能是这4种有机酸为病原菌提供了营养,促进了病原菌的生长。
Goud等使用RSD法防控大丽轮枝菌(Verticillium dahliae)引起的梓树黄萎病[22],Messiha等使用RSD法防控茄劳尔氏菌引起的土豆青枯病[23],Yossen等使用RSD法防控尖孢镰刀菌引起的康乃馨枯萎病[24],这些研究表明RSD是一种广谱性的杀灭土壤病原菌进而防控土传病害的有效方法。本研究结果同样表明,RSD过程中产生的有机酸对多种土传病原菌(茄劳尔氏菌、立枯丝核菌、尖孢镰刀菌、辣椒疫霉)具有杀灭效果,50 mmol/L的乙酸和丁酸处理过的土壤中这4种病原菌的数量分别为对照的5.9%、3.5%、11.7%、33.9%和7.9%、3.6%、11.5%、38.9%。Momma等报道指出在以乙醇为有机碳源的RSD处理土壤中可以产生约3 000 mg/L(50 mmol/ L)的乙酸,在以麦麸为有机碳源的RSD处理土壤中可以产生约2 000 mg/L(33 mmol/L)的乙酸和1 700 mg/L(19 mmol/L)的丁酸[1920],这些报道结合本研究结果表明,RSD过程中产生的有机酸对于RSD的杀菌效果起着重要的作用。此外,较低浓度的有机酸也可对病原菌起抑制作用,如10 mmol/L的丁酸可以完全抑制尖孢镰刀菌菌丝的生长;5 mmol/L的丁酸能够不可逆地抑制尖孢镰刀菌的孢子萌发,此结果与前人报道相似,即经约10 mmol/L的丁酸溶液处理后的尖孢镰刀菌分生孢子不能复苏[19]。本研究丰富了RSD的杀菌机理,明确了RSD过程中产生的主要有机酸的种类及不同浓度的有机酸对土壤病原微生物的抑制效果,尽管如此,我们并不能排除RSD过程中还产生了除有机酸以外的杀菌物质的可能性,如铁锰离子、氨气和硫化氢[15]等,还有待进一步研究。
[1] 李世东,缪作清,高卫东.我国农林园艺作物土传病害发生和防治现状及对策分析[J].中国生物防治学报,2011,27(4):433-440.
[2] 何欣,黄启为,杨兴明,等.香蕉枯萎病致病菌筛选及致病菌浓度对香蕉枯萎病的影响[J].中国农业科学,2010,43(18):3809-3816.
[3] Chinn S H F,Sallans B J,Ledingham R J.Spore populations of Helminthosporium sativum in soils in relation to the occurrence of common rootrot of wheat[J].Canadian Journal of Plant Science,1962,42(4):720-727.
[4] Oka Y.Mechanisms of nematode suppression by organic soil amendments—A review[J].Applied Soil Ecology,2010,44 (2):101-115.
[5] Katan J.Physical and cultural methods for the management of soilborne pathogens[J].Crop Protection,2000,19(8/10):725-731.
[6] Li Weiming,Qian Chenmei,Mo Yiwei,et al.Tolerance of banana for Fusarium wilt is associated with early H2O2accumulation in the roots[J].African Journal of Biotechnology, 2011,10(55):11378-11387.
[7] Blok W J,Lamers J G,Termorshuizen A J,et al.Control of soilborne plant pathogens by incorporating fresh organic amendments followed by tarping[J].Phytopathology,2000, 90(3):253-259.
[8] Shinmura A.Causal agent and control of root rot of welsh onion [C].PSJ Soilborne Disease Workshop Report,2000,20:133-143.
[9] Butler D M,Kokalis-Burelle N,Muramoto J,et al.Impact of anaerobic soil disinfestation combined with soil solarization on plant-parasitic nematodes and introduced inoculum of soilborne plant pathogens in raised-bed vegetable production[J].Crop Protection,2012,39:33-40.
[10]Momma N,Kobara Y,Uematsu S,et al.Development of biological soil disinfestations in Japan[J].Applied Microbiology and Biotechnology,2013,97(9):3801-3809.
[11]Sun E J,Su H J,Ko W H.Identification of Fusarium oxysporum f.sp.cubense Race 4 from soil or host tissue by cultural characters[J].Phytopathology,1978,68(11):1672-1673.
[12]French E R,Gutarra L,Aley P,et al.Culture media for Ralstonia solanacearum isolation,identification and maintenance [J].Fitopatolgia,1995,30(3):126-130.
[13]朱桂宁,黄福新,秦碧霞,等.致病疫霉的分离培养和单孢纯化方法[J].中国蔬菜,2003(6):41-42.
[14]Huang Xingqi,Zhang Nan,Yong Xiaoyu,et al.Biocontrol of Rhizoctonia solani damping-off disease in cucumber with Bacillus pumilus SQR-N43[J].Microbiological Research,2012, 167(3):135-143.
[15]Runia W T,Molendijk L P G.Physical methods for soil disinfestation in intensive agriculture:Old methods and new approaches[J].Acta Horticulturae,2010,883:249-258.
[16]赵爽,罗佳,凌宁,等.基因宏阵列和荧光定量PCR方法对西瓜枯萎病害土壤中尖孢镰刀菌的快速检测和定量[J].土壤学报,2010,47(4):703-708.
[17]Ling Ning,Huang Qiwei,Guo Shiwei,et al.Paenibacillus polymyxa SQR-21 systemically affects root exudates of watermelon to decrease the conidial germination of Fusarium oxysporum f.sp.niveum[J].Plant and Soil 2011,341(1/2):485-493.
[18]Katase M,Kubo C,Ushio S,et al.Nematicidal activity of volatile fatty acids generated from wheat bran in reductive soil disinfestation[J].Nematology Reasearch,2009,39(2):53-62.
[19]Momma N,Yamamoto K,Simandi P,et al.Role of organic acids in the mechanisms of biological soil disinfestation(BSD) [J].Journal of General Plant Pathology,2006,72(4):247-252.
[20]Momma N,Kobara Y,Momma M.Fe2+and Mn2+,potential agents to induce suppression of Fusarium oxysporum for biological soil disinfestation[J].Journal of General Plant Pathology,2011,77 (6):331-335.
[21]Okazaki H,Nose K.Acetic acid and n-butyric acid as causal agents of fungicidal activity of glucose-amended flooded soil[J]. Annals of the Phytopathological Society of Japan,1986,52 (3):384-393.
[22]Goud J K C,Termorshuizen A J,Blok W J,et al.Long-term effect of biological soil disinfestation on Verticillium wilt[J]. Plant Disease,2004,88(7):688-694.
[23]Messiha N A S,van Diepeningen A D,Wenneker M,et al.Biological Soil Disinfestation(BSD),a new control method for potato brown rot,caused by Ralstonia solanacearum race 3 biovar 2[J].European Journal of Plant Pathology,2007,117 (4):403-415.
[24]Yossen V,Zumelzu G,Gasoni L,et al.Effect of soil reductive sterilisation on Fusarium wilt in greenhouse carnation in Córdoba,Argentina[J].Australasian Plant Pathology,2008, 37(5):520-522.
(责任编辑:田 喆)
Inhibitory effects of organic acids produced in reductive soil disinfestation on soil-borne plant pathogens
Huang Xinqi1,2, Wen Teng1, Meng Lei3, Zhang Jinbo1,2, Cai Zucong1,2
(1.School of Geography Science,Nanjing Normal University,Nanjing 210023,China; 2.Jiangsu Provincial Key Laboratory of Materials Cycling and Pollution Control,Nanjing 210023,China; 3.College of Agriculture,Hainan University,Haikou 570228,China)
Reductive soil disinfestation(RSD)is an effective way to suppress soil-borne plant pathogens.Although it is increasingly used in USA,Netherlands and Japan,its precise mechanism has not been well elucidated so far. High performance liquid chromatography and quantitative real-time PCR were used for investigating the organic acids produced in maize straw amended RSD and the inhibitory effect of organic acids on the soilborne pathogens in this work.The results showed that acetic acid and butyric acid were the primary compounds produced in maize straw amended RSD.The populations of Rhizoctonia solani,Phytophthora capsici,Fusarium oxysporum and Ralstonia solanacearum in the diseased soil treated by 50 mmol/L butyric acid solution decreased by 96.5%,61.1%, 88.5%and 82.1%,respectively,compared with those in non-treated diseased soil.The growth of F.oxysporum mycelium was completely stopped in 1/4 potato dextrose agar medium containing 5 mmol/L butyric acid,and 5 mmol/L butyric acid could entirely inhibit the germination of F.oxysporum spores.This work together with previous reports indicated that organic acids,especially acetic and butyric acid,played an important role in the mechanism of RSD.
soil-borne disease; acetic acid; butyric acid; Fusarium oxysporum
S 432.4
A
10.3969/j.issn.0529-1542.2015.06.006
2014-09-05
201411-04
国家自然科学基金项目(41301335);高等学校博士学科点专项科研基金(20133207120018);中国博士后科学基金(2014M551622);江苏高校优势学科建设工程
*通信作者 E-mail:zccai@njnu.edu.cn

