辣椒叶片中类胡萝卜素组分分离及测定方法的研究
胡玉琴,郁继华,王小龙,吴天珍,颉建明*
(甘肃农业大学园艺学院,甘肃兰州 730070)
辣椒叶片中类胡萝卜素组分分离及测定方法的研究
胡玉琴,郁继华,王小龙,吴天珍,颉建明*
(甘肃农业大学园艺学院,甘肃兰州 730070)
建立辣椒叶片中类胡萝卜素组分及其含量的分离测定方法.通过对提取溶剂、皂化温度、皂化时间、KOH-乙醇皂化液质量浓度、KOH-乙醇皂化液体积、料液比的选择,以及对流动相、柱温、柱流速等色谱条件的考察,研究提取辣椒叶片类胡萝卜素工艺流程.建立了提取辣椒叶片中类胡萝卜素的适宜工艺和分离测定辣椒叶片中类胡萝卜素组分及其含量的RP-HPLC工艺.技术关键是:以石油醚为提取溶剂、皂化温度为80 ℃、皂化时间为40 min、皂化液质量浓度为20%、皂化液体积为10 mL、料液比为1∶5;采用YMC-C30色谱柱(250 mm×4.6 mm i.d,5 μm);检测波长450 nm;柱流速1.0 mL·min-1;柱温25 ℃;流动相A为乙腈:甲醇(V∶V=60∶40),流动相B为甲基叔丁基醚(100%),梯度洗脱.结果表明以外标法定量,叶黄素、玉米黄素和β-胡萝卜素各组分的线性关系良好,相关性系数在0.996 1~0.999 9之间;平均回收率在85.2%~95.1%之间.该方法为辣椒叶片中叶黄素、玉米黄素和β-胡萝卜素的分离与定量测定提供了方法保证.
辣椒叶片;类胡萝卜素;分离测定;方法
辣椒(CapsicumannuumL)是我国日光温室栽培的主要蔬菜,西北地区低温弱光是造成蔬菜质量不佳的主要原因[1-3],因此筛选培育辣椒耐性设施专用品种是蔬菜育种的任务之一.颉建明等[4-6]的研究表明,辣椒品种的耐性与辣椒叶片中总类胡萝卜素的含量有一定的相关性.但决定辣椒品种耐弱光性及耐低温弱光性的主要类胡萝卜素组分还不明确.植物体中的类胡萝卜素在光合作用中有吸收光能和保护光合机构的作用[7-10],新黄质、叶黄素、紫黄质、玉米黄素、β-胡萝卜素等在植物中发挥着重要作用[11-13],玉米黄素能够抵抗过剩光能对光合机构的伤害[14];β-胡萝卜素是一种重要的光破坏防御物质[15];叶黄素是捕光色素蛋白复合体的一部分[16].因此,探明决定辣椒品种耐性的主要类胡萝卜素组分,对筛选辣椒耐性品种具有重要意义.本研究以辣椒叶片为试验材料,通过对提取溶剂、皂化温度、皂化时间、KOH-乙醇皂化液质量浓度、KOH-乙醇皂化液体积和料液比的选择,以及对色谱条件进行考察,旨在建立对辣椒叶片中类胡萝卜素组分及其含量分离测定的RP-HPLC,为辣椒叶片中叶黄素、玉米黄素和β-胡萝卜素的分离与定量测定提供方法保证.
1 材料与方法
1.1 实验材料
陇椒3号为供试辣椒,育苗基质由甘肃农业大学园艺学院提供,温室内育苗基质中育苗,采集辣椒幼苗叶片,称量后用锡箔纸包好辣椒叶片放入自封袋中,-80 ℃环境下保存.
1.2 试剂与仪器
叶黄素(Lutein)、玉米黄素(Zeaxanthin)标准样品由chromadex公司生产提供;β-胡萝卜素(β-carotene)标准样品由美国sigma公司提供;甲醇、乙腈和甲基叔丁基醚为美国sigma公司生产的色谱纯试剂;甲醇、乙醇、石油醚、二氯甲烷、乙酸乙酯、丙酮、2,6-二叔丁基对甲酚(BHT)、氢氧化钾(KOH)等为国产分析纯试剂.
高效液相色谱仪(Agilent 1100 series DAD,America)、KH3200B型超声波清洗器、QL-866型涡旋混合器.
1.3 实验设计
1.3.1 提取溶剂和料液比的筛选 分别以石油醚、二氯甲烷、乙酸乙酯、丙酮、甲醇等5种溶液作为提取溶剂,筛选出适宜辣椒叶片类胡萝卜素组分分离的提取溶剂.设置料液比(样品质量∶提取溶剂)为1∶1,1∶3,1∶5,1∶7,1∶9,筛选提取辣椒叶片的适宜料液比.
1.3.2 皂化条件的优化 设置不同的皂化温度、皂化时间、皂化液质量浓度和皂化液体积,筛选优化辣椒叶片类胡萝卜素的皂化条件.皂化温度设置为50,60,70,80,90 ℃;皂化时间设置为10,20,30,40,50 min;乙醇-KOH皂化液质量浓度设置为10%,20%,30%,40%,50%;乙醇-KOH皂化液体积设置为5,8,10,12,15 mL.
1.4 样品制备
准确称取5.00 g待测辣椒叶片试样,加入少量石英砂和抗氧化剂BHT,冰浴研磨后加入KOH-乙醇溶液,并置于水浴锅中加热一定时间,冷却后加石油醚,取上清液并定容,取一定量的醚液进行浓缩,用体积比为9∶1的甲醇-甲基叔丁基醚混合液定容,再用有机滤膜过滤器过滤.
1.5 色谱条件
色谱柱 YMC C30色谱柱(250 mm×4.6 mm i.d,5 μm);检测波长450 nm;柱流速1.0 mL·min-1;柱温25 ℃;进样量10 μL;流动相A为乙腈∶甲醇(V乙腈∶V甲醇=60∶40),流动相B为甲基叔丁基醚(100%);DAD检测器;梯度洗脱见表1.

表1 梯度洗脱程序
1.6 数据统计
使用Microsoft Excel和SPSS软件对相关数据进行统计分析.
2 结果与分析
2.1 前处理方法的选择
2.1.1 提取溶剂 以二氯甲烷、石油醚、乙酸乙酯、丙酮、甲醇为提取溶剂,利用液相色谱法测定的辣椒叶片中叶黄素、β-胡萝卜素和玉米黄素的含量见图1. 5种提取溶剂中,石油醚提取的以上三种类胡萝卜素含量均最高,甲醇提取叶黄素和β-胡萝卜素的含量最低,乙酸乙酯提取玉米黄素的含量最低.同时,以石油醚为提取溶剂时,色谱图峰型良好,基线平稳;以乙酸乙酯和甲醇为提取溶剂时,色谱图杂峰多,部分杂峰的峰值高于目标物的峰值,存在非目标物质.因此选择石油醚作为辣椒叶片中类胡萝卜素的适宜提取溶剂进行试验.

图1 不同溶剂对辣椒叶片类胡萝卜素提取效果的影响Fig 1 The extraction effect for pepper leaves carotenoids in different extraction solvent
2.1.2 皂化温度 由图2可知,在80 ℃条件下,叶黄素、玉米黄素和β-胡萝卜素3种类胡萝卜素含量均最高,提取效果最好,在此温度下非目标物的影响最小,皂化最完全.在其他温度条件下,超过80 ℃后,随着温度的升高3种类胡萝卜素的含量均呈现显著下降的趋势.温度太低则皂化不完全,杂质较多,会影响目标物的测定,达不到分离纯化的目的.因此,80 ℃为皂化辣椒叶片类胡萝卜素的适宜温度.
2.1.3 皂化时间 图3表明,叶黄素、玉米黄素和β-胡萝卜素的含量随着皂化时间的延长而增大,皂化时间为40 min时,3种类胡萝卜素的含量最高,类胡萝卜素皂化完全;随着皂化时间的进一步延长,上述3种类胡萝卜素的含量均下降,可能是因为类胡萝卜素不稳定,反应时间过长导致降解.皂化时间过短,达不到皂化的目的;皂化时间过长,又会对类胡萝卜素造成破坏.综合判断,40 min为辣椒叶片类胡萝卜素的适宜皂化时间.

图2 不同皂化温度下辣椒叶片类胡萝卜素含量的变化Fig 2 The changes of pepper leaves carotenoid content in different saponification temperature

图3 不同皂化时间下辣椒叶片类胡萝卜素含量的变化Fig 3 The changes of pepper leaves carotenoid content in different saponification time
2.1.4 KOH-乙醇皂化液质量浓度 由图4可以看出,当KOH-乙醇溶液的浓度为20%时,叶黄素、玉米黄素和β-胡萝卜素的含量均最高;KOH-乙醇溶液的浓度高于20%时,随着浓度的升高,3种类胡萝卜素的含量呈下降趋势,可能是因为高浓度的强碱环境导致游离类胡萝卜素分解,降低了类胡萝卜素的得率;KOH-乙醇溶液的浓度过低、碱量过小时,类胡萝卜素皂化不完全,同样降低了类胡萝卜素的得率.所以质量浓度为20%的KOH-乙醇溶液为辣椒叶片类胡萝卜素适宜的皂化液浓度.
2.1.5 KOH-乙醇皂化液体积 由图5可知,在皂化液体积为10 mL时,叶黄素、玉米黄素和β-胡萝卜素的含量均最高;当皂化液体积低于10 mL时,随着皂化液体积的增大,3种类胡萝卜素的测出含量也随之增大;当皂化液体积高于10 mL时,随着皂化液体积的增大,类胡萝卜素的含量呈下降趋势,可能是因为皂化液质量浓度过大使类胡萝卜素提取液皂化过度,导致类胡萝卜素降解.表明辣椒叶片类胡萝卜素适宜的皂化液体积为10 mL.

图4 不同皂化液质量浓度下辣椒叶片 类胡萝卜素含量的变化Fig 4 The change of pepper leaves carotenoid content in different saponification solution mass concentration
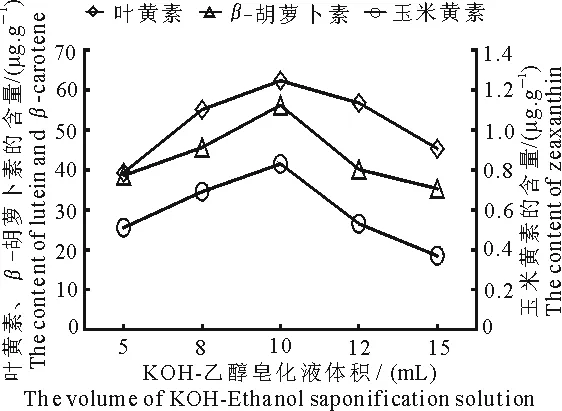
图5 不同皂化液体积下辣椒叶片 类胡萝卜素含量的变化Fig 5 The change of pepper leaves carotenoid content in different saponification solution volume
2.1.6 料液比 由图6可以看出,当料液比低于1∶5时,随着浸提取溶剂比率的增大,叶黄素、玉米黄素和β-胡萝卜素含量也相应增大,可能是因为在辣椒叶片质量不变的情况下,增加提取溶剂的体积会使得物质的溶出速率增大,更有利于类胡萝卜素的提取;料液比高于1∶5时,上述3种类胡萝卜素含量增加的趋势明显变缓并逐渐趋于稳定,可能是因为过多的溶剂将辣椒叶片中的其他可溶性物质提取出来,增加了杂质的提取量.
2.2 高效液相色谱条件
2.2.1 检测波长 类胡萝卜素在400~500 nm处可表现出强吸收带,每种类胡萝卜素分子的最大吸收波长和紫外可见光谱结构有差异(图7),叶黄素、玉米黄素和β-胡萝卜素在450 nm波长处均显示出良好的响应信号和分离效果.
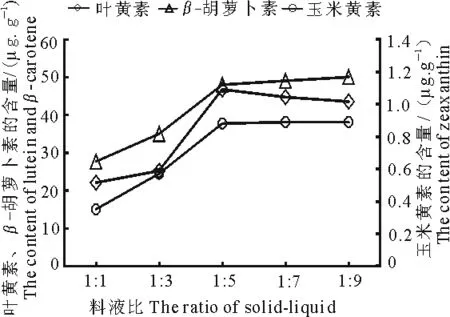
图6 不同料液比对辣椒叶片类胡萝卜素 提取效果的影响Fig 6 The extraction effect for pepper leaves carotenoids in different solid-liquid ratio

图7 叶黄素、玉米黄素和β-胡萝卜素 标样光谱扫描图Fig 7 The spectrum scan of lutein,zeaxanthin and β-carotene
2.2.2 色谱柱及流动相 采用Agilent Eclipse plus C18(250×4.6,5 μm)色谱柱和YMC C30(250×4.6,5 μm)色谱柱,选择甲醇-异丙醇-水、乙腈-甲醇-二氯甲烷、甲醇-二氯甲烷、丙酮-水、乙腈-甲醇-二氯甲烷、甲醇-乙腈-水、乙腈-乙酸乙酯等流动相进行色谱柱及流动相的选择试验,结果表明(图8、图9),采用Eclipse plus C18色谱柱不能有效的分离叶黄素和玉米黄素,而采用YMC C30色谱柱能完全分离叶黄素和玉米黄素(图10).
通过改变流动相的种类及比例,依据类胡萝卜素标准样品的出峰情况,筛选出适宜流动相为A乙腈∶甲醇(V乙腈∶V甲醇=60∶40);B甲基叔丁基醚(100%),梯度洗脱.该流动相下,叶黄素、玉米黄素和β-胡萝卜素的标准样品出峰时间明确,容易区分,标准样品和辣椒叶片试样的出峰时间一致,如图10、图11所示,说明此方法可对辣椒叶片类胡萝卜素进行定性定量分析.

图8 流动相:乙腈-甲醇-二氯甲烷Fig 8 Mobile phase:Acetonitrile- methanol-dicholromethane
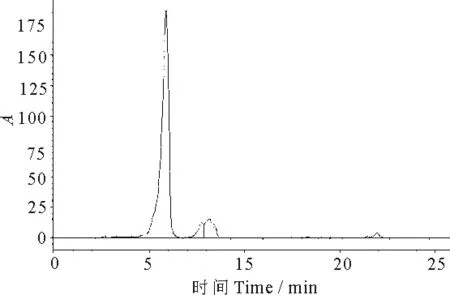
图9 流动相:甲醇-异丙醇-水Fig 9Mobile phase:Methanol-isopropanol-water
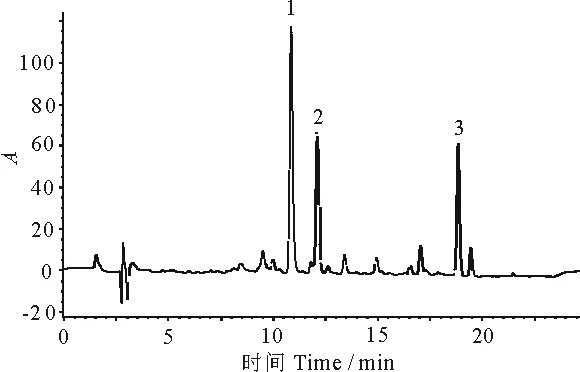
1.叶黄素(Lutein);2.玉米黄素(Zeaxanthin);3.β-胡萝卜素(β-carotene)
图10 类胡萝卜素的标准色谱图
Fig 10HPLC chromatograms of carotenoids standards

1.叶黄素(Lutein);2.玉米黄素(Zeaxanthin);3.β-胡萝卜素(β-carotene)
图11 辣椒叶片中类胡萝卜素的色谱图
Fig 11 HPLC chromatograms of carotenoids in pepper leaves
2.2.3 柱温和柱流速 设置20,25,30,35 ℃ 4种柱温,分别进行高效液相色谱分离试验.结果表明,随着柱温的升高,叶黄素、玉米黄素和β-胡萝卜素的保留时间缩短;当柱温达到30℃时,色谱图中出现较多乱峰和杂峰.综合考虑25 ℃为理想柱温.
柱流速分离效果实验表明,当柱流速为0.5 mL·min-1时,分离时间延长;当流速为1.0 mL·min-1时,叶黄素、玉米黄素和β-胡萝卜素达到完全分离的效果;当流速为1.5 mL·min-1时,分离度较差,色谱图基线不平稳.
2.2.4 标准工作曲线 分别配置不同质量浓度的标准溶液,叶黄素和β-胡萝卜素混标的浓度分别为6.25,12.5,25,50,100 mg·L-1;玉米黄素的浓度分别为0.125,0.25,0.50,1,2 mg·L-1.分别以叶黄素、玉米黄素和β-胡萝卜素标品的浓度为x轴,以色谱峰面积为y轴,建立线性回归方程.根据信噪比S/N=3,确定3种类胡萝卜素的最低检测限,结果见表2.
2.3 新建辣椒叶片类胡萝素HPLC法回收率
准确称取相同的待测辣椒叶片2份,其中1份为空白对照,另1份加入已知量的混合标液,HPLC测定,计算各组分的回收率和相对标准偏差.结果表明,玉米黄素、叶黄素和β-胡萝卜素的平均回收率在85.2~95.1%之间(表3).

表2 类胡萝卜素的回归方程、线性范围、相关系数及检测限
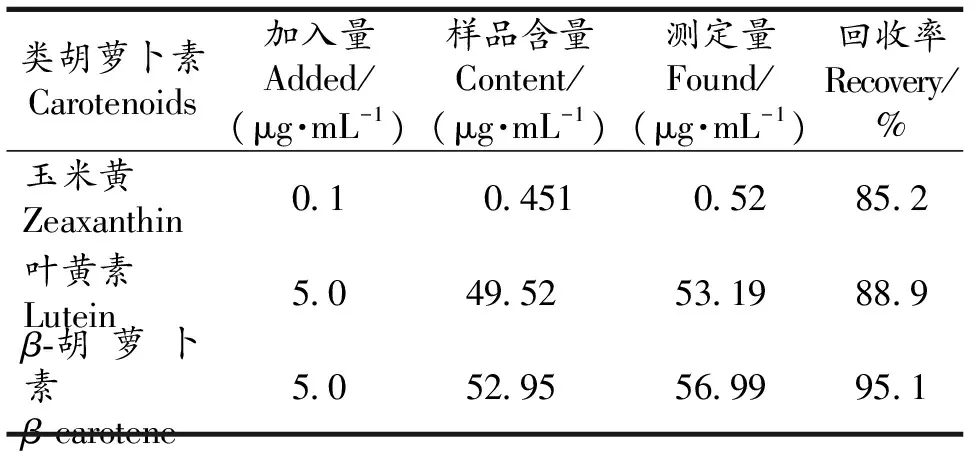
表3 新建辣椒叶片类胡萝素HPLC回收率
3 讨论
本研究以石油醚为提取溶剂,料液比为1∶5提取辣椒叶片中的类胡萝卜素,与有关学者对不同材料中类胡萝卜素的提取有一致的结论,也有不一致的结论.孙明奇[17]在提取柑橘果皮中的类胡萝卜素时,提取溶剂为丙酮和石油醚(V丙酮∶V石油醚=2∶1),料液比1∶40;刘大川等[18]对紫苏干叶中类胡萝卜素的提取溶剂是石油醚.这可能是因为不同研究材料的性质不同,对类胡萝卜素提取的难易程度不同.
皂化可除去辣椒叶片中的油脂和叶绿素[19],以简化色谱分离、准确定性和定量,是类胡萝卜素前处理过程中的一个重要环节,但皂化会引起类胡萝卜素不同程度的降解[20].
在色谱柱的考察中,C18柱对叶黄素和玉米黄素的分离效果不佳,而YMC C30柱能完全分离叶黄素和玉米黄素,这可能是因为C30柱内部优良的性能所决定的.在柱流速的筛选中,本实验以1 mL·min-1作为最佳柱流速,因为当柱流速为其他值时,会影响分离时间,且色谱图上有杂峰和乱峰,这与Christian[21]的研究结果有所不同,Christian的研究表明当柱流速为0.3 mL·min-1时可达到分离,这可能是待测样品的不同、所采用色谱柱型号不同、所用流动相等存在差异所造成.
本实验确立以石油醚为提取溶剂、皂化温度为80 ℃、皂化时间为40 min、KOH-乙醇皂化液质量浓度为20 g·100 mL、KOH-乙醇皂化液体积为10 mL、料液比为1∶5的辣椒叶片中类胡萝卜素的提取条件,以及以流动相A为乙腈∶甲醇(V乙腈∶V甲醇=60∶40),流动相B为甲基叔丁基醚(100%)的HPLC条件,建立了提取辣椒叶片中类胡萝卜素的适宜工艺和分离测定辣椒叶片中类胡萝卜素组分及其含量的RP-HPLC,为研究辣椒叶片中叶黄素、玉米黄素和β-胡萝卜素的分离与定量测定提供了方法保证.
[1] 郁继华,张国斌,冯致,等.低温弱光对辣椒幼苗抗氧化酶活性与质膜透性的影响[J].西北植物学报,2006,25(12):2478-2483.
[2] 陈青君.黄瓜低温弱光耐受性评价指标体系以及弱光耐受性QTL定位的研究[D].北京:中国农业科学院,2003.
[3] 眭晓蕾,张振贤,张宝玺,等.不同品种辣椒幼苗光合与呼吸对弱光的响应[J].中国生态农业学报,2007,15(2):88-91.
[4] 颉建明.低温弱光下辣椒生理生化变化规律及品种耐性鉴定研究 [D].兰州:甘肃农业大学.2007.
[5] 颉建明,郁继华,黄高宝,等.弱光或低温弱光下辣椒叶片类胡萝卜素含量与品种耐性的关系[J].中国农业科学,2010,43(19):4036-4044.
[6] 颉建明,郁继华,黄高宝,等.低温弱光下辣椒叶片PSII光能吸收和转换规律的变化及品种耐性的关系[J].中国农业科学,2011,44(9):1855-1862.
[7] 由淑贞,杨洪强.类胡萝卜素裂解双加氧酶及其生理功能[J].西北植物学报,2008,28(3):630-637.
[8] BRITTON G.Structure and properties of carotenoids in relation to function [J].TheFASEBJournal,1995,9(15):1551-1558.
[9] ANDERSON I C,ROBERTSON D S.Role of carotenoid in protecting chlorophyll from photo destruction [J].PlantPhysiology,1960,35:531-534.
[10] BARTLDY G E,SCOLNIK P A.Plant carotenoids:pigments for photoprotection,visual attraction,and human health [J].ThePlantCell,1995,7:1027-1038.
[11] MATSUBARA S,MOROSINOTTO T.OSMOND C B,et al.Short and long term operation of the lutein epoxide cycle in light harves-ting antenna complexes[J].PlantPhysiology,2007,144(2):926-941.
[12] MATSUBARA S,KRAUSE G H,SELTMANN M,et al.Lutein epoxide cycle,light harvesting and photoprotection in species of the tropical tree genus Inga[J].Plant,CellandEnvironment,2008,31(4):548-561.
[13] 朱蕾.玉米黄色素的分离提取及四种类胡萝卜素测定方法研究[D].北京:中国农业大学,2005.
[14]DEMMINGB,BJORKMANO.Comparisonofeffectofexcessivelightonchlorophyllfluorescence(77K)andphotonyieldofO2evolutioninleavesofhigherplants[J].Planta,1987,171:171-184.
[15] 孙小玲,许岳飞,马鲁沂,等.植株叶片的光合色素构成对遮阴的响应[J].植物生态学报,2010,34(8):989-999.
[16] 林植芳,彭长连,林桂珠.植物黄体素(Lutein)与环氧化黄体素-黄体素循环[J].植物生理学通讯,2006,42(3):385-394.
[17] 孙明奇.柑橘果皮类胡萝卜素提取鉴定及其在果皮成熟储藏中变化规律研究[D].武汉:华中农业大学,2007.
[18] 刘大川,王静.紫(白)苏叶类胡萝卜素提取工艺的研究[J].中国粮油学报,2002,17(1):54-58.
[19] RODRIGUEZ A D B.AGuidetoCarotenoidAnalysisinFoods[M].Washington D C:ILSI Press,2001:1-59.
[20] 惠伯棣,张西,文镜.反相C30柱在HPLC分析类胡萝卜素中的应用[J].食品科学,2005,26(1):264-270.
[21] CHRISTIAN W H.Development and evaluation of a new method for the determination of the carotenoid content in selected vegetables by HPLC and HPLC-MS-MS[J].JournalofChromatographicScience,2000,38:441-448.
(责任编辑 俞诗源)
Studies on separated and determined methods of the carotenoids composition in pepper leaves
HU Yu-qin,YU Ji-hua,WANG Xiao-long,WU Tian-zhen,XIE Jian-ming
(College of Horticulture,Gansu Agricultural University,Lanzhou 730070,Gansu,China)
A method that can separate and determine the composition and content of carotenoids in pepper leaves is developed.Technological process of extracting catotenoids in pepper leaves is investigated through the researches on the extraction solvent,saponification temperature,saponification time,the concentration and volume of KOH-ethanol saponification solution,ratio of solid-liquid and chromatographic conditions.In this method,the key technology for separation and determination of carotenoids in pepper leaves is the use of the petroleum ether.The saponification temperature is 80 ℃,saponification time is 40 min,the concentration of KOH-ethanol saponification solution is 20%,the volume of KOH-ethanol saponification solution is 10 mL and the ratio of solid-liquid is 1∶5.Separation and determination is achieved by using a YMC C30 colum (250 mm×4.6 mm i.d.,5 μm).A mobile phase of acetonitrile-mthanol (60∶40,v/v) (A) and methyl tert-butyl ether (100%)(B) are eluted with the gradient.Three kinds of carotenoids are resolved with the flow-rate at 1.0 mL·min-1,column temperature of 25 ℃ and the detection wavelength of 450 nm.The results show that there have good linear correlation for the lutein,zeaxanthin andβ-carotene,and the correlation coefficient is between 0.9661 and 0.9999.The average recovery of three carotenoids is between 85.2% and 95.1%.This method can be used widely to separate and determine the components and content of lutein,zeaxanthin andβ-carotene in pepper leaves.
pepper leaves;carotenoids;separation and determination;method
2014-10-15;修改稿收到日期:2014-12-02
国家自然科学基金资助项目(31260493)
胡玉琴(1987—),女,甘肃岷县人,硕士研究生.主要研究方向为蔬菜栽培生理与生长调控. E-mail:gshuyuqin@sohu.com
*通讯联系人,男,教授,博士.主要研究方向为蔬菜栽培生理及设施作物生产.E-mail:xiejianming@gsau.edu.cn
S 641.3
A
1001-988Ⅹ(2015)04-0075-06
——基于正交试验优化的皂化反应法△

