头孢唑啉钠与牛血清白蛋白的相互作用研究及共存金属离子的影响
刘 里,成飞翔,杨晓丽
(曲靖师范学院化学化工学院,云南曲靖 655011)
头孢唑啉钠与牛血清白蛋白的相互作用研究及共存金属离子的影响
刘 里,成飞翔,杨晓丽
(曲靖师范学院化学化工学院,云南曲靖 655011)
在优化的实验条件下,运用荧光光谱和紫外-可见光谱法研究了头孢唑啉钠(CS)与牛血清白蛋白(BSA)之间的相互作用,考察了Pb2+,Fe3+,Cr3+,Ni2+和Cu2+对CS与BSA相互作用的影响,计算了不同温度下的热力学参数、静态结合常数和结合位点数.结果表明,CS对BSA的猝灭机制属于形成复合物的静态猝灭过程,两者之间的作用主要是氢键或范德华力,CS在BSA中的结合位点主要位于ⅡA.Hill系数值略小于1,表明药物之间有弱的负协同作用.同步荧光光谱表明,CS对BSA构象产生一定影响,使BSA腔内疏水环境的极性增强,结合位点更接近于酪氨酸.金属离子对CS与BSA的结合常数和结合位点数均有影响,除Pb2+以外,其他金属离子都降低了其结合能力.
头孢唑啉钠(CS);牛血清白蛋白(BSA);相互作用;金属离子
头孢唑啉钠(化学名为(6R,7R)-3-[[(5-甲基-1,3,4-噻二唑-2-基)硫]甲基]-7-[(1H-四唑-1-基)乙酰氨基]-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-甲酸钠盐,分子式为C14H13N8NaO4S3,简称CS)为第一代头孢菌素,具有抗菌谱广、毒性低的特点[1],结构式见图1.
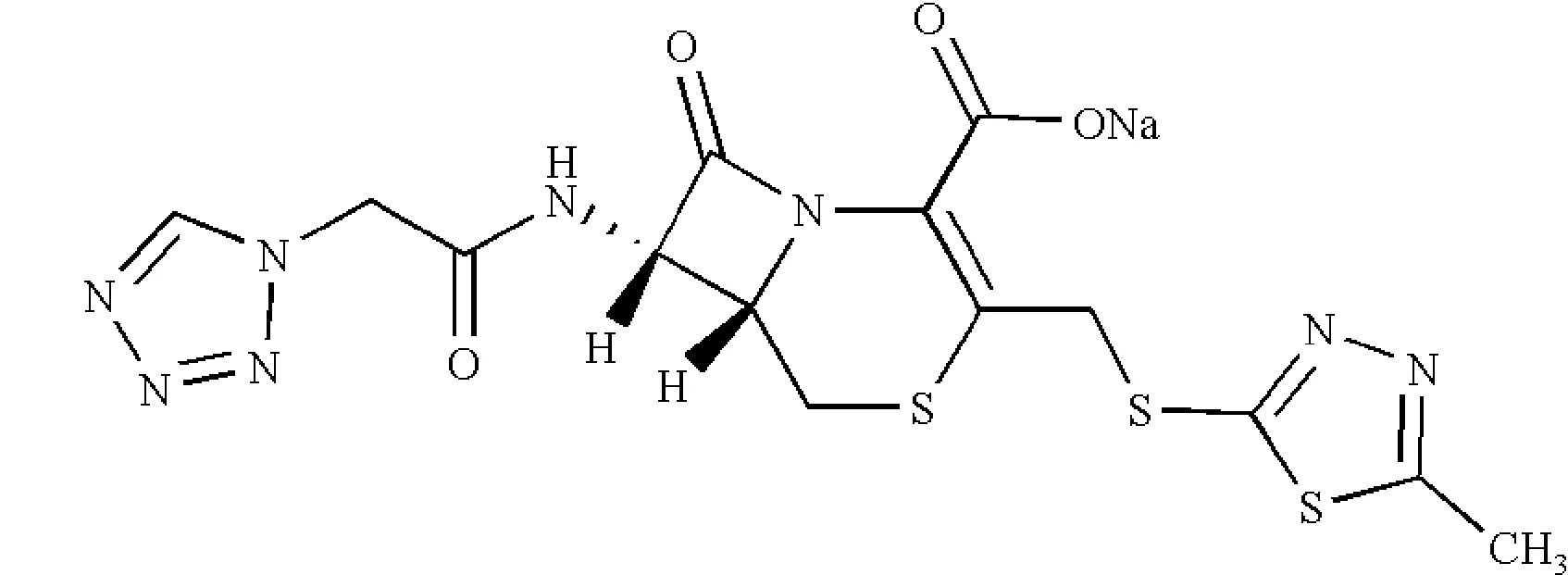
图1 头孢唑啉钠结构式Fig 1Structural formula of cefazolin sodium
血清白蛋白是血浆中最为丰富的蛋白质,能与进入血液中的药物进行可逆结合从而起到在体内转运的作用.因为结构上和人血清白蛋白的相似性,牛血清白蛋白(BSA)被广泛用于与药物结合作用的研究[2].因此,对CS与BSA的相互作用的研究有助于理解生命体内药物与蛋白的作用机制和药效的发挥以及药物毒性[2-4].以往研究药物与BSA相互作用主要集中在猝灭机理探讨上,而本文在优化实验条件下从更多角度研究了CS与BSA的结合反应,除了常规的作用机理的研究,还深入探讨了不同温度下两者的结合位点、结合力类型、结合部位、药物之间的协同性、药物对血清白蛋白构象的影响以及金属离子对CS与BSA结合反应的影响.这些研究对于阐明CS在机体内的传输、代谢过程及药理作用具有一定的参考价值.
1 实验部分
1.1 材料和仪器
牛血清白蛋白(上海楷样生物技术有限公司)配制成浓度为1.0×10-6mol·L-1的水溶液;头孢唑啉钠(97%,百灵威科技有限公司)配制成浓度为4.37×10-4mol·L-1;上述药品保存于4 ℃的冰箱中.0.5 mol·L-1NaCl溶液,0.1 mol·L-1的pH=7.40的Tris-HCl缓冲溶液;浓度为1×10-3mol·L-1Pb(NO3)2,FeCl3,CrCl3,Ni(NO3)2,CuSO4溶液;实验用水为超纯水.
日本日立公司的F-4600型荧光光谱仪;美国瓦里安技术中国有限公司的Cary-50型紫外可见分光光度计;上海虹益仪器仪表有限公司的pHS-3C型精密酸度计;上海一恒科技有限公司的DHG-9035A型超级恒温水浴.
1.2 实验方法
在10 mL比色管中依次加入1.0×10-6mol·L-1BSA溶液2 mL,不同体积的浓度为2.89×10-4mol·L-1CS溶液,0.50 mol·L-1NaCl溶液2.0 mL和0.1 mol·L-1的pH=7.40的Tris-HCl缓冲溶液1.5 mL,稀释至刻度并摇匀.分别在296,311和326 K温度下,激发与发射狭缝宽度分别为5 nm和10 nm,光电倍增负高压为700 V,固定最大激发波长(λex)为280 nm,扫描荧光猝灭光谱,最大发射波长(λem)在345 nm处,记录F0和F(F和F0分别指存在CS与不存在CS时LS-BSA的荧光强度).296 K下,按照上述方法配制溶液和设定参数扫描同步荧光光谱(Δλ=15 nm和60 nm).测定浓度比为1∶1的BSA与CS溶液的紫外吸收光谱.按照上述条件,在CS-BSA体系中加入浓度都为1.0×10-3mol·L-1金属离子0.1 mL,测荧光光谱.
2 结果与讨论
2.1 体系条件的优化
对pH值、缓冲溶液种类及用量、BSA的浓度和试剂加入顺序进行优化,结果表明,选用BSA浓度为2.0×10-7mol·L-1,缓冲溶液pH=7.40,0.01 mol·L-1的Tris-HCl溶液1.5 mL,按照BSA→CS→NaCl→Tris-HCl的顺序加入时效果最佳.
2.2 猝灭光谱
蛋白质中由于色氨酸和酪氨酸的存在使其发出荧光.蛋白质与药物小分子发生作用时,会使蛋白质的荧光强度发生变化[2].据此可以利用荧光光谱对CS与BSA的作用进行研究.图2为在优化条件下,固定激发波长为280 nm,发射波长在290~500 nm内扫描得到的荧光光谱图.由图2可知,随着CS的加入,BSA的荧光发射峰出现明显的减弱,表明CS对BSA具有猝灭作用.
2.3 猝灭机理的探讨
动态猝灭和静态猝灭是荧光猝灭的两种最主要的猝灭机理[5-7].常用温度的变化来确定猝灭类型.在动态猝灭中分子扩散起主导,猝灭常数随温度的升高而增大;对于静态猝灭,因有新物质生成,稳定性起主导作用,温度越高,猝灭常数反而越小[5-7].猝灭过程遵循S-V方程
其中,KSV为猝灭常数;Kq为猝灭过程的速率常
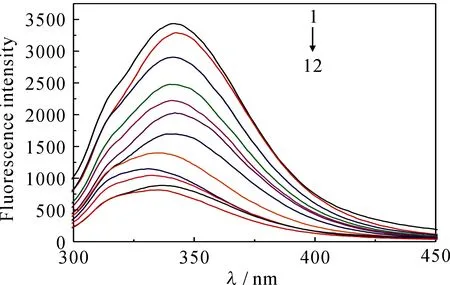
1→12.CBSA=2.0×10-7mol·L-1,CCS=(0,2.889 9,3.612 4,4.334 9,5.057 3,5.779 8,6.502 3,7.224 8,7.947 2,8.669 7,9.392 2,10.115)×10-5mol·L-1
图2 CS对BSA的猝灭光谱
Fig 2Quenching spectra of CS with BSA
数(最大值约为2.0×1010L·mol-1·s-1);τ0为荧光体平均寿命,一般为10-8s数量级;[C]为CS的浓度.假设CS对BSA的猝灭机理为动态猝灭,作出296,311和326 K温度下CS对BSA荧光猝灭的S-V曲线,如图3.所求得的KSV,Kq列于表1.表1中不同温度下所求得的Kq都远大于2.0×1010L·mol-1·s-1,说明CS对BSA的猝灭不属于动态猝灭.由图3可知,随着温度的升高,直线斜率即Ksv减小,正好与静态猝灭机理相吻合[5-7].若CS对BSA为静态猝灭,应更符合L-B方程[9]:
其中KLB为静态猝灭结合常数.(F0-F)和[C]作不同温度下的L-B曲线,结果见表2.从表2可以看出,三个温度下的相关系数都达到0.99以上,线性关系良好,其KLB值都在104个数量级,结合力很强,表明CS与BSA的结合符合静态猝灭特征.
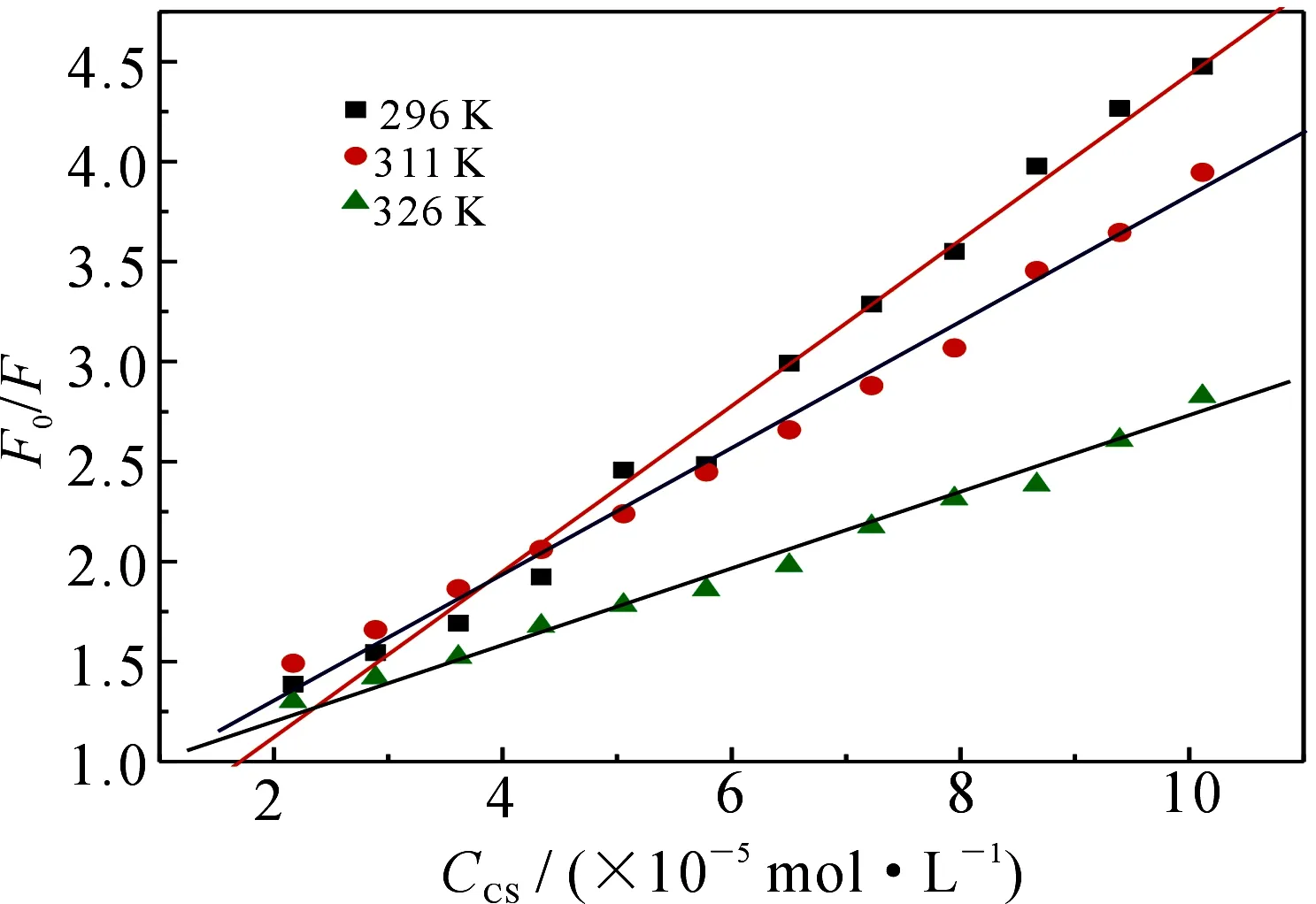
图3 CS对BSA荧光猝灭的S-V曲线Fig 3S-V plots at three different temperatures 表1 不同温度下CS和BSA的猝灭常数Tab 1S-V quenching constant at different temperatures
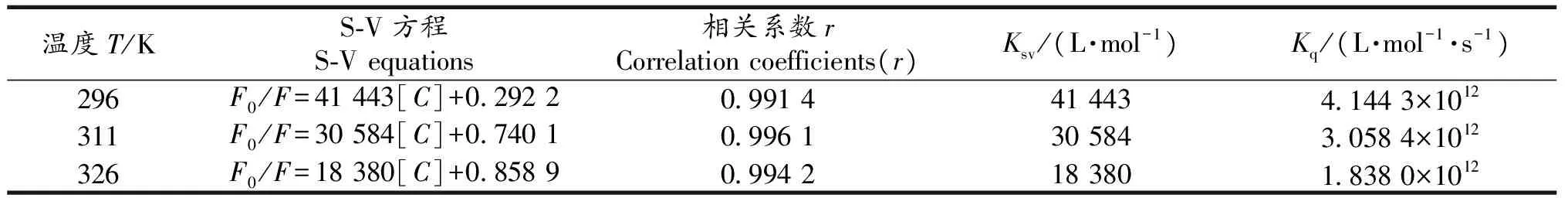
温度T/KS⁃V方程S⁃Vequations相关系数rCorrelationcoefficients(r)Ksv/(L·mol-1)Kq/(L·mol-1·s-1)296F0/F=41443[C]+02922099144144341443×1012311F0/F=30584[C]+07401099613058430584×1012326F0/F=18380[C]+08589099421838018380×1012
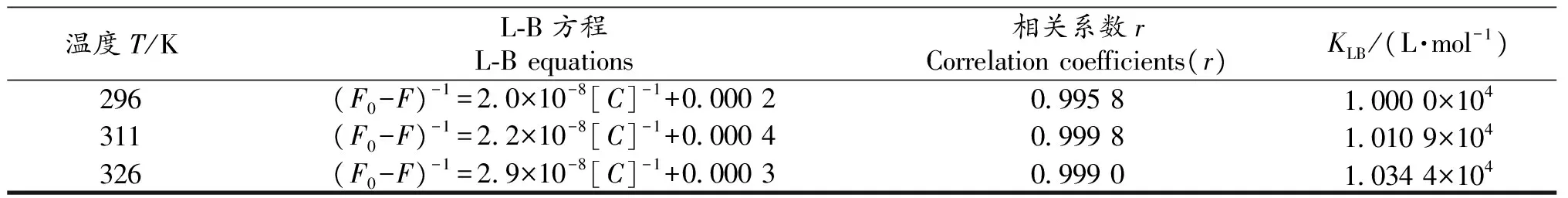
表2 L-B 线性回归方程的相关参数
紫外吸收光谱也是一种区分猝灭机理的重要方法[5-7].动态猝灭不影响荧光体的吸收光谱,而复合物的形成会引起荧光体的吸收光谱的变化[5-7].因此为了进一步证明该反应体系为静态猝灭,测定了BSA(曲线c)、CS(曲线d)、CS与BSA等摩尔混合物(曲线b)的紫外吸收曲线以及CS与BSA等摩尔混合物与CS的差谱(曲线a),结果见图4.a与c两条曲线没有重叠在一起,说明CS与BSA反应生成了新物质,猝灭机理为静态猝灭.
2.4 结合常数K以及结合位点数n
如药物小分子与生物大分子存在n个等同且独立的结合位点,它们之间相互作用关系符合
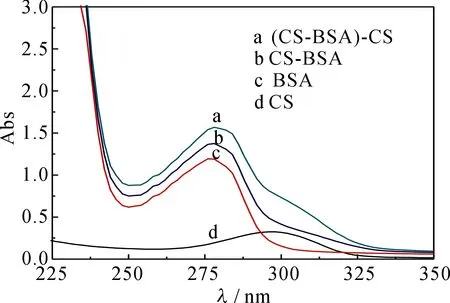
图4 CS-BSA的紫外光谱图Fig 4UV spectra of CS-BSA
Langmuir公式:
分别在296,311,326 K温度下,以lg(F0-F)/F对lg[C]作图,由直线斜率和截距可求出CS与BSA不同温度下的K及n值,结果见表3.由表3知,n≈1,表明CS与BSA可形成1个结合位点;K的值至少达到105,表明CS与BSA的结合作用较强.总体趋势来看n和K随温度升高而降低,温度的提升不利于血清白蛋白携带CS在体内进行运转、贮存和分配.
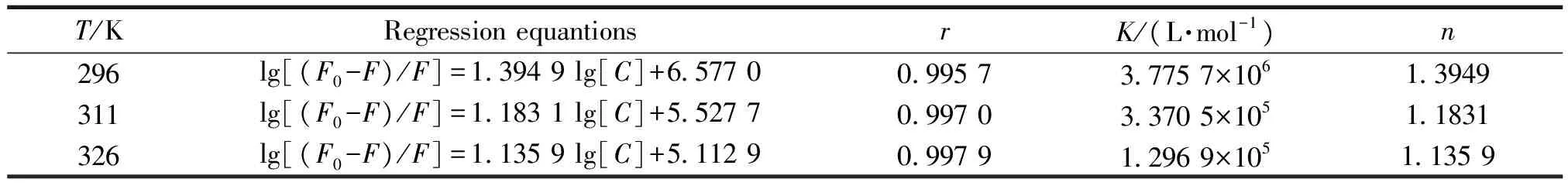
表3 CS-BSA的K和n
2.5 热力学参数和作用类型
静电引力、疏水作用力、氢键等是药物小分子与蛋白质大分子的主要结合作用力[8-11].把结合反应的焓变ΔH看作是一个常数(温度变化范围不大时)[8-11].根据热力学公式[8-11]计算CS与BSA结合反应的ΔH,熵变ΔS及吉布斯自由能变ΔG, 结果见表4.根据Ross等总结出的规则判断[11-13],ΔH<0,ΔS<0,表明氢键和范德华力是CS与BSA 之间的主要作用力.
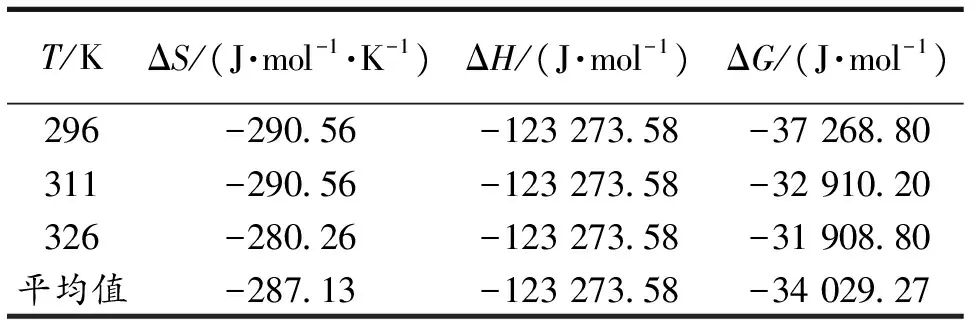
表4 CS-BSA体系的热力学参数值
2.6 结合位置的确定
与人血清白蛋白相似,BSA含有3个α-螺旋域(Ⅰ-Ⅲ),每个α-螺旋域包含两个亚螺旋域A 和 B.为确定药物小分子与BSA结合的具体位置并反映出在两者的作用过程中色氨酸残基和酪氨酸残基的实际参与情况,用Sulkowska和刘保生等[11-14]提出的方法,即比较λex=280 nm 和λex=295 nm激发时的CS与BSA浓度比与F/F0之间关系曲线.由图5可知,两种激发波长下,两条曲线是独立的,而且猝灭程度在280 nm时比295 nm时要大,说明在CS与BSA的猝灭反应中,色氨酸和酪氨酸残基都参与其中,结合位点主要位于亚螺旋域的ⅡA中.
2.7 药物协同性
刘保生等[12-15]认为药物协同性是指药物与具有多重结合部位的BSA结合过程中各结合部位之间可能存在相互影响作用,可用Hill方程[12-15]进行分析:
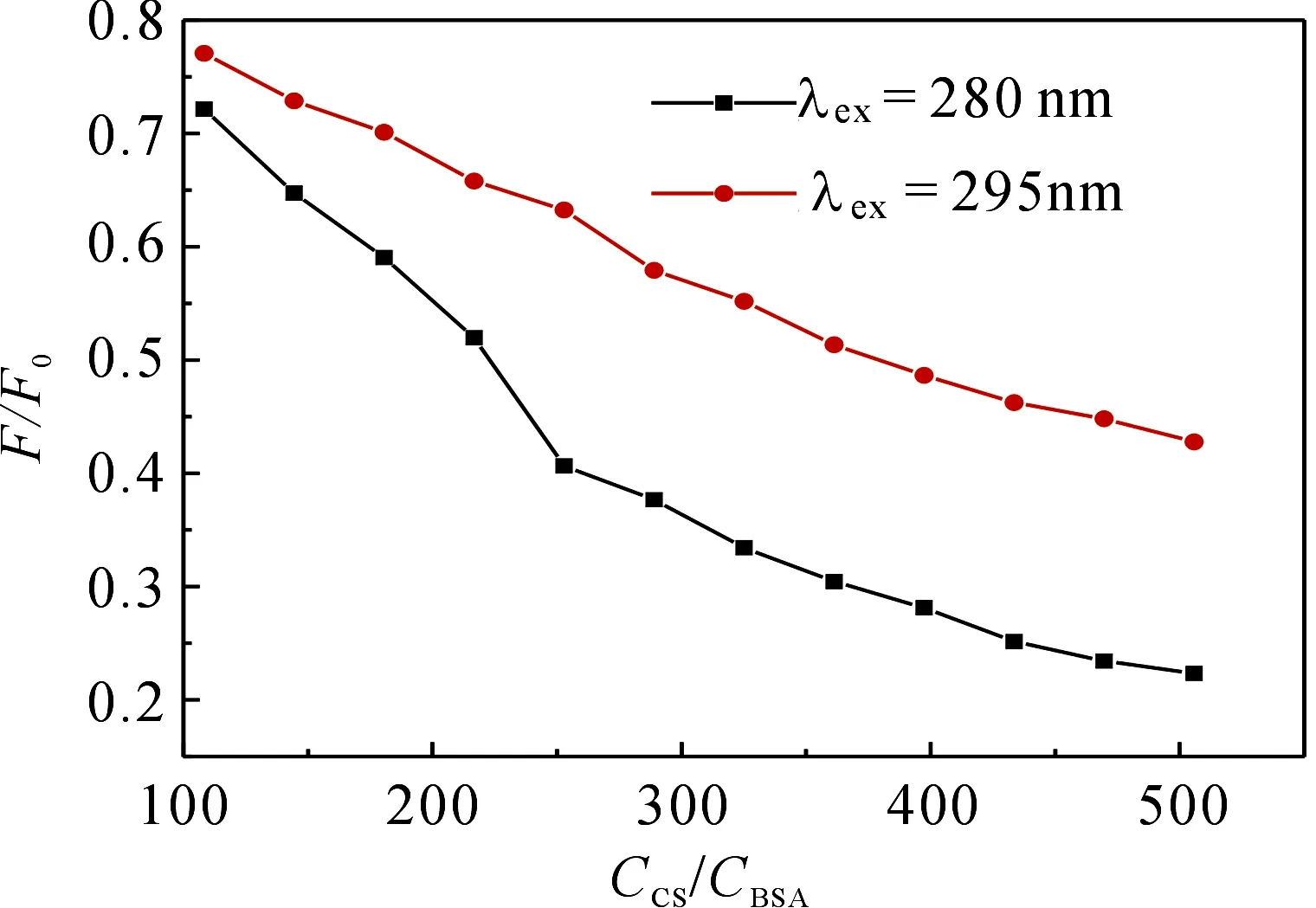
图5 λex为 280和 295 nm时,CS-BSA荧光光谱Fig 5 Fluorescence spectra of CS-BSA at λex=280 and 295 nm
lg(H/(1-H))=lgKH+nHlg[C],
其中,H为结合饱和分数;KH为结合常数;nH为Hill系数.在荧光实验中:
其中,B=(F0-F)/F0;1/Bm为1/B对1/[C]作图的截距.CS-BSA的nH值的计算结果见表5.表5中三个温度下的nH都略小于1,而且变化不大,表明药物协同性对温度变化不是很敏感.CS与BSA结合过程中,CS分子之间呈现出弱的负协同作用,即前一个药物分子结合到BSA位点上后,阻碍后一个药物分子与BSA的结合.

表5 不同温度下的Hill系数nH
2.8 CS对BSA构象的影响
蛋白质的构象变化通常用同步荧光光谱来分析,根据λem的变化来确定其荧光猝灭主要由何种氨基酸残基起主导作用[8-10],而且氨基酸残基的λem移动方向与其所处的疏水性也紧密相关[8-10].Δλ=60 nm和Δλ=15 nm分别显示色氨酸和酪氨酸残基的荧光特征[8-10].在Δλ=15 nm和Δλ=60 nm条件下测CS加入BSA之后的同步荧光光谱,结果见图6.由图可知,随CS浓度的增大,这两种氨基酸残基的λem均向长波移动,说明CS的加入改变了BSA的构象,使其疏水结构增大,引起肽链的伸展程度增大,导致BSA腔内疏水环境的极性增强,疏水性减弱.因酪氨酸的λem向长波移动的程度大于色氨酸,表明酪氨酸残基所处的微环境疏水性降低得更多[8-10].酪氨酸的猝灭程度大于色氨酸,表明CS与BSA相结合的位点偏向于酪氨酸.
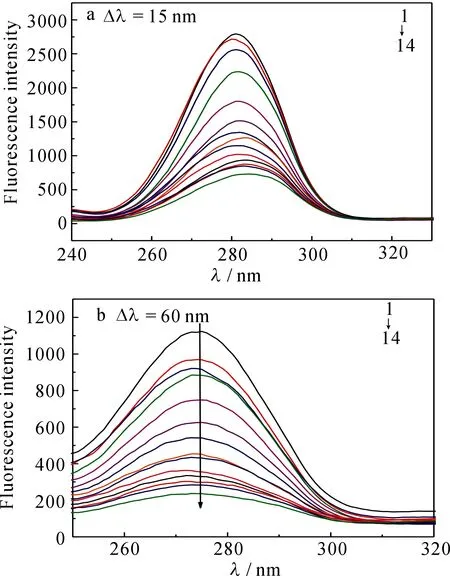
图6 CS猝灭BSA的同步荧光光谱Fig 6Synchronous fluorescence spectrometry of BSA as CS
2.9 金属离子的影响
金属离子的存在会直接影响药物与蛋白质的结合[17].因此文中研究了Fe3+,Cr3+,Ni2+,Cu2+和Pb2+对CS与BSA的结合作用的影响,实验结果见表6.从表6可以看出,金属离子不同,K′和n也不同,其原因可能是由于金属元素本身的原子结构不同,才导致与BSA的结合力和结合位点的差异.Fe3+,Cr3+,Ni2+,Cu2+减小了K,可能是Fe3+,Cr3+,Ni2+,Cu2+与BSA先结合,占据了BSA的结合位点,从而使CS与BSA结合作用减弱.而Pb2+增大了K,可能是由于它们先与CS结合,然后再与血清白蛋白结合,这样结合促进了CS与BSA的结合能力[17].总之, CS与BSA的相互作用对金属离子的加入比较敏感.Pb2+的加入会使CS与BSA的结合常数有较大增加,有利于延长药物的释放时间,增加了药效时间.而Fe3+,Cr3+,Ni2+,Cu2+的加入使CS与BSA的结合常数有所减小,缩短了药物的存储时间,增大了药物的最大作用强度[10].
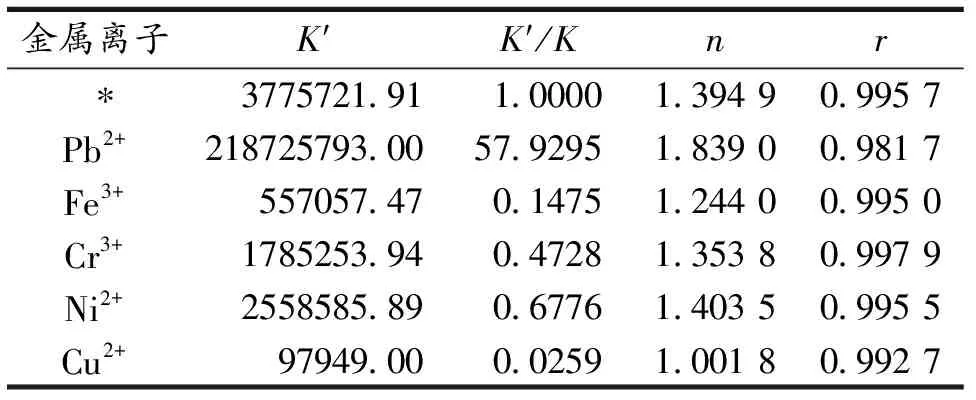
表6 共存物质的影响
注:K′为有干扰的表观结合常数值;*为不加金属离子
3 结论
用荧光和紫外光谱法推断出CS对BSA荧光产生静态猝灭,两者靠氢键和范德华力结合;通过计算求得了K和n值的大小,表明CS可以被BSA运输;两者结合位置位于BSA的亚螺旋域ⅡA中;CS对结合反应产生负协同作用,即CS加入使BSA的亲和性减弱,不利于后续CS与BSA的结合.同步荧光光谱表明,CS使BSA构象产生了影响,结合位点离酪氨酸更近,疏水性减弱.详细研究了Fe3+,Cr3+,Ni2+,Cu2+和Pb2+对CS与BSA相互作用的影响.
[1] 国家药典委员会.中华人民共和国药典:二部[M].北京:化学工业出版社,2005:921-924.
[2] 汪世龙.蛋白质化学[M].上海:同济大学出版社,2012:139-141.
[3] 薛春霞,董社英.药物分子与血清白蛋白相互作用的研究进展[J].广东化工,2013,40(20):148-149.
[4] 王芳,裴明砚,唐乾,等.药物与血清白蛋白相互作用中荧光光谱学的研究进展[J].大连大学学报,2009(3):39-43.
[5] LAKOWICA J R.PrinciplesofFluorescenceSpectroscopy[M].3rd ed.New York:Springer,2006:280-281.
[6] 许金钩,王尊本.荧光分析法[M].第3版.北京:科学出版社,2006:64-70.
[7] 陈国珍,黄贤智,郑朱梓,等.荧光分析法[M].第2版.北京:科学出版社,1990:64-86.
[8] 刘里,彭洪生,伏云红.荧光光谱法研究头孢孟多酯与牛血清白蛋白的相互作用[J].中国测试,2014,40(3):64-67.
[9] 殷磊,刘里,何志钊,等.荧光光谱法研究头孢硫脒与牛血清白蛋白的相互作用[J].安徽农学通报,2012,18(19):14-17.
[10] 刘里.光谱法研究马来酸氯苯那敏与牛血清白蛋白的相互作用[J].西北师范大学学报:自然科学版,2014,50(5):44-47.
[11] ROSS P D,SUBRAMANIAN S.Thermodynamic of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[12] 闫潇娜.光谱法研究蛋白质与药物小分子的相互作用及存金属离子的影响[D].保定:河北大学,2013.
[13] 刘保生,王晶.头孢噻肟钠和氯霉素与牛血清白蛋白相互作用的荧光光谱分析[J].发光学报,2011,32(6):628-635.
[14] SULKOWSKA A,BOJKO B,ROWNICKA J,et al.Paracetamol and cytarabine binding competition in high affinity binding sites oftransporting porotein[J].MoStruct,2006,26(9):792-793.
[15] BOJKO B,SULKOWSKA A,MACIAZEK-JURCZYK M,et al.The influence of dietary habits and pathological conditions on the binding of theophylline to serum albumin[J].PharmBiomedAnal,2010,52(3):384-390.
[16] 宋玉民,张琼.李清萍抗凝血药物华法灵钠与人血清白蛋白的相互作用研究[J].西北师范大学学报:自然科学版,2011:47(1):48-50.
[17] 乐薇,吴小霞.荧光法研究芦丁-Zn2+-牛血清白蛋白的相互作用[J].西北师范大学学报:自然科学版,2010:46(4):66-68.
(责任编辑 陆泉芳)
Study on the interaction between cefazolin sodium and bovine serum albumin and the effect of coexistent metal ion on the reaction
LIU Li,CHENG Fei-xiang,YANG Xiao-li
(College of Chemistry and Chemical Engineering,Qujing Normal University,Qujing 655011,Yunnan,China)
Under the optimal conditions,fluorescence spectrometry and U-V absorption spectrometry are used to investigate the interaction of cefazolin sodium(CS) with bovine serum albumin(BSA).The effects of metal ions on the interaction CS with BSA are also discussed.The quenching of fluorescence of BSA by CS is a static quenching procedure involving complex formation.Under different temperature,thermodynamic parameters,static binding constants and number of binding sites are calculated.The interaction between BSA and CS is dominated by van der Waals forces or hydrogen bond.The primary binding site for CS is located at sub-domainⅡA of BSA.The values of Hill’s coefficients are less than 1,which indicated that there is some very weak negative cooperative effect.Synchronous spectra shows that the conjugation reaction between CS and BSA can affect the conformation of BSA,leading to the polarity around BSA weakened.Synchronous fluorescence indicates that the binding site of CS and BSA is near by tyrosine residue.The effects of metal ions Pb2+,Fe3+,Cr3+,Ni2+and Cu2+on the interactions between BSA and CS are investigated,and the results show that Fe3+,Cr3+,Ni2+and Cu2+have negative influence and Pb2+has positive influence on the combination of CS and BSA.
cefazolin sodium(CS);bovine serum albumin(BSA);interaction;metal ions
2014-11-09;修改稿收到日期:2015-02-08
国家自然科学基金资助项目(21261019);云南省教育厅科研项目(2012Y414)
刘里(1982—),女,吉林省吉林市人,讲师,硕士.主要研究方向为药物化学和分子发光学理论与应用. E-mail:m18908746298@163.com
O 657.3;Q 51
A
1001-988Ⅹ(2015)04-0052-06

