XRCC1基因在脑胶质瘤中的表达
王参智,罗林
(1.中国五冶医院神经外科,四川 成都,610000;2.昆明医科大学第三附属医院神经外科,云南 昆明 650118)
脑胶质瘤是指来源于神经胶质细胞,发生于神经外胚层的肿瘤,也称为神经胶质瘤。是中枢神经系统中最常见的原发性恶性肿瘤,其发病率约占颅内肿瘤一半,且近年来还有不断上升的趋势[1],年发病率为5/10万左右[2]。目前,对胶质瘤的治疗尚无特异的方法,治疗手段主要以手术切除为主,术后辅以放疗、化疗、免疫治疗等,但疗效较差,其主要原因是与胶质瘤中耐药基因的存在密不可分。其中X线修复交叉互补基因1(X-rag repair crosscomplementing1,XRCC1)是临床上针对铂类的耐药基因,但XRCC1在脑胶质瘤中的研究国内外报道的文献较少,探讨分析其与胶质瘤恶性程度的关系,以期为胶质瘤患者的个性化化疗提供参考依据。
1 材料和方法
1.1 一般资料 随机收集昆明医科大学第三附属医院神经外科2011年7月至2013年7月手术中切除的病理结果明确的脑胶质瘤标本47例,所有患者术前均未行放、化疗并排除身体其他部位肿瘤。47例患者标本中,男性30例,年龄16~69岁,平均40.26岁;女性17例,年龄21~72岁,平均38.30岁,病程1周至8个月。
1.2 主要试剂 浓缩型兔抗人XRCC1单克隆抗体 (北京中山金桥生物公司);SP广谱试剂盒 (云南晨绿生物公司);EDTA修复液 (云南晨绿生物公司);DAB显色剂 (北京中山金桥生物公司);APES防脱片剂 (福州迈新生物技术开发有限公司);柠檬酸盐抗原修复液 (福州迈新生物技术开发有限公司);苏木素染液 (台湾BASO贝索企业)。
1.3 石蜡切片的制备 所有标本经10%中性甲醛固定24~48 h用自来水冲洗24 h去甲醛)。用不同浓度的酒精(酒精浓度可以逐渐升高)置换出组织中的水后。进行透明、浸蜡、包埋,用石蜡切片机将石蜡块连续切2张成4 μm厚的切片,分别作为组织学分级和免疫组化染色。
1.4 SP染色
1.4.1 石蜡切片后烤片,68℃,20 min。
1.4.2 常规二甲苯脱蜡,梯度酒精脱水 二甲苯I 20 min—二甲苯 II 20 min—100% 酒精 I 10 min—100%II 10 min—95%,5 min—80%,5 min—70%,5 min。
1.4.3 阻断灭活内源性过氧化物酶 3%H2O237℃孵育10 min,PBS冲洗3×5 min。
1.4.4 抗原修复 置0.01M枸橼酸缓冲液 (pH 6.0)中用煮沸 (95℃,15~20 min),自然冷却20 min以上,再用冷水冲洗缸子,加快冷却至室温,PBS冲洗3×5 min。
1.4.5 正常羊血清工作液封闭,37℃ 10 min,倾去勿洗。
1.4.6 滴加1滴 (1∶50)一抗兔抗人XRCC1单克隆抗体4℃ 冰箱孵育过夜,PBS冲洗3×5 min(用PBS缓冲液代替一抗作阴性对照);滴加生物素标记二抗,37℃孵育30 min,PBS冲洗3×5 min。
1.4.7 滴加辣根过氧化物酶标记的链霉素卵白素工作液,37℃孵育30 min,PBS冲洗3×5 min。
1.4.8 DAB/H2O2反应染色,自来水充分冲洗后。
1.4.9 苏木素复染,常规脱水,透明,干燥,封片。显微镜下观察染色结果并摄片。
1.5 XRCC1阳性结果判定 采用半定量积分法:阳性染色XRCC1以细胞核或/和胞浆出现棕黄色颗粒者为准。具体标准为:(1)阳性细胞数<5%为0分,6% ~25%为1分,26%~50%为2分,51% ~75%为3分,>75%为4分;(2)阳性强度 (以多数细胞判定):淡黄色为1分,黄色为2分,棕褐色为3分。以 (1)、(2)两者乘积判断阳性等级:0分为阴性 (-),1~4分为弱阳性 (+),5~8分为阳性 (++),9~12分为强阳性 (+++)。所有检测结果在双盲情况下由主要研究者及病理科专业人员两位阅片评估。采用已知阳性切片作对照 (购买试剂时赠送的阳性对照切片)。
1.6 统计学方法 本实验结果均采用SPSS 17.0统计学软件进行统计学处理。XRCC1在不同级别胶质瘤中的表达水平采用Spearman相关性分析进行分析;胶质瘤组织中XRCC1的表达与患者性别、年龄的相关性采用Fisher确切概率法进行分析。
2 结 果
胶质瘤细胞中XRCC1阳性细胞的形态 胶质瘤细胞核或/和胞浆内出现棕黄色颗粒为阳性细胞,XRCC1的表达见图1及图2。
47例胶质瘤标本中XRCC1阳性细胞率的表达 在47例胶质瘤标本中,XRCC1阳性细胞率为38.30%。在WHO分类Ⅰ、Ⅱ、Ⅲ、Ⅳ级的XRCC1阳性细胞率分别为33.33%、25.00%、50.00%、41.67%,经统计学分析结果表明,胶质瘤不同级别间XRCC1阳性细胞表达率,差异无统计学意义 (P>0.05),胶质瘤不同级别间XRCC1的阳性表达水平,差异也无统计学意义P>0.05) (表1)。在性别、年龄方面之间所存在的差异也无统计学意义,(表2~3,P>0.05)。
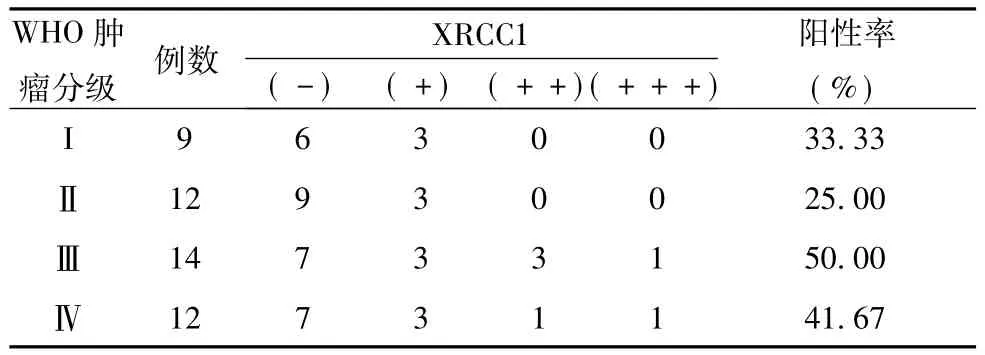
表1 XRCC1在不同级别胶质瘤间阳性细胞表达率和阳性表达水平
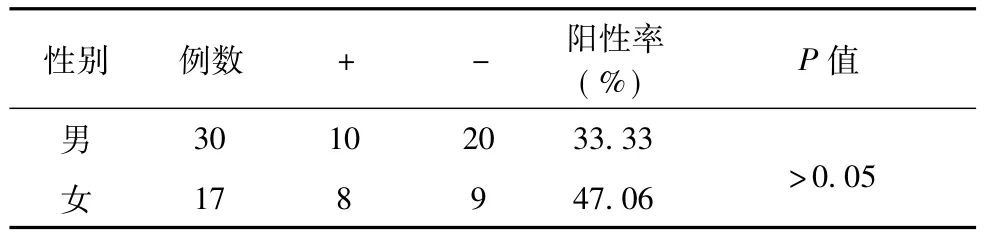
表2 XRCC1在不同性别胶质瘤病人中的阳性表达率
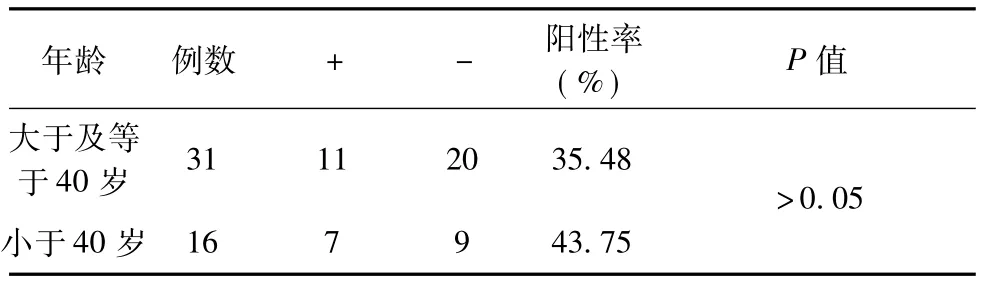
表3 在不同年龄段胶质瘤病人中的阳性表达率
3 讨 论
XRCC1是参与哺乳动物DNA修复的130种基因之一,而且是第一个被分离出来的参与修复离子辐射所致损害的哺乳动物的修复基因。XRCC1位于19号染色体的长臂区(q13.2~q13.3),全长31.9 kb。XRCC1基因的cDNA全长2.2 kb,包括17个外显子,编码一个由633个氨基酸组成的70 kD的蛋白质[3]。目前已发现XRCC1编码区有3个单核苷酸多肽位点,为 C263047T(Arg194Trp)、G27466A(Arg280His)和G28152A(Arg399Gln),这些编码区的变异可能改变XRCC1的功能,从而使机体对疾病的易感性发生变化。
本研究结果显示,不同级别胶质瘤间XRCC1的阳性表达率差异无统计学意义 (P>0.05),不同级别胶质瘤间XRCC1的阳性表达水平差异也无统计学意义 (P>0.05)。其原因,可能是因为在不同个体、不同器官以及同一肿瘤组织的不同部位中XRCC1的表达存在很大的差异。在不同级别的肿瘤细胞或同一肿瘤组织切片中发现XRCC1阳性细胞的染色强度和分布并不均一,缺乏规律。因此XRCC1阳性表达率和表达水平与肿瘤的恶性程度之间并无关系。XRCC 1在碱基切除修复中起整体作用,编码碱基损伤修复联合序列的一种重要蛋白[4],其对一系列内外氧化剂导致的DNA单链断裂和碱基损伤修复起重要作用。XRCC1单核苷酸多态影响XRCC1的活性[5],当XRCC1低表达或阴性表达时,DNA损伤的修复能力下降或得不到及时修,就会引发癌变或者促进癌变的发生,当XRCC1高表达或阳性表达时,可以修复DNA的损伤,降低癌变的风险。以前的研究显示:XRCC1基因多态性与头颈部、肺、结肠及前列腺癌等多种恶性肿瘤发病风险有关[6-7]。最近的研究显示:XRCC1基因多态性与脑胶质瘤的发生有明显的相关性[8]。
另外,在脑胶质瘤中XRCC1的表达水平在性别、年龄方面所存在的差异也无统计学意义 (表2-3)(P>0.05),因此在临床诊疗过程中为病人制定个体化治疗方案时年龄、性别不能作为参考因素。铂类药物的主要作用靶点是DNA,药物进入肿瘤细胞后与DNA形成铂-DNA加合物,导致DNA损伤,从而影响DNA的复制与转录,抑制肿瘤的分裂导致细胞凋亡[9]。这些铂-DNA加合物的形成是药物发挥毒性作用的关键,体内铂-DNA加合物水平较高的肿瘤患者,对化疗具有更高的敏感性且有更好的临床预后[10-12]影响铂类化疗敏感性的因素很多,但DNA修复在其耐药机制中起重要作用[13-14]NA损伤后的修复能力与XRCC1密切相关。XRCC1是碱基切除修复及单链断裂修复系统中的核心成员,参与铂类药物引起的损伤修复过程[15]。肿瘤细胞中的XRCC1编码的蛋白质与DNA连接酶Ⅲ相互作用,修复DNA单链断裂,并与DNA聚合酶β一起进行碱基切除修复,降低了铂类药物的细胞毒作用,是造成肿瘤细胞耐药的主要原因。不同个体的XRCC1活性不一样[16],这可能是导致个体间DNA修复能力差异的分子基础。肿瘤细胞中的XRCC1阳性表达率和表达水平越高,DNA修复能力强,肿瘤耐药越明显,化疗敏感性越差。
总之XRCC1是DNA损伤修复的重要基因,XRCC1突变使基因的稳定性下降,可能增加肿瘤易感性,XRCC1在胶质瘤的发生、发展过程中起着重要的作用。XRCC1的过渡表达与胶质瘤细胞对铂类化疗药物产生耐药有关,同时也为胶质瘤的个性化治疗提供了一个新的靶点和方向。检测脑胶质瘤中XRCC1表达水平的高低可作为脑胶质瘤对铂类化疗药是否耐药的指标,从而为不同级别的脑胶质瘤患者制定个体化治疗方案提供合理的理论依据。

图1 XRCC1在胶质瘤细胞中的阴性表达 (10×40)

图2 XRCC1在胶质瘤细胞中的阳性表达 (10×40)(10×40)
[1]Ohgaki H,Kleihues P.Epidemiology and etiology of gliomas[J],Acta neuropathologica,2005,109(4):93 -108.
[2]Stupp R,Hegi ME,Vanden Bent MJ,et al.Changing paradigms-an update on the multidisciplinary management of malignant glioma [J].Oncologist,2006,11(2):165 -180.
[3]Karlsson KH,Radulescu I,Rydberg B,et al.Repair of radiation-induced heat-labile sites is independent of DNA -PKcs,XRCC1 and PARP [J].Radiat Res,2008,169(5):506-512.
[4]Thacker J,Zdzienicka MZ.The manmalian XRCC1 genes:their roles in DNA repair and genetic stability [J].DNA Repair,2003,2:655-672.
[5]RosellR,Lord RV,TaronM,et al.DNA repair and cisplat in resistan cein nonsm al l cell lung cancer [ J].Lung Cancer,2002,38(3):217-227.
[6]朱虔兮,边建超.XRCC1基因多态性与肿瘤遗传易感性研究进展[J].国外医学肿瘤分册,2004,31:323-326.
[7]Lin Y,Scheurer MZ,El-zein R,et al.Association and interactions between DNA repair gene Polymorphisms and adult glioma[J].Cancer Epidemiol Biomarkers Prev,2009,18:204.
[8]刘建民,孙鸿,黄良文,等.XRCC1基因多态性与脑胶质瘤相关性研究[J].现代预防医学,2011,38(16):3340-3341.
[9]Altaha R,Liang X,Yu JJ,et al.Excision repair cross complementing group 1:gene expression and platinum resistance[J].Int J Mol Med,2004,14:959-970.
[10]Jordan p.Carmo Fonseca M:moleculer mechanisms involved in cisplatin cytotoxicity [J].Cell Mol Life Sci,2000,57:1229-1235.
[11]Van de vaart PJM,Belderbos J,De Jong D,et al.DNA -adduct levels as a predictor of outcome for NSCLC patients receiving daily cisplatin and radiotherapy [J].Int J Cancer,2000,89:160-166.
[12]Furuta T,Ueda T,Aune G,et al.Transcription coupled nucleotide excision repair as a determinant of cisplatin sensitivity of human cells[J].Cancer Res,2002,62:4899 -4902.
[13]Lord RVN,Brabender J,Gandara D,et al.Low ERCC1 expression on correlates with prolonged survival after cisplatin plus gemcitabine chemotherapy in non-small-cell lung cancer[J].Clin Cancer Res,2002,8(11):2286 -2291.
[14]kennedy RD,Qu Inn JE,Mullan PB,et al.The role of BRCA1 in the cellular response to chemotherapy[J].Natl Cancer Inst,2004,96(22):1659 -1669.
[15]Rosell,Lord R V,Taron M,et al.DNA repair and cisplatin resistance in non - smasll cell lung cancer[J].Lung Cancer,2002,38:217-227.
[16]Lunn RM,Langlois RG,Hsieh LL,et al.XRCC1 polymorphimsm:effects on aflatoxin B1-DNA adducts and glycophorin A variant frequency [J].Cancer Res,1999,59:2557-2561.

