麻醉暴露对发育期儿童神经系统功能的影响
邓菲,芦睿,张惠
·综 述·
麻醉暴露对发育期儿童神经系统功能的影响
邓菲,芦睿,张惠
随着麻醉理念的更新及麻醉技术的提高,越来越多的儿童在全身麻醉下接受手术治疗,全麻药物对神经系统发育的影响也随之成为了关注热点。基础研究发现,在大脑发育的易损窗口期,全麻药物可降低神经系统突触的可塑性、导致神经元凋亡、引发退行性神经病变,影响成年期学习记忆等功能。2007年以来全球多个研究中心对这一问题进行了大规模临床研究,发现在小儿早期接受麻醉可引起认知功能障碍,但也有研究显示两者之间并无直接相关性。
儿童发育;麻醉药,全身;中枢神经系统
美国全国住院患者样本数据(nationw ide inpatient sample)显示,每年大约有600万儿童(其中包括150万小于1岁的婴幼儿)接受手术或非手术操作下的麻醉[1]。一方面,麻醉可以提供良好的遗忘、镇静、镇痛和肌松作用,并抑制由手术操作引起的不良反应(如自主神经反射等)[2-3];另一方面,麻醉为介入治疗、影像学检查、诊断操作等非手术操作的安全、平稳进行提供充分的保障[4]。但在这些优势突显的同时,麻醉药物对神经发育的影响也成为了公众关注的焦点和热点问题[5-6]。
1 全麻药神经毒性的基础研究
早在1945年levy等就提出了麻醉药物的神经毒性问题。1999年Ikonomidou等[7]在Science杂志上发表的动物研究结果显示,给处于中枢神经系统发育高峰期(即出生后7d)的大鼠注射氯胺酮,能引发广泛的脑神经元凋亡。随后越来越多的动物实验显示,全麻药可引起发育期神经元凋亡、死亡、突触发育异常,使发育期啮齿类和灵长目动物大脑结构发生改变,引起行为和神经功能改变并导致长期认知功能障碍[8-9]。麻醉药导致的动物神经毒性具有以下3个特点:①与药物剂量、暴露时间和次数相关。有研究显示,长时间或者反复暴露于高剂量氯胺酮可引起大鼠及恒河猴的神经元凋亡和神经退行性变,丙泊酚和异氟醚也具有类似的作用[10-12]。②与多重麻醉药物暴露相关。与暴露于一种麻醉药相比,同时暴露于多种药物可产生更加显著的毒性作用[10,13]。③存在麻醉暴露的易感期。在啮齿类动物的研究中发现,当麻醉暴露发生在出生后7d时,神经元凋亡达到峰值,此时期为突触发生的高峰期[11,13-14]。产后6d的恒河猴使用异氟醚后,也出现了神经细胞凋亡[15]。
2 人类大脑发育过程
虽然基础研究为认识全麻药的发育期神经毒性及其对长期认知功能的影响提供了重要线索,但来自动物实验的结论并不能简单推论至人类的临床实践,主要原因有以下3点:①动物模型中麻醉药物的浓度和作用时间与人类临床实践存在差异[16-17];②动物模型不可能完全模拟临床过程,且在动物麻醉过程中普遍缺乏对呼吸、循环及其他器官功能的支持[18-19];③人类大脑的发生和发展与动物存在时空上的巨大差别[20-21]。因此,动物大脑对全麻药的反应不能直接推论于人类大脑[22-23]。
人类神经系统的发生始于胚胎第18天,此时胎盘中轴部的外胚层细胞增殖为增厚的外胚层板,即神经板。随后神经板沿其长轴凹陷形成神经沟,沟两侧的隆起称神经褶。随着进一步发育,两侧神经褶开始在神经沟的多个部位发生闭合,在胚胎第25天,神经沟完全关闭形成神经管。在胚胎第4周末,神经管头端膨大形成3个原始脑泡,分别称前脑、中脑和菱脑,至第5周后,以上结构逐渐演变为端脑、间脑、中脑、脑桥、小脑、延髓。此期大脑大约有125 000个细胞。出生后,神经元的数量达到100亿,这就意味着,每分钟大约有250 000个新生的神经元[24]。
虽然上述发育过程较为复杂,但仍具有特殊的规律和模式。第一阶段是神经诱导,脊索诱导其背侧的外胚层演变为神经板;第二阶段是神经细胞分化,即神经前体细胞经过多个步骤转变为终末细胞;第三阶段是神经细胞迁移,即新产生的神经元从诞生地迁移到合适的地点,这是神经系统发生中最为独特的生命现象;第四阶段是突起生长,即细胞体生长树突接受其他细胞传来的信号,并发出轴突与特定的靶细胞发生联系;第五阶段是突触形成,即轴突到达特定靶区后识别有关的靶细胞并与之形成突触连接。除以上细胞增殖、迁移、分化等过程外,还存在神经系统发育阶段特殊的细胞凋亡,即程序性细胞死亡(50%~70%的神经元和前体细胞经历程序性死亡)。神经系统的发育过程既具有阶段性又相互交织[25-26]。
从宏观上看,胎儿期神经系统的发育先于其他系统,重量占优势。出生时脑重约为370g(占成人脑重的25%),6个月时脑重约为700g(占成人脑重的50%),2岁时达900~1000g,4岁时脑重为出生时的4倍,约为1500g,与成人接近。出生时神经细胞数量已与成人相同,但其树突与轴突少而短。出生后脑重量的增加主要是由于神经细胞体积增大和树突增多、延长,以及神经髓鞘的形成和发育。3岁时神经细胞已大致分化完成,8岁时已接近成人。神经髓鞘的形成和发育在4岁左右完成,在此之前,尤其在婴儿期,各种刺激引起的神经冲动传导缓慢,易于泛化,不易形成兴奋灶。神经细胞之间由突触连接,目前认为怀孕后3个月突触形成,在出生后的2~3年突触形成终止[27]。突触数目在出生后迅速增加,6个月时为出生时的7倍,4岁左右突触的密度约为成人的1.5倍,持续到10~11岁,以后逐渐下降至成人水平。与突触密度变化相对应,神经回路在出生后迅速发育。
3 麻醉药神经毒性的临床相关研究
为了明确全身麻醉对远期神经发育的影响[28],人们展开了一系列基于大脑发育关键期的临床研究(表1)。现根据临床研究的特点分述如下:
3.1 具有前瞻性研究背景的临床研究 虽然目前大多数临床研究采用回顾性队列研究资料,但哥伦比亚大学研究人员于2012年、2014年发表在Pediatrics、Anesthesiology及J Neurosurg Anesthesia杂志上的研究[29-31]则采用了雷恩医学研究所在1989-1992年间开展的一项关于澳大利亚西部妊娠人群产前超声学检查对婴幼儿长期影响的前瞻性出生队列研究资料。他们以麻醉暴露为准入标准,重新整合分析后发现,与无麻醉暴露史儿童相比,在3岁之前接受过麻醉暴露的儿童,当成长至10岁时其语言理解、表达及总体语言能力和认知能力较差,特别是抽象推理能力明显降低,但无明显的行为学障碍;采用麦卡伦分析(MAND)对运动能力进行评估,经多变量Possion回归模型分析发现,在3岁前首次经历麻醉暴露的儿童其10岁时的大运动和精细动作评分无明显降低,而3岁后麻醉暴露者其10岁时的大运动和精细动作评分均降低,发生运动缺陷的危险性升高。
3.2 来自于双胞胎的临床研究 与众多回顾性队列研究人群数据不同的是,荷兰阿姆斯特丹大学的研究数据来自于双胞胎,这样可极大地降低遗传及后天环境因素对麻醉本身暴露的影响。在选取的1143对同卵双生双胞胎中有71对为非相似双胞胎(双胞胎中一人婴幼儿期有麻醉暴露史,另一人无),其余1072对为相似双胞胎(两者均有或均无麻醉暴露史),有麻醉暴露史的儿童均在3岁之前接受过单次麻醉或在3~12岁再次接受了麻醉。在接近12岁时,对学习成绩和认知能力进行评估发现:与无麻醉暴露史的双胞胎相比,3岁前接受过麻醉的双胞胎学习成绩明显降低,出现了较多显著的认知问题。然而,在非相似同卵双生双胞胎中,接受麻醉
暴露的一方与无麻醉暴露的另一方在学习成绩和认知能力方面并无明显差异。该研究提示麻醉暴露与后天认知障碍之间并无直接的因果关系,而只是其后天认知障碍发生的一个易感因素[32]。除上述研究外,哥伦比亚大学在使用美国纽约州医疗补助计划资料进行统计分析时发现,有138对双胞胎中的一方有手术麻醉暴露史,而另一方无麻醉接触史,在2005年评估结束后统计发现:有11对双胞胎均被诊断为行为/发育障碍,107对双胞胎均正常,而在剩余的20对双胞胎中有9对双胞胎中有暴露史的患儿被诊断为行为/发育障碍,而另外11对双胞胎中无暴露史的一方被诊断为行为/发育障碍。麻醉暴露总相对风险比为0.9(95%CI 0.6~1.4),无统计学意义,但由于样本量较少,无法明确手术麻醉暴露与行为/发育之间的确切关系[33]。
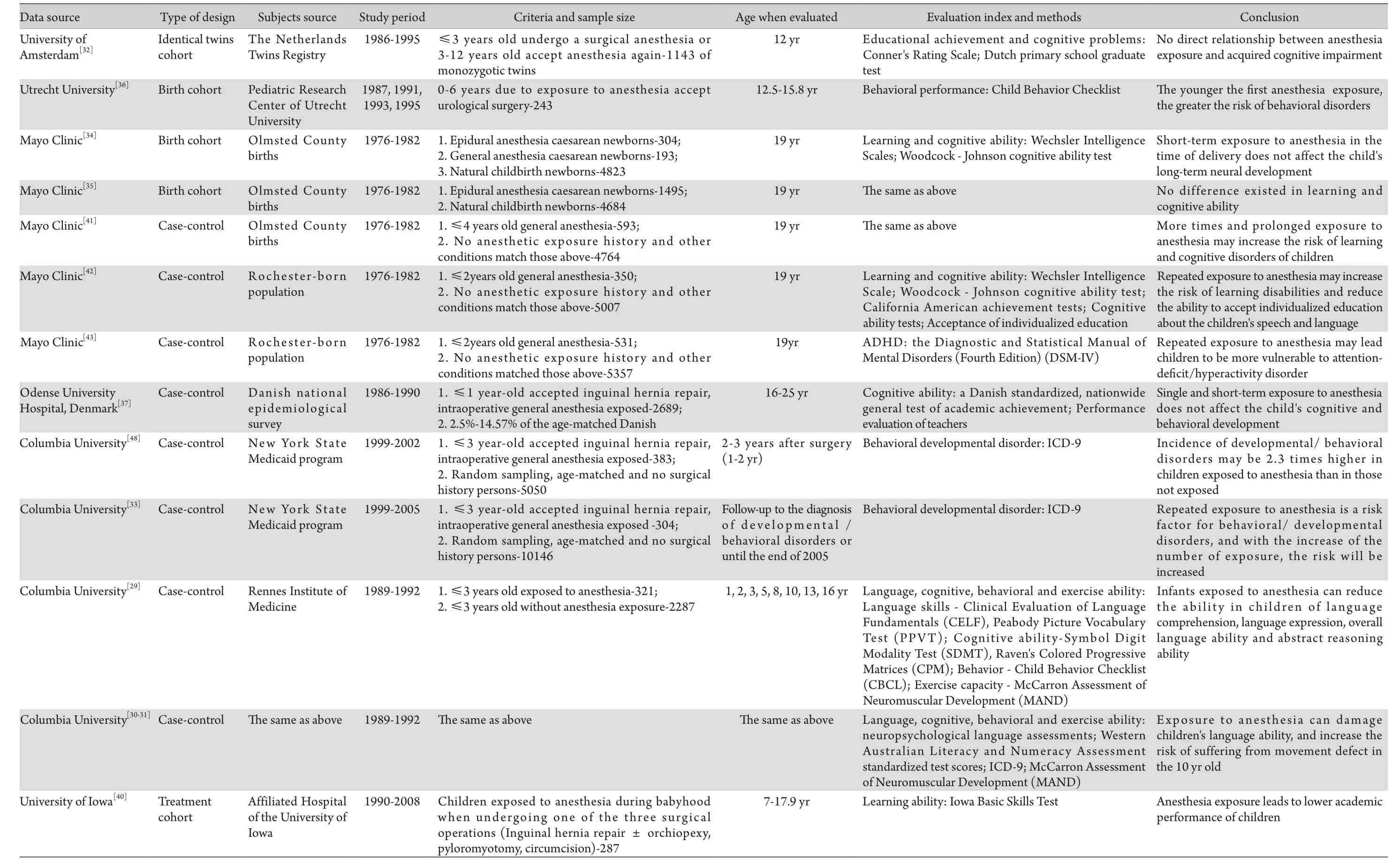
表1 麻醉暴露对发育期儿童神经系统功能影响的临床研究Tab. 1 Clinical studies of effects of anesthetic exposure on nervous system function in children
3.3 产时麻醉暴露的临床研究 新生儿麻醉暴露的发生可以在产时也可在产后,目前大多数研究都将目光集中在了产后,而梅奥诊所则将研究的重点放在了不同分娩方式及不同麻醉暴露方式对新生儿后天语言及数学等认知能力的影响。结果显示,与自然分娩相比,剖宫产中接受全身麻醉或区域麻醉后生产的新生儿在成年后并没有明显的学习认知障碍,也就是说产时短期麻醉暴露并不影响胎儿长期的神经发育[34-35]。
3.4 特定手术麻醉暴露的临床研究 由于受到麻醉本身的限制,麻醉暴露始终伴随着手术或其他诊疗操作,也受到原有疾病的干扰及围术期患者自身的影响,因此麻醉不可能像其他疾病一样,可以排除一切干扰因素独立分析,只能选取一定时间段内具有特定相似因素的人群进行归纳总结。鉴于以上因素,很多研究都将目光投向了泌尿外科手术(如尿路阻塞、腹股沟疝修补术、腹股沟疝修补+睾丸固定术、包皮环切术等),旨在纳入相同手术人群以降低研究对象的差异性,同时有效地控制术中手术及麻醉操作的影响。该类临床研究包括乌得勒支大学儿科研究中心以接受尿路梗阻为主的手术纳入标准进行的临床分析[36],丹麦对腹股沟疝修补术中儿童麻醉暴露的全国性流行病学调查[37],哥伦比亚大学利用美国纽约州医疗补助计划中接受腹股沟疝修补术儿童进行的麻醉分析[33,38-39],以及美国爱荷华大学对接受腹股沟疝修补术(或腹股沟疝修补+睾丸固定术)、包皮环切术及幽门肌切开术三种手术之一儿童麻醉暴露的分析[40]。乌得勒支大学研究发现在1岁之前接受手术的患儿比在2岁后接受手术的患儿更易出现行为障碍,说明首次麻醉暴露年龄与后天行为障碍的发生存在密切联系。但由于样本量仅为243例,统计学结果不明确(以手术年龄大于2岁患儿儿童行为量表得分的OR值为参照值1,手术年龄小于6个月组的OR=1.38,手术年龄6~12个月组的OR=1.19,手术年龄12~24个月组的OR=1.20)。2011年丹麦在种族和社会因素同源的人群基础上,选取了1986-1990年间出生后第一年内接受腹股沟疝修补术的2689名儿童,并随机从年龄相匹配的丹麦人口中选取了5%(即14 575人)作为正常对照人群,调查发现:l岁前于全麻下接受腹股沟疝修补术儿童的平均学习成绩低于未暴露组(平均成绩低0.26,95%CI 0.21~0.31),不达标率高于未暴露者(OR=1.18,95%CI 1.04~1.35),但排除先天畸形患儿后,两组之间无统计学差异。因此研究者认为,在排除自身疾病干扰后,婴幼儿期单次、短时的麻醉暴露(30~60min)对认知功能和行为发育无影响。以上两项来自不同地区的研究均显示早期麻醉暴露与后天认知障碍之间并无直接的因果关系,只是存在某种可能的联系。然而,美国爱荷华大学的相关研究发现,儿童接受全身麻醉后,其在中、小学阶段的爱荷华考试成绩较正常儿童降低。哥伦比亚大学多学科联合研究发现,在出生后前3年接受全身麻醉暴露后,术后2~3年发生发育/行为学障碍的风险比增加,进一步扩大样本量后发现手术及麻醉药的单次暴露不会引发明显的发育/行为学异常,但多次暴露却是发生发育/行为学障碍的一个高危因素,且随着暴露次数的增加,风险随之升高。梅奥诊所对1976-1982年间2岁及4岁之前接受全身麻醉暴露儿童进行3次临床评估发现,单次麻醉后学习障碍风险比并无改变,但接受2次或2次以上手术麻醉的儿童19岁时出现学习障碍的比例较正常儿童升高,且更易出现注意力缺陷/多动症[41-43]。总而言之,单次手术麻醉对长期认知功能的影响目前尚无定论,但普遍认为多次手术麻醉可造成长期的认知功能损害[44]。
4 目前临床研究现状
4.1 目前研究的不足 目前麻醉药对发育期大脑影响的临床研究较少,且都存在明显的不足和局限性,主要包括以下几点:①在回顾性队列研究中,非麻醉因素难以控制,造成统计结果偏差;②由于临床样本从纳入、追踪到统计分析经历时间较长,许多临床研究缺乏详细的术中麻醉用药方案,如麻醉药物种类、用药剂量和持续时间;③评价体系千差万别,缺乏全球公认的规范化评价标准;④由于不同研究纳入的样本所处年代不同,而麻醉药物却在不断更新,导致来自不同研究中心的回顾性队列研究结果存在客观差异[45]。
4.2 目前正在开展的前瞻性研究 为了明确麻醉暴露对发育期中枢神经系统的影响,需要有一个跨学科多地联合的团队统筹进行前瞻性临床试验研究,制定严格、详细的纳入标准,系统收集和追踪纳入人群的流行病学资料,并选用全球公认的标准评价体系和科学合理的统计学方法进行分析。目前正在进行的大规模临床研究主要有3个,即PANDA研究(Pediatric Anesthesia and Neurodevelopment Assessment)[46-48]、GAS研究(General Anesthesia and Spinal)、MASK study (MAyo Safety in Kids),同时FDA也已启动了一个名为SmartTots的项目(Strategies for Mitigating Anesthesia-Related Neuro-Toxicity in Tots)以支持和辅助相关临床研究。现将各项目概况及已有结果介绍如下:
4.2.1 PANDA研究 PANDA研究是一个双胞胎模型控制的双向多中心队列研究,计划纳入1000个(约500对双胞胎)ASA Ⅰ-Ⅱ级[49-50]、出生36个月内因单次腹股沟疝修补而接受麻醉暴露的儿童,并在8岁和15岁两个时间点评估其语言交流能力、注意力、IQ、学习记忆能力、思维推理能力、运动和行为能力,以分析手术麻醉与认知功能之间的关系。2012年以哥伦比亚大学为主的29所进入PANDA计划的大学研究中心联合发表了该项目的初步结果,整个项目均采用双向性队列研究设计,从最初进入项目的394对双胞胎中,最终纳入28对,所有研究对象均为母亲妊娠≥36周出生,以英语为第一语言,并在6~11岁时接受WASI(韦氏智力量表)、NEPSY Ⅱ(神经心理学评估Ⅱ,第2版)中有关认知功能的检测,其父母也接受并完成了相关行为学问卷调查表[儿童行为量表和康纳尔父母量表(CONNERS)]。韦氏智力量表检测结果显示有麻醉暴露史的患儿其语言、动手能力及总的智商值均略低于未暴露组,而在神经心理学评估Ⅱ、儿童行为量表和康纳尔父母量表的评估中,配对t检验显示暴露组与非暴露组比较均无统计学差异[51]。2014年4月举行了第4次PANDA专题研讨会,最终的结论仍然是没有足够的证据需要改变现有的临床实践[47,52-53]。
4.2.2 GAS研究 该研究为一项国际性的大规模多中心随机对照研究,主要观察婴幼儿在出生后6个月内接受腹股沟疝修补术时采用全身麻醉和椎管内麻醉对神经发育影响的差别。计划纳入600个婴儿作为研究对象,在接受手术时随机接受全身麻醉或椎管内麻醉,在2岁时评估其发育情况,5岁时评估其神经发育水平和智力。目前,该项研究正在进行中,预计结果将于2014-2017年间发表。
4.2.3 MASK研究 该研究是梅奥诊所和美国国家毒理学中心联合进行的一项研究。选取3岁前接受过单次或多次麻醉暴露且出生和生活在明尼苏达州罗契斯特市的儿童,同时以本地无麻醉暴露史的相关儿童作为对照,使用了一系列神经认知功能测试对其进行评估。
4.2.4 SmartTots项目 该项目是由国际麻醉研究学会和美国FDA联合启动的一项计划,意在评估儿童麻醉用药对神经发育的安全性,并为小儿麻醉神经毒性研究提供专业指导,传播研究成果并筹措资金[54-56]。
5 展望
虽然各项大规模临床研究结果正在陆续公布,但麻醉暴露对发育期中枢神经系统的确切影响仍未有共识,这对当前临床麻醉用药提出了巨大的挑战。有动物实验研究结果发现,无麻醉下的痛觉刺激会引起神经元死亡、神经递质传递失衡、痛觉敏感度增加,出现行为/学习障碍[57]。临床研究也发现婴儿在无镇静、镇痛的非麻醉状态下接受包皮环切术时,手术带来的恐惧、疼痛和所产生的应激反应会使患儿在术后的几个月中出现痛阈降低[58]。这从另一个角度说明在手术和其他操作中,适当的麻醉或(和)足够的疼痛治疗是必须的。麻醉不仅能减轻手术本身带给患者的恐惧和疼痛等副作用,同时还能有效避免术中瞬间或长时程生理参数波动(如低血压、低碳酸血症、低血糖、低体温)[59]带来的不良影响。因此,麻醉与手术及其他操作一样,本身就是一把双刃剑,为了将不良因素降低,麻醉医生术前必须做好充分的访视工作,制订相对安全、完善的术中麻醉方案,严格规范术中麻醉操作并合理规范化使用麻醉药物。我们相信随着现代医学技术的发展和麻醉机制的阐明[60],麻醉产生的不良影响将会降到最低。
[1] DeFrances CJ, Cullen KA, Kozak LJ. National Hospital Discharge Survey: 2005 annual summary with detailed diagnosis and procedure data[J]. Vital Health Stat 13, 2007, (165): 1-209.
[2] Li MM, Fei X, Lu XL, et al. Anesthetic management of adenoidectomy and tonsillectomy assisted by low-temperature plasma technology in children[J]. Med J Chin PLA, 2014, 39(9): 751-754. [李萌萌, 费翔, 吕绪磊, 等. 低温等离子技术行小儿腺样体切除、扁桃体消融术的麻醉管理[J]. 解放军医学杂志, 2014, 39(9): 751-754.]
[3] Zhang YF, Chen L, Ma SY. Effects of sevoflurane combined with intravenous anesthesia with nerve block on cleft lip and palate surgery in 56 children[J]. J Logist Univ PAPF (Med Sci), 2014, 23(10): 851-852. [张云飞, 陈龙, 马世颖. 七氟醚静吸复合全麻加神经阻滞在56例小儿唇腭裂手术中的应用[J]. 武警后勤学院学报(医学版), 2014, 23(10): 851-852.]
[4] Sun L. Early childhood general anaesthesia exposure and neurocognitive development[J]. Br J Anaesth, 2010, 105(Suppl 1): i61-i68.
[5] Davidson AJ. Anesthesia and neurotoxicity to the developing brain: the clinical relevance[J]. Paediatr Anaesth, 2011, 21(7): 716-721.
[6] Kuehn BM. FDA considers data on potential risks of anesthesia use in infants, children[J]. JAMA, 2011, 305(17): 1749-1750, 1753.
[7] Ikonomidou C, Bosch F, Miksa M, et al. Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain[J]. Science, 1999, 283(5398): 70-74.
[8] Kodama M, Satoh Y, Otsubo Y, et al. Neonatal desflurane exposure induces more robust neuroapoptosis than do isoflurane and sevoflurane and impairs working memory[J]. Anesthesiology, 2011, 115(5): 979-991.
[9] Brambrink AM, Evers AS, Avidan MS, et al. Ketamine-induced neuroapoptosis in the fetal and neonatal rhesus macaque brain[J]. Anesthesiology, 2012, 116(2): 372-384.
[10] Mellon RD, Simone AF, Rappaport BA. Use of anesthetic agents in neonates and young children[J]. Anesth Analg, 2007, 104(3): 509-520.
[11] Slikker WJ, Zou X, Hotchkiss CE, et al. Ketamine-induced neuronal cell death in the perinatal rhesus monkey[J]. Toxicol Sci, 2007, 98(1): 145-158.
[12] Yon JH, Carter LB, Reiter RJ, et al. Melatonin reduces the severity of anesthesia-induced apoptotic neurodegeneration in the developing rat brain[J]. Neurobiol Dis, 2006, 21(3): 522-530.
[13] Jevtovic-Todorovic V, Hartman RE, Izumi Y, et al. Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing rat brain and persistent learning deficits[J]. J Neurosci, 2003, 23(3): 876-882.
[14] Stratmann G, Sall JW, May LD, et al. Isoflurane differentially affects neurogenesis and long-term neurocognitive function in 60-day-old and 7-day-old rats[J]. Anesthesiology, 2009, 110(4): 834-848.
[15] Brambrink AM, Evers AS, Avidan MS, et al. Isoflurane-induced neuroapoptosis in the neonatal rhesus macaque brain[J]. Anesthesiology, 2010, 112(4): 834-841.
[16] Wang Y, Cheng Y, Liu G, et al. Chronic exposure of gestation rat to sevoflurane impairs offspring brain development[J]. Neurol Sci, 2012, 33(3): 535-544.
[17] Zou X, Liu F, Zhang X, et al. Inhalation anesthetic-induced neuronal damage in the developing rhesus monkey[J]. Neurotoxicol Teratol, 2011, 33(5): 592-597.
[18] Stratmann G, Sall JW, May LD, et al. Isoflurane differentially affects neurogenesis and long-term neurocognitive function in 60-day-old and 7-day-old rats[J]. Anesthesiology, 2009, 110(4): 834-848.
[19] Anand KJ, Soriano SG. Anesthetic agents and the immature brain: are these toxic or therapeutic[J]? Anesthesiology, 2004, 101(2): 527-530.
[20] Clancy B, Darlington RB, Finlay BL. Translating developmental time across mammalian species[J]. Neuroscience, 2001, 105(1): 7-17.
[21] Istaphanous GK, Ward CG, Loepke AW. The impact of the perioperative period on neurocognitive development, with a focus on pharmacological concerns[J]. Best Pract Res Clin Anaesthesiol, 2010, 24(3): 433-449.
[22] Hansen TG. Anesthesia-related neurotoxicity and the developing animal brain is not a significant problem in children[J]. Paediatr Anaesth, 2015, 25(1): 65-72.
[23] Mintz CD, Wagner M, Loepke AW. Preclinical research into the effects of anesthetics on the developing brain: promises and pitfalls[J]. J Neurosurg Anesthesiol, 2012, 24(4): 362-367.
[24] Cowan WM. The development of the brain[J]. Sci Am, 1979, 241(3): 113-133.
[25] LaMantia AS, Rakic P. Axon overproduction and elimination in the anterior commissure of the developing rhesus monkey[J]. J Comp Neurol, 1994, 340(3): 328-336.
[26] Bourgeois JP. Synaptogenesis, heterochrony and epigenesis in the mammalian neocortex[J]. Acta Paediatr Suppl, 1997, 422: 27-33.
[27] Dobbing J, Sands J. Comparative aspects of the brain growth spurt[J]. Early Hum Dev, 1979, 3(1): 79-83.
[28] Sinner B, Becke K, Engelhard K. Neurotoxicity of general anesthetics in childhood: does anesthesia leave its mark on premature babies, newborns and infants[J]? Anaesthesist, 2013, 62(2): 91-100.
[29] Ing C, DiMaggio C, Whitehouse A, et al. Long-term differences in language and cognitive function after childhood exposure to anesthesia[J]. Pediatrics, 2012, 130(3): e476-e485.
[30] Ing CH, DiMaggio CJ, Malacova E, et al. Comparative analysis of outcome measures used in examining neurodevelopmental effects of early childhood anesthesia exposure[J]. Anesthesiology, 2014, 120(6): 1319-1332.
[31] Ing CH, DiMaggio CJ, Whitehouse AJ, et al. Neurodevelopmental outcomes after initial childhood anesthetic exposure between ages 3 and 10 years[J]. J Neurosurg Anesthesiol, 2014, 26(4): 377-386.
[32] Bartels M, Althoff RR, Boomsma DI. Anesthesia and cognitive performance in children: no evidence for a causal relationship[J]. Twin Res Hum Genet, 2009, 12(3): 246-253.
[33] DiMaggio C, Sun LS, Li G. Early childhood exposure to anesthesia and risk of developmental and behavioral disorders in a sibling birth cohort[J]. Anesth Analg, 2011, 113(5): 1143-1151.
[34] Sprung J, Flick RP, Wilder RT, et al. Anesthesia for cesarean delivery and learning disabilities in a population-based birth cohort[J]. Anesthesiology, 2009, 111(2): 302-310.
[35] Flick RP, Lee K, Hofer RE, et al. Neuraxial labor analgesia for vaginal delivery and its effects on childhood learning disabilities[J]. Anesth Analg, 2011, 112(6): 1424-1431.
[36] Kalkman CJ, Peelen L, Moons KG, et al. Behavior and development in children and age at the time of first anesthetic exposure[J]. Anesthesiology, 2009, 110(4): 805-812.
[37] Hansen TG, Pedersen JK, Henneberg SW, et al. Academic performance in adolescence after inguinal hernia repair in infancy: a nationwide cohort study[J]. Anesthesiology, 2011, 114(5): 1076-1085.
[38] DiMaggio C, Sun LS, Kakavouli A, et al. A retrospective cohort study of the association of anesthesia and hernia repair surgery with behavioral and developmental disorders in young children[J]. J Neurosurg Anesthesiol, 2009, 21(4): 286-291.
[39] DiMaggio C, Sun LS, Ing C, et al. Pediatric anesthesia and neurodevelopmental impairments: a Bayesian meta-analysis[J]. J Neurosurg Anesthesiol, 2012, 24(4): 376-381.
[40] Block RI, Thomas JJ, Bayman EO, et al. Are anesthesia andsurgery during infancy associated with altered academic performance during childhood[J].Anesthesiology, 2012, 117(3): 494-503.
[41] Wilder RT, Flick RP, Sprung J, et al. Early exposure to anesthesia and learning disabilities in a population-based birth cohort[J]. Anesthesiology, 2009, 110(4): 796-804.
[42] Flick RP, Katusic SK, Colligan RC, et al. Cognitive and behavioral outcomes after early exposure to anesthesia and surgery[J]. Pediatrics, 2011, 128(5): e1053-e1061.
[43] Sprung J, Flick RP, Katusic SK, et al. Attention-deficit/ hyperactivity disorder after early exposure to procedures requiring general anesthesia[J]. Mayo Clin Proc, 2012, 87(2): 120-129.
[44] Jevtovic-Todorovic V. Functional implications of an early exposure to general anesthesia: are we changing the behavior of our children[J]? Mol Neurobiol, 2013, 48(2): 288-293.
[45] Sanders RD, Hassell J, Davidson AJ, et al. Impact of anaesthetics and surgery on neurodevelopment: an update[J]. Br J Anaesth, 2013, 110(Suppl 1): i53-i72.
[46] Sun LS. Introduction to the proceedings of the third PANDA symposium on "Anesthesia and Neurodevelopment in Children"[J]. J Neurosurg Anesthesiol, 2012, 24(4): 356.
[47] Sun LS. Introduction to "Anesthesia and Neurodevelopment in Children": a supplement from the Fourth PANDA Symposium[J]. J Neurosurg Anesthesiol, 2014, 26(4): 343.
[48] Miller TL, Park R, Sun LS. Report of the third PANDA symposium on "Anesthesia and Neurodevelopment in Children"[J]. J Neurosurg Anesthesiol, 2012, 24(4): 357-361.
[49] Filan PM, Hunt RW, Anderson PJ, et al. Neurologic outcomes in very preterm infants undergoing surgery[J]. J Pediatr, 2012, 160(3): 409-414.
[50] Marlow N. Anesthesia and long-term outcomes after neonatal intensive care[J]. Paediatr Anaesth, 2014, 24(1): 60-67.
[51] Sun LS, Li G, DiMaggio CJ, et al. Feasibility and pilot study of the Pediatric Anesthesia NeuroDevelopment Assessment (PANDA) project[J]. J Neurosurg Anesthesiol, 2012, 24(4): 382-388.
[52] Lei S, Davis N, Lee M, et al. Engaging stakeholders in research related to anesthesia and neurodevelopment in children[J]. J Neurosurg Anesthesiol, 2014, 26(4): 387-390.
[53] Monteleone M, Khandji A, Cappell J, et al. Anesthesia in children: perspectives from nonsurgical pediatric specialists[J]. J Neurosurg Anesthesiol, 2014, 26(4): 396-398.
[54] Ramsay JG, Roizen M. SmartTots: a public-private partnership between the United States Food and Drug Administration (FDA) and the International Anesthesia Research Society (IARS)[J]. Paediatr Anaesth, 2012, 22(10): 969-972.
[55] Jevtovic-Todorovic V. Pediatric anesthesia neurotoxicity: an overview of the 2011 SmartTots panel[J]. Anesth Analg, 2011, 113(5): 965-968.
[56] Ramsay JG, Rappaport BA. SmartTots: a multidisciplinary effort to determine anesthetic safety in young children[J]. Anesth Analg, 2011, 113(5): 963-964.
[57] Ruda MA, Ling QD, Hohmann AG, et al. Altered nociceptive neuronal circuits after neonatal peripheral inflammation[J]. Science, 2000, 289(5479): 628-631.
[58] Sinner B, Becke K, Engelhard K. General anaesthetics and the developing brain: an overview[J]. Anaesthesia, 2014, 69(9): 1009-1022.
[59] Padhi R, Panda BN, Jagati S, et al. Hyponatremia in critically ill patients[J]. Indian J Crit Care Med, 2014, 18(2): 83-87.
[60] Bajwa SJ, Panda A. Alternative medicine and anesthesia: Implications and considerations in daily practice[J]. Ayu, 2012, 33(4): 475-480.
Effect of exposure to anesthesia on the functions of nervous system of children in the growth period
DENG Fei, LU Rui, ZHANG Hui*
Department of Anesthesiology, State Key Laboratory of Military Stomatology, School of Stomatology, Fourth Military Medical University, Xi'an 710032, China
*
, E-mail: zhanghuifmmua@yahoo.com
This work was supported by the National Natural Science Foundation of China (81371265, 81071528)
With the update of concept of anesthesia and the improvement in anesthesia technology, an increasing number of children
surgical treatment under general anesthesia. Subsequently, the influence of anesthetic agents on the development of nervous system becomes a focused issue. Basic research found that anesthetic agents can lower the synaptic plasticity of nervous system, produce neuronal apoptosis and other neurodegenerative diseases during the vulnerable window period for brain development, thus affect learning and memory function when the children reach adulthood. Since 2007, a number of research centers around the world conducted a large-scale clinical study on this issue, but there are relevant studies showing that there is no direct correlation between the two.
child development; anesthetics, general; central nervous system
R726.142.106
A
0577-7402(2015)03-0248-07
10.11855/j.issn.0577-7402.2015.03.16
2014-12-01;
2015-01-30)
(责任编辑:沈宁,胡全兵)
国家自然科学基金(81371265,81071528)
邓菲,硕士研究生。主要从事全身麻醉药物对神经发育影响方面的研究
710032 西安 第四军医大学口腔医学院麻醉科、军事口腔医学国家重点实验室(邓菲、芦睿、张惠)
张惠,E-mail:zhanghuifmmua@yahoo.com

