支气管肺泡灌洗液4种新型肿瘤标志物检测对周围型肺癌的诊断价值
张实,张明周,吴学玲
·临床研究·
支气管肺泡灌洗液4种新型肿瘤标志物检测对周围型肺癌的诊断价值
张实,张明周,吴学玲
目的 探讨支气管肺泡灌洗液(BALF)和血清中4种新型肿瘤标志物热休克蛋白90α(HSP90α)、谷胱甘肽S
转移酶P1(GSTP1)、泛素特异性肽酶8(USP8)、几丁质酶3样蛋白1(CHI3L1)在周围型肺癌诊断中的临床价值。方法采用酶联免疫吸附法检测100例周围型肺癌住院患者及50例肺部良性疾病患者BALF和血清中HSP90α、GSTP1、USP8、CHI3L1的浓度。分析4种肿瘤标志物含量与不同细胞类型、患者年龄、肺癌分期之间的相关性,以及对周围型肺癌的诊断敏感性和特异性。结果 肺癌患者BALF中HSP90α平均浓度显著高于肺部良性疾病显著(P<0.05),诊断敏感性为77.0%,特异性为82.0%;肺癌患者血清中HSP90α平均浓度与肺部良性疾病患者比较差异无统计学意义(P>0.05)。肺癌患者BALF中CHI3L1平均浓度显著高于肺部良性疾病显著(P<0.05),诊断敏感性为72.0%,特异性为80.0%;肺癌患者血清中CHI3L1平均浓度与肺部良性疾病患者比较差异无统计学意义(P>0.05)。小结节肺癌(原发病灶≤1cm)患者BALF 中HSP90α及CHI3L1平均浓度与肺部良性疾病患者比较差异无统计学意义(P>0.05)。肺癌患者BALF及血清中USP8、GSTP1平均浓度与肺部良性疾病患者比较差异无统计学意义(P>0.05)。肺癌患者BALF及血清中4种肿瘤标志物浓度与年龄、肺癌分型(腺癌或鳞癌)、肺癌分期(Ⅰ-Ⅳ期)等因素无相关性;CHI3L1在肺癌患者BALF中的浓度与原发灶直径有一定相关性(P<0.05),Pearson相关系数为0.203;其他3种肺癌标志物在BALF、血清中的浓度与肿瘤原发灶直径无相关性。结论 检测BALF中HSP90α及CHI3L1浓度对周围型肺癌的诊断有一定价值,且优于血清肿瘤标志物。
支气管肺泡灌洗液;肿瘤标记,生物学;肺肿瘤;诊断
肺癌是全球发病率最高的恶性肿瘤之一,死亡率在各类肿瘤中居首位,全球每年约有100万人死于肺癌[1]。尽管现代诊疗水平不断上升,但肺癌的长期生存时间与过去20年相比并无明显改善[2-3]。提高肺癌生存期的关键手段是早期诊断[4],纤维支气管镜是目前诊断中央型肺癌的主要工具[5],气管镜获取组织、支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)、纤刷物等可为肿瘤细胞学检查提供标本[6]。然而,周围型肺癌超出了气管镜视野,纤维支气管镜往往不能获得组织标本[7],部分肿块靠近肺门或者患者存在肺大泡、肺气肿等客观因素导致肺穿刺取活检风险大,造成此类患者确诊困难[8]。取肺癌患者的血液标本检测肿瘤标志物也是一种积极有效的检查方法[9],其中的一些指标如癌胚抗原(CEA)、细胞角蛋19片段CYFRA21-1、神经特异性烯醇化酶(NSE)等已作为临床常用肿瘤标志物广泛应用[10-11]。然而目前尚无一种敏感性、特异性均高的血清标志物[12-13]。
有研究表明,从肿瘤原发病变部位获取标本检测肿瘤标志物,其敏感性高于血清学检测[14],如对肺癌组织分泌至肺泡中的物质进行检测,其诊断敏感性高于血液标本,可对周围型肺癌的诊断起辅助作用。本研究对肺癌患者BALF中4种新型肿瘤标志物热休克蛋白90α(HSP90α)、谷胱甘肽S转移酶P1(GSTP1)、泛素特异性肽酶8(USP8)、几丁质酶3样蛋白1(CHI3L1)进行筛查,以期发现比血液标本更为敏感的肿瘤标志物。
1 资料与方法
1.1 研究对象 150例患者均为第三军医大学新桥医院2013年7月-2014年5月呼吸内科住院患者。肺癌组100例,均为周围型肺癌,无法进行气管镜钳取活检,均经肺穿刺活检与手术病理切片检查确诊为肺癌(鳞癌与腺癌)。对照组为同期住院的肺部良性疾病(包括肺炎、肺结核、尘肺、支气管扩张、慢性嗜酸粒细胞肺炎)患者,共50例。两组患者一般情况见表1。
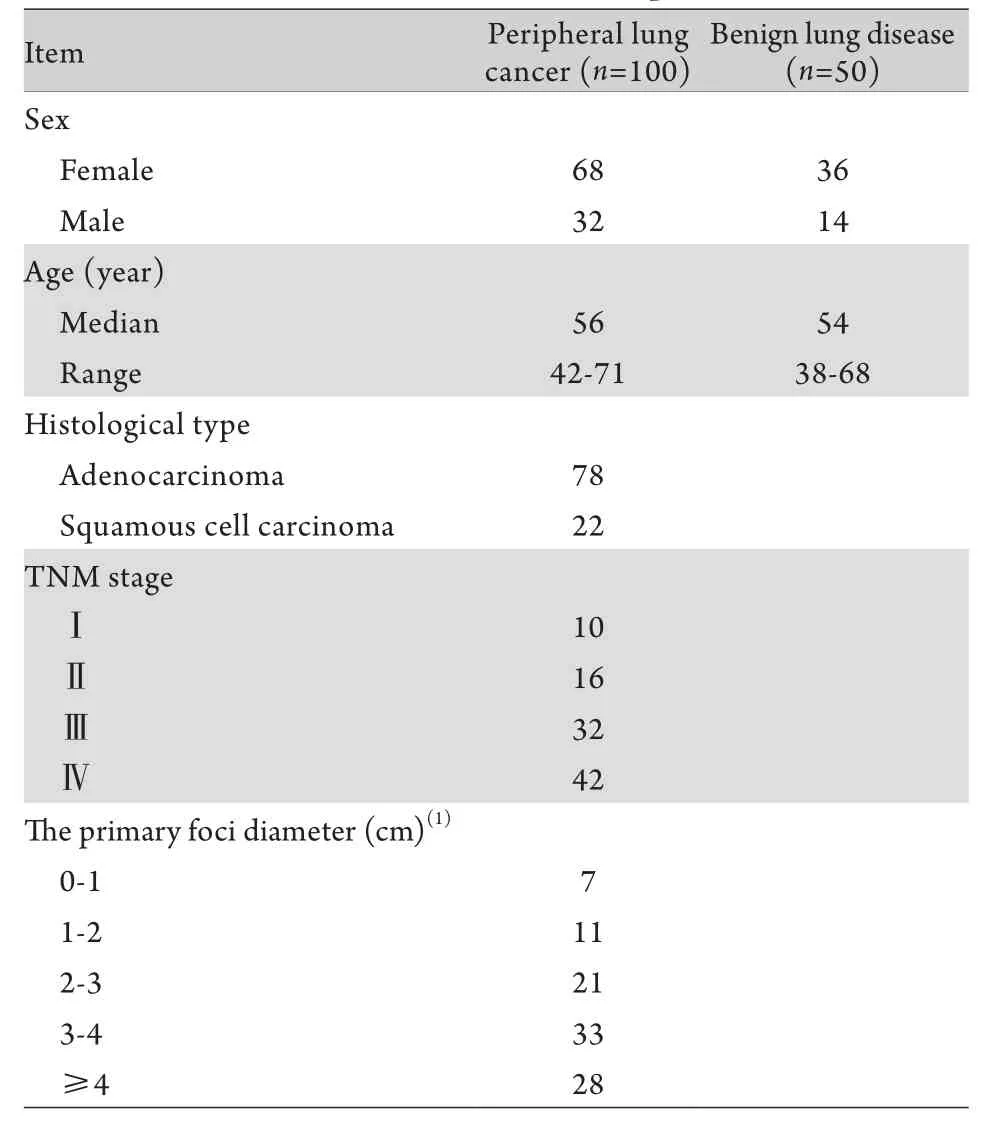
表1 入组患者基本信息Tab. 1 Clinical data of the patients
1.2 标本收集 血清:清晨取患者空腹静脉血4ml,2000r/min离心20min,上清–80℃保存。BALF:两组患者均按纤维支气管镜常规操作技术,将纤维支气管镜远端楔于肿瘤或其他病变所在的段支气管开口处,弥漫病变则冲洗右中叶或左舌叶。注入室温生理盐水,50ml/次,灌洗2次,以50~100mmHg负压吸引,回收40%~60%的BALF,经双层无菌纱布过滤后2000r/min离心10min,上清–80℃保存。
1.3 检测方法 4种肿瘤标志物USP8、HSP90α、CHI3L1和GSTP1均采用酶联免疫分析法,检测试剂盒由上海沪尚生物科技有限公司提供,按照试剂盒说明书步骤进行操作。
1.4 统计学处理 采用SPSS 13.0软件进行统计分析。计量资料以±s表示,经方差齐性检验,4种肿瘤标志物在两组患者BALF及血清中的浓度均服从正态分布(P>0.05)。两组比较采用两独立样本t检验,多组间比较采用单因素方差分析;肿瘤标志物含量与年龄、原发灶直径的关系采用Pearson相关分析,与肺癌TNM分期的关系用Spearman相关分析。用受试者工作特征曲线(ROC曲线)来定义诊断界值,计算曲线下面积并描述其诊断敏感性及特异性。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者BALF与血清中4种肿瘤标志物浓度比较 肺癌患者BALF中HSP90α及CHI3L1平均浓度显著高于肺部良性疾病患者(P<0.05),而血清中HSP90α和CHI3L1的平均浓度与肺部良性疾病患者比较差异无统计学意义(P>0.05);肺癌患者BALF及血清中USP8和GSTP1的平均浓度与肺部良性疾病患者比较差异均无统计学意义(P>0.05,表2)。

表2 4种肿瘤标志物在肺癌组与肺部良性疾病组的比较Tab. 2 Comparison of the levels of 4 tumor markers between peripheral lung cancer (PLC) and benign lung disease (BLD) patients
肺癌患者BALF中HSP90α及CHI3L1平均浓度显著高于肺部良性疾病患者。为进一步明确HSP90α和CHI3L1能否为周围型肺癌的早期诊断提供帮助,进一步比较小结节肺癌(原发病灶直径≤1cm)与肺部良性病变之间的差异性。HSP90α 及CHI3L1在小结节肺癌组的浓度服从正态分布(P>0.05),统计学分析显示,小结节肺癌组BALF中HSP90α及CHI3L1浓度(分别为150.05±54.10pg/ml 和18.67±6.20ng/ml)虽然稍高于肺部良性疾病组(分别为141.63±49.40pg/ml和15.85±11.32ng/ml),但两组间差异无统计学意义(P>0.05)。
2.2 4种肿瘤标志物的含量与不同细胞类型、患者年龄、肺癌分期之间相关性的分析 肺腺癌患者与肺鳞癌患者BALF、血清中4种肿瘤标志物平均浓度无明显差别(P>0.05),表明4种肿瘤标志物的浓度与肺癌分型无明显相关性(鳞癌与腺癌)。对肺癌患者BALF及血清中4种肿瘤标志物浓度与患者年龄、原发灶直径、肺癌分期(Ⅰ-Ⅳ期)的关系进行分析,结果显示仅BALF中CHI3L1的浓度与原发灶直径有一定相关性,Pearson相关系数为0.203(P<0.05),关联性较低(表3)。
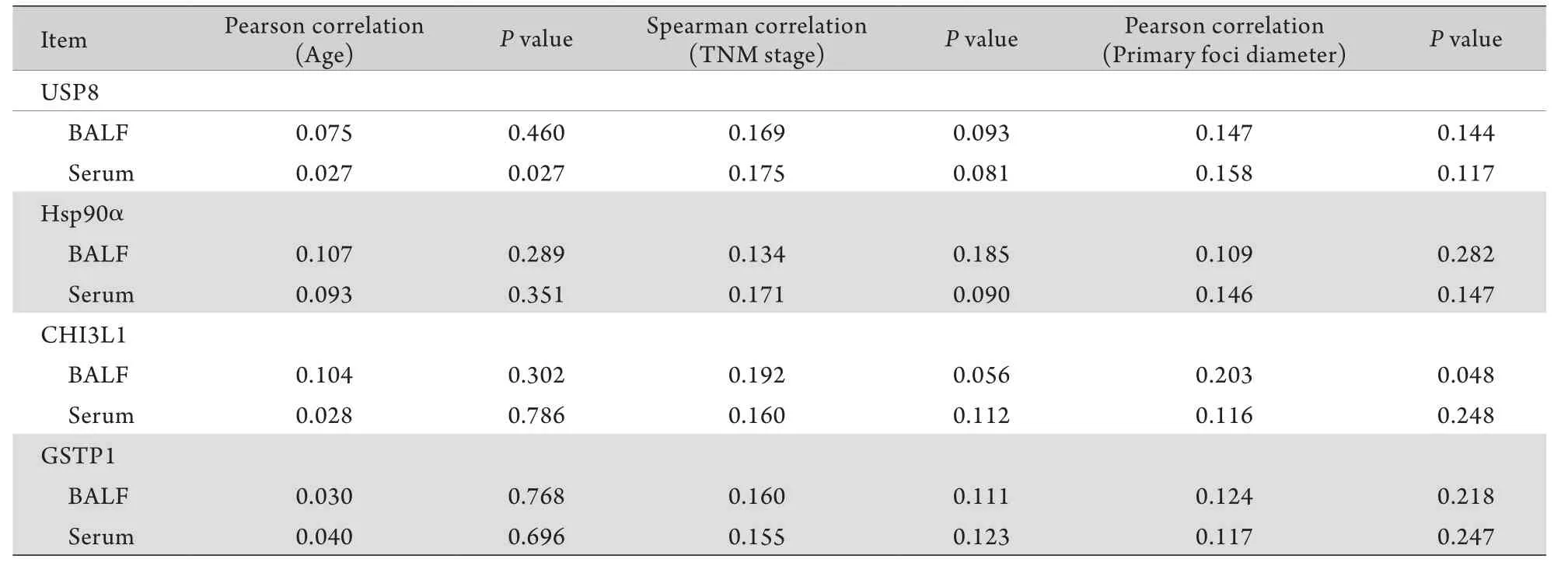
表3 4种肿瘤标志物浓度与肺癌患者年龄、肿瘤分期、原发灶直径的相关性分析Tab.3 Correlation analysis of tumor marker concentrations to patients' age, TNM stage and primary foci diameters
2.3 CHI3L1、HSP90α对周围型肺癌的诊断敏感性及特异性 BALF和血清中CHI3L1及HSP90α的ROC曲线如图1所示,计算曲线下面积,并通过曲线拐点即敏感性+特异性最大值处确定诊断二者对周围型肺癌的诊断界值。通过诊断界值,确定两种标志物的诊断敏感性及特异性(表4)。
3 讨 论
肿瘤标志物是细胞在癌变的发生、发展、浸润及转移过程中所分泌、产生的一些活性物质,它们存在于癌组织和宿主体液中,其实质是由肿瘤组织产生的反映肿瘤自身存在的化学物质[15]。肿瘤标志物通过肿瘤细胞分泌或肿瘤细胞凋亡后释放到体液(血液、痰等)中,因此在体液标本中检测肿瘤标志物可以为肺癌的诊断提供帮助。一些经典的标志物如CEA、NSE、CYFRA21-1等已经广泛应用于临床[16-17]。同时,一些有潜力的新型肺癌标志物如USP8等引发了很多学者的兴趣,并取得了很多进展。
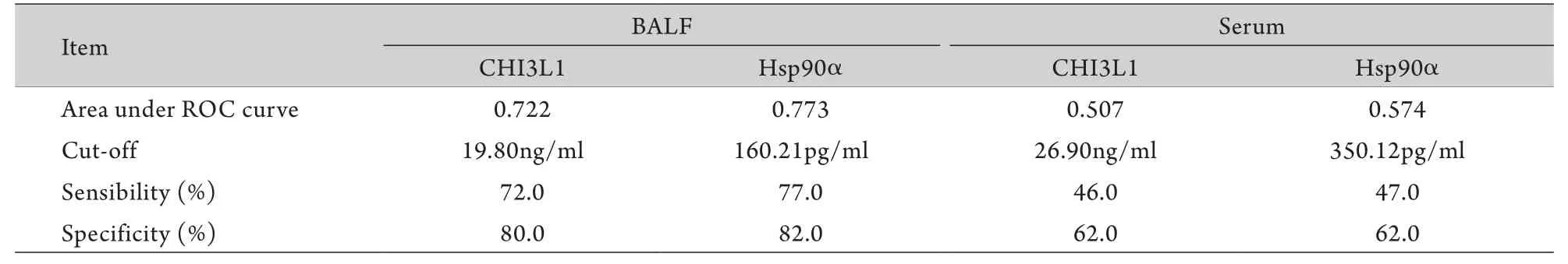
表4 BALF及血清CHI3L1和HSP90α诊断周围型肺癌的相关参数Tab. 4 Corresponding parameters of CHI3L1 and HSP90α in BALF and serum in diagnosis of peripheral lung cancer
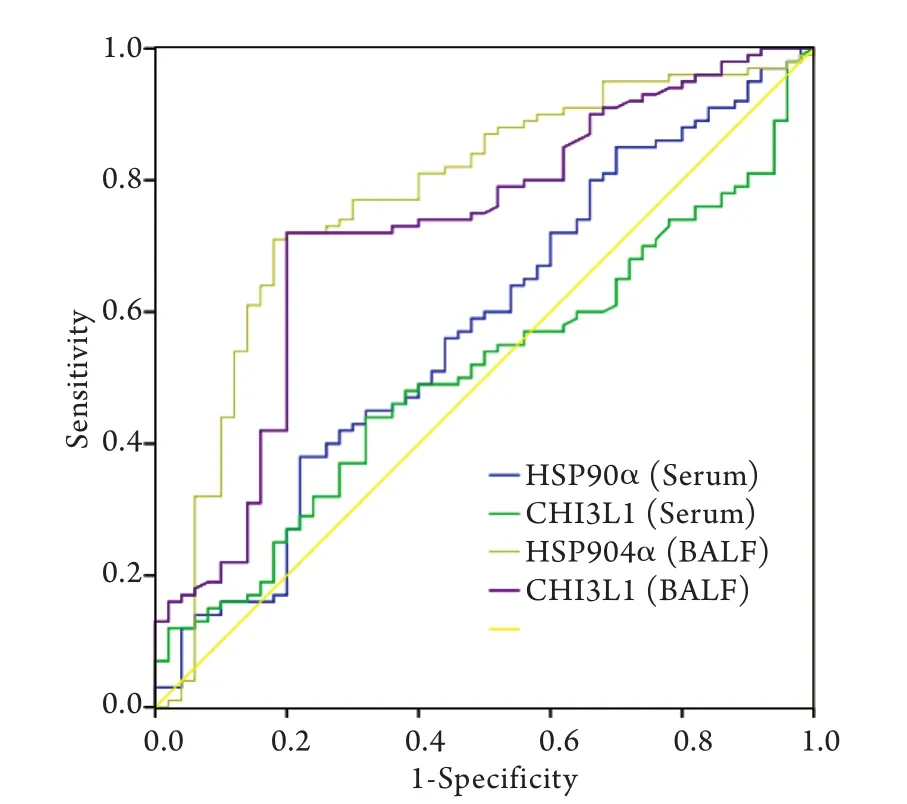
图1 BALF及血清标本中CHI3L1、HSP90α的ROC曲线Fig. 1 The ROC curve of CHI3L1 and HSP90α in BALF and serum
泛素-蛋白酶体通路是人体内降解蛋白质的主要途径之一,该过程可以被泛素特异性肽酶(USP)介导的去泛素化抑制[18]。肿瘤细胞内的蛋白质也可以经过泛素-蛋白酶体通路降解为氨基酸。然而,肿瘤细胞中富含很多泛素特异性肽酶如USP8,这些USP可以抑制泛素-蛋白酶体通路降解肿瘤细胞中的蛋白质,延长肿瘤细胞寿命[19]。Baykara等[20]的研究表明,肺癌患者血清中的USP8水平显著高于健康志愿者(P<0.01),可作为肺癌标志物。Byun等[21]的研究表明,USP8抑制剂可有效杀死小鼠肿瘤细胞,且对正常细胞损害不大,提示USP8可作为肺癌靶向治疗的目标。
热休克蛋白在机体受到应急等刺激时大量分泌。HSP90是热休克蛋白中的一种,是细胞突变中的一个重要缓冲因子,可以纠正突变蛋白所发生的错误折叠[22]。HSP90与肿瘤关系密切,多项研究表明其在肿瘤细胞中高表达并可与P53等癌基因产物结合,使后者不受蛋白酶降解,半衰期延长,从而保护肿瘤细胞[23]。HSP90的抑制剂如替拉替尼等可作为肿瘤靶向治疗药物,目前正在被广泛研究[24]。一些学者认为,HSP90α可以作为肺癌标志物用于临床[25]。
谷胱甘肽S转移酶(GST)是一种多功能代谢Ⅱ相酶,主要生理作用是促进体内有毒物质与谷胱甘肽结合,起到解毒作用[26]。很多致癌物质本身并没有致癌毒性,在体内经代谢后与遗传物质发生作用,才能起到致癌作用[27]。GST-P1为GST同工酶的一种,与肿瘤关系密切[28]。Eimoto等[29]采用免疫组化法证实了肺癌组织中GST-P1含量高于癌旁组织(P<0.05)。Hida等[30]的实验证明NSCLC患者血清中GST-P1含量高于健康志愿者(P<0.05)。Howie等[31]的实验也证实肺癌患者血浆中GST-P1含量高于健康志愿者(P<0.05)。
Chitinase-3-like蛋白1(CHI3L1)是一种分泌糖蛋白,由巨噬细胞、软骨及细胞及某些肿瘤细胞分泌,具体生理作用尚不清楚,目前认为其参与炎症及组织重塑过程[32]。Yan等[33]的实验表明肺癌组小鼠BALF及血清中CHI3L1含量显著高于正常组小鼠(P<0.01),可作为肺癌标志物。Thöm等[34]的研究表明血清中CHI3L1含量高的肺癌患者生存期短于CHI3L1含量低的肺癌患者,故可作为判断肺癌预后的一项标志物。
周围型肺癌系指发生于肺段以下支气管直到细小支气管的肺癌,临床症状出现较晚,以腺癌、鳞癌多见[35]。应用纤维支气管镜通常无法取到病变部位的病理组织,但肺穿刺取病理组织风险高、术后并发症较多。尽管支气管镜超声和电磁导航支气管镜可以为孤立性肺结节的诊断提供帮助[36-38],但这些检查在中国绝大多数医院还没有开展。寻找高诊断效能的检测方法,可以为孤立性肺结节的诊断与鉴别诊断提供帮助,解决临床实际问题。
在原发病灶获取标本,其诊断效能必然高于循环标本(血液标本),这是由于从原发灶获取的标本更能反映病变情况,且该标本没有受到循环、代谢、溶血等因素的影响。该观点在临床已得到证实,如半乳甘露聚糖实验(GM实验)中BALF标本的敏感性远远高于血液标本,而抗酸染色时采用BALF标本可提高诊断效能。因此,在测定肿瘤标志物时BALF标本优于血液标本,可以为周围型肺癌的临床诊断提供帮助。例如,Deng等[39]和Li等[40]已经证实在BALF中检测CEA、NSE、CYFRA21-1、鳞状细胞癌抗原(SCC-Ag)对肺癌的诊断价值优于血清标本;Ghosh等[41]也证实了肺癌患者BALF中CA-125、CA-153、CA-199的平均浓度高于血清,在BALF中检测CA-125、CA-153、CA-199对肺癌的诊断价值优于血清。然而,对于USP8等新型肿瘤标志物在BLAF中的检测结果对周围型肺癌的诊断价值目前尚不明确。本研究针对USP8等4种新型有潜力的肿瘤标志物进行BALF及血清浓度检测,以探究其对周围型肺癌的诊断价值。结果显示,肺癌患者BALF中HSP90a及CHI3L1浓度显著高于肺部良性病变患者(P<0.05);HSP90α、CHI3L1在两组患者血清中差异无统计学意义,GSTP1、USP8在两组患者BALF及血清中差异无统计学意义,考虑为样本量不足或其诊断敏感性偏低所致。针对HSP90α及CHI3L1两种标志物,通过ROC曲线获得最佳界值,使每种标志物的诊断特异性高达80%以上,在这种特异性下的诊断敏感性是可靠的,其中HSP90α诊断敏感性为77.0%,特异性为82.0%,CHI3L1诊断敏感性为72.0%,特异性为80.0%,与CEA、NSE等经典标志物相比不相上下。通过ROC曲线计算出HSP90α 及CHI3L1两种BALF标志物的曲线下面积分别为0.722与0.773,再次印证了两种BALF标志物对周围型肺癌的诊断效能比较可靠。同时,为进一步探究HSP90α及CHI3L1两种BALF标志物对超早期肺癌的诊断价值,本研究将小结节肺癌组与肺部良性病变组进行比较,虽然统计结果未见显著差异,但小结节肺癌组的平均浓度有高于肺部良性病变组的趋势,可扩大样本量进行进一步观察。
本研究中,肺癌组BALF中HSP90α及CHI3L1浓度显著高于肺部良性病变组,而两组患者血清中两种标志物浓度无明显差异,再次印证了BALF肿瘤标志物标本检测敏感性优于血清标本,与Li等[14]及Ghosh等[38]的结论一致。
总之,尽管本研究中肿瘤标志物的检测方法并非诊断肺癌的金标准,但在BALF检测肿瘤标记物可作为诊断周围型肺癌的一种补充手段,为临床医生提供新的思路与方法。
[1] Thunnissen E, van der Oord K, den Bakker M. Prognostic and predictive biomarkers in lung cancer. A review[J]. Virchows Arch, 2014, 464(3): 347-358.
[2] Li WB, Gao DW, Lu WN, et al. Analysis of complications and outcomes after pulmonary resection in patients aged 80 years or over with non-small cell lung cancer[J]. Med J Chin PLA, 2014, 39(10): 823-825. [李文兵, 高德伟, 卢文宁, 等. 80岁以上老年非小细胞肺癌切除术后并发症及预后分析[J]. 解放军医学杂志, 2014, 39(10): 823-825.]
[3] Zhang LL, Wang L, Chen Z, et al. Efficacy analysis of two drugs consisting platinum combined with first-line chemotherapeutics regimens on 117 elderly pateints with advanced non-small cell lung carcinoma[J]. Med J Chin PLA, 2013, 38(8): 644-648. [张黎黎, 王莉, 陈卓, 等. 一线含铂两药化疗方案治疗117例老年晚期非小细胞肺癌的疗效分析[J]. 解放军医学杂志, 2013, 38(8): 644-648.]
[4] Buettner R, Heydt C. Biomarker analysis from a pathologist's view. Founding the rationale for personalised treatment of lung cancer[J]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz, 2013, 56(11): 1502-1508.
[5] Gao L, Asmitanand T, Ren H, et al. Fiber-optic bronchoscope and detection of lung cancer: a five year study[J]. Neoplasma,2012, 59(2): 201-206.
[6] Li LD, Mo BW, Yu HN, et al. The Diagnostic Value of Sox2 mRNA Transcription Level in Bronchoscopy Biopsy Specimens in Lung Cancer[J]. Tianjin Med J, 2014, 42(4): 301-304. [李劳冬, 莫碧文, 于会娜, 等. 纤维支气管镜活检组织Sox2基因对肺癌的诊断价值[J]. 天津医药, 2014, 42(4): 301-304.]
[7] Fukui T, Mitsudomi T. Small peripheral lung adenocarcinoma: clinicopathological features and surgical treatment[J]. Surg Today, 2010, 40(3): 191-198.
[8] Lal H, Neyaz Z, Nath A, et al. CT-guided percutaneous biopsy of intrathoracic lesions[J]. Korean J Radiol, 2012, 13(2): 210-226.
[9] Harmsma M, Schutte B, Ramaekers FC. Serum markers in small cell lung cancer: opportunities for improvement[J]. Biochim Biophys Acta, 2013, 1836(2): 255-272.
[10] Dragomir A, Moldoveanu E, Mihǎltan F. Update regarding the role of biomarkers in early diagnosis of non-small cell bronchopulmonary cancer[J]. Pneumologia, 2011, 60(1): 7, 9-13.
[11] Li YK, Wei S, Li XR, et al. Influence of preoperative peripheral blood CYFRA21-1 level on the prognosis of non-small-cell lung cancer patients[J]. Med J Chin PLA, 2014, 39(5): 406-410. [李旸凯, 魏晟, 李晓蓉, 等. 术前外周血CYFRA21-1水平对非小细胞肺癌手术患者预后的影响[J].解放军医学杂志, 2014, 39(5): 406-410.]
[12] Cagle PT, Allen TC, Olsen RJ. Lung cancer biomarkers: present status and future developments[J]. Arch Pathol Lab Med, 2013, 137(9): 1191-1198.
[13] Jiang BL, Sha H. Current Study and Progress of Serum Tumor Markers in Lung Cancer[J]. Tianjin Med J, 2014, 42(4): 393-395. [蒋贝兰, 沙杭. 肺癌血清肿瘤标志物的研究现状及进展[J]. 天津医药, 2014, 42(4): 393-395.]
[14] Cao C, Chen ZB, Sun SF, et al. Evaluation of VEGF-C and tumor markers in bronchoalveolar lavage fluid for lung cancer diagnosis[J]. Sci Rep, 2013, 3: 3473.
[15] Grunnet M, Sorensen JB. Carcinoembryonic antigen (CEA) as tumor marker in lung cancer[J]. Lung Cancer, 2012, 76(2): 138-143.
[16] Cedres S, Nunez I, Longo M, et al. Serum tumor markers CEA, CYFRA21-1, and CA-125 are associated with worse prognosis in advanced non-small-cell lung cancer (NSCLC)[J]. Clin Lung Cancer, 2011, 12(3): 172-179.
[17] Li J, Liang XF, Zhai GL. Application of combined detection of serum levels of CA199, CA125 and CEA in diagnosis of pancreatic cancer[J]. J Jilin Univ (Med Ed) 2014, 40(6): 1252-1255. [李静, 梁晓芳, 翟桂兰. 血清CA199、CA125和CEA联合检测在胰腺癌诊断中的应用[J]. 吉林大学学报(医学版), 2014, 40(6): 1252-1255.]
[18] Lill JR, Wertz IE. Toward understanding ubiquitin-modifying enzymes: from pharmacological targeting to proteomics[J]. Trends Pharmacol Sci, 2014, 35(4): 187-207.
[19] Burkhart RA, Peng Y, Norris ZA, et al. Mitoxantrone targets human ubiquitin-specific peptidase 11 (USP11) and is a potent inhibitor of pancreatic cancer cell survival[J]. Mol Cancer Res, 2013, 11(8): 901-911.
[20] Baykara M, Yaman M, Buyukberber S, et al. Clinical and prognostic importance of XIAP and USP8 in advanced stages of non-small cell lung cancer[J]. J Buon, 2013, 18(4): 921-927.
[21] Byun S, Lee S Y, Lee J, et al. USP8 is a novel target for overcoming gefitinib resistance in lung cancer[J]. Clin Cancer Res, 2013, 19(14): 3894-3904.
[22] Saibil H. Chaperone machines for protein folding, unfolding and disaggregation[J]. Nat Rev Mol Cell Biol, 2013, 14(10): 630-642.
[23] Chae YC, Angelin A, Lisanti S, et al. Landscape of the mitochondrial Hsp90 metabolome in tumours[J]. Nat Commun, 2013, 4: 2139.
[24] Garcia-Carbonero R, Carnero A, Paz-Ares L. Inhibition of HSP90 molecular chaperones: moving into the clinic[J]. Lancet Oncol, 2013, 14(9): e358-e369.
[25] Proia DA, Bates RC. Ganetespib and HSP90: translating preclinical hypotheses into clinical promise[J]. Cancer Res, 2014, 74(5): 1294-1300.
[26] Di Pietro G, Magno LA, Rios-Santos F. Glutathione S-transferases: an overview in cancer research[J]. Expert Opin Drug Metab Toxicol, 2010, 6(2): 153-170.
[27] Chang BX, Mao PY. The research progress and its relevance with tumor of glutathione S[J]. Med J Chin PLA, 2012, 37(8): 838-842. [常彬霞, 貌盼勇. 谷胱甘肽S转移酶的研究进展及其与肿瘤的相关性[J]. 解放军医学杂志, 2012, 37(8): 838-842.]
[28] Lopez-Cima MF, Alvarez-Avellon SM, Pascual T, et al. Genetic polymorphisms in CYP1A1, GSTM1, GSTP1 and GSTT1 metabolic genes and risk of lung cancer in Asturias[J]. BMC Cancer, 2012, 12: 433.
[29] Eimoto H, Tsutsumi M, Nakajima A, et al. Expression of the glutathione S-transferase placental form in human lung carcinomas[J]. Carcinogenesis, 1988, 9(12): 2325-2327.
[30] Hida T, Kuwabara M, Ariyoshi Y, et al. Serum glutathione S-transferase-pi level as a tumor marker for non-small cell lung cancer. Potential predictive value in chemotherapeutic response[J]. Cancer, 1994, 73(5): 1377-1382.
[31] Howie AF. Measurement of glutathione S-transferase pi by radioimmunoassay: elevated plasma levels in lung cancer patients[J]. Br J Biomed Sci, 1993, 50(3): 187-199.
[32] Libreros S, Garcia-Areas R, Iragavarapu-Charyulu V. CHI3L1 plays a role in cancer through enhanced production of proinflammatory/pro-tumorigenic and angiogenic factors[J]. Immunol Res, 2013, 57(1/3): 99-105.
[33] Yan C, Ding X, Wu L, et al. Stat3 downstream gene product chitinase 3-like 1 is a potential biomarker of inflammationinduced lung cancer in multiple mouse lung tumor models and humans[J]. PLoS One, 2013, 8(4): e61984.
[34] Thöm I, Andritzky B, Schuch G, et al. Elevated pretreatment serum concentration of YKL-40-An independent prognostic biomarker for poor survival in patients with metastatic nonsmall cell lung cancer[J]. Cancer, 2010, 116(17): 4114-4121.
[35] Kim HR, Kim TH, Chung JH, et al. The detection of peripheral lung cancer by MAGE A1-6 RT-nested PCR in bronchial washing specimens[J]. Lung Cancer, 2009, 65(2): 166-169.
[36] Port J, Harrison S. Electromagnetic navigational bronchoscopy[J]. Semin Intervent Radiol, 2013, 30(2): 128-132.
[37] Nabavizadeh N, Zhang J, Elliott DA, et al. Electromagnetic navigational bronchoscopy-guided fiducial markers for lung stereotactic body radiation therapy: analysis of safety, feasibility, and interfraction stability[J]. J Bronchology Interv Pulmonol, 2014, 21(2): 123-130.
[38] Vanderlaan PA, Wang HH, Majid A, et al. Endobronchial ultrasound-guided transbronchial needle aspiration (EBUSTBNA): An overview and update for the cytopathologist[J]. Cancer Cytopathol, 2014, 122(8): 561-576.
[39] Deng LP, Dong W, Du YP. Combined determination of tumor markers in serum and bronchoalveolar lavage fluid for lung cancer diagnosis[J]. Acta Acad Med Mil Tert, 2008, 30(1): 78-80.
[40] Li J, Chen P, Mao CM, et al. Evaluation of diagnostic value of four tumor markers in bronchoalveolar lavage fluid of peripheral lung cancer[J]. Asia Pac J Clin Oncol, 2014, 10(2): 141-148.
[41] Ghosh I, Bhattacharjee D, Das AK, et al. Diagnostic Role of Tumour Markers CEA, CA15-3, CA19-9 and CA125 in Lung Cancer[J]. Indian J Clin Biochem, 2013, 28(1): 24-29.
Diagnostic value of 4 new tumor markers in bronchoalveolar lavage fluid in the diagnosis of peripheral lung cancer
ZHANG Shi, ZHANG Ming-zhou, WU Xue-ling*
Institute of Respiratory Disease, Xinqiao Hospital, Third Military Medical University, Chongqing 400037, China
*
, E-mail: wuxueling@aliyun.com
This work was supported by the National Natural Science Foundation of China (81270130)
ObjectiveTo investigate the clinical value of heat shock protein 90α (HSP90α), glutathione S-transferase P1 (GSTP1), ubiquitin specific peptidase 8 (USP8) and chitinase 3-like 1 (CHI3L1) in bronchoalveolar lavage fluid (BALF) and serum for diagnosis and evaluation of the extent of peripheral lung cancer.MethodsThe levels of HSP90α, GSTP1, USP8 and CHI3L1 of in BALF and serum were measured and compared among 100 patients with peripheral lung cancer (PLC) and 50 patients with benign lung diseases (BLD) by ELISA. The results were compared and analyzed.ResultsThe average content of HSP90α and CHI3L1 in BALF of PLC patients were higher than that in BLD patients (P<0.05). The diagnostic sensitivity of HSP90α and CHI3L1 in BLAF for the diagnosis of lung cancer were respectively 77.0% and 72.0%, and the specificity of them was respectively 82.0% and 80.0%. The levels of HSP90α and CHI3L1 in serum of PLC patients and BLD patients showed no significant difference (P>0.05). The levels of HSP90α and CHI3L1 in BALF of the patients with small nodular lung cancer group (primary focus diameter ≤1cm) and BLD patients showed no significant difference (P>0.05). The levels of GSTP1 and USP8 in BALF and serum of PLC patients and that of BLD patients showed no significant difference (P>0.05). The levels of HSP90α, GSTP1, USP8 and CHI3L1 in BALF and serum showed no significant correlation with other factors, such as the patient's age, pathological classification (adenocarcinoma or squamous carcinoma) and stage of lung cancer (phase Ⅰ to Ⅳ). The level of CHI3L1 in BALF was correlatedto the diameter of the primary foci (P<0.05), while the levels of other lung cancer markers in BALF and serum showed no significant correlation with diameter of primary focus.ConclusionDetection of tumor markers such as HSP90α and CHI3L1 from patients' BALF has a diagnostic value for PLC, and is superior to the examinations of patients' serum specimens. The measurement of HSP90α in BALF shows better clinical value, and it may contribute to the diagnosis of peripheral pulmonary carcinoma.
bronchoalveolar lavage fluid (BALF), tumor marker, peripheral lung cancer pulmonary carcinoma, diagnosis
R734.2
A
0577-7402(2015)03-0206-06
10.11855/j.issn.0577-7402.2015.03.07
2014-10-14;
2015-02-12)
(责任编辑:沈宁)
国家自然科学基金(81270130)
张实,医学硕士。主要从事肺部疾病的临床诊断及治疗工作
400037 重庆 第三军医大学新桥医院呼吸科(张实、张明周、吴学玲)
吴学玲,E-mail:wuxueling@aliyun.com

