雌二醇短期暴露对非洲爪蟾性腺和输卵管形态及性二态基因表达影响的初步研究
徐伟,楼钦钦,魏无际,*,秦占芬
1. 南京工业大学环境学院,南京 210009 2. 中国科学院生态环境研究中心 环境化学与生态毒理学国家重点实验室,北京 100085
雌二醇短期暴露对非洲爪蟾性腺和输卵管形态及性二态基因表达影响的初步研究
徐伟1,楼钦钦2,魏无际1,*,秦占芬2
1. 南京工业大学环境学院,南京 210009 2. 中国科学院生态环境研究中心 环境化学与生态毒理学国家重点实验室,北京 100085
环境雌激素对两栖动物的生殖内分泌干扰作用已引起关注,目前的研究主要集中在长期暴露对性腺分化和发育的影响。以雌二醇(E2,10 nmol·L-1)为模式化合物,以非洲爪蟾为实验动物,6月龄的幼蛙暴露6 d,研究雌激素对性腺和输卵管形态以及性二态性基因表达的影响。结果发现,6 d的E2暴露对精巢和卵巢的形态没有明显影响,但从组织学结构来看对卵和精子的发育有微弱的促进作用。E2能够明显地促进了雌性输卵管的发育,表现为输卵管变粗变弯曲。E2暴露显著抑制精巢和卵巢中性激素合成相关基因cyp11a1、3βHSD、Srd5α、ARO的表达,对cyp17的表达无影响,使脑中LHβ和FSHβ的表达下调;对性别分化和性腺发育相关基因Dax、AR、ERα、TFⅢA、TBPL2的表达均无影响,但能够促进卵巢中Sox3的表达;同时促进脑中Emi2的表达,抑制脑中Dmrt1的表达。因此,输卵管可作为敏感的形态指标,性腺中Srd5α、cyp11a1、3βHSD、ARO、Sox3和脑中LHβ、FSHβ、Dmrt1、Emi2可作为分子指标。以上结果可为后续建立评价化学品对两栖动物雌激素效应的短期试验方法提供参考。
磁二醇;非洲爪蟾;雌激素效应;输卵管;性腺;性二态基因
大量研究显示,环境雌激素类物质广泛存在于水体当中[1-4]。这些环境雌激素对水生生物尤其鱼类的生殖系统发育和生殖功能的影响已有大量报道[5-9]。与鱼类相似,两栖动物的幼体在水中发育,成体也不能脱离对水环境的依赖。尤其有文献证实,一些两栖动物种的性腺分化对雌激素敏感,在雌激素类物质的诱导下可出现从雄到雌的逆转或者雌雄两性[10-14]。因此,环境雌激素对两栖动物的生殖内分泌干扰作用受到关注。
目前有关环境雌激素对两栖动物生殖内分泌干扰作用的研究,主要集中在长期暴露对性腺分化和发育的影响。Hayes等[10]报道非洲爪蟾暴露低剂量阿特拉津46 d可导致雄性体内睾酮水平显著下降,并出现雌雄两性个体。树蛙暴露雌二醇108 d导致性别比显著偏向雌性,出现间性个体,并促进肝脏中vtg2、hdlbp、dhcr7等基因表达[14]。长期暴露研究虽然能够较为真实地揭示环境暴露的负面效应,但是存在研究周期长、耗时耗力等缺点。所以探索短期暴露的研究方法,寻找相对敏感的终点指标,对于高效快速地评价环境雌激素对两栖动物的生殖内分泌干扰作用具有重要的意义。
基于此,本文选择对雌激素敏感的非洲爪蟾(Xenopus laevis)为实验动物,以典型雌激素E2为模式化合物,研究雌激素对性腺和输卵管形态以及性二态性基因表达的影响,筛选对雌激素敏感的终点指标,为后续建立评价化学品对两栖动物雌激素效应的短期试验方法提供参考。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:离心机(5415R,Eppendorf Centrifuge)、组织碾磨仪(MM301,Retsch)、超微量紫外可见分光光度计(ND-1000,Nanodrop)、荧光定量 PCR 仪(Lightcycler 480,Roche)、石蜡切片机(2135,Leica)、体式显微镜(XTL0745,重庆光电仪器有限公司)、数码相机(COOLPIX995,尼康)。
试剂:MS-222、E2购自美国Sigma公司,动物饲料购自香港Totoro Supplies公司,Trizol、 FastQuant RT Kit试剂盒、RNase-free H2O、SYBR Green Mix试剂盒均购自北京天根生化科技有限公司,异丙醇、乙醇、苦味酸、甲醛、冰醋酸、二甲苯、氯仿均为分析纯,购自北京化学试剂公司,荧光定量PCR引物由上海生工生物工程技术有限公司合成。
1.2 实验动物和短期暴露
本实验室饲养的非洲爪蟾,雌雄分开饲养于盛有除氯水的玻璃缸中,水温(22±2)℃, 明暗光周期为12 h:12 h。每日喂食1次面包虫,每周喂食2次1:1配比的猪肝和动物饲料,喂食2 h后换水。
暴露实验选取个体发育一致且活跃的非洲爪蟾(变态后6个月)雌雄各5只,20 L玻璃缸中加18 L除氯水,暴露10 nmol·L-1E2,同时设置空白对照。暴露6 d,每天喂食面包虫,喂食2 h后换水,换水后重新加药以维持暴露浓度。
1.3 取样
6 d暴露结束后,用MS-222麻醉非洲爪蟾,称量体重,冰上解剖。取脑及部分性腺,液氮冻存,用于性二态基因表达分析;另取部分性腺浸入Bouin氏固定液,用于组织学结构检测;取肾脏(两侧附着输卵管)浸入Bouin氏固定液,于体式显微镜下观察输卵管形态并照相。
1.4 性腺和输卵管形态学和组织学检查
肾脏(附着输卵管)经Bouin氏固定液固定2 h后取出,于体视显微镜下观察输卵管形态并照相。
性腺在Bouin氏固定液中固定过夜,取出,于体视显微镜下观察形态并照相。随后进行组织学切片分析:流动水冲水后梯度酒精(70%、80%、95%、100%)脱水,二甲苯透明,石蜡包埋,切片机切片,切片厚度6 μm,苏木素、伊红染色后树胶封固,在显微镜下观察并照相。
1.5 性二态基因表达分析(qRT-PCR)
脑、性腺组织匀浆后用Trizol提取总RNA,紫外可见分光光度计测定RNA浓度及质量,保证吸光度A260 nm/A280 nm在1.8~2.0,并用1%的琼脂糖凝胶电泳检测RNA纯度。 1 μg RNA用于反转录合成第一链cDNA,操作根据FastQuant RT Kit试剂盒说明书进行,反转录后合成的cDNA产物保存于-20℃用于后续PCR扩增。
根据实验室积累的研究数据,选择5个性激素合成转化相关基因(Srd5α、cyp11a1、3βHSD、cyp17、ARO)、3个性激素合成调控基因(GnRH、LHβ、FSHβ)以及8个性别分化和性腺发育相关基因(AR、ERα、Dmrt1、Dax、Emi2、TFⅢA、TBPL2、Sox3)作为候选基因,通过研究这些基因表达对E2的响应,筛选对其敏感的基因。使用 Primer Premier 6.0软件设计引物,引物序列及相关信息见表1。qPCR根据SYBR Green Mix试剂盒说明书进行操作,基因表达水平用2-ΔΔCt方法处理,内参基因为rpl8。
1.6 数据分析
脑和性腺中基因的表达数据采用SPSS16.0进行统计分析,数据结果以均值±标准差表示,E2处理组与对照组之间的显著性差异用独立T检验分析(*表示 p<0.05),图形采用Origin 6.0软件绘制。
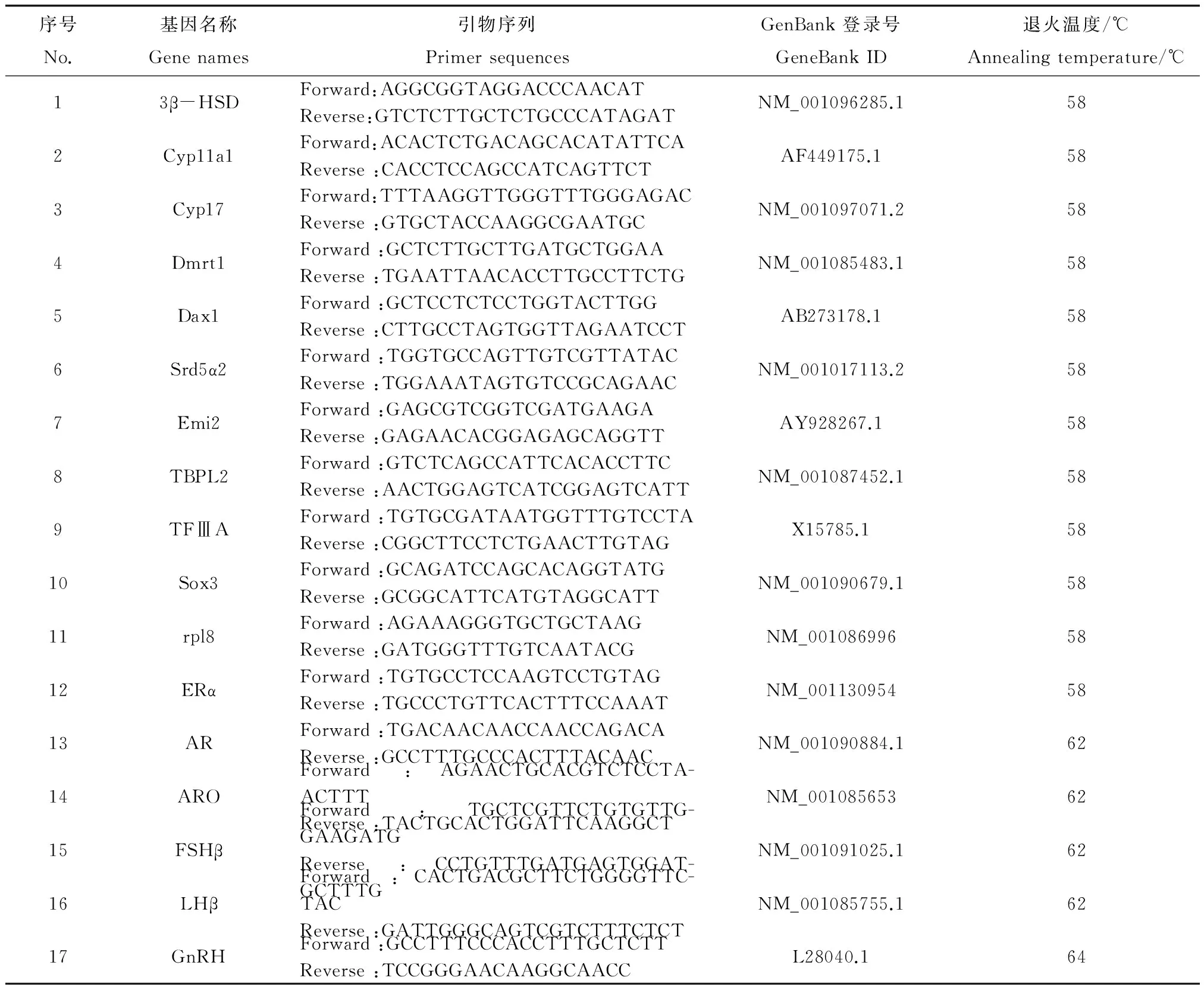
表1 荧光定量PCR引物信息
2 结果(Results)
2.1 E2暴露对性腺和输卵管组织形态的影响
E2暴露对精巢和卵巢的整体形态没有明显影响,但从组织学结构来看,一定程度上促进了精子和卵的发育。由精巢组织学观察结果可见,正常的非洲爪蟾精巢(图1a)由众多生精小管紧密排列组成,生精小管中紧贴管壁排列着不同发育时期的生殖细胞:精原细胞(sg)、精母细胞(sc)、精细胞(st),管腔中间可见零散分布着少量精子(sz)。10 nmol·L-1E2暴露促进精巢的发育(图1b),生精小管变大,管腔中间精子(sz)数目显著增多,成簇排列。卵巢组织学观察结果显示,相比对照(图1c),6 d的E2暴露对卵巢的组织结构没有显著的改变(图1d),但略促进卵母细胞发育。对照组卵巢中卵母细胞均处于Ⅰ期(直径50~300 μm)。10 nmol·L-1E2处理后,卵巢中除了Ⅰ期卵母细胞外,同时存在Ⅱ期卵母细胞(直径300~450 μm)。
正常性腺发育过程中,雌性的缪勒氏管分化为输卵管,成为重要的第二性特征。对照中肾脏两侧输卵管已明显发育,但整体形态比较直挺,弯曲较少(图2a),而10 nmol·L-1E2处理6 d后(图2b),肾脏两侧输卵管变粗变长,出现多个弯曲盘旋,E2显著促进了输卵管的发育。
2.2 E2暴露对性腺和脑中性二态基因表达的影响
2.2.1 对性激素合成转化相关基因及上游调控基因表达的影响
图3显示E2暴露6 d后脑和性腺中性激素合成转化相关基因cyp11a1、3βHSD、cyp17、Srd5α、ARO的表达水平。性激素合成转化通路中的cyp11a1、3βHSD、Srd5α基因,精巢中表达水平显著高于卵巢中表达;E2暴露后,cyp11a1、3βHSD基因在精巢和卵巢中的表达均降低,精巢中Srd5α的表达也受抑制。ARO为卵巢中高表达基因,E2暴露后ARO在卵巢中的表达下调了2.5倍。脑中这些基因的表达均没有显著雌雄差异,且不受E2影响。
脑中GnRH、FSHβ、LHβ调控激素的合成和转化。在正常情况下,雄性中GnRH表达高于雌性,而雌性中FSHβ、LHβ表达高于雄性。E2暴露后雌雄个体脑中FSHβ、LHβ表达水平均受显著抑制:与对照相比,E2暴露使雌雄脑中FSHβ的表达分别下调250倍和50倍,LHβ的表达分别下调1500倍和500倍,且不存在雌雄表达差异。E2暴露不影响脑中GnRH的表达(图4)。
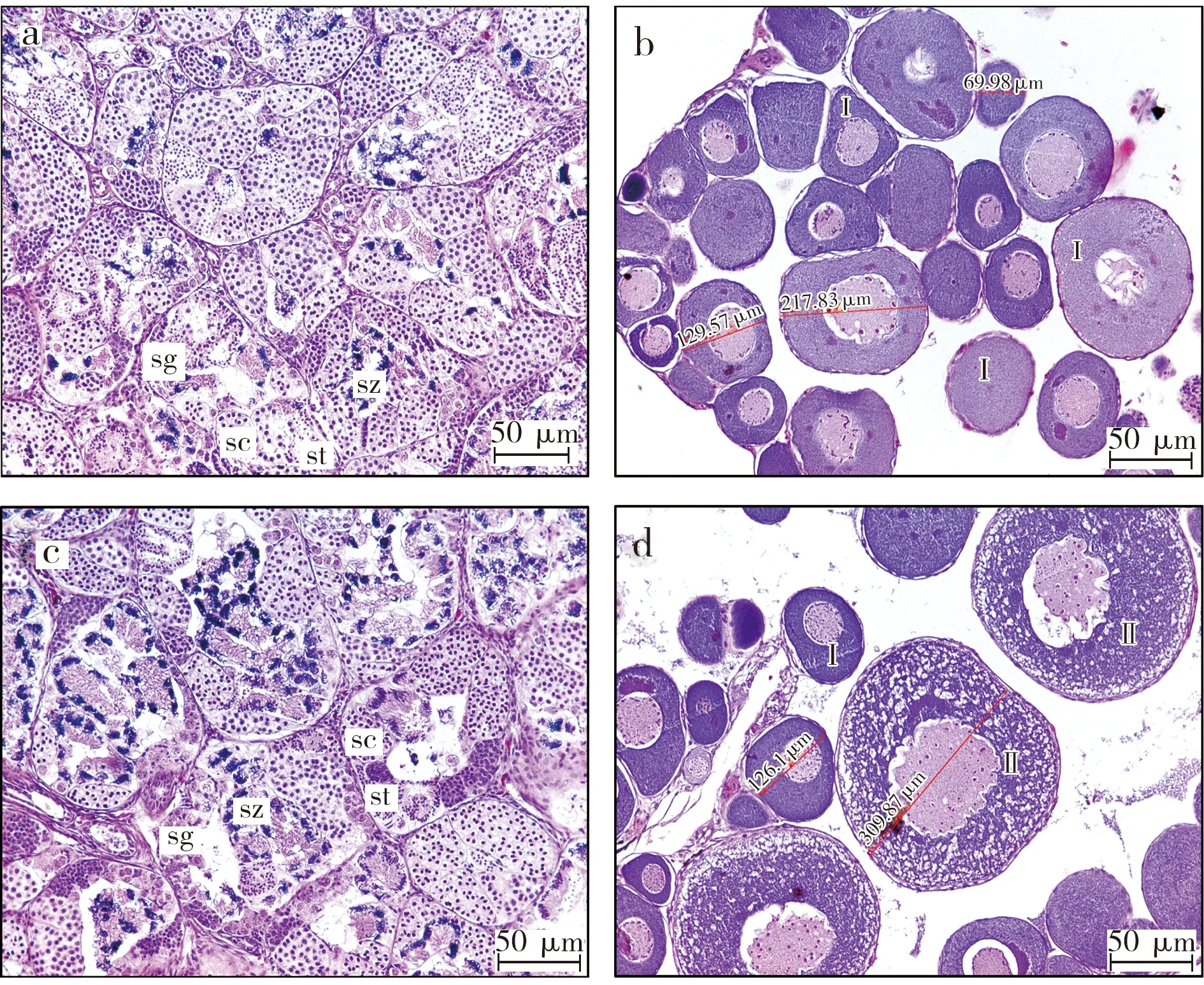
图1 E2暴露对非洲爪蟾性腺组织学的影响(a. 对照组精巢;b. E2暴露组精巢;c. 对照组卵巢;d. E2暴露组卵巢;sg. 精原细胞;sc. 精母细胞;st. 精细胞;sz. 精子;Ⅰ.Ⅰ期卵母细胞;Ⅱ. Ⅱ期卵母细胞)Fig. 1 Effects of E2 on gonad histology in Xenopus laevis

图2 E2暴露对非洲爪蟾输卵管的影响(a. 对照组输卵管;b. E2暴露组输卵管;K. 肾脏;OD. 输卵管)Fig. 2 Effects of E2 on oviductive morphology in Xenopus laevis
2.2.2 对性别分化及性腺发育相关基因表达的影响
正常情况下,Dmrt1、Dax、AR、ERα、TFⅢA在精巢中高表达(图5a),精巢中的表达分别是卵巢中的120倍、30倍、3倍、2倍、4.5倍。脑中这些基因的表达没有性别差异。E2暴露对性腺中这些基因表达没有影响,但使脑中Dmrt1的表达下调。
Sox3、Emi2、TBPL2在卵巢中高表达,卵巢中的表达水平分别是精巢中的1200倍、50倍、37倍。脑中这些基因的表达没有性别差异。E2暴露促进卵巢中Sox3的表达,对Emi2、TBPL2的表达则无影响。而在脑中,E2暴露促进雌雄脑中Emi2的表达(图5b)。

图3 E2暴露对性激素合成转化相关基因表达的影响Fig. 3 Effects of E2 on mRNA expression of the genes that are related to sex hormone synthesis and conversion in Xenopus laevis
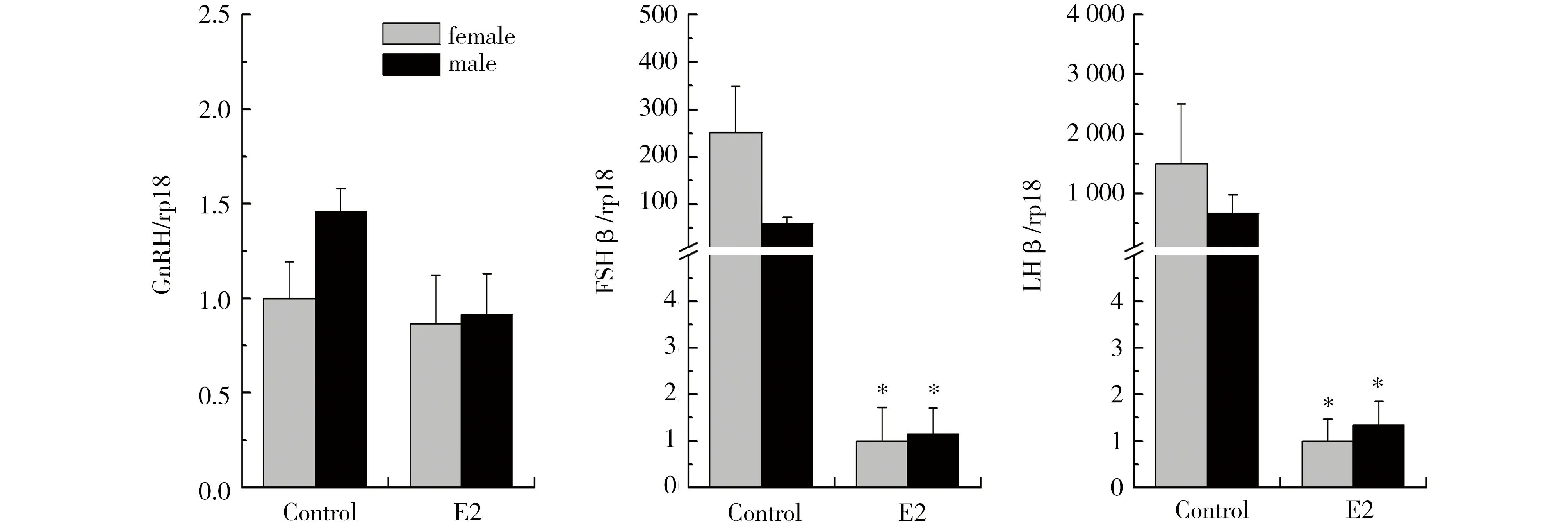
图4 E2暴露对非洲爪蟾脑中GnRH、FSHβ、LHβ表达的影响Fig. 4 Effects of E2 on mRNA expression of GnRH, LHβ and FSHβ in Xenopus laevis brains
3 讨论(Discussion)
有众多研究证实,雌激素类物质长期暴露可影响两栖动物的性腺发育,导致性腺形态和组织学结构出现雌性化特征[14-17]。本研究结果显示,短期E2暴露对精巢及卵巢形态基本没有影响,对组织结构的影响也并不十分明显,只是对精子和卵的发育有一定的促进作用。显示外源雌激素对性腺发育的影响需要一定时间累积。因此,性腺形态和组织学结构不适合作为短期暴露评价雌激素效应的指标。但是,6 d的E2暴露对第二性特征输卵管有显著影响,导致输卵管明显变粗变弯曲。Pettersson等[17]研究了乙炔雌二醇(EE2)长期暴露对热带爪蟾生殖器发育的影响,结果发现10 nmol·L-1EE2暴露蝌蚪9个月后组织形态学观察发现所有性腺均呈现卵巢特性,且约有40%的卵巢没有输卵管,含有输卵管的个体其输卵管躯体指数(输卵管重量/身体重量)相比对照升高,100 nmol·L-1EE2则显著增加输卵管躯体指数。因此输卵管可能是一个对雌激素十分敏感的器官,可作为评价化学品短期暴露对非洲爪蟾雌激素效应的形态指标。

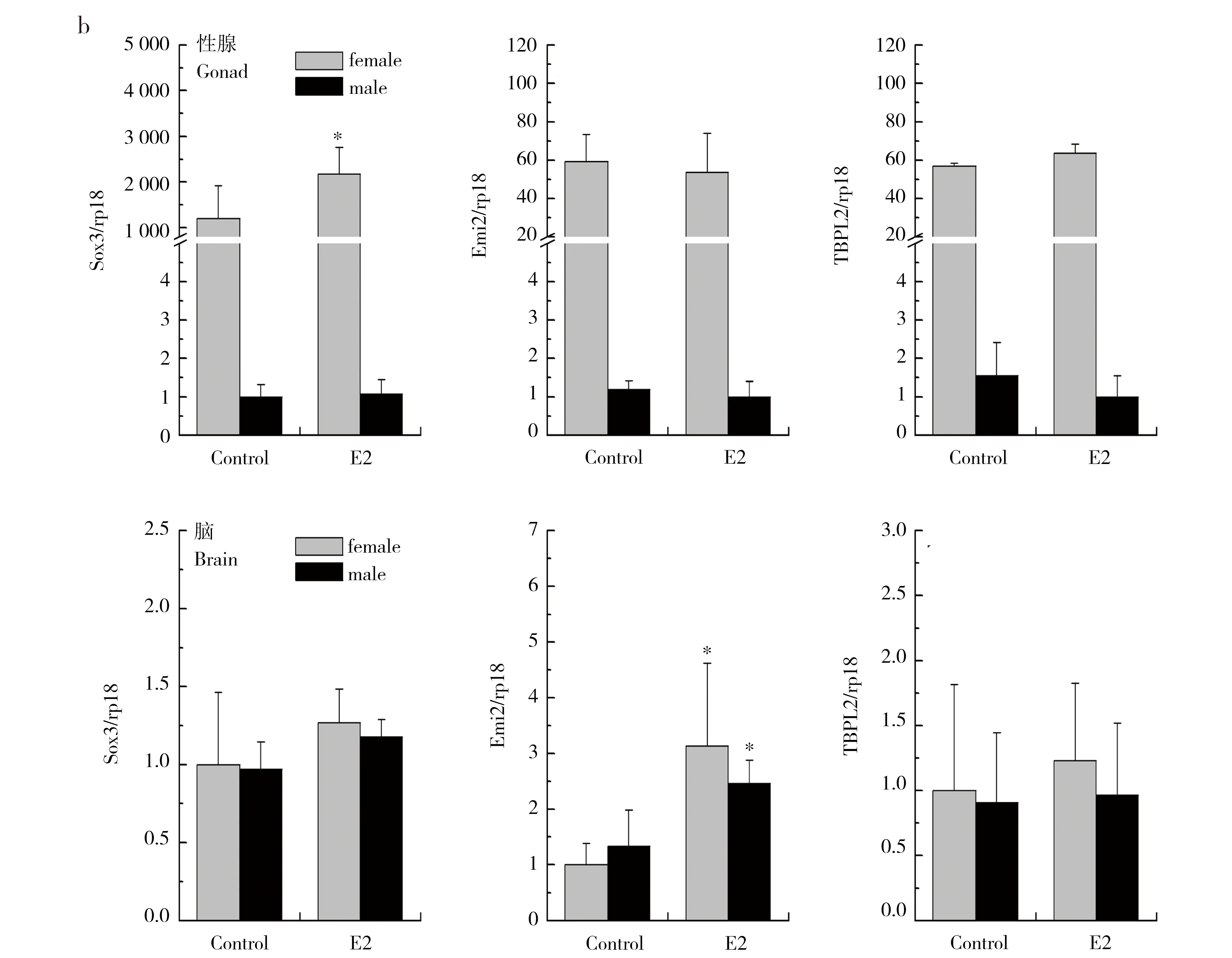
图5 E2暴露对性别分化和性腺发育相关基因表达的影响Fig. 5 Effects of E2 on mRNA expression of the genes that are related to sexual differentiation and gonadal development in Xenopus laevis
脊椎动物的性腺发育受到下丘脑-垂体-性腺轴(HPG)的调节和控制,激素及其受体在信息传递过程中起了重要作用[18]。下丘脑分泌的促性腺激素释放激素GnRH促进垂体分泌黄体生成素LH和促卵泡激素FSH,随后FSH、LH作用于性腺,刺激性腺合成相应性激素。本文研究结果显示,10 nmol·L-1E2暴露 6 d后,脑中LHβ、FSHβ的表达显著抑制。与我们的研究结果类似,Li等[19]用炔雌醇(EE)暴露8周龄SD雄鼠7 d,结果发现在1 mg·kg-1剂量下即可引起血清中LH和FSH的水平显著下降,在10 mg·kg-1剂量下血清中睾酮水平也显著下调。cyp11a1、3βHSD、cyp17、ARO、Srd5α等基因参与了胆固醇合成激素的过程:cyp11a1编码P450 11-羟化酶催化胆固醇转化为孕烯醇酮,孕烯醇酮在3β-羟基类固醇脱氢酶(3βHSD)作用下转化为孕酮,随后孕酮由cyp17编码的P450 17-羟化酶催化转化为雄烯二酮,进而转化形成睾酮。在精巢中,睾酮经5α-还原酶(Srd5α)作用生成活性更强的双氢睾酮;在卵巢中,睾酮则在芳香化酶(ARO)作用转变为雌二醇。本文研究结果显示,10 nmol·L-1E2暴露 6 d后,性腺中激素合成转化重要基因cyp11a1、3βHSD、ARO、Srd5α的表达均受到显著抑制,cyp17的表达水平不受影响。Liu等[20]的研究显示,25 ng·L-1乙炔雌二醇(EE2)暴露7 d可抑制稀有鮈鲫性腺中cyp11a1、cyp17、cyp19的表达,但对3βHSD没有影响。Overturf等[21]的研究结果则表明黑头呆鱼暴露左炔诺孕酮(LNG)28d后可引起FSH、3βHSD、ARO、ERβ表达显著下调,但对LHβ、cyp11a1、cyp17、AR、ERα的表达没有影响。这些结果与本文研究结果基本一致,显示在短期暴露下,性激素的合成及转化相关基因Srd5α、cyp11a1、3βHSD、ARO 以及上游调控基因LHβ、FSHβ对雌激素的作用十分敏感,且6 d暴露后产生的效应与长期暴露数据基本吻合,可以作为短期暴露筛查化学品雌激素效应的分子指标。
两栖动物的性别决定是由基因控制的,但性激素的暴露可干扰正常的性别分化[22-23]。Dmrt1、Dax、AR、ERα、TFⅢA、Sox3、Emi2、TBPL2是性别分化和性腺发育相关的重要基因。本文研究了E2暴露对这些基因表达的影响,结果发现E2导致脑中Dmrt1的表达下调,促进脑中Emi2及卵巢中Sox3的表达,对其他基因的表达没有显著影响。在脊椎动物中,Dmrt1被认为与性腺发育有重要关联,主要在非洲爪蟾精巢中表达,卵巢中水平很低[24]。Sox家族基因也是重要的性别决定基因,其中Sox3被认为是重要的X决定基因[25]。Emi2基因则是非洲爪蟾卵母细胞减少分裂过程中重要的生长抑制因子,对卵母细胞的发育起重要调节作用[26]。文献报道显示,成年斑马鱼暴露25 ng·L-1EE2 两周,显著抑制精巢中Dmrt1的表达,对AR、ERα、ARO的表达则无显著作用[27]。由此可见,雌激素暴露会在一定程度上干扰性别决定基因的表达,产生一定雌激素干扰效应。但整体而言,除Sox3外,雌激素暴露对性别分化和性腺发育相关基因的影响并不十分明显。
综上所述,本研究发现输卵管对雌激素的短期暴露十分敏感,可作为评价化学品对两栖动物的雌激素效应的形态指标,并可发展输卵管重量、盘曲数及相关基因表达水平等定量指标。同时,性腺中Srd5α、cyp11a1、3βHSD、ARO、Sox3和脑中LHβ、FSHβ、Emi2、Dmrt1对雌激素的短期暴露也十分敏感,可作为研究化学品雌激素效应的分子指标。以上结果为后续建立评价化学品对两栖动物雌激素效应的短期试验方法提供了参考。
[1] Baronti C, Curini R, D'Ascenzo G, et al. Monitoring natural and synthetic estrogens at activated sludge sewage treatment plants and in a receiving river water [J]. Environmental Science & Technology, 2000, 34(24): 5059-5066
[2] Atkinson S, Atkinson M J, Tarrant A M. Estrogens from sewage in coastal marine environments [J]. Environmental Health Perspectives, 2003, 111(4): 531
[3] Nie M, Yang Y, Liu M, et al. Environmental estrogens in a drinking water reservoir area in Shanghai: Occurrence, colloidal contribution and risk assessment [J]. Science of the Total Environment, 2013, 487: 785-791
[4] Schultz M M, Minarik T A, Martinovic-Weigelt D, et al. Environmental estrogens in an urban aquatic ecosystem: II. Biological effects [J]. Environment International, 2013, 61: 138-149
[5] Brausch J M, Rand G M. A review of personal care products in the aquatic environment: Environmental concentrations and toxicity [J]. Chemosphere, 2011, 82(11): 1518-1532
[6] Souza M S, Hallgren P, Balseiro E, et al. Low concentrations, potential ecological consequences: Synthetic estrogens alter life-history and demographic structures of aquatic invertebrates [J]. Environmental Pollution, 2013, 178: 237-243
[7] Segner H, Casanova-Nakayama A, Kase R, et al. Impact of environmental estrogens on Yfish considering the diversity of estrogen signaling [J]. General and Comparative Endocrinology, 2013, 191: 190-201
[8] Han J, Wang Q, Wang X, et al. The synthetic progestin megestrol acetate adversely affects zebrafish reproduction [J]. Aquatic Toxicology, 2014, 150: 66-72
[9] Orlando E F, Ellestad L E. Sources, concentrations, and exposure effects of environmental gestagens on fish and other aquatic wildlife with an emphasis on reproduction [J]. General and Comparative Endocrinology, 2014, 203: 241-249
[10] Hayes T B, Collins A, Lee M, et al. Hermaphroditic, demasculinized frogs after exposure to the herbicide atrazine at low ecologically relevant doses [J]. Proceedings of the National Academy of Sciences, 2002, 99(8): 5476-5480
[11] Kloas W. Amphibians as a model for the study of endocrine disruptors [J]. International Review of Cytology, 2002, 216: 1-57
[12] Qin Z F, Qin X F, Yang L, et al. Feminizing/demasculinizing effects of polychlorinated biphenyls on the secondary sexual development of Xenopus laevis [J]. Aquatic Toxicology, 2007, 84(3): 321-327
[13] Storrs S I, Semlitsch R D. Variation in somatic and ovarian development: Predicting susceptibility of amphibians to estrogenic contaminants [J]. General and Comparative Endocrinology, 2008, 156(3): 524-530
[14] Tompsett A R, Wiseman S, Higley E, et al. Effects of exposure to 17α-ethynylestradiol during larval development on growth, sexual differentiation, and abundances of transcripts in the liver of the wood frog (Lithobates sylvaticus) [J]. Aquatic Toxicology, 2013, 126: 42-51
[15] Coady K K, Murphy M B, Villeneuve D L, et al. Effects of atrazine on metamorphosis, growth, laryngeal and gonadal development, aromatase activity, and sex steroid concentrations in Xenopus laevis [J]. Ecotoxicology and Environmental Safety, 2005, 62(2): 160-173
[16] Oka T, Tooi O, Mitsui N, et al. Effect of atrazine on metamorphosis and sexual differentiation in Xenopus laevis [J]. Aquatic Toxicology, 2008, 87(4): 215-226
[17] Pettersson I, Arukwe A, Lundstedt-Enkel K, et al. Persistent sex-reversal and oviducal agenesis in adult Xenopus (Silurana) tropicalis frogs following larval exposure to the environmental pollutant ethynylestradiol [J]. Aquatic Toxicology, 2006, 79(4): 356-365
[18] Kallivretaki E, Eggen R, Neuhauss S, et al. Aromatase in zebrafish: A potential target for endocrine disrupting chemicals [J]. Marine Environmental Research, 2006, 62: 187-190
[19] Li J, Wang H, Zhang J, et al. Abnormal secretion of reproductive hormones and antioxidant status involved in quinestrol-induced reproductive toxicity in adult male rat [J]. Tissue and Cell, 2014, 46(1): 27-32
[20] Liu S, Qin F, Wang H, et al. Effects of 17α-ethinylestradiol and bisphenol A on steroidogenic messenger ribonucleic acid levels in the rare minnow gonads [J]. Aquatic Toxicology, 2012, 122: 19-27
[21] Overturf M D, Overturf C L, Carty D R, et al. Levonorgestrel exposure to fathead minnows (Pimephales promelas) alters survival, growth, steroidogenic gene expression and hormone production [J]. Aquatic Toxicology, 2014, 148: 152-161
[22] Schmid M, Steinlein C. Sex chromosomes, sex-linked genes, and sex determination in the vertebrate class amphibia [J]. Genes and Mechanisms in Vertebrate Sex Determination, 2001: 143-176
[23] Bögi C, Levy G, Lutz I, et al. Functional genomics and sexual differentiation in amphibians [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2002, 133(4): 559-570
[24] Yoshimoto S, Okada E, Umemoto H, et al. A W-linked DM-domain gene, DM-W, participates in primary ovary development in Xenopus laevis [J]. Proceedings of the National Academy of Sciences, 2008, 105(7): 2469-2474
[25] Nagai K. Molecular evolution of Sry and Sox gene [J]. Gene, 2001, 270(1): 161-169
[26] Ohe M, Inoue D, Kanemori Y, et al. Erp1/Emi2 is essential for the meiosis I to meiosis II transition in Xenopus oocytes [J]. Developmental Biology, 2007, 303(1): 157-164
[27] Reyhanian N, Volkova K, Hallgren S, et al. 17α-Ethinyl estradiol affects anxiety and shoaling behavior in adult male zebra fish ( Danio rerio) [J]. Aquatic Toxicology, 2011, 105(1): 41-48
◆
Initial Evaluation on Gonadal and Oviductive Morphology and Sexually Dimorphic Gene Expression ofXenopuslaveisafter Short-term Exposure to 17 beta-Estrodiol
Xu Wei1, Lou Qinqin2, Wei Wuji1,*, Qin Zhanfen2
1. College of Environment, Nanjing University of Technology, Nanjing 210009, China 2. State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
19 May 2014 accepted 9 June 2014
Reproductive endocrine disruption by environmental estrogens in amphibians has aroused great concern. The research in the field was focused on effects of long-term exposure on gonadal differentiation and development. In this study, Xenopus laevis frogs (6 month old) were exposed to 10 nmol·L-1estradiol (E2, a model compound) for six days to investigate the effects on gonadal and oviductive morphology as well as mRNA expression of sexually dimorphic genes. It was found that 6-day exposure to E2 had no significant effect on testicular and ovarian morphology, whereas it seemed to exhibit a weak promoting effect on egg and sperm development. E2 made oviducts widen and curve, exhibiting a promoting effect on oviductive development. Compared with the control, E2 exposure significantly inhibited expression levels of cyp11a1, 3βHSD, Srd5α and ARO, which are related to sex hormone synthesis and transformation, in testis and ovary, with no effect on the expression of cyp17. E2 also decreased LHβ and FSHβ expression in brain. Several genes that are related to sex differentiation and gonadal development, including Dax, AR, ERα, TFⅢA and TBPL2, were not affected by E2 at the transcriptional levels. By contrast, E2 significantly promoted Sox3 expression in the ovary and Emi2 in the brain, and inhibited Dmrt1 expression in the brain. Therefore, oviductive morphology and the expression levels of Srd5α, cyp11a1, 3βHSD, ARO and Sox3 in the gonad as well as LHβ, FSHβ, Dmrt1 and Emi2 in the brain can be used as sensitive endpoints. Our study can provide technical reference for developing a short-term assay for evaluating estrogenic effects of chemicals on amphibians.
17 beta-estrodoil; Xenopus laevis; estrogenic effect; oviduct; gonad; sexually dimorphic genes
国家自然科学基金项目(21377153;21077125)
徐伟(1989-),男,硕士,研究方向为毒理学,E-mail: xuwei07415224@163.com;
*通讯作者(Corresponding author),E-mail: weiwujipg@163.com
10.7524/AJE.1673-5897.20140519001徐伟, 楼钦钦, 魏无际, 等. 雌二醇短期暴露对非洲爪蟾性腺和输卵管形态及性二态基因表达影响的初步研究[J]. 生态毒理学报, 2015, 10(1): 263-270
2014-05-19 录用日期:2014-06-09
1673-5897(2015)1-263-08
X171.5
A
魏无际(1955—),男,应用化学硕士,南京工业大学环境学院副院长、教授,主要研究方向金属表面缓蚀剂的制备与应用,有机高分子化合物的合成及改性、工业水处理。
Xu W, Lou Q Q, Wei W J, et al. Initial evaluation on gonadal and oviductive morphology and sexually dimorphic gene expression of Xenopus laveis after short-term exposure to 17beta-estrodiol [J]. Asian Journal of Ecotoxicology, 2015, 10(1): 263-270 (in Chinese)

