DDTs对水生哺乳动物的组织残留基准初步研究
苏海磊,冯承莲,常红,穆云松,吴丰昌
中国环境科学研究院 环境基准与风险评估国家重点实验室,北京 100012
DDTs对水生哺乳动物的组织残留基准初步研究
苏海磊,冯承莲,常红,穆云松,吴丰昌*
中国环境科学研究院 环境基准与风险评估国家重点实验室,北京 100012
作为一种曾经广泛使用的氯化烃杀虫剂,DDT及其主要代谢产物DDE和DDD(合称为DDTs)是一类典型的具有持久性和生物累积性的有毒污染物。亲脂性和持久性使得DDTs可以通过食物链进行生物放大,从而对处于高营养级的水生哺乳动物造成严重的毒害作用。在综述DDTs对哺乳动物的毒性研究基础上,采用物种敏感度分布(species sensitivity distribution, SSD)和毒性百分数排序法(toxicity percentile rank method, TPRM)推导DDTs保护水生哺乳动物的组织残留基准(Tissue Residue Guideline, TRG)。使用SSD和TPRM得到的TRG分别为23.9和22.7 ng·g-1食物(湿重)。相应的,DDTs保护水生哺乳动物的水质基准分别为188.2和178.7 pg·L-1。依据研究得到的DDTs的组织残留基准及其在鱼类体内的含量评估对水生哺乳动物的风险。研究结果可用于评估DDTs对水生哺乳动物的生态风险,并为DDTs的风险管理提供理论依据。
DDTs;中华白海豚;江豚;水生哺乳动物;组织残留基准;生物累积因子;风险评估
组织残留基准(Tissue Residue Guideline, TRG)是某种物质在水生生物体内的最大浓度,超过此浓度会对以水生生物为食的野生生物造成危害[1]。TRG主要针对具有生物累积性和持久性的污染物,以水生生物的组织残留浓度表示,用于保护以水生生物为食的野生生物。相比较传统的水质基准(Water Quality Criteria, WQC)来说,TRG考虑了物质的生物累积性,提供了野生生物对污染物的有效暴露水平,因此能够提供更加科学的保护。
滴滴涕(DDT)及其主要代谢产物滴滴伊(DDE)和滴滴滴(DDD),合称为DDTs,是一种典型的具有持久性、生物累积性和毒性的物质[2]。作为一种曾经广泛使用的氯化烃杀虫剂[3],DDT由于对生态环境和人类健康的严重危害而受到广泛关注。尽管DDT从1983年起在我国禁止生产和使用,但依旧在各环境相中广泛存在。DDTs由于具有较强的亲脂性和持久性,可以通过食物链进行生物累积,从而对高营养级的野生生物造成严重的危害[4-6]。水生态系统中的野生生物(包括哺乳动物和鸟类)主要以鱼类等水生生物为食,这些食物来源是水生哺乳动物对DDTs最主要暴露途径。研究表明处于高营养级的哺乳动物组织内有较高浓度的DDTs[4],如条纹海豚(striped dolphins, Stenella caeruleoalba)DDT的含量高达水体中含量的1 000万倍[6]。DDTs暴露对野生生物的毒害作用有降低寿命,改变细胞代谢、神经活性和肝功能,危害繁殖、生长和免疫活性等[3-4]。对动物的毒性研究表明,长期暴露于DDTs会在动物体内(大多是肝)形成肿瘤[4,7]。研究显示,蟾蜍对DDT的有害作用比兔和大鼠敏感[7]。加拿大1999年推导了保护水生哺乳动物的DDTs的TRG,为94.0 ng·g-1食物(湿重)[4]。该TRG是根据DDT对大鼠的毒性数据以及水貂的摄食速率和体重,使用评价因子法计算获得。美国1995年推导了保护哺乳动物的DDTs的野生生物基准值,为280 pg·L-1[8],依据DDT对大鼠的毒性数据,以及2种代表性水生哺乳动物(貂和水獭)的体重和摄食速率,使用评价因子法推导。目前,还没有保护中国水生哺乳动物的DDTs的TRG研究。
本研究总结了DDTs对哺乳动物的毒性研究,选择2种中国的代表性水生哺乳动物,采用物种敏感度法(SSD)和毒性百分数排序法(TPRM)2种方法推导DDTs保护水生哺乳动物的TRG和WQC。并结合我国鱼类体内DDTs的含量,评估DDTs对水生哺乳动物的生态风险。研究结果可用于保护中国的水生哺乳动物,为评估DDTs对水生哺乳动物的生态风险提供理论依据。
1 研究方法(Methodology)
1.1 数据收集筛选方法
选择通过水生食物链暴露于DDTs的代表性水生哺乳动物是推导DDTs的TRG的重要基础[8],使用它们的体重和摄食速率等参数推导适合于保护我国哺乳动物的TRG。研究中选择中华白海豚和江豚作为我国2种代表性水生哺乳动物。中华白海豚(indo-pacific humpback dolphin, Sousa chinensis)处于水生食物链的最顶端,主要以多种內湾和近海的鱼类为食,是中国海洋鲸豚中唯一的国家一级保护动物[9]。中华白海豚主要分布于广西、海南、广东、香港、澳门、福建、台湾西部、浙江沿岸等中国水生态系统中[10],肌肉残留较高浓度的DDT[11]。江豚(finless porpoise, Neophocaena phocaenoides)是我国二级保护动物,分布在我国各海域,长江中下游干流、洞庭湖和鄱阳湖等区域,位于淡水生物链顶端。江豚通过食物链(网)积累较高浓度的污染物,如重金属、有机氯农药等,给江豚等海洋哺乳动物造成很大危害[12]。由于环境污染、非法捕捞等原因,江豚的数量锐减,列入濒危动物行列。中华白海豚和江豚被选为中国2种代表性的水生哺乳动物,它们广泛分布在中国水生态系统中,捕食鱼类等水生生物,在中国受到广泛关注和充分研究[13-14]。中华白海豚和江豚的体重(body weight, BW)和食物摄食速率(food injection rate, FI)如表1所示。
推导TRG的另一个重要基础是收集筛选充足有效的毒性数据。无观察效应水平(no observed adverse effect level, NOAEL)和最低可观察效应水平(lowest observed adverse effect level, LOAEL)是通过慢性或次慢性毒性研究得到的毒性数据,用来推导DDTs对哺乳动物的TRG。美国环境保护局综述了DDTs对老鼠等几种哺乳动物的急慢性研究,总结了DDTs对部分哺乳动物的不同毒性终点的NOAEL和LOAEL[8,17]。根据体重和摄食速率,将这些基于饮食暴露的毒性数据转化为可接受的日摄入量(tolerable daily intake, TDI)。依据加拿大推导组织残留基准规定的原则,选择可用的NOAEL和LOAEL计算TRG[1]。数据选择的原则有:选择适当控制条件下的研究,考虑适当的生态毒性终点,如繁殖和胚胎发育等;选择可以描述剂量-效应关系的慢性或次慢性研究;选择的研究中要给出测试物质的形式和剂量等信息。在此基础上,根据最新的文献报道,总结DDTs对哺乳动物的毒性数据,用于推导DDTs的TRG。

表1 代表性水生哺乳动物的体重(BW)和摄食速率(FI)
1.2 TRG的推导方法
由于引起有害效应的最低剂量在NOAEL和LOAEL之间,使用NOAEL或LOAEL作为参考剂量会造成“过保护”或“欠保护”的问题[18]。因此,使用NOAEL和LOAEL的几何均值作为阈值浓度,保护生物不受污染物的有害影响。如果某研究中只有NOAEL或LOAEL数据,则由公式(1)计算另一个值[1]。TDI由公式(2)计算,其中不确定因子(UF)选为10,以解释物种间敏感性差异和次慢性到慢性外推引起的不确定性[1,18]。参考浓度(RC)由摄食速率(FI)和体重(BW)通过公式(3)计算得出。保护野生生物的WQC由公式(4)计算,即由RC除以生物累积因子(BAF)获得[19]。
研究中使用SSD和TPRM这2种方法推导保护哺乳动物的TRG。其中,SSD是用于描述物种间敏感性差异的概率分布函数[20],被广泛用于水生态风险评估和水质基准推导中[21-22]。SSD方法的基本假设是物种敏感性可用某个特定的统计分布描述,比如正态分布等。根据DDTs对哺乳动物毒性数据的综述结果,使用各物种最敏感毒性终点的数据(TDI)构建SSD曲线,以推导保护哺乳动物的TRG[23]。假设选择的毒性数据符合对数正态分布,使用Origin 8拟合分布曲线,计算保护95%物种免受污染物有害影响的HC5值(TDI)。然后使用我国2种代表性哺乳动物的体重和摄食速率,计算DDTs对这2种哺乳动物的RC,取它们的几何均值作为DDTs对我国水生哺乳动物的TRG。
作为美国环境保护局推荐的水质基准推导的标准方法[24],这里使用TPRM来推导DDTs保护哺乳动物的TRG。首先,将筛选的TDI由大到小排列,给各数据分配等级R,最小值的等级为1,最大值的等级为N(N是物种个数)。然后,用公式P=R/(N+1)计算各物种的累积频率P。最后,选择4个累积频率接近0.05的TDI(一般是最低的4个),使用公式(5)~(8)计算DDTs的HC5值(TDI)。最后,根据计算得到的TDI值,使用代表性哺乳动物的体重和摄食数量及公式3,计算DDTs对这2种哺乳动物的RC。取两个RC的几何均值作为DDTs对水生哺乳动物的TRG。
NOAEL=LOAEL÷5.6
(1)
TDI=(NOAEL×LOAEL)0.5÷UF
(2)
RC=TDI÷(FI÷BW)
(3)
WQC=RC÷BAF
(4)
(5)
(6)
(7)
HC5=eA
(8)
2 结果(Results)
2.1 DDTs对哺乳动物的毒性数据筛选结果
综述文献报道,总结DDTs对哺乳动物的慢性和次慢性毒性研究,用于推导保护水生哺乳动物的TRG。急性经口暴露研究显示,DDT对哺乳动物的LD50由大鼠(Rattus norvegicus)的87 mg·kg-1到仓鼠(Mesocricetus auratus)的大于5 000 mg·kg-1[8],大鼠对DDT的急性毒性效应较敏感。DDTs对野生哺乳动物的次慢性/慢性研究较少。本研究整理了可获得的几种哺乳动物的毒性数据,包括不同毒性终点的NOAEL和/或LOAEL[8,17],如表2所示。
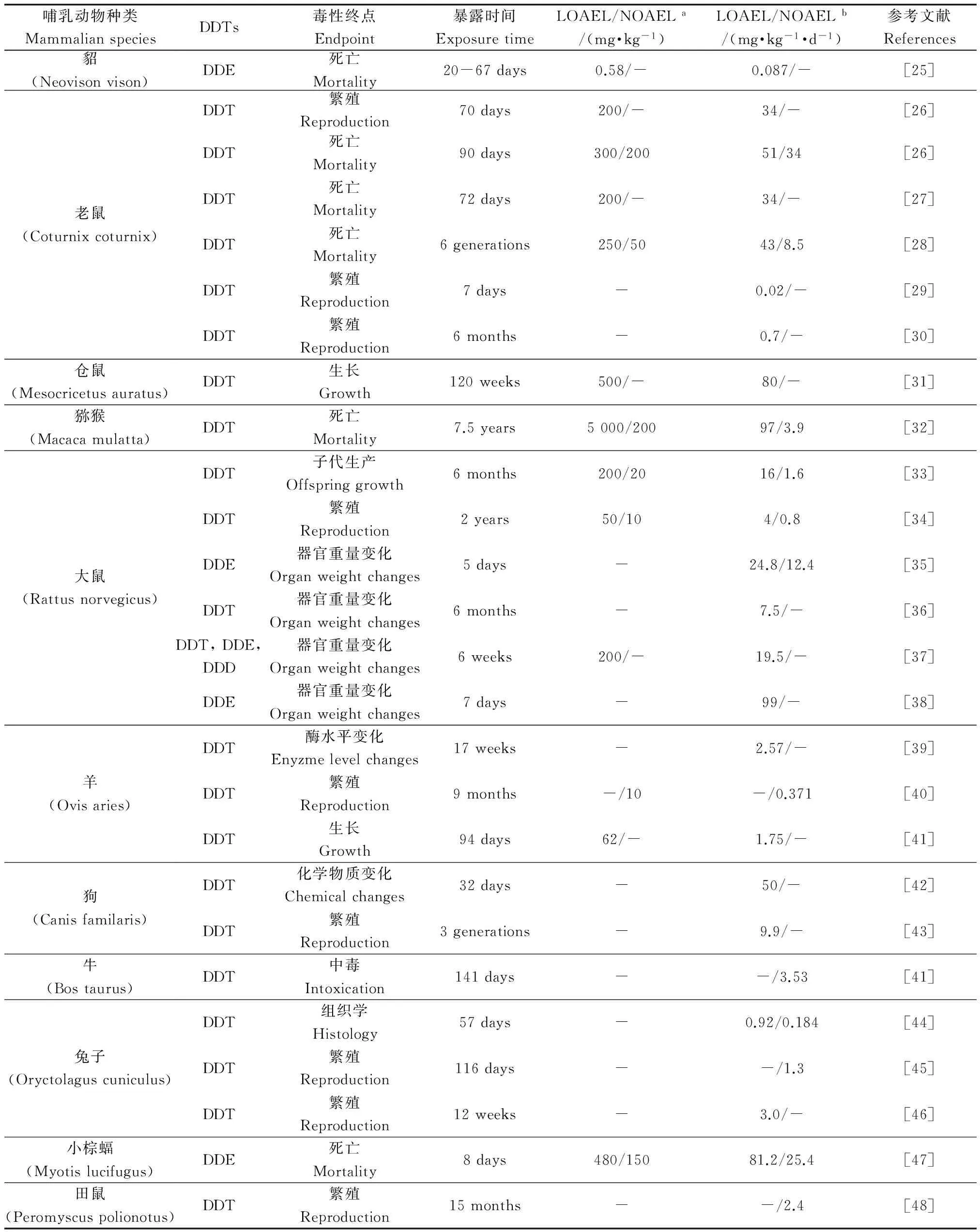
表2 DDTs对哺乳动物的次慢性和慢性研究
注:NOAEL为无观察效应水平,LOAEL为最低可观察效应水平;LOAEL/NOAELa为以食物中浓度表示的数据(RC),LOAEL/NOAELb为使用体重和摄食速率转化后的日暴露数据(TDI);-表示文献中没有报道此数据。
Note: NOAEL = no observed effect level, LOAEL =lowest observed effect level; LOAEL/NOAELa= toxicity data expressed in food concentration(RC), LOAEL/NOAELb=daily exposure data considered body weight and food intake rate(TDI); - indicates no report of the data in literature.
对每类可获得毒性数据的哺乳动物,选择最敏感毒性终点的NOAEL/LOAEL,使用公式(2)计算TDI。所选择的的毒性数据如表3所示。根据计算获得的TDI(表3),使用SSD和TPRM这2种方法计算DDTs的TRG。
2.2 TRG的推导结果
2.2.1 物种敏感度分布法
根据表3中列出的TDI数据,使用Origin 8拟合DDTs对哺乳动物的物种敏感度分布曲线,如图1所示。依据模拟的结果,计算得到HC5=1.18 ng·g-1·d-1,R2值为0.9897。使用表1中给出的2种代表性水生哺乳动物的FI∶BW值(0.0486,0.05),通过公式(3)计算得到这2种哺乳动物的RC,分别为24.28和23.6 ng·g-1食物(湿重)。取这2个RC的几何均值作为DDTs对哺乳动物的TRG,为23.9 ng·g-1食物(湿重)。
据报道,DDT的生物累积因子(BAF,鱼体内浓度与水体中浓度的比值)为127 000[49],使用公式(4)计算得到WQC为188.2 pg·L-1。
2.2.2 毒性百分数排序法
根据表3中列出的TDI值,选择4个最低的TDI(貂、老鼠、兔子、羊),使用TPRM计算保护水生哺乳动物的TRG,相关计算数值如表4所示。其中,R=1, 2, 3, 4,N=11。

图1 DDTs对哺乳动物的毒性数据的物种敏感度分布Fig. 1 Species sensitivity distribution for mammalian toxicity data of DDTs
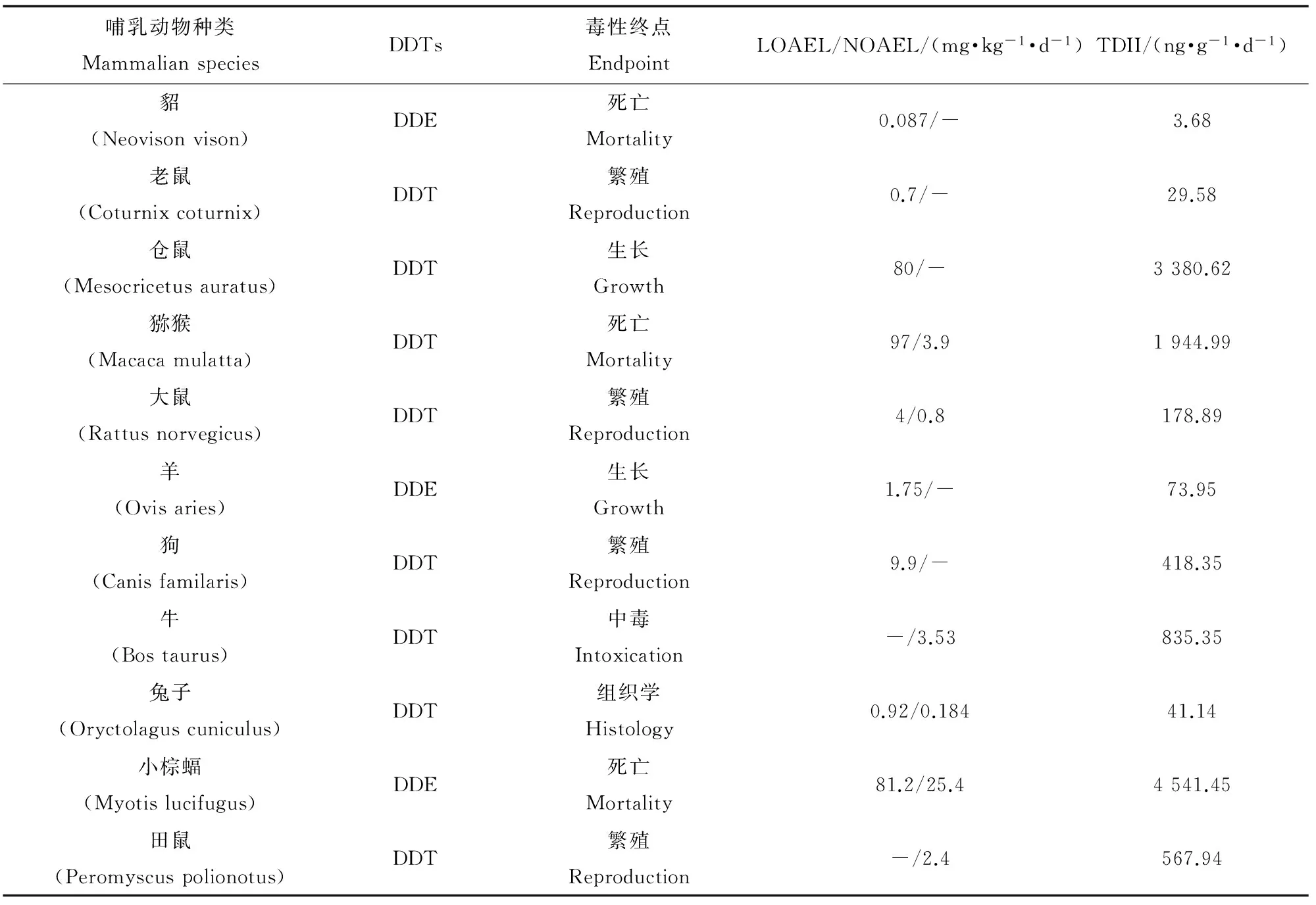
表3 用于推导哺乳动物的可接受日摄入量(TDI)的毒性数据

表4 使用毒性百分数排序法(TPRM)计算组织残留基准(TRG)的TDI及相关数据
注:P为累积频率,R为等级,N为哺乳动物的种类数量。
Note: P=cumulative probability; R=rank; N=number of mammalian species.
根据表4中给出的值,使用公式(5)~(8),计算的结果为:S=14.15,L=-3.05,A=0.114,HC5=1.12 ng·g-1·d-1。使用表1中给出的2种代表性哺乳动物的FI∶BW值(0.0486,0.05),计算得到这2种水生哺乳动物的RC分别为23.05和22.4 ng·g-1食物(湿重)。取这2个RC的几何均值作为保护水生哺乳动物的TRG,TRG为22.7 ng·g-1食物(湿重)。根据DDT的生物累积因子(127 000)[49],使用公式(4)计算得到WQC为178.7 pg·L-1。
3 讨论(Discussion)
3.1 不同基准值的比较分析
本研究中,使用SSD和TPRM这2种方法推导DDTs的保护我国水生哺乳动物的TRG分别为23.9和22.7 ng·g-1食物(湿重),这2个值基本相同。这2个基准值均低于加拿大保护水生哺乳动物的DDTs的TRG,94.0 ng·g-1食物(湿重)[4]。这说明使用加拿大的TRG不能很好地保护我国的水生哺乳动物,也证明了推导适合中国水生态系统的TRG的必要性。研究中推导的组织残留基准使用了更多的毒性数据,考虑了我国代表性哺乳动物的体重和摄食速率,结果能够更加科学地保护我国的水生哺乳动物。
使用SSD和TPRM这2种方法得到的保护水生哺乳动物的WQC分别为188.2和178.7 pg·L-1,低于美国环境保护局推导的保护水生哺乳动物的野生生物基准(280.0 pg·L-1)[8]。根据DDTs的TRG和生物累积因子,推导DDTs保护水生哺乳动物的WQC,提供了具有生物累积性物质的水质基准推导的新途径,且由于考虑了生物对物质生物累积作用,能够更加科学地保护水生态系统中的野生生物,从而保护整个生态系统。
3.2 风险评估
根据推导得到的DDTs保护水生哺乳动物的TRG,以太湖为例,评估鱼体内DDTs对水生哺乳动物的风险。研究表明,太湖4种不同鱼类(鲤鱼、鲫鱼、鳙鱼、白鱼)体内的的DDTs浓度为3.24~37.1 ng∑DDT·g-1(湿重)[50]。1999-2001年在太湖的实地研究结果显示太湖鱼类体内DDTs的浓度为3.7~23.5 ng ∑DDT·g-1(湿重)[51]。2个不同时期的研究结果一致,说明近年来太湖鱼类体内DDTs的浓度变化不大。
本研究使用2种方法推导的TRG分别为23.9和22.7 ng·g-1食物(湿重),2个值基本相同。太湖鱼类体内DDTs的浓度范围基本低于TRG,但最高值稍微高于TRG。这说明太湖鱼类体内的DDTs基本不会对水生哺乳动物产生风险。
3.3 不确定分析与展望
研究对DDTs保护水生哺乳动物的TRG和WQC进行了初步探讨,使用了更多的毒性数据,考虑了我国代表性水生哺乳动物的体重和摄食速率,能够更好地用于保护中国的水生哺乳动物及水生态风险评估。但由于数据缺乏等原因,结果仍有较大的不确定性。首先,不同地区的生物区系不同,污染物的环境行为不同。推导保护我国水生哺乳动物的基准值,应该使用我国水生哺乳动物毒性数据,但目前没有获得DDTs对我国水生哺乳动物的毒性数据,给研究结果造成了较大的不确定性。其次,获得毒性数据的来源不同,暴露时间和毒性终点都有所差异,也给计算结果带来了一定的不确定性。此外,虽然食鱼暴露是水生哺乳动物对DDTs等生物累积性物质的主要暴露途径,但还有皮肤暴露、摄食饮用水等其他暴露途径,研究水生哺乳动物的食物网结构及食物组成,分析不同暴露途径的比例,能很大程度上提高TRG计算结果的科学性和准确性。最后,DDTs的生物累积因子来自文献报道,不同区域中生物对DDTs的生物累积能力不同,准确测定我国水环境中DDTs的生物累积因子,能够提高水质基准计算结果的准确性。
[1] CCME. Protocol for derivation of Canadian Tissue Residue Guidelines for the protection of wildlife consumers of aquatic biota [R]. Winnipeg: Canadian Council of Ministers of the Environment, 1998
[2] Jones K C,Voogt P D. Persistent organic pollutants (POPs): State of the science [J]. Environmental Pollution, 1999, 100(1): 209-221
[3] ATSDR. Toxicological profile for DDT, DDE, and DDD [R]. Washington DC: U.S. Department of Health and Human Services, Public Health Service, Agency for Toxic Substances and Disease Registry, 1994
[4] CCME. Canadian Tissue Residue Guidelines for the protection of wildlife consumers of aquatic biota: DDT(total) [R]. Winnipeg: Canadian Council of Ministers of the Environment, 1999
[5] Suntio L R, Shiu W Y, Mackay D, et al. Critical review of Henry's Law constants for pesticides [J]. Reviews of Environmental Contamination and Toxicology, 1988, 103: 1-59
[6] Tanabe S, Iwata H, Tatsukawa R. Global contamination by persistent organochlorines and their ecotoxicological impact on marine mammals [J]. Science of the Total Environment, 1994, 154(2): 163-177
[7] 李孟楠, 雷磊, 刘欣. DDT毒性及毒理机制的研究进展[J]. 绿色科技, 2011 (10): 114-116
Li M N, Lei L, Liu X. Study the progress on the toxicity and toxicological mechanism of DDT [J]. Journal of Green Science and Technology, 2011 (10): 114-116 (in Chinese)
[8] USEPA. Great lakes water quality initiative criteria documents for the protection of wildlife. EPA-820-B-95-008. [R]. Washington DC: Office of Water, 1995
[9] 鲁慧. 大襟岛海域中华白海豚体内及栖息地持久性有毒物质含量与评价[D]. 广州: 华南师范大学, 2007: 15-16
Lu H. Evaluation on the persistent toxic substances contents in Chinese white dolphins (Sousa chinensis) and their habitat at the marine area of Dajin island [D]. Guangzhou: South China Normal University, 2007: 15-16 (in Chinese)
[10] 王丕烈, 韩家波. 中国水域中华白海豚种群分布现状与保护[J]. 海洋环境科学, 2007, 26(5): 484-487
Wang P L, Han J B. Present status of distribution and protection of Chinese white dolphins (Sousa chinensis) population in Chinese waters [J]. Marine Environmental Science, 2007, 26(5): 484-487 (in Chinese)
[11] Minh T B, Watanabe M, Nakata H, et al. Contamination by persistent organochlorines in small cetaceans from Hong Kong coastal waters [J]. Marine Pollution Bulletin, 1999, 39(1): 383-392
[12] 王艳, 方展强, 周海云. 北部湾海域江豚体内有机氯农药和多氯联苯的含量及分布[J]. 海洋环境科学, 2008, 27(4): 343-347
Wang Y, Fang Z Q, Zhou H Y. Concentrations and distribution of organochlorine pesticide and polychlorinated biphenyls in finless porpoise in Beibu Gulf [J]. Marine Environmental Science, 2008, 27(4): 343-347 (in Chinese)
[13] 杨健, 尹君, 许海伦, 等. 长江江豚锌、铜、铅、镉和砷的摄入与累积[J]. 水生生物学报, 2005, 29(5): 557-563
Yang J, Yin J, Xu H L, et al. The ingestion and accumulation of zinc, copper, lead, cadmium and arsenic in the Yangtze finless porpoise, Neophocaena phocaenoides asiaeorientalis [J]. Acta Hydrobiological Sinica, 2005, 29(5): 557-563 (in Chinese)
[14] 黄健生, 贾晓平, 甘居利. 广东大鹏湾海域糙齿海豚体内多氯联苯的分布特征与毒性评价[J]. 中国水产科学, 2007, 14(6): 974-980
Huang J S, Jia X P, Gan J L. Distribution and toxicity assessment of polychlorinated biphenyls (PCBs) in tissues of rough toothed dolphin (Steno bredanensis) from Dapeng Bay, Guangdong, China [J]. Journal of Fishery Sciences of China, 2007, 14(6): 974-980 (in Chinese)
[15] Jefferson T A. Population biology of the Indo-Pacific hump-backed dolphin in Hong Kong waters [M]. Blacksburg, VA: The Wildlife Society, 2000: 1-65
[16] Hung C L, Lau R K, Lam J C, et al. Risk assessment of trace elements in the stomach contents of Indo-Pacific humpback dolphins and finless porpoises in Hong Kong waters [J]. Chemosphere, 2007, 66(7): 1175-1182
[17] USEPA. Ecological soil screening level for DDT and metabolites[R]. Washington DC: Office of Solid Waste and Emergency Response, 2007
[18] Kannan K, Blankenship A, Jones P, et al. Toxicity reference values for the toxic effects of polychlorinated biphenyls to aquatic mammals [J]. Human and Ecological Risk Assessment, 2000, 6(1): 181-201
[19] Ludwig J P, Giesy J P, Summer C L, et al. A comparison of water quality criteria for the Great Lakes based on human and wildlife health [J]. Journal of Great Lakes Research, 1993, 19(4): 789-807
[20] Leo G W, Theo P T, Posthuma L, et al. Species Sensitivity Distributions in Ecotoxicology [M]// Environmental and Ecological Risk Assessment. Washington DC: Lewis Publishers, 2002
[21] Caldwell D J, Mastrocco F, Hutchinson T H, et al. Derivation of an aquatic predicted no-effect concentration for the synthetic hormone, 17α-ethinyl estradiol [J]. Environmental Science & Technology, 2008, 42(19): 7046-7054
[22] Hall L W, Scott M C, Killen W D. Ecological risk assessment of copper and cadmium in surface waters of Chesapeake Bay watershed [J]. Environmental Toxicology and Chemistry, 2009, 17(6): 1172-1189
[23] USEPA. Science Advisory Board Consultation Document. Proposed Revisions to Aquatic Life Guidelines: Tissue-Based Criteria for "Bioaccumulative" Chemicals [R]. Washington DC: Office of Water, 2005
[24] USEPA. Guidelines for deriving numerical national water quality criteria for the protection of aquatic organisms and their uses [R]. Washington DC: United States Environmental Protection Agency, Office of Research and Development, 1985
[25] Gilbert F F. Physiological effects of natural DDT residues and metabolites on ranch mink [J]. The Journal of Wildlife Management, 1969, 33(4): 933-943
[26] Bernard R F,Gaertner R A. Some effects of DDT on reproduction in mice [J]. Journal of Mammalogy, 1964, 45(2): 272-276
[27] Cannon M S, Holcomb L C. The effect of DDT on reproduction in mice [J]. 1968, 68(1): 19-24
[28] Turusov V, Day N, Tomatis L, et al. Tumors in CF-1 mice exposed for six consecutive generations to DDT [J]. Journal of the National Cancer Institute, 1973, 51(3): 983-997
[29] Palanza P, Morellini F, Parmigiani S, et al. Prenatal exposure to endocrine disrupting chemicals: Effects on behavioral development [J]. Neuroscience & Biobehavioral Reviews, 1999, 23(7): 1011-1027
[30] Taran R, Kemeny T. Multigeneration studies on DDT in mice [J]. Food and Cosmetics Toxicology, 1969, 7: 215-222
[31] Rossi L, Barbieri O, Sanguineti M, et al. Carcinogenicity study with technical-grade dichlorodiphenyltrichloroethane and 1,1-dichloro-2,2-bis (p-chlorophenyl) ethylene in hamsters [J]. Cancer Research, 1983, 43(2): 776-781
[32] Durham W F, Ortega P, Hayes W. The effect of various dietary levels of DDT on liver function, cell morphology, and DDT storage in the rhesus monkey [J]. Archives Internationales de Pharmacodynamie, 1963, 141: 111-129
[33] Clement J G, Okey AB. Reproduction in female rats born to DDT-treated parents [J]. Bulletin of Environmental Contamination and Toxicology, 1974, 12(3): 373-377
[34] Fitzhugh OG. Use of DDT insecticides on food products [J]. Industrial & Engineering Chemistry, 1948, 40(4): 704-705
[35] Leavens T L, Sparrow B R, Devito M J. Lack of antiandrogenic effects in adult male rats following acute exposure to 2,2-bis (4-chlorophenyl)-1, 1-dichloroethylene (p,p′-DDE) [J]. Toxicology, 2002, 174(2): 69-78
[36] Ali S, Shakoori A. Short and long term toxicity of DDT in albino rats: Biochemical effects in liver [J]. Punjab University Journal of Zoology, 1996, 11: 7-24
[37] Banerjee B, Ray A, Pasha S. A comparative evaluation of immunotoxicity of DDT and its metabolites in rats [J]. Indian Journal of Experimental Biology, 1996, 34 (6): 517-522
[38] You L, Chan S K, Bruce J M, et al. Modulation of testosterone-metabolizing hepatic cytochrome p-450 enzymes in developing Sprague-Dawley rats following in utero exposure to p, p′- DDE [J]. Toxicology and Applied Pharmacology, 1999, 158(2): 197-205
[39] Cecil H C, Harris S J, Bitman J, et al. Estrogenic effects and liver microsomal enzyme activity of technical methoxychlor and technical 1,1,1-trichloro-2,2-bis (p-chlorophenyl) ethane in sheep [J]. Journal of Agricultural and Food Chemistry, 1975, 23(3): 401-403
[40] Wrenn T R, Weyant J R, Fries G F, et al. Influence of dietary o, p′-DDT on reproduction and lactation of ewes [J]. Journal of Animal Science, 1971, 33(6): 1288-1292
[41] Wilson H, Allen N. Feeding experiments with DDT-treated pea vine silage with special reference to dairy cows, sheep, and laboratory animals [J]. Journal of Economic Entomology, 1946, 39(6): 801-806
[42] Copeland M, Cranmer M. Effects of o, p'-DDT on the adrenal gland and hepatic microsomal enzyme system in the beagle dog [J]. Toxicology and Applied Pharmacology, 1974, 27(1): 1-10
[43] Ottoboni A, Bissell G D, Hexter A C. Effects of DDT on reproduction in multiple generations of beagle dogs [J]. Archives of Environmental Contamination and Toxicology, 1977, 6(1): 83-101
[44] Street J,Sharma R. Alteration of induced cellular and humoral immune responses by pesticides and chemicals of environmental concern: Quantitative studies of immunosuppression by DDT, aroclor 1254, carbaryl, carbofuran, and methylparathion [J]. Toxicology and Applied Pharmacology, 1975, 32(3): 587-602
[45] Seiler P, Fischer B, Lindenau A, et al. Fertilization and early embryology: Effects of persistent chlorinated hydrocarbons on fertility and embryonic development in the rabbit [J]. Human Reproduction, 1994, 9(10): 1920-1926
[46] Lindenau A, Fischer B, Seiler P, et al. Effects of persistent chlorinated hydrocarbons on reproductive tissues in female rabbits [J]. Human Reproduction, 1994, 9(5): 772-780
[47] Clark Jr D R, Stafford C J. Effects of DDE and PCB (Aroclor 1260) on experimentally poisoned female little brown bats (Myotis lucifugus): Lethal brain concentrations [J]. Journal of Toxicology and Environmental Health, Part A Current Issues, 1981, 7(6): 925-934
[48] Wolfe J, Esher R, Robinson K, et al. Lethal and reproductive effects of dietary mirex and DDT on old-field mice, Peromyscus polionotus [J]. Bulletin of Environmental Contamination and Toxicology, 1979, 21(1): 397-402
[49] LeBlanc G A. Trophic-level differences in the bioconcentration of chemicals: Implications in assessing environmental biomagnification [J]. Environmental Science & Technology, 1995, 29(1): 154-160.
[50] Guo J Y, Wu F C, Zhang L, et al. Characteristics of DDTs in fish from Lake Taihu: An indicator of continual DDTs input in China [J]. Science of the Total Environment, 2012, 437: 196-199
[51] Feng K, Yu B, Ge D, et al. Organo-chlorine pesticide (DDT and HCH) residues in the Taihu Lake. Region and its movement in soil-water system: I. Field survey of DDT and HCH residues in ecosystem of the region [J]. Chemosphere, 2003, 50(6): 683-687
◆
Study on Tissue Residue Guidelines of DDTs for Protection of Aquatic Mammalian Species in China
Su Hailei, FengChenglian, Chang Hong, MuYunsong,WuFengchang*
State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmentmental Sciences, Beijing 100012, China
14 May 2014 accepted 1 July 2014
As a chlorinated hydrocarbon insecticide that has been used worldwide, DDT and its primary metabolites named DDE and DDD (collected as DDTs) is one typical bioaccumulative and persistent toxic substances. Because of the lipophilic nature and persistence, DDTs could biomagnify in wildlife that feed at higher trophic levels through food chain and could accordingly cause adverse effects to aquatic mammalian. Studies about effects of DDTs on mammals were reviewed. The Tissue Residue Guidelines (TRGs) for protection of aquatic mammals in China were derived by use of species sensitivity distribution (SSD) and toxicity percentile rank method (TPRM). The TRGs of DDTs for aquatic mammals by SSD and TPRM were derived to be 23.9 and 22.7 ng·g-1food (wet weight), respectively. The WQCs of DDTs for protecting aquatic mammals were 188.2 and 178.7 pg·L-1, respectively. The risk of DDTs to aquatic mammals was assessed based on TRGs derived in this study and the concentrations of DDTs in fish in China. The results could be used in risk assessments of DDTs to mammals in China and provide scientific foundation for risk management of DDTs.
DDTs; Sousa chinensis;Neophocaena phocaenoides; aquatic mammals; tissue residue guideline; bioaccumulation factor; risk assessment
环保公益项目(201409037);环保公益项目(201309060)
苏海磊(1985-),男,博士,研究方向为风险评估,E-mail: suhailei666@163.com;
*通讯作者(Corresponding author),E-mail: wufengchang@vip.skleg.cn
10.7524/AJE.1673-5897.20140514002
2014-05-14 录用日期:2014-07-01
1673-5897(2015)1-110-09
X171.5
A
吴丰昌(1965—),男,研究员,博士生导师,主要研究湖泊污染机理与过程,水质基准和风险评估。
苏海磊, 冯承莲, 常红, 等. DDTs对水生哺乳动物的组织残留基准初步研究[J]. 生态毒理学报, 2015, 10(1): 110-118
Su H L, Feng C L, Chang H, et al. Study on tissue residue guidelines of DDTs for protection of aquatic mammalian species in China [J]. Asian Journal of Ecotoxicology, 2015, 10(1): 110-118 (in Chinese)

