双酚A(BPA)暴露对WHHL家兔糖类和脂类代谢的影响
方超,宁博,范江霖,,董四君,*
1. 中国科学院城市环境研究所 中国科学院城市环境与健康重点实验室,厦门 361021 2. 日本山梨大学大学院医学工学综合研究部 分子病理学实验室,山梨県 409-3898
双酚A(BPA)暴露对WHHL家兔糖类和脂类代谢的影响
方超1,宁博2,范江霖1,2,董四君1,*
1. 中国科学院城市环境研究所 中国科学院城市环境与健康重点实验室,厦门 361021 2. 日本山梨大学大学院医学工学综合研究部 分子病理学实验室,山梨県 409-3898
为利用和人类更为接近的动物模型来研究在高脂血症条件下,BPA暴露是否能促进脂类和糖类代谢异常,并探索潜在的毒性效应机制,选取渡边可遗传高脂血症家兔(WHHL)模型,通过灌胃的方式将其暴露于400 μg·kg-1体重的BPA溶液长达12周。在持续暴露第8周,检测了在空腹状态下,家兔血浆中葡萄糖、胰岛素和脂肪含量的变化,并根据所得结果进行了静脉注射胰岛素耐受试验(IVTT)。在暴露第12周,同样对空腹状态下,家兔血浆中的葡萄糖,胰岛素和脂肪含量进行了检测,并测量了血压和心率。然后,将所有的家兔进行解剖,通过苏木精-伊红(HE)及糖原(PAS)染色分别对心脏和肝脏部位的脂肪及糖原蓄积情况进行了病理学切片分析。同时,检测了肝脏中与脂类和糖类代谢相关基因在mRNA水平上的表达变化。结果显示,BPA暴露8周后促使WHHL家兔发生了胰岛素抵抗现象,导致第12周血糖及胰岛素含量升高,同时也促进了高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)及游离脂肪酸(NEFA)含量的上升。BPA暴露第12周,暴露组WHHL家兔的冠状动脉粥样硬化损伤程度未发生明显增加,但心肌细胞发生了肿胀,胞质中出现了脂肪的蓄积,同时伴随着心律失常。肝脏重量发生增加,肝细胞中同时出现了脂肪和糖原的蓄积现象,相关基因的表达发生了显著上调。研究结果表明,BPA持续暴露可促进WHHL家兔发生脂类和糖类代谢异常,其毒性效应机制可能和胰岛素抵抗及相关基因的异常表达有关。
双酚A(BPA);WHHL家兔;代谢异常;脂肪和糖原蓄积;胰岛素抵抗;基因表达
双酚A(BPA)是一类具有雌激素活性的典型环境内分泌干扰物。作为当今世界生产量最大的人造化学物质之一,BPA被广泛应用于饮用水容器、餐具、婴儿奶瓶、食品饮料包装、罐装食品的内涂层、热敏纸及各类医疗设备中[1]。因此,BPA可通过多种途径进入环境造成污染,使得人类对BPA的暴露几乎无处不在。一些流行病学调查研究发现绝大部分人体的尿液和血液中均能检测到BPA的存在[2-3]。据此,美国“时代周刊”有文章称,BPA广泛存在于现代人的体内[4]。正因为BPA在环境和人体内广泛分布,其对人类健康的影响也越来越受到关注。一些流行病学调查显示,尿液或血液中的BPA含量和各类代谢相关疾病如肥胖症、2型糖尿病及心血管疾病存在显著相关性[5-8]。虽然BPA对人体代谢系统的危害不容忽视,但其毒性效应和致病机理还尚未明确。目前,已有研究利用大/小鼠模型发现出生前或出生后暴露于BPA即可扰乱母体及后代的血糖和血脂平衡,从而增加患胰岛素抵抗和代谢综合征的风险[9-10]。此外,长期暴露于BPA还能损害大/小鼠的心脏结构和功能,引起心律失常[11]。但利用小/大鼠模型来研究BPA的毒性效应所得到的结果无法确定是否能推测到人体上,因为已有大量的研究表明小/大鼠和人类存在很多不同点,包括脂类代谢、血糖代谢、心血管系统以及对炎症刺激的分子响应水平等[12-13]。并且,人类和小/大鼠在局部脂质沉积,细胞的组成(如褐色和白色脂肪的比例,巨噬细胞的入侵)以及对各类蛋白(如抵抗素、刺蛋白和脂肪酶),血糖转运和相关受体(如肾上腺素能受体)的调节方面也存在很大的区别[14-15]。而家兔模型则由于在基因组和上述各方面条件上更接近于人类,被证明更适用于各项人类疾病的研究[12]。
此外,高脂血症被定义为血液中的脂肪或脂蛋白含量异常升高,在当今社会尤其是在发达国家已成为一种普遍的病理现象[16]。根据发病机制的不同,高脂血症可分为先天性和后天性高脂血症,前者是由于基因缺陷造成的常见家族性遗传疾病,全球有近千万人患此疾病[17];后者则是由于各类疾病(糖尿病、肥胖、肾病和肝病等)的影响,不健康饮食,吸烟,过度酗酒,药物反应及缺乏运动等原因造成的典型“现代病”[18],在美国血脂含量超标的人口超过30%[19]。同时,由于BPA在各类医疗设备中运用广泛,导致高脂血症人群接触和暴露于BPA的风险大幅度提高[20]。然而,目前国内外还没有研究来专门探讨在高脂血症的条件下,BPA暴露是否能促进脂类和糖类代谢异常,并加速相关疾病的发生和发展。
针对上述问题,本研究选取了渡边可遗传高脂血症家兔(WHHL)模型来研究BPA对脂类和糖类代谢的影响。WHHL家兔作为日本特有的模式生物,是由日本神户大学的渡边博士在1973年发现,并经过20多年的发展而形成的自发性内源性高胆固醇血症家兔品系。其特点类似于高脂血症家族人群,由于先天性低密度脂蛋白(LDL)受体缺乏,不需要投喂高脂高糖饮食就能自发形成高脂血症和动脉粥样硬化等疾病,已被广泛应用于代谢综合征、动脉粥样硬化和胰岛素抵抗等疾病的研究[21]。但目前,国内外还没有人利用此类动物模型来研究BPA对心血管及代谢系统方面的毒性作用和潜在的病理学机制。因此,本研究利用此类模型一方面关注BPA是否促进了动脉粥样硬化的形成,另一方面重点研究BPA对血液、心脏及肝脏系统中脂类和糖类代谢的影响,以期为进一步阐明BPA的毒性效应机制,并为该类污染物及相关疾病的控制提供科学依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:Lightcycler 480实时荧光定量PCR仪(瑞士 Roche公司),ML870 PowerLab血压和心率监测仪(日本ADInstuments公司),SpectraMAX M5多功能酶标仪(美国Molecular Devices公司),Tissue- Tek®TECTM5组织包埋机(日本Sakura公司),Tissue-Tek®VIPTM5 Jr. 组织自动脱水机(日本Sakura公司),REM-700石蜡切片机(日本Ymato公司),Olympus BX51TF光学显微镜(日本Olympus公司)。
试剂:双酚A(BPA),纯度为97%,购于美国Sigma-Aldrich公司;无水乙醇,分析纯,购于日本Wako化学公司;玉米油,纯度为98%,购于日本Wako化学公司。
1.2 实验材料
WHHL家兔:雄性,体重(2.34±0.24) kg,4个月大小,处于青年期,均由日本神户大学提供。根据体重将其分为2组,分别为对照组(含6只兔子)和BPA暴露组(含6只兔子)。所有兔子均在日本山梨大学医学部的无菌动物房进行饲养和暴露实验,每只兔子单独在不锈钢铁笼中进行饲养,饲养室的温度控制在(25 ± 2) °C,并保持12 h光照和12 h黑暗的循环周期,每天由不锈钢自动出水装置提供饮水,并提供100 g经过压制的普通饮食。每周的体重和每天的摄食量均严格进行记录。所有动物实验的操作均得到了山梨大学伦理委员会及动物管理协会的许可,并严格遵照美国联邦卫生研究所颁布的实验动物操作指南上的相关规定。
400 μg·kg-1体重BPA溶液的配置:首先将BPA溶于少量无水乙醇(体积比控制在4%)然后溶于玉米油。每天早上,通过灌胃的方式将WHHL家兔暴露于上述浓度的BPA溶液(投喂量控制在2 mL·kg-1),并持续12周。对照组也同样通过灌胃的方式每天投喂相同体积但不含BPA的玉米油。在持续暴露第8周,我们检测了在空腹状态下,家兔血浆中葡萄糖、胰岛素和脂肪含量的变化,并根据所得结果进行了静脉注射胰岛素耐受试验(IVTT)。在暴露第12周,我们对家兔进行了血压和心率的检测,并对空腹状态下血浆中的葡萄糖、胰岛素和脂肪含量进行了分析。然后,我们将所有的家兔进行解剖,通过苏木精-伊红(HE)和糖原(PAS)染色,重点对心脏和肝脏部位的脂肪及糖原蓄积情况进行了病理学切片分析。同时,我们还对肝脏中和脂类及糖类代谢密切相关的若干基因在mRNA水平上的表达进行了检测。为了使每只兔子的条件保持一致,我们在解剖前实施了绝食16 h的处理。
1.3 血浆中葡萄糖、胰岛素和脂肪含量的测定
血浆中葡萄糖含量的测定采用葡萄糖测定试剂盒(日本Wako化学公司);胰岛素含量的测定采用兔子胰岛素ELISA试剂盒(日本Shibayagi公司);血浆中脂肪含量,包括总胆固醇(TC)、三油甘酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)及游离脂肪酸(NEFA),脂肪酶(Lipase)均采用相应的试剂盒(日本Wako化学公司)进行测定。
1.4 静脉注射胰岛素耐受试验(IVTT)
采用Waqar等[22]建立的方法进行。此外,浓度-时间曲线下面积(AUC)代表某种物质进入生物体内后随时间在体内或血液中的总蓄积量,其大小可通过梯形面积累加法进行计算[22]。本实验利用AUC来表征从0到120 min,葡萄糖在WHHL家兔血浆中累积的总浓度。
1.5 石蜡切片及苏木精-伊红(HE)和糖原(PAS)染色
采用Waqar等[22]建立的方法进行。同时,我们采用3人随机打分的方式对HE和PAS染色中脂肪和糖原蓄积程度进行评价,得分越高则代表富集程度越严重。
1.6 实时荧光定量PCR(RT-PCR)检测相关基因的表达
采用Fang等[23]建立的方法进行,用于荧光定量PCR的引物序列见表1所示。
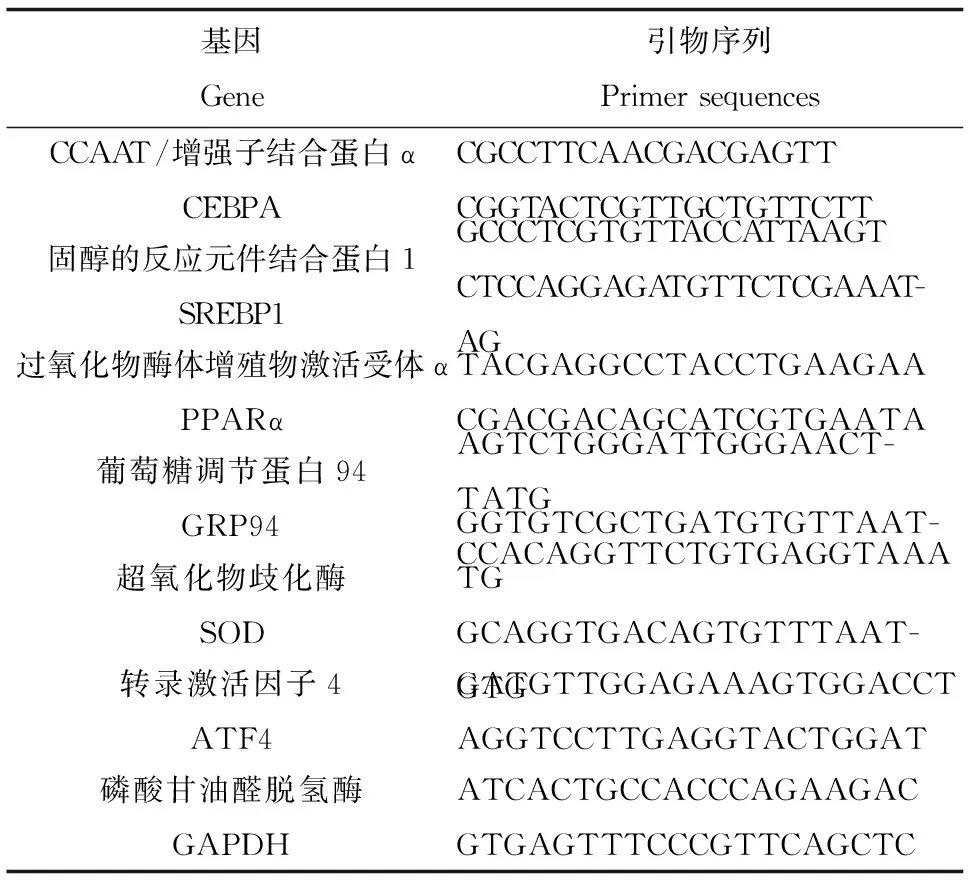
表1 用于实时荧光定量PCR分析的引物序列
1.7 数据分析
采用WinROOF ver. 7.0图像处理软件(日本Mitani公司)对HE和PAS染色的图像进行比较分析。采用SPSS16.0软件中的Independent-Samples T Test检验对暴露组和对照组之间各实验结果的差异进行统计学分析。置信水平P<0.05时差异显著,置信水平P<0.01时差异极显著。
2 结果(Results)
2.1 BPA暴露8周后血糖、胰岛素和血脂含量的变化
经400 μg·kg-1体重的BPA暴露8周后,WHHL家兔血液中胰岛素和葡萄糖的含量如图图1A所示,从图中可以发现暴露组WHHL家兔血液中胰岛素和葡萄糖含量和对照组相比均未发生显著性变化。因此,我们进一步进行了静脉注射胰岛素耐受试验(IVTT),注射胰岛素后,WHHL家兔的血糖浓度和时间变化曲线如图1B所示,从图中可以看出,暴露组家兔对血糖的代谢略滞后于对照组,特别是在60 min这个点表现出了显著性差异(P=0.02);在90 min和120 min,暴露组家兔血糖的含量分别是对照组的1.19和1.21倍,但两者之间没有表现出显著性差异(P>0.05)。
这表明暴露组家兔对胰岛素的利用率或敏感性要低于对照组,表现出了一定的胰岛素抵抗效应,这一结论从浓度-时间曲线下面积(AUC)上也得到了证实。此外,暴露组家兔血液中的血脂含量,包括总胆固醇(TC)、三油甘酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)及游离脂肪酸(NEFA)的含量和对照组相比均未出现显著性变化(数据未展示)。
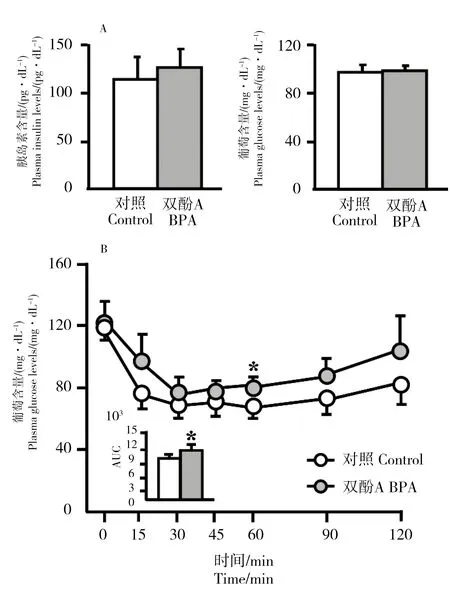
图1 BPA暴露8周后,(A)WHHL家兔血浆中胰岛素和葡萄糖的含量(B)静脉注射胰岛素耐受试验(IVTT)中WHHL家兔的血糖浓度和时间变化曲线Fig. 1 Exposure to BPA for 8 weeks, (A) the insulin and glucose levels in the plasma of WHHL rabbits (B) intravenous insulin tolerance test (IVTT),the time curve of plasma glucose levels
2.2 BPA暴露12周后血糖、胰岛素和血脂含量的变化
经400 μg·kg-1体重的BPA暴露12周后,WHHL家兔血液中胰岛素和葡萄糖的含量如图2所示,从图中可以看出,暴露组WHHL家兔血液中的胰岛素和葡萄糖含量均显著高于对照组;此外,血液中的脂肪酶、高密度脂蛋白胆固醇(HDL-C)及游离脂肪酸(NEFA)的含量也发生了显著升高。然而,血液中的总胆固醇(TC)和三油甘酯(TG)的含量和对照组相比均没有发生显著性变化(数据未展示)。虽然,低密度脂蛋白胆固醇(LDL-C)在含量上也未发生显著性变化,但和0周相比,其增加的倍数要显著高于对照组所增加的倍数。
其次,我们从图3A发现在整个12周的暴露阶段,暴露组WHHL家兔和对照组相比,体重未发生显著性改变,但肝脏的重量发生了显著增加。图3B显示暴露组家兔的血压也没有显著性改变,但心率和对照组相比则发生了显著下降。
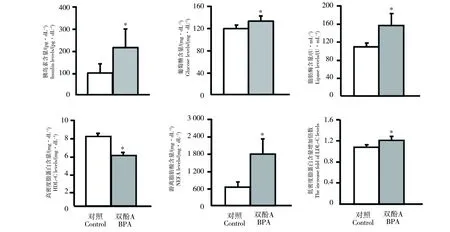
图2 BPA暴露12周后,WHHL家兔血浆中胰岛素、葡萄糖和脂肪含量的变化Fig. 2 Exposure to BPA for 12 weeks, the changes of plasma insulin, glucose and lipid levels
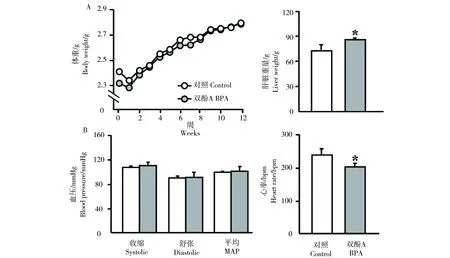
图3 BPA暴露12周后,(A)WHHL家兔体重、肝脏重量的变化(B)血压和心率的变化Fig. 3 Exposure to BPA for 12 weeks, (A) the changes of body and liver weights (B) the changes of blood pressure and heart rate in the WHHL rabbits
2.3 BPA暴露12周后对心脏脂肪蓄积的影响
经400 μg·kg-1体重的BPA暴露12周后,冠状动脉粥样硬化的损伤程度如图4A,B所示,结果显示,暴露组和对照组家兔冠状动脉硬化的损伤程度均达到了73%左右,两者之间并没有显著性差异。但经HE染色后发现,暴露组家兔的心肌细胞发生了明显的肿胀,并且在胞质中还出现了脂肪蓄积现象(图4C,箭头所指),进一步通过软件统计发现其损伤区域面积显著高于对照组(图4D)。2.4 BPA暴露12周后对肝脏脂肪和糖原蓄积的影响
经400 μg·kg-1体重的BPA暴露12周后,从图5A的肝脏HE染色图可以发现,暴露组家兔的肝脏细胞中发生了明显的脂肪蓄积现象,脂肪颗粒以中央静脉为中心,向四周略呈放射状排列。图5B是我们进一步通过3人随机打分的方式来评估每只家兔肝脏中的脂肪蓄积程度,结果也同样发现暴露组家兔肝脏中脂肪蓄积程度要显著高于对照组。同时,从图5C的肝脏HE染色图也发现暴露组家兔的肝细胞中发生了明显的糖原蓄积现象,肝细胞的胞质中出现大量的白色沉积,并且在靠近中央静脉的区域尤为明显。图5D进一步显示了通过PAS染色后糖原蓄积的情况,可发现暴露组家兔肝脏中的PAS染色程度(紫色部分)更为明显,该结果通过图5E的3人随机打分评估方式得到了进一步证实,表明暴露组家兔肝脏对糖原的蓄积程度要显著高于对照组。
2.5 肝脏中相关基因mRNA水平的表达
经400 μg·kg-1体重的BPA暴露12周后,WHHL家兔肝脏中和脂类及糖类代谢相关基因的表达水平如图6所示,结果显示CEBPA、SREBP1、PPARα、GRP94、MTTP和ATF4基因的mRNA表达水平与对照组相比均发生了显著的上调。
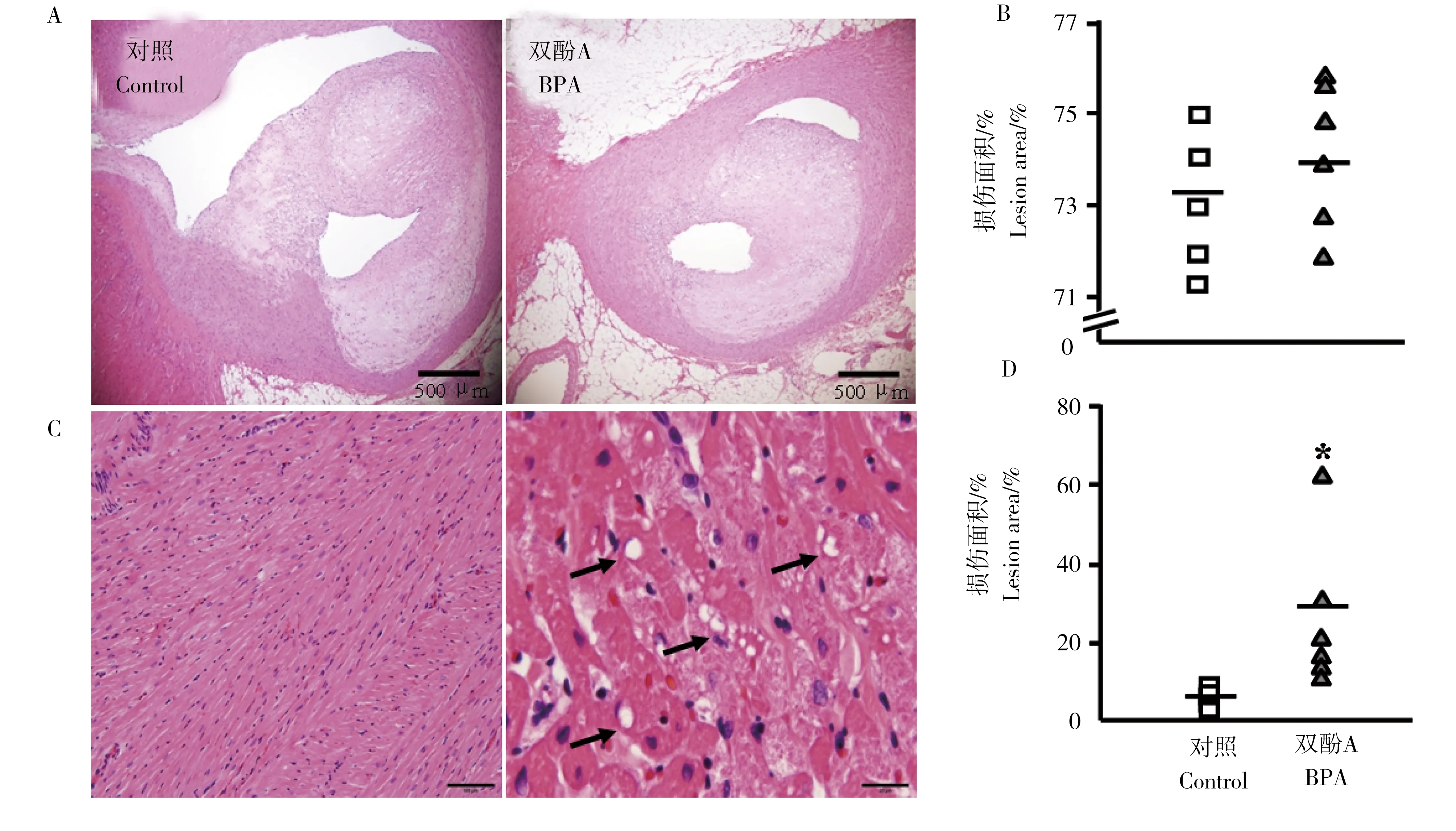
图4 BPA暴露12周后,(A)冠状动脉粥样硬化苏木精-伊红(HE)染色图 (B)冠状动脉粥样硬化损伤面积统计,黑色短横线代表平均值 (C)心肌细胞HE染色图,黑色箭头显示心肌细胞中发生的脂肪蓄积 (D)心肌细胞损伤区域面积统计,黑色短横线代表平均值注:对照组,n=5;暴露组,n=6。Fig. 4 Exposure to BPA for 12 weeks, (A) the HE staining of atherosclerosis of coronary artery (B) the lesion areas of atherosclerosis, the black small line represents the mean value (C) the HE staining of cardiac muscle cell, black arrow shows lipid accumulation in the cardiac muscle cell (D) the lesion areas of cardiac muscle cell, the black small line represents the mean valueNote: Control, n=5; exposure group, n=6.
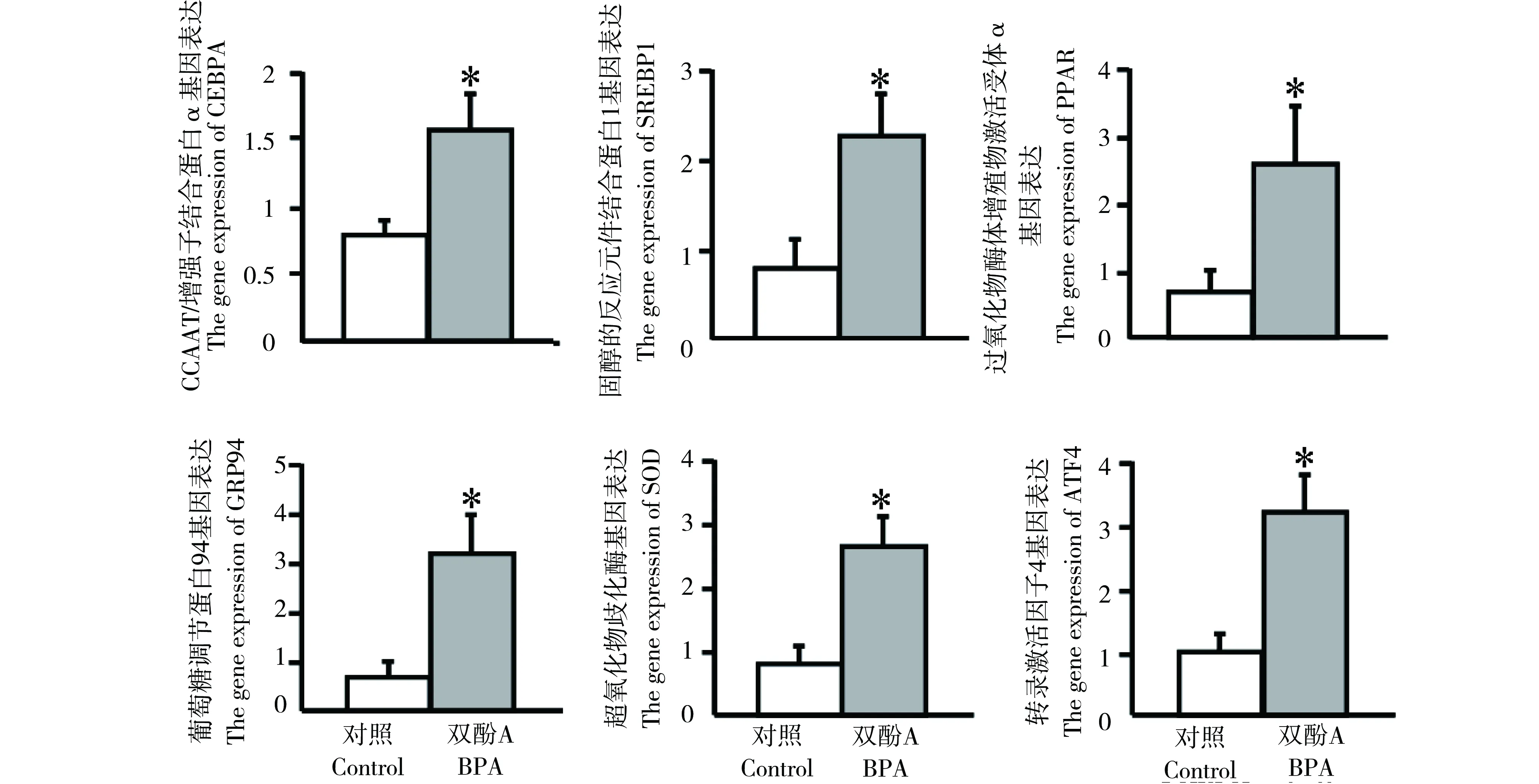
图6 BPA暴露12周后,肝脏中若干与脂类和糖类代谢相关基因mRNA水平的表达变化Fig. 6 Exposure to BPA for 12 weeks, the mRNA expression of some genes related to lipid and glucose metabolism in the liver
3 讨论(Discussion)
3.1 BPA暴露浓度的选择
本研究选取BPA的暴露浓度为400 μg·kg-1主要有以下两方面原因:首先,BPA的暴露无处不在,人类摄入BPA存在多种途径。虽然有研究根据尿液中BPA的含量推算出人体每天经口摄入BPA的量约为1 μg·kg-1,但目前还没有研究能准确估算出人体每天通过多种途径(包括经口、呼吸及皮肤接触)摄入BPA的总量[1]。一项最新研究利用恒河猴和CD-1小鼠模型,发现经400 μg·kg-1BPA暴露后的24 h期间,它们血清中BPA的含量在1 h达到最大值,之后发生下降,在24 h后基本回到了起始值,并且整个浓度的变化范围均处于正常人体含量水平之内(如表2所示),BPA在它们血液中的动力学变化过程和人体中也十分相似,据此推测人体日常通过多种途径摄入BPA的总量很可能在400 μg·kg-1左右[24-25]。其次,我们在预实验中也初步发现经400 μg·kg-1BPA暴露后的24 h期间,日本大耳白兔和WHHL家兔血清中BPA的含量变化范围和动力学过程均接近于恒河猴、CD-1小鼠及正常人体水平(如表2所示)。因此,本研究选用的这个暴露浓度存在一定的现实意义。
3.2 BPA对血糖和血脂代谢的影响
BPA暴露8周后,WHHL家兔出现了一定的胰岛素抵抗现象,胰岛素的主要功能是促进组织细胞对血浆中葡萄糖的摄取和利用,从而维持血糖浓度的稳定[27]。胰岛素抵抗则是由于外周组织(肌肉、脂肪和肝脏)细胞中的胰岛素受体对胰岛素响应的敏感性降低,从而无法有效地利用胰岛素来对血糖进行转化,导致高血糖症。胰岛中的β-细胞是分泌胰岛素的主要场所,由于胰岛素抵抗,胰腺β细胞不得不分泌更多的胰岛素进行工作,从而造成高胰岛素血症,增加了患2型糖尿病的风险[28]。因此,本研究在BPA暴露12周后,发现WHHL家兔血浆中的葡萄糖和胰岛素含量均发生了显著上升,其原因可能和BPA促进了胰岛素抵抗的发生密切相关。
此外,脂肪酶在脂肪的消化、转移和利用方面起着重要作用,胰岛功能受损,胰岛素抵抗,以及脂代谢紊乱都是导致血液中脂肪酶含量上升的重要原因[29],因此,本实验发现WHHL家兔血浆中脂肪酶含量升高可能和上述原因存在一定的关联。同时,胰岛素抵抗和血脂代谢紊乱也存在密切的联系,高密度脂蛋白(HDL)主要功能是去除组织细胞和血液中的脂肪和胆固醇,将其运载到肝脏中进行转化和排除,其含量的降低将引起血脂代谢异常,诱发动脉粥样硬化和糖尿病的发生[30]。相反,低密度脂蛋白(LDL)则主要将脂肪和胆固醇转移至细胞外液(包括血液)中,其含量升高将造成脂肪和胆固醇在组织和血管内壁发生堆积,从而诱发动脉粥样硬化和其他代谢综合征等疾病的发生[30]。游离脂肪酸(NEFA)含量的升高和脂类代谢、糖代谢、内分泌功能失调有关,同时肝脏和甲状腺功能受损也会造成其含量发生改变[31]。因此,本实验发现WHHL家兔血液中上述指标的改变,表明BPA可促进血脂代谢异常,诱发高脂血症和相关代谢疾病的发生。Wei等[10]的研
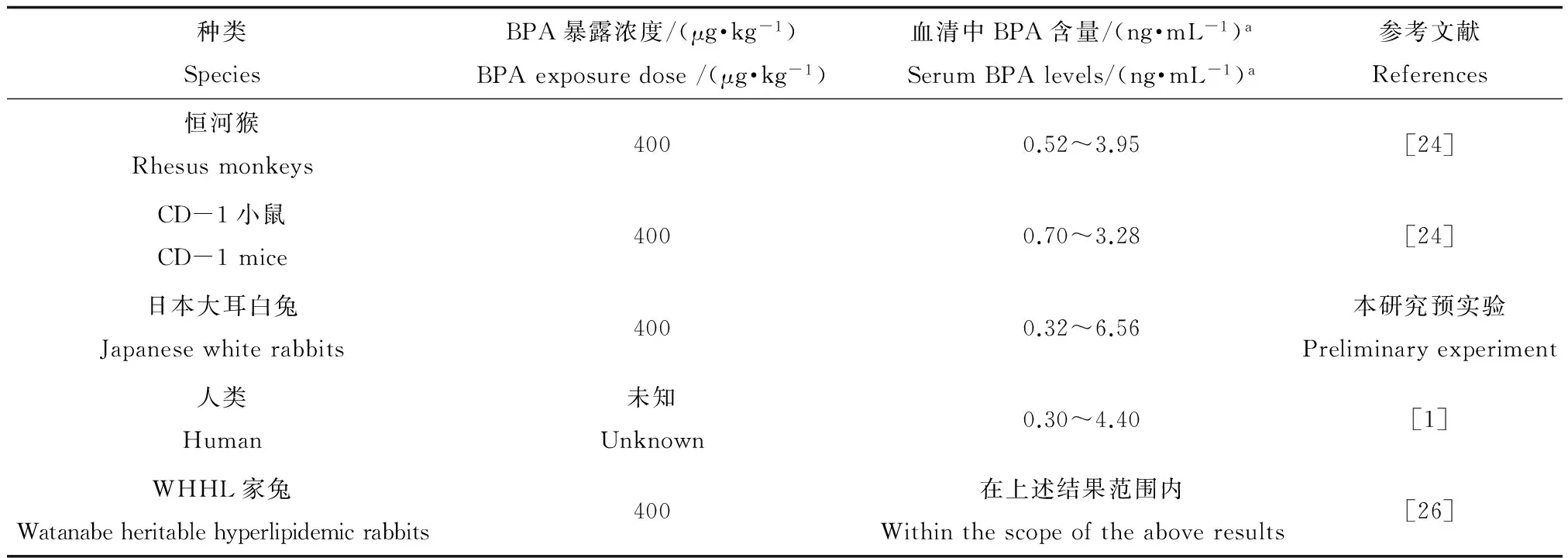
表2 经BPA暴露后的24 h期间各生物血清中BPA的含量水平
注:a 标注表示此处均为自由态的BPA。
Note:a the BPA hereby refers to unconjugated BPA.
究也证实了大鼠围产期暴露于低剂量的BPA,并在断乳后投喂高脂高糖饮食,可导致子代血清中总胆固醇、甘油三酯、低密度脂蛋白显著升高,同时高密度脂蛋白水平显著降低。本实验没有发现WHHL家兔其他血脂指标发生改变,如总胆固醇和甘油三酯,这一方面可能是由于在WHHL家兔中上述血脂指标的本底值较高,要引起变化较为困难;另一方面则是由于暴露时间较短,在今后的实验中,我们将延长暴露时间,从而进一步观察上述指标的变化。
3.3 BPA对心脏中脂类代谢的影响
利用WHHL家兔模型我们首先关注BPA对冠状动脉粥样硬化的影响,动脉粥样硬化是由于脂肪类物质(如胆固醇)在血管内壁富集造成动脉壁增厚的现象。最新的一项研究通过给ApoE基因敲除小鼠投喂50 μg·kg-1体重的BPA外加高脂和高胆固醇饮食,经过12周的持续暴露后发现,BPA促使主动脉动脉硬化的损伤面积增长了1.7倍(P= 0.03)[32]。但在本实验中,我们并没有发现BPA暴露后对冠状动脉粥样硬化的损伤面积造成显著的影响,这可能还是和BPA的暴露时间较短有关。先前的研究发现通过给普通家兔投喂高脂饮食长达22周,暴露组的主动脉粥样硬化损伤面积显著增加,但巨噬细胞、平滑肌细胞的损伤面积却没有发生显著的改变[22]。因此,适当延长暴露时间是我们将来的实验亟需改进的重要问题。
尽管如此,本研究还是发现了BPA对WHHL家兔的心肌细胞造成了损害,包括心肌细胞肿胀及脂肪蓄积。脂肪在非脂肪(肝脏、骨骼肌、心脏和肾脏等)细胞的细胞质中发生富集,是机体脂类代谢异常和脂肪变性的重要表现,并且已有研究证实脂肪在心肌细胞中发生富集和心脏功能障碍及心力衰竭存在关联,这也是导致糖尿病型心肌病的重要原因[33]。因此,在本研究中所发现的暴露组WHHL家兔的心率发生改变则很可能和上述心肌细胞的受损密切相关。
3.4 BPA对肝脏中糖类和脂类代谢的影响
肝脏在协调机体糖类和脂类代谢平衡方面起着重要作用,其可通过储存或降解肝糖原的方式来维持血糖的稳定。在本实验解剖前家兔均处于空腹状态,肝脏将通过糖原分解和糖质新生的方式来补充血液中葡萄糖的含量,但我们发现暴露组的家兔由于胰岛素抵抗效应而使血液中的葡糖糖无法被肝脏等组织有效转化和利用,因此,和对照组相比,其肝糖原的分解率也将有所下降,从而造成肝糖原的蓄积量显著提高[34]。糖原蓄积可促进肝脏中的过氧化物酶体增殖,脂肪酸的合成增加、胆固醇和甘油三酯蓄积,从而诱导脂肪肝的生成[35]。同时,本实验发现血液中游离脂肪酸含量的升高,有研究表明这将增加脂肪酸向肝脏的迁移和蓄积,促进脂质过氧化和脂肪肝的生成,并且加速肝细胞的凋亡[36]。此外,胰岛素抵抗常伴随着炎症反应和氧化应激,从免疫和脂肪细胞释放的各类调节因子也将对肝脏造成损害,诱发脂肪肝及其他各类肝脏疾病的发生[36]。Marmugi等对CD1雄鼠连续28 d进行不同剂量的BPA饮食暴露后发现,低剂量的BPA(5~500 μg·kg-1·d-1)可导致肝脏组织中与脂质合成有关的基因mRNA和蛋白表达显著上调,脂肪酸的合成增加,胆固醇和甘油三酯蓄积而诱发脂肪肝[37]。与上述结果类似,本研究也发现BPA促使肝脏中和脂类代谢(CEBPA、SREBP1、PPARα),糖类代谢(GRP94、ATF4)及氧化应激(SOD)相关的基因发生了显著上调,表明BPA可能主要是通过上述分子机制来诱导脂肪肝及糖原蓄积现象的发生。
综上所述,本研究表明选择在剂量上具有一定现实意义的BPA暴露可促进WHHL家兔发生脂类和糖类代谢异常,其毒性效应可能和胰岛素抵抗及相关基因的表达异常密切相关。这为我们将来采取有效措施进一步控制BPA,特别是在医疗设备中的使用,以减少高脂血症等易感人群的暴露,提供了重要的科学依据。
[1] Vandenberg L N, Chahoud I, Heindel J J, et al. Urinary, circulating, and tissue biomonitoring studies indicate widespread exposure to bisphenol A [J]. Environmental Health Perspective, 2010, 118(8): 1055-1070
[2] Calafat A M, Ye X, Wong L Y, et al. Exposure of the US population to bisphenol A and 4-tertiary-octylphenol: 2003-2004 [J]. Environmental Health Perspective, 2008, 116(1): 39-44
[3] He Y, Miao M, Herrinton L J, et al. Bisphenol A levels in blood and urine in a Chinese population and the personal factors affecting the levels [J]. Environmental Research, 2009, 109(5): 629-633
[4] Walsh B. The perils of plastic [J]. Time, 2010, 175(14): 44-54
[5] Melzer D, Osborne N J, Henley W E, et al. Urinary bisphenol A concentration and risk of future coronary artery disease in apparently healthy men and women [J]. Circulation, 2012, 125(12): 1482-1490
[6] Bae S, Kim J H, Lim Y H, et al. Associations of bisphenol A exposure with heart rate variability and blood pressure novelty and significance [J]. Hypertension, 2012, 60(3): 786-793
[7] Trasande L, Attina T M, Blustein J. Association between urinary bisphenol A concentration and obesity prevalence in children and adolescents [J]. Journal of the American Medical Association, 2012, 308(11): 1113-1121
[8] Rochester J R. Bisphenol A and human health: A review of the literature [J]. Reproductive Toxicology, 2013, 42: 132-155
[9] Alonso-Magdalena P, Vieira E, Soriano S, et al. Bisphenol A exposure during pregnancy disrupts glucose homeostasis in mothers and adult male offspring [J]. Environmetal Health Perspective, 2010, 118(9): 1243-1250
[10] Wei J, Lin Y, Li Y, et al. Perinatal exposure to bisphenol A at reference dose predisposes offspring to metabolic syndrome in adult rats on a high-fat diet [J]. Endocrinology, 2011, 152(8): 3049-3061
[11] Yan S, Song W, Chen Y, et al. Low-dose bisphenol A and estrogen increase ventricular arrhythmias following ischemia-reperfusion in female rat hearts [J]. Food and Chemical Toxicology, 2013, 56: 75-80
[12] Fan J, Watanabe T. Transgenic rabbits as therapeutic protein bioreactors and human disease models [J]. Pharmacology & Therapeutics, 2003, 99(3): 261-282
[13] Seok J, Warren H S, Cuenca A G, et al. Genomic responses in mouse models poorly mimic human inflammatory diseases [J]. Proceedings of the National Academy of Sciences, 2013, 110(9): 3507-3512
[14] Hugo E R, Brandebourg T D, Woo J G, et al. Bisphenol A at environmentally relevant doses inhibits adiponectin release from human adipose tissue explants and adipocytes [J]. Environmental Health Perspective, 2008, 116(12): 1642-1647
[15] Vassilopoulos S, Esk C, Hoshino S, et al. A role for the CHC22 clathrin heavy-chain isoform in human glucose metabolism [J]. Science, 2009, 324(5931): 1192-1196
[16] Marrie R A, Yu B N, Leung S, et al. Rising prevalence of vascular comorbidities in multiple sclerosis: Validation of administrative definitions for diabetes, hypertension, and hyperlipidemia [J]. Multiple Sclerosis (Houndmills, Basingstoke, England), 2012, 18(9): 1310-1319
[17] Repas T B, Tanner J R. Preventing early cardiovascular death in patients with familial hypercholesterolemia [J]. The Journal of the American Osteopathic Association, 2014, 114(2): 99-108
[18] Gan S I, Edwards A L, Symonds C J, et al. Hypertriglyceridemia-induced pancreatitis: A case-based review [J]. World Journal of Gastroenterology, 2006, 12(44): 7197-7202
[19] Arnold S V, Rich M. Hyperlipidemia in older adults [J]. Clinics in Geriatric Medicine, 2009, 25: 591-606
[20] Vandentorren S, Zeman F, Morin L, et al. Bisphenol-A and phthalates contamination of urine samples by catheters in the Elfe pilot study: Implications for large-scale biomonitoring studies [J]. Environmental Research, 2011, 111(6): 761-764
[21] Shiomi M, Fan J. Unstable coronary plaques and cardiac events in myocardial infarction-prone Watanabe heritable hyperlipidemic rabbits: Questions and quandaries [J]. Current Opinion in Lipidology, 2008, 19(6): 631-636
[22] Waqar A B, Koike T, Yu Y, et al. High-fat diet without excess calories induces metabolic disorders and enhances atherosclerosis in rabbits [J]. Atherosclerosis, 2010, 213(1): 148-155
[23] Fang C, Wu X, Huang Q, et al. PFOS elicits transcriptional responses of the ER, AHR and PPAR pathways in Oryzias melastigma in a stage-specific manner [J]. Aquatic Toxicology, 2012, 106: 9-19
[24] Taylor J A, Vom Saal F S, Welshons W V, et al. Similarity of bisphenol A pharmacokinetics in rhesus monkeys and mice: Relevance for human exposure [J]. Environmental Health Perspective, 2011, 119(4): 422-430
[25] Vandenberg L N, Hauser R, Marcus M, et al. Human exposure to bisphenol A (BPA) [J]. Reproductive Toxicology, 2007, 24(2): 139-177
[26] Fang C, Ning B, Waqar A B, et al. Bisphenol A exposure enhances atherosclerosis in WHHL rabbits [J]. PLOS One, 2014, 9(10): e110977
[27] Bornfeldt K E, Tabas I. Insulin resistance, hyperglycemia, and atherosclerosis [J]. Cell Metabolism, 2011, 14(5): 575-585
[28] Samuel V T, Shulman G I. Mechanisms for insulin resistance: Common threads and missing links [J]. Cell, 2012, 148(5): 852-871
[29] Miksztowicz V, Lucero D, Zago V, et al. Hepatic lipase activity is increased in non-alcoholic fatty liver disease beyond insulin resistance [J]. Diabetes/Metabolism Research and Reviews, 2012, 28(6): 535-541
[30] Barter P, Gotto A M, LaRosa J C, et al. HDL cholesterol, very low levels of LDL cholesterol, and cardiovascular events [J]. The New England Journal of Medicine, 2007, 357(13): 1301-1310
[31] Carlsson M, Wessman Y, Almgren P, et al. High levels of nonesterified fatty acids are associated with increased familial risk of cardiovascular disease [J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2000, 20(6): 1588-1594
[32] Kim M J, Moon M K, Kang G H, et al. Chronic exposure to bisphenol A can accelerate atherosclerosis in high-fat-fed apolipoprotein E knockout mice [J]. Cardiovascular Toxicology, 2013: 1-9
[33] van Herpen N A, Schrauwen-Hinderling V B. Lipid accumulation in non-adipose tissue and lipotoxicity [J]. Physiology & Behavior, 2008, 94(2): 231-241
[34] Gribble F M, Ashcroft F M. Sulfonylurea sensitivity of adenosine triphosphate-sensitive potassium channels fromcells and extrapancreatic tissues [J]. Metabolism, 2000, 49(10): 3-6
[35] Tao L, Wang W, Li L, et al. Effect of dibromoacetic acid on DNA methylation, glycogen accumulation, and peroxisome proliferation in mouse and rat liver [J]. Toxicological Sciences, 2004, 82(1): 62-69
[36] Bugianesi E, Moscatiello S, Ciaravella M F, et al. Insulin resistance in nonalcoholic fatty liver disease [J]. Current Pharmaceutical Design, 2010, 16(17): 1941-1951
[37] Marmugi A, Ducheix S, Lasserre F, et al. Low doses of bisphenol A induce gene expression related to lipid synthesis and trigger triglyceride accumulation in adult mouse liver [J]. Hepatology, 2012, 55(2): 395-407
◆
The Effects of Bisphenol A (BPA) Exposure on the Glucose and Lipid Metabolism in WHHL Rabbit
Fang Chao1, Ning Bo2, Fan Jianglin1,2, Dong Sijun1,*
1. Key Lab of Urban Environment and Health, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China 2. Department of Molecular Pathology, Interdisciplinary Graduate School of Medicine and Engineering, University of Yamanashi, Yamanashi 409-3898, Japan
31 March 2014 accepted 15 June 2014
In order to use an animal model that is more close to humans to study whether BPA exposure can accelerate the disorders of lipid and glucose metabolism in the setting of hyperlipidemia and explore the underlying toxic mechanisms. The Watanabe heritable hyperlipidemic (WHHL) rabbit was selected and exposed to 400 μg·kg-1body weight BPA for 12 weeks by oral gavage. At 8 weeks, the fasting plasma glucose, insulin and lipid levels were detected. The intravenous insulin tolerance test (IVITT) was performed. At 12 weeks, the fasting plasma glucose, insulin and lipid levels were also detected, and the blood pressure and heart rate were analyzed as well. Then all the rabbits were anatomized. The pathological examination of lipid and glycogen accumulation in the heart and liver were observed through hematoxylin-eosin (HE) and periodic acid-schiff (PAS) staining. Meanwhile, the genes expression closely related to lipid and glucose metabolism was analyzed in the liver. Results showed that BPA accelerated insulin resistance in the WHHL rabbit after BPA exposure for 8 weeks, resulting in the increased of fasting plasma glucose and insulin levels at 12 weeks, and the change of some blood lipid levels (HDL-C, LDL-C and NEFA). At 12 weeks, the extent of coronary atherosclerosis lesions was not increased obviously. However, the hypertrophy of cardiac muscle cell was detected and lipid accumulation was observed in the cytoplasm, leading to arrhythmia. The liver weight was increased accompanied by lipid and glycogen accumulation in the hepatocyte. The related genes expression was up-regulated significantly. These results indicated that continuous exposure to BPA can accelerate the disorders of glucose and lipid metabolism in the WHHL rabbit, which may be associated with the insulin resistance and abnormal expression of related genes.
bisphenol A (BPA); WHHL rabbit; metabolic disorders; lipid and glucose accumulation; insulin resistance; genes expression
国家自然科学基金(21207127, 21277137, 21477124, 41390240),宁波市自然科学基金(2013A610179),中国科学院城市环境研究所城市环境与健康重点实验室基金(KLUEH-S-201303)
方超(1984-),男,博士,主要研究方向为环境毒理学,E-mail: cfang@iue.ac.cn;
*通讯作者(Corresponding author),E-mail: sjdong@iue.ac.cn
10.7524/AJE.1673-5897.20140331001
2014-03-31 录用日期:2014-06-15
1673-5897(2015)1-252-11
X171.5
A
董四君(1966—),男,博士,研究员,研究方向为环境分子毒理、环境防卫医学和天然活性物质在健康领域的应用,发表学术论文40余篇。
方超, 宁博, 范江霖, 等. 双酚A(BPA)暴露对WHHL家兔糖类和脂类代谢的影响[J]. 生态毒理学报, 2015, 10(1): 252-262
Fang C, Ning B, Fan J L, et al. The effects of Bisphenol A (BPA) exposure on the glucose and lipid metabolism in WHHL rabbit [J]. Asian Journal of Ecotoxicology, 2015, 10(1): 252-262 (in Chinese)

